博文
膳食脂质吸收的新机制:免疫细胞、肠道菌群与肠道上皮细胞的协同作用  精选
精选
|
在成年哺乳动物中,膳食脂质是日常热量的主要来源之一。教科书对脂质吸收的描述十分简洁:脂质穿过肠道内层细胞(即肠道上皮细胞),从肠道内部进入血液循环。在本期《科学》杂志第149页,Gao等人[1]报道,小鼠的脂质吸收还依赖于免疫细胞与特定肠道上皮细胞(肠上皮细胞)之间的通讯。这种相互作用受到肠道菌群——肠道内复杂多样的微生物生态系统[2]——的影响。免疫细胞中Aster-A蛋白的缺失会抑制脂质吸收,并保护小鼠免受饮食诱导的肥胖及其相关后果(包括脂肪组织炎症和脂肪肝)的影响。这些发现可能会引起针对膳食脂肪吸收的疗法研究领域的广泛关注。
T cell cholesterol transport links intestinal immune responses to dietary lipid absorption | Science
肠道上皮是一道物理和生化屏障,将肠道内部空间(肠腔)与宿主组织分隔开来(见图)。大多数膳食脂质是甘油三酯,这类分子由三个脂肪酸通过酯化作用连接到一个甘油骨架上构成。脂肪酸进入肠上皮细胞的过程依赖于胰脂肪酶的活性——胰脂肪酶是一种能分解甘油三酯的酶[3]。单酰甘油和游离脂肪酸会与胆汁酸及磷脂乳化,形成一种名为“胶束”的球形结构。肠上皮细胞朝向肠腔的顶膜(即细胞顶端的细胞膜)的生物物理特性,也会影响脂质吸收。该细胞膜在溶血磷脂酰胆碱酰基转移酶蛋白家族的酶作用下不断重构,这些酶会改变细胞膜的磷脂组成[4]。肠道菌群同样在脂肪酸摄取中发挥作用:与拥有自然多样菌群的小鼠相比,无菌小鼠的循环系统和外周组织中,膳食多不饱和脂肪酸的水平更高[5]。在人类中,共生的黏液降解菌——嗜黏蛋白阿克曼菌(*Akkermansia muciniphila*)的存在,与血浆脂质水平降低、脂肪储存减少及肥胖风险下降相关[6],但这些作用背后的机制尚不明确。
膳食脂质摄入的调控过程
甘油三酯是膳食脂质的主要形式,会被脂肪酶分解;脂肪酸与胆汁酸、磷脂乳化后形成球形结构(即胶束);胶束释放的脂肪酸随后被肠道上皮细胞(肠上皮细胞)摄取。
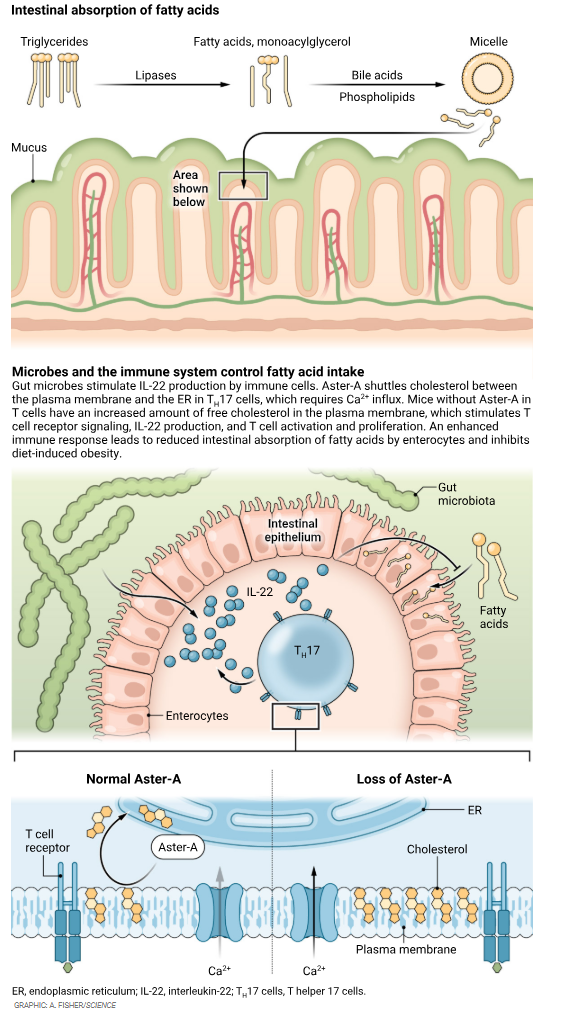
肠道内层覆盖着黏膜,黏膜包含多个不同区域。在固有层组织和派尔集合淋巴结(Peyer’s patches)中,存在着能感知微生物刺激并启动相应反应的免疫细胞[7]。Gao等人观察到,辅助性T细胞17(TH17细胞,CD4+T细胞的一个亚群)会表达Aster-A蛋白——该蛋白参与细胞内胆固醇的非囊泡转运,负责将胆固醇从细胞膜转运到内质网[8]。游离胆固醇约占哺乳动物细胞细胞膜总脂质含量的50%[9]。这部分游离胆固醇中,有一部分被称为“封存胆固醇”(sequestered cholesterol),是维持细胞膜生物物理特性所必需的;另一部分则被称为“可利用胆固醇”(accessible cholesterol),可被转运到其他细胞器[10]。Gao等人发现,在小鼠中特异性敲除T细胞的Aster-A后,其小肠和循环系统中的膳食脂质吸收会减少,这表明免疫细胞中的胆固醇转运会影响肠上皮细胞对脂质的摄取。考虑到TH17细胞在维持黏膜完整性、阻止病原体侵入体内方面的固有免疫功能,免疫细胞稳态与肠道脂质吸收之间存在这样的关联,是一项令人意外的发现。
进入体内的潜在有害物质(抗原)会被分解为更小的组分。这些组分由抗原呈递细胞表面的主要组织相容性复合体(MHC)分子呈递,并被T细胞表面的T细胞受体(TCR)识别。细胞膜中的高胆固醇水平会刺激TCR信号通路,进而影响T细胞的增殖[11]。Gao等人观察到,T细胞活化会增加细胞膜中可利用胆固醇的含量;但Aster-A的活性会迅速降低细胞膜中这类胆固醇的水平,从而减弱TCR信号传导,并抑制TH17细胞的活化与增殖。此外,Aster-A与基质相互作用分子1(STIM1,一种调控细胞膜钙离子(Ca2⁺)流动的蛋白)之间的相互作用,是可利用胆固醇从细胞膜转运到内质网的必要条件。
在这一过程中,肠道菌群扮演着怎样的角色?Gao等人发现,白细胞介素-22(IL-22,一种参与肠道稳态维持和黏膜防御的细胞因子[12])会作为T细胞与肠上皮细胞之间的信号分子,抑制脂质吸收。肠道菌群中的分节丝状菌(segmented filamentous bacteria)可诱导T细胞产生IL-22[13]。Gao等人观察到,用广谱抗生素处理小鼠以诱导肠道菌群失调后,小鼠体内IL-22的表达会降低;而在T细胞特异性缺失Aster-A的菌群失调小鼠中,脂质摄取能力会恢复。
Gao等人的研究强调了肠道微生物、免疫细胞与肠道上皮细胞之间的相互作用在调控膳食脂肪吸收中的重要性。作者阐明了细胞间通讯背后复杂信号级联反应的多个关键环节:Aster-A控制TH17细胞对肠道微生物的反应;TH17细胞中Aster-A的缺失会增加细胞膜中可利用游离胆固醇的含量,进而增强TCR信号传导,并促进肠道微生物依赖的IL-22产生;这些过程随后会减少肠上皮细胞对膳食脂质的吸收,并抑制饮食诱导的肥胖。
免疫细胞中的Aster-A究竟如何改变肠上皮细胞的脂质流入,目前仍有待进一步研究。这一过程可能涉及以下机制:肠上皮细胞中的肠道脂肪酸转运体(如CD36[3])、溶血磷脂酰胆碱酰基转移酶对肠上皮细胞顶膜组成的修饰[4],或是小肠肠腔内的乳化过程。
对于心脏代谢疾病领域的研究人员而言,“Aster-A缺失可使小鼠抵抗饮食诱导的肥胖(包括脂肪肝)”这一发现可能具有重要意义。靶向全身性脂质吸收的药物研发正受到广泛关注,因为膳食脂质不仅会在脂肪细胞和肝细胞中积累,还会在多种癌细胞(包括人类结直肠肿瘤细胞[14])中蓄积。在高胆固醇血症小鼠中,过量胆固醇会沉积在T细胞的细胞膜上[15],这可能会促进免疫介导的疾病发生。在这种情况下,Aster-A通过清除细胞膜上的胆固醇,可能会通过抑制炎症反应发挥抗炎作用。
探索在小鼠中发现的“微生物-免疫细胞-肠上皮细胞”相互作用,在多大程度上也调控着人类的膳食脂质吸收,将是一个有趣的研究方向。未来的研究或许会揭示这一信号通路在代谢和炎症中的生理重要性,并为新疗法的开发开辟道路。

编辑摘要
胆固醇是细胞膜的重要组成成分,可在Aster家族蛋白的作用下在细胞内不同亚细胞结构间转运。高(Gao)等人发现,在小鼠体内特异性敲除T细胞中的Aster-A蛋白,可抑制其对膳食脂肪的摄取,并预防饮食诱导的肥胖(参见伯克哈特(Burkhardt)与埃克(Ecker)撰写的展望文章)。通过调控细胞膜中胆固醇的含量,Aster-A能够调节T细胞受体信号传导及细胞分化过程。在Aster-A缺失的情况下,肠道中的CD4⁺T细胞会产生一种名为白细胞介素-22(IL-22)的细胞因子,而该细胞因子会降低肠道上皮细胞从膳食中摄取脂肪酸的能力。——萨拉·H.罗斯(Sarah H. Ross)
引言
在人类疾病中,脂质流动异常会导致细胞和组织功能障碍,但维持膜脂质稳态的通路仍未完全明确。免疫细胞需适应不断变化的威胁与复杂的微环境,其发挥最佳功能可能尤其依赖于自身膜结构的重组能力。免疫反应的启动与终止,也可能需要对细胞脂质库进行及时调整。目前,人们对免疫细胞膜稳态是否会影响器官功能及全身代谢,以及具体如何影响,仍缺乏充分了解。
研究依据
胆固醇是哺乳动物细胞膜(PM)中不可或缺的脂质成分。此前,我们已对Aster家族非囊泡脂质转运蛋白进行了研究,这类蛋白可将胆固醇从细胞膜转运至内质网。尽管已有研究证实胆固醇含量与免疫信号传导存在关联,但免疫细胞如何精细调节膜胆固醇水平,目前仍不明确。
研究结果
我们对小鼠小肠中的脂肪酸摄取过程进行了追踪,发现特异性敲除T细胞中的Aster-A可减少脂肪酸吸收,并使小鼠获得对饮食诱导肥胖的抵抗能力。Aster-A缺失会使小肠驻留T细胞中与辅助性T细胞17(TH17细胞)相关的基因表达特征增强。研究发现,Aster-A在TH17细胞中高表达,且对维持该细胞类型中正常的细胞膜胆固醇水平至关重要。通过特异性胆固醇探针,我们观察到T细胞受体(TCR)活化会短暂增加细胞膜中可利用胆固醇库的含量,而这一变化会招募Aster-A,以抑制细胞膜胆固醇的过度积累。在Aster-A缺失的情况下,细胞膜中过量的胆固醇会进入一种特殊的细胞脂质库——鞘磷脂封存库,进而导致TCR纳米簇形成增加。最终,Aster-A缺失的TH17细胞会表现出TCR信号传导增强及效应细胞因子(白细胞介素-17(IL-17)和白细胞介素-22(IL-22))产生增多的现象。对T细胞进行邻近标记实验发现,Aster-A与基质相互作用分子1(STIM1)存在相互作用;STIM1是TCR活化后介导钙离子(Ca2⁺)内流的核心成分。我们还发现,TCR诱导的Ca2⁺内流需要细胞膜中存在可利用胆固醇,而Aster-A会抑制这一过程。因此,Aster-A既能抑制TCR直接触发的早期信号,也能抑制依赖Ca2⁺内流的后期信号事件。
单细胞转录组学分析与免疫谱分析进一步表明,在T细胞特异性缺失Aster-A的小鼠小肠中,TH17细胞分泌的IL-22水平升高。在喂食前短期给予IL-22,就足以抑制肠道对脂肪酸的摄取。相反,通过中和抗体阻断IL-22、基因敲除T细胞中的Il22基因,或通过抗生素清除维持肠道TH17细胞的微生物信号,均能恢复小鼠对膳食脂肪的吸收能力或逆转饮食诱导的体重增加。
结论
本研究发现了一种可快速响应需求的免疫膜稳态调节因子。Aster-A会对TCR活化诱导的细胞膜重构做出反应,进而清除膜中过量的胆固醇,以抑制TCR信号级联反应。我们提出,膜脂质重构可能通过调控组织T细胞的反应性,促进细胞对微环境的适应。因此,T细胞膜胆固醇的调控异常与积累,可能导致肠道TH17细胞效应功能异常,改变免疫-上皮细胞间的通讯,并调节肠道及全身的营养代谢。
非囊泡胆固醇转运将肠道T细胞免疫与脂质吸收关联起来
T细胞活化会诱导细胞膜中可利用胆固醇积累,并招募Aster-A;Aster-A可提取胆固醇并将其转运至内质网,从而抑制TCR纳米簇的形成。在细胞膜处,Aster-A与STIM1的结合会进一步抑制TCR活化(以闪电符号标示)过程中的Ca2⁺内流。Aster-A可防止肠道TH17细胞反应过度,进而协调膳食脂质流动与全身代谢。图中:GRAM表示Aster-A的GRAM结构域;ORAI1表示钙释放激活钙调节蛋白1;TM表示Aster-A的跨膜结构域。[图由BioRender.com制作]
摘要
目前,关于免疫细胞中控制膜结构的内在通路及其对细胞功能的影响,人们了解尚浅。本研究发现,非囊泡胆固醇转运蛋白Aster-A可将CD4⁺T细胞的细胞膜(PM)胆固醇可用性与全身代谢关联起来。在T细胞受体(TCR)活化过程中,Aster-A会被招募至细胞膜,协助清除膜中的可利用胆固醇。Aster-A缺失会导致细胞膜中胆固醇积累,进而增强TCR纳米簇形成与信号传导。Aster-A与基质相互作用分子1(STIM1)存在关联,并对钙离子(Ca2⁺)流动具有负调控作用。Aster-A缺失会促进CD4⁺T细胞向辅助性T细胞17(TH17细胞)表型分化,并刺激白细胞介素-22(IL-22)的产生,而IL-22会减少肠道脂肪吸收,使小鼠获得对饮食诱导肥胖的抵抗能力。这些发现阐明了免疫细胞膜稳态与全身生理功能之间的关联机制。
https://wap.sciencenet.cn/blog-41174-1505484.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:从氢气医学、氢气农学,再到氢气生态学!