博文
从氢气医学、氢气农学,再到氢气生态学!
||
氢气,从医学农学到生态学!
氢气生物学的核心价值,是安全有效,不仅在医学上,农业上,在生态学上也都是核心价值。因为对整个生态系统,我们最能接受的前体都是安全,当然也要有效果。所以安全有效是核心价值,是可用性的重要依据。我在任何时候讲氢气医学,都把传递和贯穿这一价值作为中心内容。氢气用于医学,经济性没有那么重要,用于农业,经济性很重要,用于生态,经济性是可用的基本条件。在森林海洋这样的环境下如何使用氢气,需要巧妙地设计,必需具有可持续,绿色环保等要求。当然氢气的获取条件不高,绿色氢气技术已经越来越成熟,未来大量使用这种工具的条件越来越成熟。
评估应激拮抗剂对自然热暴露后珊瑚恢复的促进作用
科学网—氢气对珊瑚热应激的保护作用,以及氢气的生物危害性 - 孙学军的博文
摘要
造礁珊瑚(硬珊瑚)对热应激高度敏感,常导致白化和死亡,因此找到缓解应激、促进恢复的方法至关重要。2023年红海中部发生热应激事件后,我们通过短期实验,评估了四种潜在应激拮抗剂(氢气、磷酸盐、铵盐和益生菌)对广泛分布的造礁珊瑚——鹿角珊瑚属(*Acropora* spp.)和焦黄滨珊瑚(*Pocillopora favosa*)的作用。珊瑚分别接受四种拮抗剂处理及对照组处理,时长48小时,期间监测其存活率、颜色及光合效率。结果显示:氢气使鹿角珊瑚属的存活率提高25%,使焦黄滨珊瑚的存活率提高40%;磷酸盐和铵盐均使两种珊瑚的存活率提高40%,同时还提升了焦黄滨珊瑚的光合效率与颜色饱和度;益生菌使鹿角珊瑚属的存活率提高20%,使焦黄滨珊瑚的存活率提高40%,且对两种珊瑚的光合效率均有改善;添加磷酸盐和铵盐后,鹿角珊瑚属的存活率达到100%。这些研究结果表明,上述所有应激拮抗剂均具有辅助热应激后珊瑚恢复的潜力。根据不同海域的需求、后勤条件及技术能力,这些应激拮抗剂可用于珊瑚礁管理和污水处理工作。
Mezger, S.D., El-Khaled, Y.C., Carvalho, S. et al. Evaluating stress antagonists for enhanced coral recovery after natural heat exposure. Sci Rep 15, 35235 (2025).
作者及所属机构
德国不来梅大学(University of Bremen)生物与化学学院(Faculty of Biology and Chemistry)海洋生态学研究组(Marine Ecology Group),
塞尔玛·D·梅茨格(Selma D. Mezger)、克里斯蒂安·怀尔德(Christian Wild)
沙特阿拉伯图瓦尔市(Thuwal, Saudi Arabia)阿卜杜拉国王科技大学(King Abdullah University of Science and Technology, KAUST)生物、环境科学与工程学部(Biological and Environmental Sciences and Engineering Division, BESE)
优素福·C·哈立德(Yusuf C. El-Khaled)、苏珊娜·卡瓦略(Susana Carvalho)、拉克尔·S·佩肖托(Raquel S. Peixoto)
引言
珊瑚礁生态系统不仅是海洋生物多样性的重要支撑,更是全球数百万人口食物与收入的关键来源1,2,3。然而,珊瑚礁正面临多种人为应激因素的威胁,其中气候变化的影响最为显著4,5。气候变化引发的海洋热浪(MHWs)频率和强度不断增加,已成为珊瑚礁的主要威胁,导致大规模珊瑚白化和死亡事件频发5,6,7。自1950年以来,全球造礁珊瑚已消失一半,这一惊人的消失速度凸显了珊瑚保护工作的迫切性8。
红海区域正经历快速变暖,其升温速度超过全球平均水平9,10,是全球气候变暖趋势的典型缩影。随着海洋热浪加剧,珊瑚白化事件的频率和规模预计将进一步增加,对全球珊瑚礁生态系统的恢复力构成严重威胁11,12。了解珊瑚的恢复力(包括其抗白化能力和白化后的恢复能力),是评估珊瑚物种抵御环境应激并从中恢复的整体能力的核心13,14。例如,热应激引发的珊瑚白化会破坏珊瑚与其共生虫黄藻之间的关键共生关系,导致珊瑚色素流失,最终走向死亡15,16。尽管部分珊瑚能够从白化事件中恢复,但恢复的程度和机制因物种及环境条件的不同而存在差异17。
珊瑚的恢复过程复杂,受能量储备、异养摄食能力及共生关系稳定性等多种因素影响18,19。然而,由于白化事件频率不断增加,超出了珊瑚礁的自然恢复速度,珊瑚的恢复能力可能会受到损害18,20。以往的研究多聚焦于不同时间尺度(主要为数月至数年)的珊瑚恢复过程,关注造礁珊瑚覆盖度、共生关系重建及能量储备补充等指标。此外,这些恢复研究大多在自然环境中原位开展,未考虑可能促进恢复的潜在应激拮抗剂。而且,珊瑚恢复研究的结果差异较大,尤其是在对比年度周期性白化事件与单次白化事件时:部分物种能适应反复白化,而另一些物种则无法适应,这凸显了恢复动态的物种特异性18,21。因此,尽管在热应激强度较低或持续时间较短的情况下,部分珊瑚能够恢复17,但目前对于珊瑚在热应激后的短期响应机制,仍存在明显的认知空白。
白化事件发生频率与珊瑚恢复速度的不匹配,对珊瑚的生存构成了重大威胁20。在气候变化导致干扰机制发生改变的背景下,了解影响珊瑚恢复速度的因素变得愈发关键23。面对气候变化引发的大规模白化等威胁,亟需采取措施增强珊瑚礁的恢复力。国际珊瑚礁保护界公认珊瑚礁保护的三大核心支柱:(1)降低全球气候变化带来的威胁;(2)通过地方措施增强珊瑚礁的恢复力与保护力度;(3)投入资金开展恢复科学研究24。而了解珊瑚礁生态系统内部的拮抗作用,是实现这些目标的关键。
尽管已有研究通过多种方法(如利用益生菌重塑珊瑚微生物群落25,26,27)应对珊瑚恢复力提升的需求,但本研究进一步拓展了研究范围,探究多种候选物质对珊瑚恢复的辅助作用。基于以往研究中已证实的对热应激下珊瑚生理具有积极影响的物质(详见补充材料表S1),我们筛选出四种潜在候选物质——氢气、磷酸盐、铵盐和益生菌。其中,氢气(H₂)的特性表明其可能是一种有效的应激拮抗剂28。研究显示,氢气可减少固氮作用29,30,并具有强抗氧化性,从而降低活性氧(ROS)的含量31,32,33;磷酸盐(PO₄)可能提高珊瑚的光合能力与碳转运效率,并在热应激期间稳定类囊体膜34,35;补充铵盐(NH₄)与珊瑚光保护色素增加、活性氧释放减少及总抗氧化能力提升相关34,36,37,此外,通过补充铵盐缓解珊瑚的氮限制,可提高共生藻细胞密度和叶绿素浓度38,39。不过,较高的共生藻密度虽可能通过提升光合潜力促进应激后的恢复,但也可能因热暴露下氧化应激增强而增加珊瑚的白化敏感性40。因此,铵盐补充的时机和剂量至关重要,需避免产生意外负面影响,以最大化其潜在益处。最后,益生菌是从健康珊瑚中分离并筛选出的具有有益特性的珊瑚有益微生物(BMC)26,已被证实不仅能促进珊瑚生长,还可缓解污染、白化或疾病对珊瑚的影响。
这些不同类型的应激拮抗剂为应对气候变化引发的热应激威胁、促进珊瑚恢复提供了潜在途径。归根结底,整个生态系统的恢复力取决于珊瑚等基础物种从应激中恢复的能力,这凸显了研究应激拮抗剂以加速珊瑚恢复过程的迫切需求23。本研究通过对鹿角珊瑚属和焦黄滨珊瑚这两种造礁珊瑚开展短期实验,旨在探究自然热暴露后,不同应激拮抗剂对造礁珊瑚恢复过程的影响。研究聚焦珊瑚的生理指标,以期为应对热暴露加剧的珊瑚保护策略提供有价值的参考。
材料与方法
实验设计
2023年,红海中部受持续时间较长的海洋热浪影响,发生了珊瑚白化事件,该事件始于6月,持续至11月(图1A)。根据定义,海洋热浪是指某一区域海水温度超过该区域历史观测数据90百分位值的持续时期52。从6月初至10月采样期间,受此次海洋热浪引发的温度异常影响54,珊瑚经历的累积热周(DHW,定义参考Liu等人的研究53,详见补充图S1)约为17度·周。野外监测显示,8月末至9月中旬,海水温度最高达到33.9°C(图1B)55,这导致法哈尔礁(Al Fahal Reef,北纬22°18′19.1″,东经38°57′55.0″)采样点及该区域其他珊瑚礁出现大规模珊瑚白化和死亡(参考文献55及个人观测)。10月初,海水温度开始下降,此后不久,存活的珊瑚群体开始缓慢恢复(个人观测)。
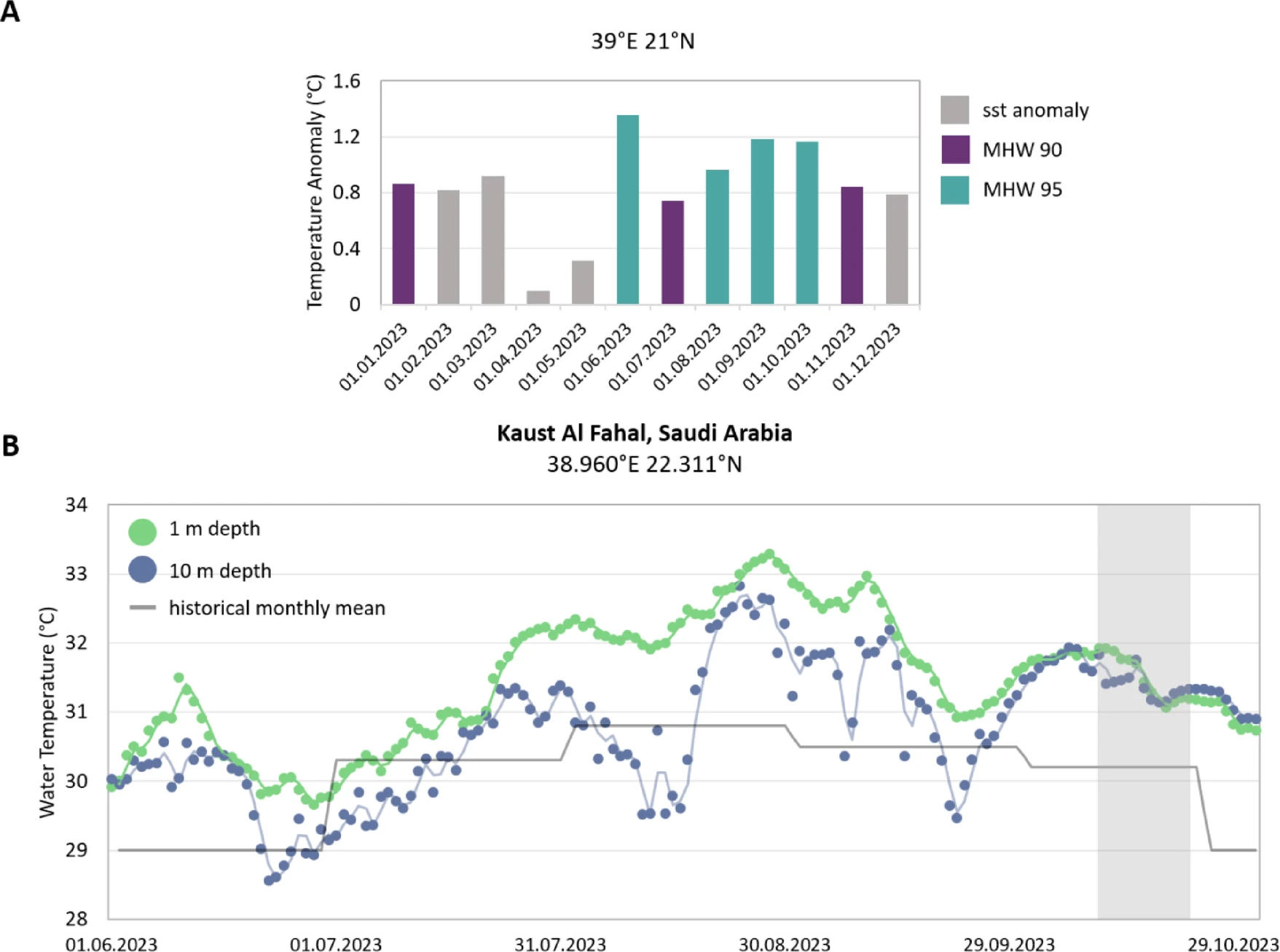
图1 研究区域的温度异常与海水温度
(A)图显示基于美国国家海洋和大气管理局(NOAA)卫星数据获取的2023年采样珊瑚礁区域的温度异常情况。颜色标识表示各月份是否属于海洋热浪(MHW),判定阈值为3个月窗口期内海表温度异常观测值的90百分位(MHW 90)或95百分位(MHW 95)。(B)图显示法哈尔礁1米和10米水深的日平均海水温度,同时标注了历史月平均温度(https://aqualink.org/sites/3376,访问时间2024年4月8日)。灰色方框代表10月11日至24日的野外采样期。
为评估不同应激拮抗剂对自然热暴露(即上述海洋热浪)后造礁珊瑚短期恢复潜力的影响,我们采集了红海区域常见的两种造礁珊瑚——鹿角珊瑚属(*Acropora* spp.)和近期重新分类的焦黄滨珊瑚(*Pocillopora favosa*)56(图2)。对于鹿角珊瑚片段,我们通过视觉观察选取形态类似亨氏鹿角珊瑚(*Acropora cf. hemprichii*)的样本;但由于该属珊瑚形态变异性显著且分类学界定尚未完全明确,本研究中统一将其称为鹿角珊瑚属(*Acropora* spp.)。
实验片段(每个处理组n=5)采集自法哈尔礁的“红海研究中心珊瑚益生菌试验区”(北纬22°18′19.1″,东经38°57′55.0″),该地点位于沙特阿拉伯红海沿岸的阿卜杜拉国王科技大学(KAUST)附近海域,距海岸约15公里。采样通过水肺潜水进行,使用钳子(ACE品牌)从两种珊瑚各5个独立群体(水深约10米)上截取长度为2-4厘米的片段,每个处理组包含每个群体的1个片段(共5个片段),确保所有处理组及后续生理分析均采用相同的5个生物重复(群体)。采集时所有珊瑚群体均呈现出比海洋热浪前更明显的褪色(白化)现象。我们对珊瑚群体进行了标记,以便在整个实验期间对同一群体进行重复采样。
由于水族箱、LED水族灯及实验室实验空间有限,实验采用序贯处理方式:完成一个完整的实验流程(即一种处理)后,再启动下一种处理。所有实验于2023年10月在两周内完成,处理顺序依次为:磷酸盐、益生菌、对照组、铵盐、氢气。
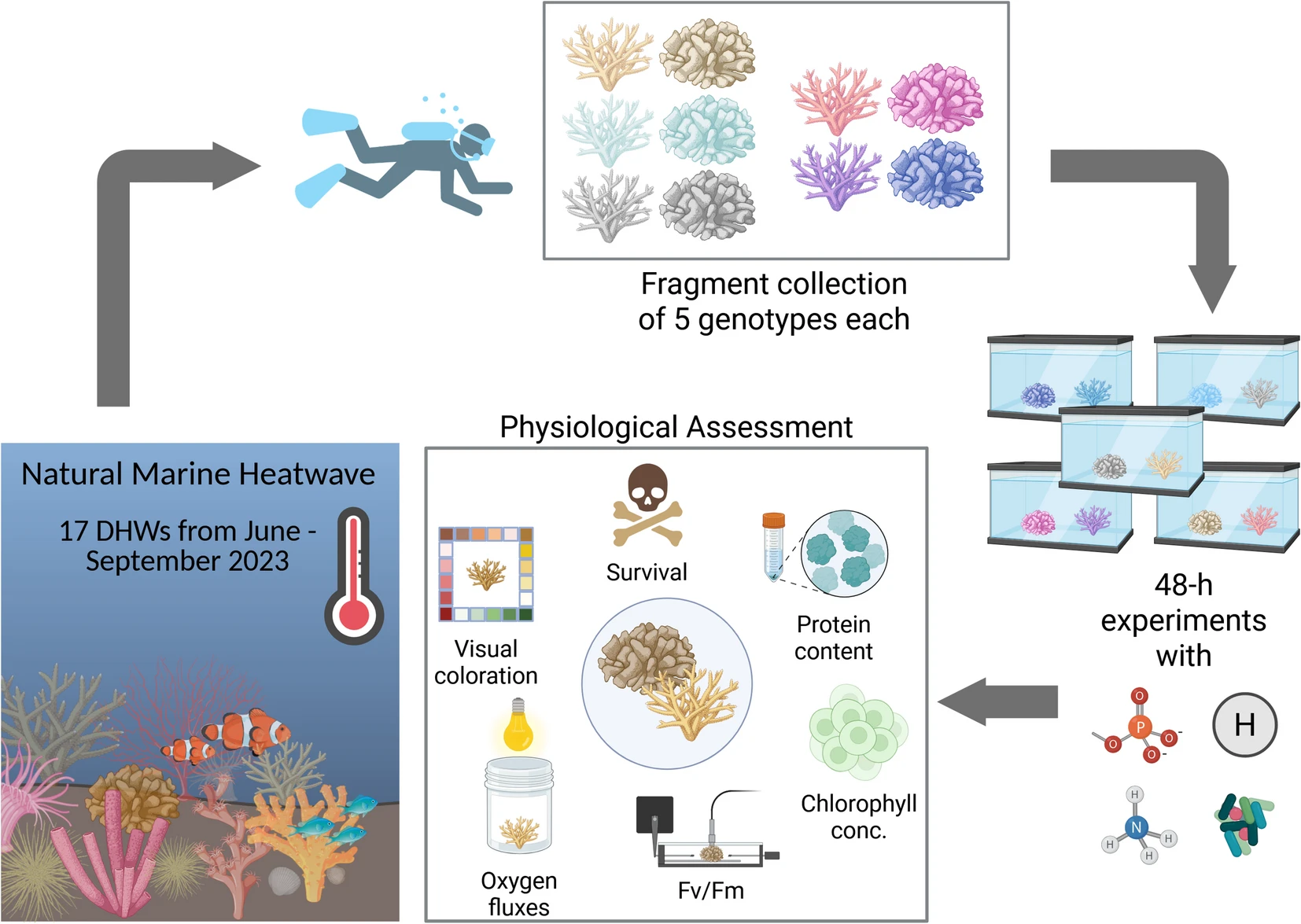
图2 研究实验设计
在累积热周达17度·周的持续海洋热浪后,从野外褪色的珊瑚群体中采集5个基因型的鹿角珊瑚属和焦黄滨珊瑚片段,将其转移至小型中型生态缸(mesocosm tanks)中,在30°C条件下分别接受5种处理,持续48小时,随后通过生理评估确定其恢复情况。图表由BioRender制作。
采样与实验操作详情
在每个采样日,从5个珊瑚群体中各截取2个片段(实验方案编号:22IBEC003_V2,经阿卜杜拉国王科技大学(KAUST)研究合规办公室下属机构生物安全与生物伦理委员会批准),将其放入装有海水的黑色采样袋中,再一同置于盛有80升海水的塑料桶内。在氢气处理实验中,1个鹿角珊瑚属(*Acropora* spp.)样本不慎丢失,导致该处理组的重复样本量减少至4个基因型。随后,样本片段被放入装有采样点海水的塑料箱(乐柏美(Rubbermaid)冷藏箱,规格25×36厘米,容积22升)中运送至实验室,以避免在船只转运过程中受到高强度光照和高温影响。
样本抵达实验室后,首先对所有片段进行拍照,记录其视觉颜色特征;之后,从每个珊瑚群体的2个片段中随机选取1个立即冷冻并置于-80°C冰箱中,作为基线生理分析样本(起点样本),另1个片段则被分配至实验缸,放入3D打印的固定架中,转移至对应处理组的实验缸内(终点样本)。
实验缸设置
实验缸为小型封闭式玻璃水族箱,内装10升从珊瑚礁采集的海水。实验共使用5个小型中型生态缸(mesocosm tank),每个缸中放置1个来自不同鹿角珊瑚属群体的片段和1个来自不同焦黄滨珊瑚(*P. favosa*)群体的片段,以避免“缸效应”(即不同实验缸环境差异对结果的干扰)。
每个实验缸均配备以下设备:
- 水族箱水泵(Barst潜水式水泵,型号JR-250B);
- 加热棒(Schego钛管加热棒,防护等级IP68,功率200瓦,规格250毫米×25毫米),并连接恒温控制器(英邦(Inkbird)温度控制器,型号ITC-308);
- LED水族灯(Galaxyhydro品牌),模拟12小时光照/12小时黑暗的昼夜周期。
在48小时的实验过程中,对温度、盐度和光照强度进行常规监测,以确保各实验缸环境条件一致(缸内参数:光合有效辐射(PAR)≈200微摩尔·平方米·秒⁻¹,盐度39.6±0.3‰,温度30.0±0.4°C)。为模拟真实的热浪后环境,包括对照组在内的所有实验缸均维持在约30.0°C,这与该区域10月和11月的历史平均海表温度(分别为30.5°C和30.2°C)一致57。因此,本研究中的对照组代表了自然热环境下无干预的基线状态,可用于评估应激拮抗剂在珊瑚早期恢复阶段的额外益处。在封闭式水族箱系统中,为避免盐度升高,每天需调整盐度3次(分别在早晨开灯时、中午及傍晚关灯时)。由于实验持续时间较短,未对营养盐浓度进行连续监测。
处理组设置
每个采样日启动1个不同处理组的实验,每种珊瑚物种的样本量为5个片段(n=5)。这5个片段始终来自上述相同的5个珊瑚群体(每个处理组中每个群体对应1个片段),所有生理分析均基于同一组重复样本进行。处理组具体设置如下:
1. 对照组:不添加任何物质;
2. 氢气组(H₂):通过将10%的缸内海水替换为富氢蒸馏水(使用富氢水杯(Aukewel品牌,型号ABS-FQ-02)制备,并添加海水盐(红海盐,Red Sea品牌)),使缸内氢气浓度维持在0.3-0.5ppm(相当于150-250微摩尔);
3. 磷酸盐组(PO₄):添加磷酸钠(Sigma Aldrich品牌,化学式Na₂HPO₄·2H₂O,CAS号10028-24-7),使缸内磷酸盐浓度达到2微摩尔;
4. 铵盐组(NH₄):添加氯化铵(Sigma Aldrich品牌,CAS号12125-02-9),使缸内铵盐浓度达到3微摩尔;
5. 益生菌组:使用定制化的珊瑚有益微生物(BMC)。实验所用的2种定制BMC由阿卜杜拉国王科技大学海洋微生物组实验室提供:
- BMC I(针对焦黄滨珊瑚设计):包含6种菌株,分别为盐单胞菌属(*Halomonas* sp.)、Suctlifiella属(*Suctlifiella* sp.)、2种假交替单胞菌属(*Pseudoalteromonas* sp.)菌株及2种考克氏菌属(*Cobetia* sp.)菌株58,59;
- BMC II(针对亨氏鹿角珊瑚(*A. cf. hemprichii*)设计):包含4种菌株,分别为盐单胞菌属(*Halomonas* sp.)、考克氏菌属(*Cobetia* sp.)及2种假交替单胞菌属(*Pseudoalteromonas* sp.)菌株。
氧气通量测定
为测定氧气通量,将珊瑚片段放入3D打印固定架中,再置于培养瓶内(全程不接触空气)。在光照和黑暗培养阶段,培养瓶均保持密封状态,并放入设定为对应处理温度的恒温水浴中;同时,培养瓶放置在磁力搅拌板(汉纳仪器(Hanna instruments),型号HI 200 M)上,每个瓶内均放置磁力搅拌子以确保水体充分混合。
在每次培养的开始和结束时,使用氧气探头(梅特勒-托利多(Mettler Toledo)SevenGo Duo Pro便携式溶氧仪,配备InLab OptiOx电极)测量水中的氧气浓度。光照和黑暗培养时间均约为1.5小时,其中光照培养使用LED水族灯,光照强度约为200微摩尔·平方米·秒⁻¹。黑暗培养结束后,对片段进行脉冲调制叶绿素荧光(PAM)测定。
氧气通量数据(净光合速率Pnet和呼吸速率R)的计算方法如下:分别用光照培养结束与开始时的氧气浓度差值计算净光合速率,用黑暗培养结束与开始时的氧气浓度差值计算呼吸速率。随后,结合每个片段的表面积(SA)、培养瓶总体积(V)、总培养时间(h)及背景氧气通量(空白对照),对速率进行标准化,公式如下:
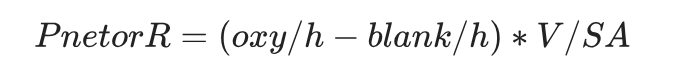
总光合速率(Pgross)通过以下公式计算:
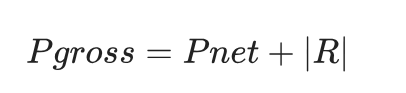
脉冲调制叶绿素荧光(PAM)测定
在实验开始时、12小时后、24小时后,以及48小时黑暗培养结束后,对珊瑚片段进行PAM测定,以评估其光合效率。测定前,需将珊瑚片段暗适应30分钟以上,使用的仪器为水下脉冲调制叶绿素荧光仪(DIVING-PAM-II/R,Walz GmbH品牌)。
对于每个片段,测定其暗适应下的初始荧光(F0)和最大荧光(Fm),并在片段上随机选取一个点,计算其光系统II(PSII)的最优量子产额(Fv/Fm,以下简称“光合效率”)。此外,通过10组梯度光照(光照强度从0至1455微摩尔光子·平方米·秒⁻¹递增),在片段的另一个点上绘制快速光响应曲线(RLC)。在每组光照之间,用对应光强的作用光照射片段10秒,每组照射结束后进行一次饱和脉冲测定。
PAM测定完成后,再次对片段拍照,记录其视觉颜色特征并评估存活率,随后将片段放入-80°C冰箱保存,待后续分析。
视觉颜色与存活率评估
在实验开始前和48小时应激拮抗剂处理结束后,以白色背景为参照,使用手机相机(iPhone 7)拍摄每个片段的照片,用于视觉颜色评估。照片分析参照Mclachlan和Grottoli60的方法,使用ImageJ软件进行:每个片段选取10个独立的灰度值,以白色背景为标准进行标准化,计算平均灰度值(MIG)。
对平均灰度值进行倒置处理:数值越低(或数值下降),表示片段褪色/白化程度越高;数值越高,则表示片段颜色越深(恢复越好)。
存活率的判定标准为:片段组织损失率低于75%。若组织损失率超过75%,则判定为死亡,该标准参考Casey等人的研究61。
吹脱法(Airbrushing)与表面积测定
将硬珊瑚片段在冰上解冻1小时后,使用5毫升微滤海水和喷枪将珊瑚组织从骨骼上吹脱下来。将得到的组织浆液收集到离心管(VWR品牌,15毫升离心管,货号525-1084)中,随后分装到3个1.5毫升离心管(Fisher Scientific品牌,货号05-408-137)中,再次放入-80°C冰箱保存,待后续生理分析。
珊瑚片段的表面积通过以下方法测定:为每个片段拍摄50张照片,使用Agisoft Metashape软件(2.1.0专业版)构建3D模型,再通过MeshLab软件(2023.12版)对模型进行分析,计算得出表面积。
叶绿素含量测定
为测定总色素含量,将冷冻的组织浆液从冰箱取出,在冰上解冻。所有测定准备步骤均在黑暗环境下(红光照明)进行:
1. 用涡旋振荡器(VWR品牌迷你涡旋振荡器,货号58816-123)将组织浆液涡旋混匀;
2. 吸取500微升样本至2毫升离心管(Fisher Scientific品牌,货号05-408-146)中,在4°C、5000转/分钟的条件下离心5分钟(离心机型号:Eppendorf 5424 R);
3. 弃去上清液,加入2毫升90%丙酮(VWR品牌,HPLC级丙酮,货号20067.320);
4. 将样本置于冰水浴中超声处理10分钟(超声清洗仪型号:Bransonic 5510E-MTH),随后放入纸盒中,在4°C冰箱中提取48小时;
5. 提取完成后,取出样本涡旋2秒,用台式离心机(Cole Parmer品牌,美国伊利诺伊州弗农山,邮编60061)离心5秒,然后吸取200微升上清液,每个样本做两个重复,加入96孔板(VWR品牌细胞培养板,欧洲货号734-2327)中;
6. 在每个96孔板中,选取两个孔加入200微升90%丙酮作为空白对照;
7. 将96孔板放入分光光度计酶标仪(赛默飞世尔科技(Thermo Scientific),型号A51119700)中,在630、663、664和750纳米波长下测定吸光度。
样本吸光度值需通过减去空白对照的平均吸光度进行校正。随后,参照Jeffrey和Humphrey62的公式计算叶绿素a和叶绿素c₂的浓度,并通过除以0.55563来校正96孔板的光程长度。将浓度值乘以提取体积,转换为提取的叶绿素绝对量,再乘以稀释倍数;最后,以珊瑚片段的表面积为基准,对叶绿素a和叶绿素c₂的绝对量进行标准化。
蛋白质含量测定
采用布拉德福德(Bradford) assay试剂盒(赛默飞世尔科技,货号23200)测定蛋白质浓度,步骤如下:
1. 用白蛋白标准品(赛默飞世尔科技,货号23209)和超纯水(MilliQ水)配制一系列浓度的标准品稀释液;
2. 将组织浆液在冰上解冻,用涡旋振荡器(VWR品牌迷你涡旋振荡器,货号58816-123)充分混匀;
3. 根据样本情况,在新的1.5毫升离心管(Fisher Scientific品牌,货号05-408-137)中用超纯水稀释组织浆液,使稀释后的蛋白质浓度落在标准曲线范围内;
4. 混匀后,用台式离心机(Cole Parmer品牌,美国伊利诺伊州弗农山,邮编60061)离心5秒;
5. 吸取5微升样本上清液,每个样本做3个技术重复,加入96孔板(VWR品牌细胞培养板,欧洲货号734-2327)中;
6. 用多通道移液器向每个孔中加入250微升考马斯亮蓝(Coomassie)试剂,轻轻混匀(避免产生气泡);
7. 将96孔板放在摇床(Eppendorf MixMate)上,以500转/分钟的速度振荡30秒,随后在室温下孵育10分钟;
8. 孵育结束后,再次将孔板放在摇床上振荡30秒(500转/分钟),然后放入分光光度计酶标仪(赛默飞世尔科技,型号A51119700)中,在595纳米波长下测定吸光度。
样本吸光度值需通过减去空白标准品的平均吸光度进行校正;若3个技术重复中某一吸光度值与其他两个值的差异超过0.03单位,则剔除该异常值。参照标准曲线(采用二次曲线拟合,强制过原点)计算蛋白质浓度,乘以组织浆液的稀释倍数及后续额外稀释倍数;最后,以珊瑚片段的表面积为基准,对蛋白质浓度进行标准化。
数据分析
由于实验条件限制(各处理组需序贯进行而非同步开展),不同实验批次的初始值存在差异。为解决这一问题,我们计算了每个珊瑚片段从起点到终点的参数变化百分比,该方法适用于所有评估的生理参数,包括视觉颜色(平均灰度值)、光合效率(Fv/Fm)、叶绿素a含量及蛋白质浓度。通过关注单个片段随时间的相对变化,可最大限度降低批次间差异的影响,确保组间比较反映的是处理组特异性效应,而非基线条件的差异。
为进一步实现各处理组数据的标准化,采用以下公式对变化百分比进行归一化处理(原文未列出具体公式,此处保留原文逻辑):该公式将数值集中在1附近,便于在统一尺度上解释参数的升高或降低。
数据分析使用R软件(4.3.3版本64)及stats64和emmeans65软件包进行,且对两种珊瑚物种分别开展分析。在进行统计检验前,分别采用夏皮罗-威尔克(Shapiro-Wilk)检验和巴特利特(Bartlett)检验,验证数据的正态性和方差同质性假设。
数据分析与结果
为评估实验结束时(48小时)各处理组对不同珊瑚物种的影响差异,在满足统计假设的情况下,对百分比变化数据进行单因素方差分析(ANOVA)。事后多重比较采用基于“emmeans”包的检验,并通过Benjamini–Hochberg(BH)方法校正P值。若数据不满足正态性或方差同质性假设,则采用非参数检验中的Kruskal–Wallis检验,后续 pairwise 比较使用Wilcoxon秩和检验,并通过BH方法校正P值。
为评估各处理组内珊瑚生理参数随时间的变化,若两个时间点的数据均满足正态性假设,则对原始数据进行双样本t检验;若其中一个或两个时间点的数据不满足正态性假设,则采用非参数Wilcoxon秩和检验。上述检验均针对每个物种的不同处理组单独进行。
为确保生理参数分析的可靠性,仅纳入实验结束时仍存活的珊瑚片段。死亡片段因无可用组织进行测定,被排除在光合效率(Fv/Fm)、叶绿素含量、氧气通量及蛋白质含量的分析之外;但死亡数据仍保留,用于分析各处理组对珊瑚存活率的影响。因此,这些参数的统计结果与图表均基于表1中所示的重复样本量得出。
表1 48小时实验结束后存活的鹿角珊瑚属(*Acropora* spp.)和焦黄滨珊瑚(*P. favosa*)片段数量,这些样本用于光合效率(Fv/Fm)、叶绿素含量、氧气通量及蛋白质含量的分析
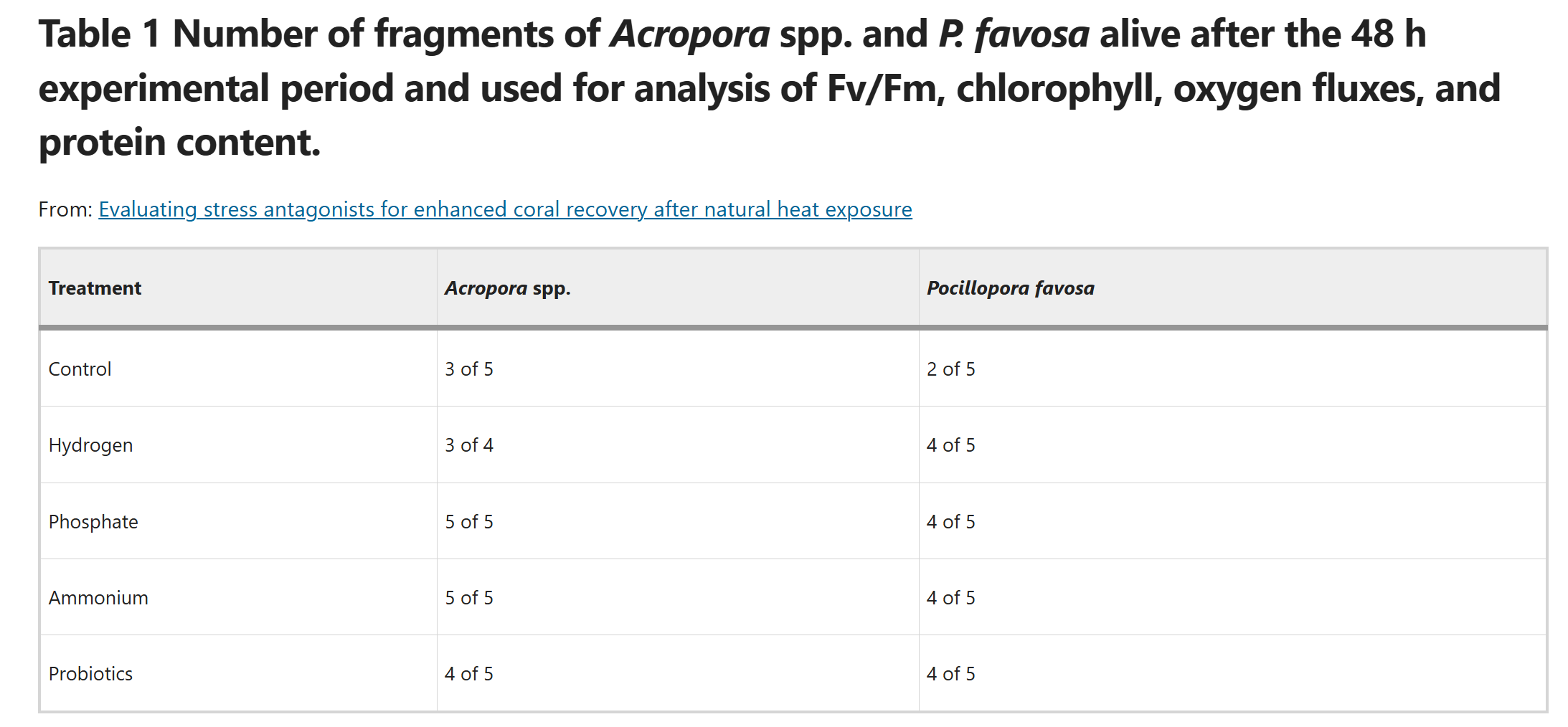
所有结果以P<0.05为统计学显著水平。本研究是对潜在应激拮抗剂辅助造礁珊瑚恢复的创新性探索,因此即使是未达到显著水平的结果也会被报告。那些未达统计学显著性的趋势,可作为未来在更严格实验条件下开展针对性研究的潜在指标。
结果
对照组处理
实验48小时结束后,鹿角珊瑚属(*Acropora* spp.)在阴性对照组中的存活率为5个片段存活3个(表1)。48小时内,其颜色灰度值下降8%(图3)、叶绿素a含量下降22%(图4)、叶绿素c2含量下降34%(补充图S2),但这些下降均无统计学显著性。此外,鹿角珊瑚属的光合效率(图5)和氧气通量随时间变化均无显著差异;不过,该组的净光合速率(Pnet)最高值达75.0毫克氧气·平方米·小时⁻¹,呼吸速率(R)最低值达-99.3毫克氧气·平方米·小时⁻¹,由此计算的总光合速率与呼吸速率比值(Pgross:R)为1.8(图6),是所有处理组中最高的。蛋白质含量未发生变化(补充图S4)。
图3 48小时实验期间鹿角珊瑚属和焦黄滨珊瑚的倒置平均灰度值百分比变化
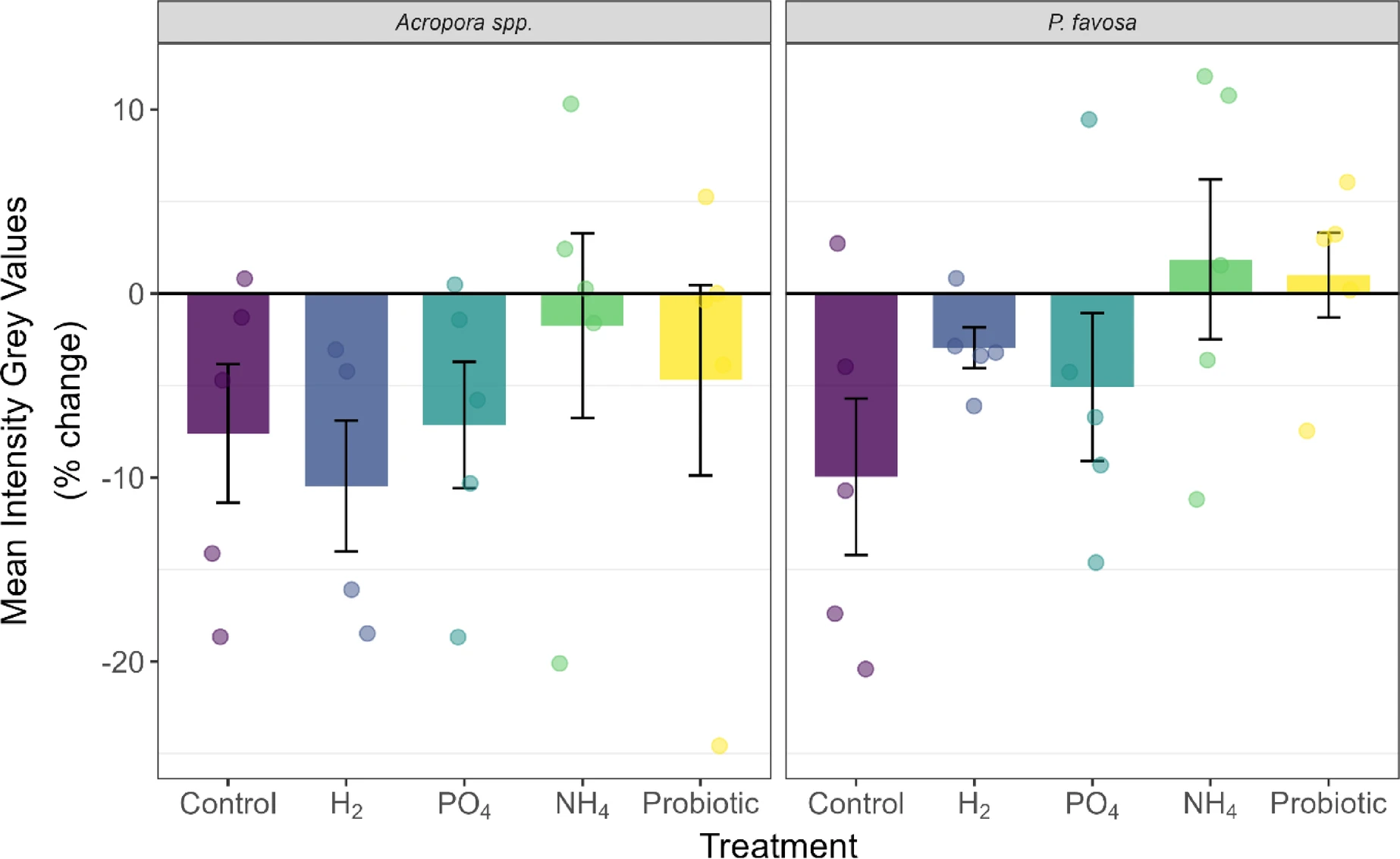
柱状图显示平均值百分比变化,误差线代表标准误;每个独立测定值以对应处理组颜色的圆点标注。
图4 48小时实验期间鹿角珊瑚属和焦黄滨珊瑚的叶绿素a浓度百分比变化
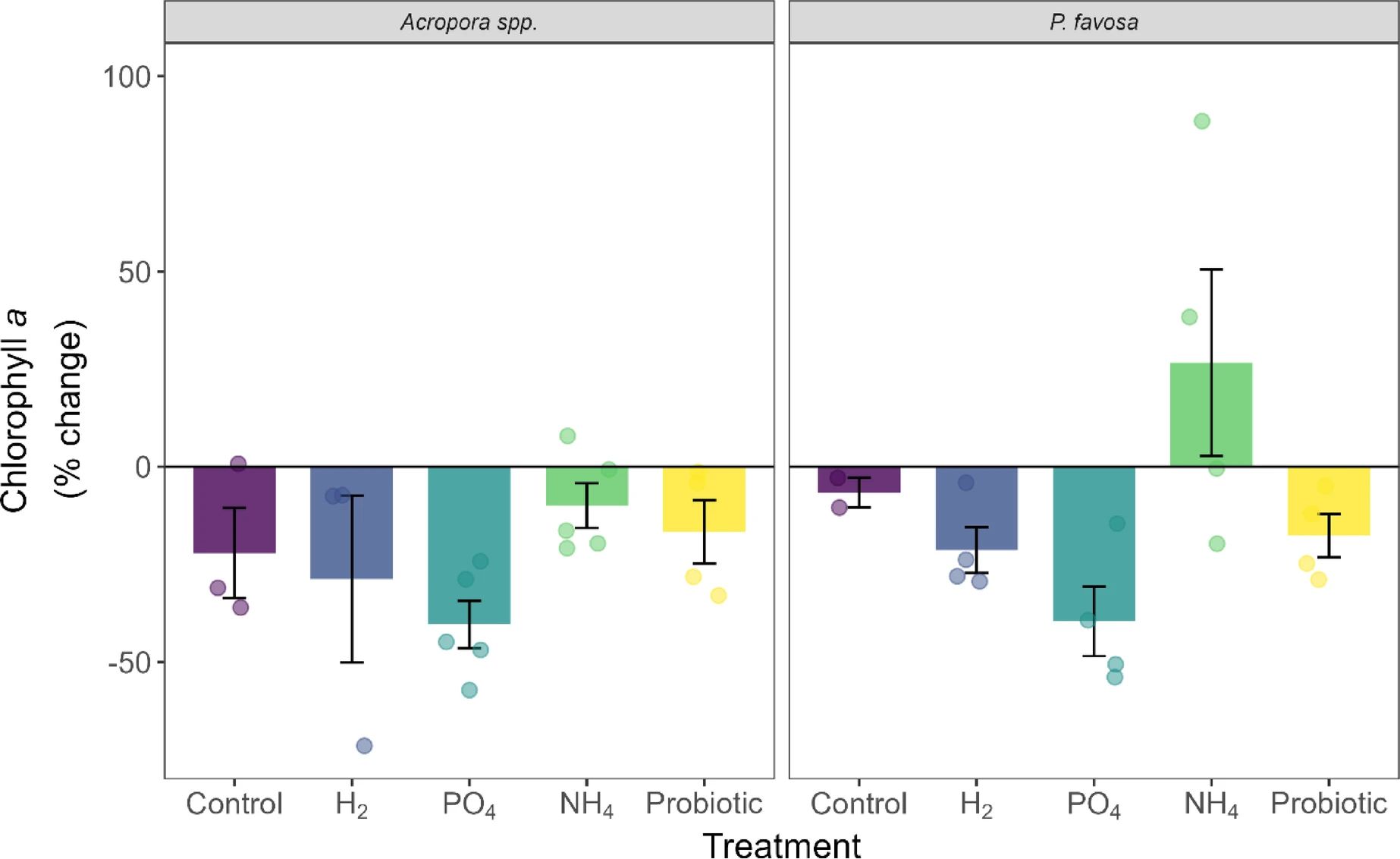
柱状图显示平均值百分比变化,误差线代表标准误;每个独立测定值以对应处理组颜色的圆点标注。
图5 48小时实验期间鹿角珊瑚属和焦黄滨珊瑚的光合效率(Fv/Fm)百分比变化
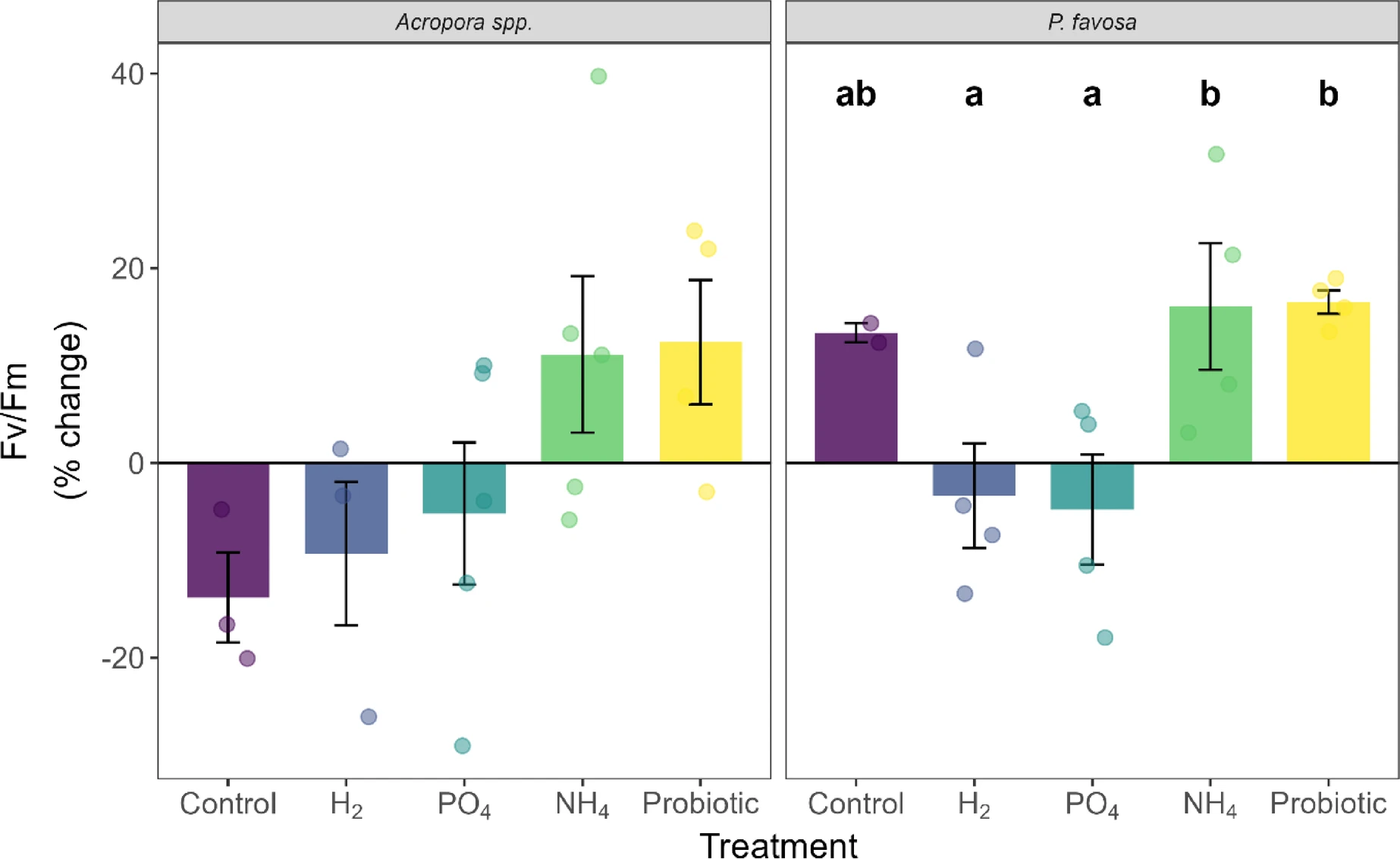
柱状图显示平均值百分比变化,误差线代表标准误;每个独立测定值以对应处理组颜色的圆点标注。柱上方不同字母表示处理组间存在显著差异(P<0.05)。
图6 48小时实验期间鹿角珊瑚属和焦黄滨珊瑚的总光合速率与呼吸速率比值(Pgross:R)
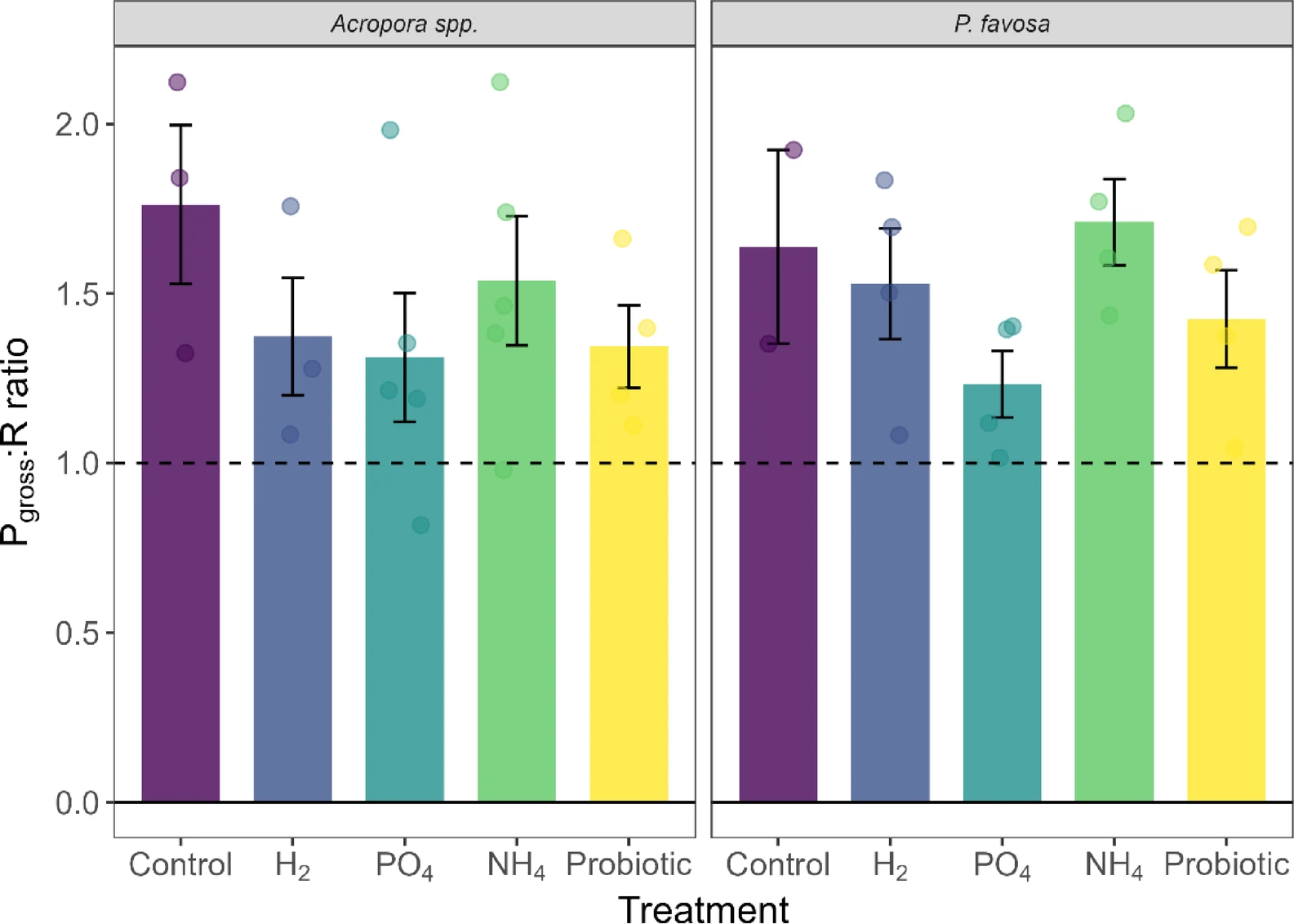
柱状图显示平均值百分比变化,误差线代表标准误;每个独立测定值以对应处理组颜色的圆点标注。虚线表示比值为1,高于虚线的值意味着能量获取大于能量消耗。
对于焦黄滨珊瑚(*P. favosa*),阴性对照组中5个片段仅存活2个(表1)。48小时内,其颜色灰度值下降10%(图3)——尽管无统计学显著性,但这是所有处理组中颜色损失最严重的,且与叶绿素a(图4)和叶绿素c2(补充图S2)各下降7%的趋势一致。值得注意的是,存活的2个片段光合效率随时间提升13%,但由于样本量较小,该变化无统计学显著性(图5)。氧气通量与其他处理组相近,总光合速率与呼吸速率比值(Pgross:R)为1.6(图6及补充图S3)。
氢气处理组
与对照组相比,氢气(H₂)处理组中鹿角珊瑚属的存活率为4个片段存活3个(表1)。此外,其颜色灰度值下降10%(图3),叶绿素a(图4)和叶绿素c2(补充图S2)浓度分别下降29%和18%;光合效率下降9%,与对照组降幅相近。该组总光合速率(Pgross)平均值为124.0毫克氧气·平方米·小时⁻¹,呼吸速率(R)平均值为-88.2毫克氧气·平方米·小时⁻¹,总光合速率与呼吸速率比值(Pgross:R)为1.4。但颜色、叶绿素含量及氧气通量的变化趋势均无统计学显著性(P>0.05)。
与之相反,氢气处理使焦黄滨珊瑚的存活率较对照组翻倍,达到5个片段存活4个(表1)。48小时内,其颜色灰度值和光合效率均下降3%,但无统计学显著性(P>0.05);叶绿素a和叶绿素c2分别损失21%和16%,同样无统计学显著性。富氢环境下的氧气通量与其他处理组无显著差异,总光合速率与呼吸速率比值(Pgross:R)为1.5。此外,蛋白质含量下降6%,但该变化无统计学显著性。
磷酸盐处理组
对于两种造礁珊瑚,磷酸盐(PO₄)处理均使存活率较对照组增加2个片段:鹿角珊瑚属实现5个片段全部存活(5/5),焦黄滨珊瑚存活率翻倍至5个片段存活4个(表1)。
值得注意的是,两种珊瑚的叶绿素a和叶绿素c2在该处理组中的降幅均为最大,其中焦黄滨珊瑚的叶绿素a和叶绿素c2含量随时间显著下降(叶绿素a:P=0.026;叶绿素c2:P=0.023),但与其他处理组相比,该降幅无统计学显著性(P>0.05;图4及补充图S2)。此外,磷酸盐富集环境下,两种珊瑚的呼吸速率均为最低——鹿角珊瑚属为-79.0毫克氧气·平方米·小时⁻¹,焦黄滨珊瑚为-84.9毫克氧气·平方米·小时⁻¹,但与对照组相比无显著差异(P>0.05)。结合所有处理组中最低的总光合速率(Pgross),鹿角珊瑚属和焦黄滨珊瑚的总光合速率与呼吸速率比值(Pgross:R)分别为1.3和1.2(图6)。
铵盐处理组
与磷酸盐处理类似,铵盐(NH₄)处理也使两种珊瑚的存活率增加2个片段:鹿角珊瑚属实现5个片段全部存活(5/5)(表1)。尽管其他生理参数无显著变化,但仍可观察到明显趋势:铵盐处理使珊瑚颜色灰度值降幅最小(仅-2%),叶绿素a和叶绿素c2分别下降10%和9%;48小时内光合效率提升11%(P=0.142,图5)。总光合速率(Pgross)和呼吸速率(R)与其他处理组相近,总光合速率与呼吸速率比值(Pgross:R)为1.5,在所有处理组中排名第二(图6)。富铵环境下,蛋白质含量下降15%(补充图S4)。
焦黄滨珊瑚在铵盐处理下的趋势与鹿角珊瑚属相似,存活率翻倍至5个片段存活4个(表1)。此外,铵盐处理使珊瑚颜色灰度值提升2%——这很可能是由于48小时内叶绿素a含量增加27%、叶绿素c2含量增加39%(尽管这些变化无统计学显著性)。值得注意的是,铵盐处理使焦黄滨珊瑚的光合效率随时间显著提升16%(P=0.026,图5),且显著高于氢气组和磷酸盐组(两组P值均为0.038),其总光合速率与呼吸速率比值(Pgross:R)达1.7,为所有处理组中最高(图6)。
益生菌处理组
益生菌处理使鹿角珊瑚属的存活率提升至5个片段存活4个(表1)。48小时内,其颜色灰度值下降5%,叶绿素a和叶绿素c2浓度分别下降17%和9%,但这些变化均无统计学显著性;不过,光合效率随时间显著提升12%(P=0.046,图5)。鹿角珊瑚属在该处理组中的总光合速率与呼吸速率比值(Pgross:R)为1.3。
益生菌处理使焦黄滨珊瑚的存活率翻倍至5个片段存活4个(表1)。其叶绿素a和叶绿素c2浓度分别下降18%和19%,但无统计学显著性(P>0.05);光合效率随时间显著提升17%(P=0.001,图5),且显著高于氢气组和磷酸盐组(两组P值均为0.038)。有趣的是,益生菌处理组的呼吸速率(R)最高,达-121.6毫克氧气·平方米·小时⁻¹,总光合速率(Pgross)也最高,达174.5毫克氧气·平方米·小时⁻¹(补充图S3),总光合速率与呼吸速率比值(Pgross:R)为1.4(图6)。
讨论
据我们所知,本研究首次比较了不同应激拮抗剂对海洋热浪(MHW)后珊瑚短期恢复的影响。研究旨在深入理解不同潜在应激拮抗剂作用下珊瑚的热应激恢复机制,从而为珊瑚“定制化修复手段”提供新工具66。由于所有测试的应激拮抗剂均能提高珊瑚片段的存活率(焦黄滨珊瑚在各处理组中的存活率甚至实现翻倍),因此建议根据不同海域的需求及现有后勤条件,综合应用这些研究成果。
氢气的作用
对照组珊瑚在48小时实验期间表现出明显的应激特征:存活率和颜色灰度值均为最低。而在富氢环境下,鹿角珊瑚属和焦黄滨珊瑚的存活率均有所提升——鹿角珊瑚属4个片段存活3个,焦黄滨珊瑚存活率翻倍至5个片段存活4个。在小鼠、大鼠及人类等其他生物中,氢气已被证实是一种强效抗氧化剂31,32,33。
根据珊瑚白化的氧化应激理论,热应激会导致共生藻的光合机制受损,产生活性氧(ROS);这些活性氧会扩散到珊瑚宿主细胞中,超出宿主抗氧化系统的清除能力,进而损伤宿主组织67,68。珊瑚最终能否恢复或走向死亡,取决于活性氧造成的氧化损伤程度:轻微的活性氧损伤可通过修复机制恢复,而关键细胞结构的不可逆损伤则会导致珊瑚死亡67。因此,氢气的抗氧化特性可能在海洋热浪后珊瑚恢复过程中发挥关键作用。
尽管对照组与氢气处理组的珊瑚片段在氧气通量上存在细微差异,但这些差异均无统计学显著性。鹿角珊瑚属片段初级生产力略有下降,可能是由于氢气抑制了固氮作用,导致氮可用性降低(氮是影响光合速率的关键营养盐)69,70。此外,本研究中观察到的珊瑚颜色灰度值和叶绿素含量轻微下降,也可能暗示氢气诱导的氮限制已开始显现——氢气是固氮菌固氮作用的竞争性抑制剂29,30,71,而氮限制会阻碍共生藻的生长72,73,这也能进一步解释光合速率下降的现象。
尽管如此,所有处理组的总光合速率与呼吸速率比值(Pgross:R)均大于1,这意味着珊瑚通过自养作用获取的能量仍大于消耗的能量74。此外,需特别指出的是,珊瑚可能经历了“热应激后紊乱(PHSD)”——这一术语由Santoro等人提出46,指珊瑚在热应激期结束后数天至数周内,仍会面临细胞、免疫及代谢层面的后续影响,包括炎症加剧、组织损伤、细胞凋亡,以及细胞膜和细胞骨架的重建等。其中部分影响在珊瑚片段出现明显白化迹象前就已触发,例如热应激期间营养循环的改变可能导致珊瑚-藻共生关系破裂,进而在后续阶段引发白化和死亡75。
总体而言,本研究揭示了氢气对珊瑚生理影响的复杂性。未来需进一步研究,从机制层面探索氢气对珊瑚共生体氮循环的作用,并在珊瑚礁群落层面评估其对周边其他生物的影响,以全面阐明氢气在珊瑚恢复中的角色。
磷酸盐的作用
磷酸盐处理使鹿角珊瑚属实现100%存活(5/5),焦黄滨珊瑚存活率较对照组翻倍(4/5),这凸显了磷酸盐作为应激拮抗剂在珊瑚短期恢复中的潜在有效性。以往研究表明,磷酸盐缺乏会对珊瑚-藻共生关系产生不利影响,包括降低白化阈值、损害藻的光合功能35,76。
此外,Rädecker等人提出75,热应激会增加珊瑚的代谢能量需求,珊瑚可通过分解代谢氨基酸或消化共生藻细胞来补偿能量缺口77。氨基酸的分解会导致珊瑚共生体从“净吸收铵盐”转变为“释放铵盐”,而释放的铵盐会促进共生藻增殖,而非为珊瑚宿主提供光合产物。这种反馈循环会逐渐改变珊瑚宿主与共生藻之间的营养循环状态75,可能进一步加剧磷酸盐限制。在此背景下,本研究结果表明,磷酸盐富集可缓解应激诱导的营养失衡,从而提高珊瑚存活率。
此外,Ezzat等人34的研究表明,补充磷酸盐(PO₄)并降低氮磷比(N:P),可在热应激条件下防止珊瑚白化并改善其光合性能。这提示,磷酸盐富集不仅能维持珊瑚健康,还可增强对珊瑚耐热性至关重要的生理过程。然而,尽管本研究凸显了磷酸盐富集对珊瑚短期恢复的潜在益处,其应用仍需谨慎。我们认为,磷酸盐富集作为预防性措施可能比热应激后的干预措施更有效。在热事件发生前或发生期间主动提高磷酸盐水平,有助于维持营养平衡、缓解应激诱导的营养限制,从而提前规避Rädecker等人75所述的负面反馈循环。
综上,本研究结果强调了在珊瑚保护策略中考虑营养动态(尤其是磷酸盐可利用性)的重要性。磷酸盐富集为增强珊瑚对热应激的恢复力提供了可能,也为珊瑚礁管理中的针对性干预措施开辟了潜在途径。
铵盐的作用
本研究表明,铵盐(NH₄)富集可提高鹿角珊瑚属(*Acropora* spp.)和焦黄滨珊瑚(*P. favosa*)的短期存活率:鹿角珊瑚属实现5个片段全部存活(5/5),焦黄滨珊瑚存活率翻倍至5个片段存活4个(4/5)。此外,与其他处理组相比,处于富铵环境中的珊瑚片段展现出最高的总光合速率与呼吸速率比值(Pgross:R),同时光合效率、叶绿素浓度及颜色灰度值均有所提升。这一观察结果与以往研究一致——此前研究发现,造礁珊瑚在3-20微摩尔铵盐富集环境中暴露2-5周后,共生藻密度和叶绿素浓度会显著增加37,38,39,78。
铵盐富集对珊瑚恢复的积极作用可归因于以下几点:首先,铵盐可解除共生藻的营养限制状态,使其生长速度快于其他处理组39,78;其次,在植物中,铵盐富集可通过促进核酸合成和蛋白质周转来加速分子修复79。
不仅单独的铵盐富集能产生积极效果,在热应激条件下,铵盐富集同样具有益处。Béraud等人36发现,热应激环境中,暴露于铵盐富集条件的珊瑚比仅受热处理的对照组具有更高的叶绿素浓度和光合速率。这与本研究中观察到的“焦黄滨珊瑚叶绿素水平和光合效率提升”趋势一致。Béraud等人36认为,这可能是由于珊瑚组织中光保护色素增加,进而保护细胞膜,使其光合速率相较于对照组得以维持。其次,Fernandes de Barros Marangoni等人37的研究也显示,与热应激对照组相比,铵盐富集环境下的珊瑚共生藻密度和叶绿素浓度更高,同时活性氧(ROS)浓度更低。该研究发现,铵盐富集可通过改善珊瑚共生体的氧化状态和能量代谢,来缓解热应激的有害影响——这可能是因为与对照组相比,铵盐富集促进了碳的获取及向宿主珊瑚的转运。此外,他们认为,维持正常的共生藻密度有助于珊瑚在热应激下维持内环境稳定。上述两项研究提出的机制,均能解释本研究中“富铵环境下珊瑚片段存活率更高、叶绿素浓度及颜色灰度值更佳”的整体结果:铵盐富集可能影响了光保护色素的含量并降低了活性氧浓度,从而使这些珊瑚片段在48小时内的热应激后紊乱(PHSD)程度整体降低。
尽管以往研究已证实铵盐富集对热应激下珊瑚生理的显著积极作用,且本研究通过“存活率提升、叶绿素浓度增加”进一步支持了这一结论,但铵盐的作用仍存在争议。研究表明,热应激还会导致珊瑚共生体从“净吸收铵盐”转变为“大量净释放铵盐”,这主要是由于珊瑚宿主通过氨基酸分解代谢产生的铵盐增多,进而引发共生藻排出(即珊瑚白化)75。而在本研究中,我们未观察到明显的铵盐净释放现象;相反,珊瑚表现出对铵盐的吸收——水样中铵盐浓度从实验初始的2微摩尔降至24小时后的1.2微摩尔,48小时后进一步降至0.6微摩尔。本研究中珊瑚对铵盐的吸收,可能是因为它们处于白化后的自然温度恢复期,而非正经历高温胁迫。
总体而言,研究表明氮的作用可能是有益的36,37,80,也可能是有害的35,70,81,82,83,84,具体取决于氮的浓度、环境条件及氮源类型。因此,在使用铵盐富集时,需结合珊瑚礁当前的氮浓度进行评估,将其作为“校正低氮水平”的手段,而非使其超过最适浓度。尽管本研究为铵盐富集对珊瑚短期恢复的益处提供了宝贵见解,但仍需进一步研究以阐明其长期影响。此前在红海中部开展的原位富营养化研究(将溶解无机氮水平提高至1.3微摩尔,其中大部分为硝酸盐)显示,这一操作虽有利于 turf藻( turf algae,即丛生藻)繁殖85,却对“藻主导”和“珊瑚主导”的珊瑚礁群落产生了异质性影响86,且有迹象表明,微生物氮循环不仅无法缓解富营养化,反而会通过增加固氮作用加剧珊瑚礁的富营养化程度87。未来若开展以“提高铵盐浓度”为主的长期跟踪实验,或可确定铵盐富集的临界阈值——超过该阈值后,铵盐的作用可能从有益转为有害,再次破坏珊瑚-藻共生关系。此外,还需研究该铵盐浓度对与造礁珊瑚存在竞争关系的其他底栖生物(如丛生藻、软珊瑚)的影响,以制定全面的处理方案:既要对珊瑚有益,又要避免意外促进藻类生长85。尽管如此,本研究结果仍凸显了铵盐作为“辅助珊瑚恢复的应激拮抗剂”的潜力,并强调在“旨在通过优化氮利用以缓解气候变化对珊瑚礁影响”的保护策略中,考虑营养动态的重要性。
益生菌的作用
使用定制化益生菌促进造礁珊瑚的短期恢复,是珊瑚保护领域的一个潜在方向。益生菌已成为珊瑚适应环境变化的快速策略(耗时数天至数周),而相比之下,通过突变和选择实现适应则需数年时间26。本研究中,益生菌处理所选用的菌株均基于其有益特性(包括缓解活性氧影响、参与氮循环等)筛选而来,旨在改善珊瑚健康状况并增强其恢复力26,88。这些益生菌可作为珊瑚共生体的保护剂,恢复珊瑚宿主与其相关微生物群之间的平衡关系,进而提升珊瑚的健康水平和存活率——这一过程甚至可能对整个生态系统产生积极影响89。
本研究发现,益生菌处理可提高鹿角珊瑚属和焦黄滨珊瑚的存活率:与对照组相比,两种珊瑚的存活率均提升至5个片段存活4个(4/5)。这一结果与以往研究一致——此前研究表明,暴露于“温度升高”等应激因素的珊瑚,在益生菌处理后存活率会提高46。此外,我们观察到益生菌处理组的珊瑚白化程度更低,这也与“热应激下益生菌处理可减少珊瑚白化”的既往研究结论相符45。Rosado等人42在研究中证实,在受控的水族箱环境中可对珊瑚微生物群进行调控,且这种调控能影响珊瑚健康。他们推测,益生菌可能推动了珊瑚微生物群的结构变化:抑制病原体生长,促进其他有益微生物定殖,从而间接降低珊瑚对致病菌的敏感性。
有趣的是,本研究中益生菌处理组的焦黄滨珊瑚片段展现出最高的呼吸速率。这可能是由于益生菌影响了珊瑚微生物群中的厌氧呼吸过程,进而可能促进代谢活性增强27,也可能与处理所用微生物本身的代谢活动有关。本研究观察到,鹿角珊瑚属和焦黄滨珊瑚的光合效率均有显著提升,分别增加12%和17%。以往研究也发现,与热应激对照组相比,益生菌处理可维持甚至轻微提高珊瑚的光合效率41,45,46。由于益生菌处理组的珊瑚白化程度较低、叶绿素含量降幅较小,这提示光合效率的提升可能是珊瑚有益微生物(BMC)缓解白化的结果。这些结果凸显了益生菌在“维持或增强对珊瑚健康及恢复力至关重要的关键生理过程”中的潜在作用。
综上,本研究强调了理解“益生菌改善珊瑚健康的直接和间接途径”的重要性,并为“益生菌对珊瑚短期恢复的益处”提供了新见解。以往研究表明,暴露于益生菌的珊瑚之所以应激耐受性增强,与热应激后恢复阶段珊瑚共生体内的基因表达、免疫反应及代谢变化密切相关46。通过推动珊瑚微生物群结构变化、增强代谢活性,益生菌为提升珊瑚对环境应激的恢复力提供了一种有潜力的策略。然而,仍需进一步研究以阐明益生菌作用的潜在机制,及其对珊瑚健康和生态系统动态的长期影响,尤其是在原位实验中验证其效果。
生态意义与展望
全球珊瑚礁正面临局部应激因素与气候变化的双重影响4,5。减少温室气体排放固然至关重要,但仍需采取积极的干预措施66。传统珊瑚礁管理措施已被证实有效,但主动干预措施正受到越来越多的关注90,91。这些措施涵盖从传统珊瑚繁殖,到“辅助进化”“微生物群调控”等新型手段25,66,92,93。尽管对这些手段进行风险评估必不可少,但当前迫切需要通过创新来提高珊瑚礁的恢复力和恢复速度66。
本研究中,所有测试的应激拮抗剂均提高了鹿角珊瑚属和焦黄滨珊瑚的存活率,其中焦黄滨珊瑚的存活率实现翻倍。这表明这些干预措施不仅能缓解热应激,还具有改善珊瑚恢复的普遍潜力34,36,45。然而,将实验室结果转化为野外应用并非易事。目前尚无针对整个珊瑚礁生态系统的“全礁尺度”应用案例(如为整个 reef 提供抗氧化剂、营养盐或益生菌),但美国国家科学院、工程院和医学院(NASEM,2019)建议借鉴农业领域的技术和方法寻找解决方案。此外,已有相关产品逐步涌现,例如通过不同递送方式88甚至自动化递送系统,将营养盐或益生菌储备液释放到珊瑚礁中。通过在珊瑚礁中安装此类系统并实现远程连接,不仅可在较长时间内为珊瑚礁施用目标拮抗剂,还能在白化预警出现时立即远程启动干预。尽管“全礁尺度”的大规模应用仍是重大挑战,但这些经测试的拮抗剂可立即用于针对性保护工作,例如保护高价值珊瑚礁区域、辅助苗圃移植珊瑚的存活、在受控环境中帮助濒危物种恢复,从而支持珊瑚的存活与恢复。此外,未来或可利用污水处理厂作为递送系统,向近岸珊瑚礁区域输送营养盐,实现更广泛的营养调控。
理解拮抗剂的最适浓度及其对生态系统的广泛影响至关重要。例如,失衡的营养比可能使珊瑚对热应激更为敏感35,94,或促进有害藻类繁殖85。因此,必须根据具体海域情况计算拮抗剂浓度,且浓度应控制在实现有益效果所需的最低水平。由于近期研究表明,益生菌在促进珊瑚健康的同时45,46,对周边环境无负面影响58,因此益生菌成为进一步原位研究的重要候选对象。基于我们对这些应激拮抗剂的新认知,可根据不同珊瑚礁的具体需求,开发更具针对性的珊瑚修复手段66。未来甚至可尝试将不同拮抗剂组合使用,但需首先在实验室中研究它们的相互作用,以确保不存在负面的叠加效应或协同危害95。通过衔接实验室研究与野外应用,我们可制定出针对性的保护策略,充分利用这些应激拮抗剂的潜力,缓解气候变化对珊瑚礁的影响。
https://wap.sciencenet.cn/blog-41174-1505625.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:释氢纳米酶缓解骨关节炎