博文
释氢纳米酶缓解骨关节炎
||
释氢纳米酶缓解骨关节炎
自释氢纳米酶通过减轻氧化应激和逆转线粒体功能障碍缓解骨关节炎
摘要
骨关节炎(Osteoarthritis, OA)是一种慢性退行性关节疾病,随着人口老龄化加剧,其发病率逐年升高,已成为重大的社会负担。尽管研究取得了一定进展,但骨关节炎的有效治疗方案仍十分有限。在骨关节炎病理过程中,慢性炎症会介导缺氧微环境形成,导致细胞能量需求增加。长期如此会引发线粒体功能障碍,促使活性氧(Reactive Oxygen Species, ROS)蓄积,进而加剧炎症循环。此外,衰老软骨细胞的自噬能力下降,无法有效清除受损线粒体,进一步加重氧化应激。本研究开发了一种简单且环境友好的策略,制备出可自发释放氢气的纳米酶(Se-HMPB@AB@COS)。该纳米酶通过抗氧化、抗炎及逆转线粒体功能障碍的机制,实现了骨关节炎的有效治疗。在氢气治疗过程中,小分子氢气可轻松穿透线粒体,特异性降低羟基自由基(•OH)水平,从而保护线粒体功能。研究进一步发现,氢气治疗能有效增强线粒体自噬(mitophagy),延缓软骨细胞衰老。在体内实验中,经硫酸软骨素(Chondroitin Sulfate, COS)包裹的Se-HMPB@AB@COS可显著促进Ⅱ型胶原蛋白合成,抑制细胞外基质降解,并降低炎症因子水平。综上,本研究创新性地合成了一种自释氢纳米酶,证实其可通过抑制氧化应激、减轻炎症、促进线粒体自噬及细胞外基质合成,减少软骨和线粒体损伤,延缓骨关节炎进展,为骨关节炎治疗提供了新方案。
Wang Q, Zhang M, Jiang W, Li D, Qi B, Shi S, Shi S, Yi C. Spontaneous hydrogen-releasing nanoenzyme alleviates osteoarthritis via oxidative stress reduction and mitochondrial dysfunction reversal. J Nanobiotechnology. 2025 Oct 11;23(1):662.
作者单位分别来自复旦大学、同济大学和上海交通大学。
引言
骨关节炎(OA)是一种累及整个关节的慢性进行性退行性疾病,病变范围包括关节软骨、软骨下骨、韧带、关节囊及滑膜组织[1]。目前,全球膝关节骨关节炎患者已超过2.5亿人,成为全球增长最快的健康问题之一[2]。骨关节炎的进展与多种因素密切相关,包括氧化应激、慢性低度炎症、软骨细胞增殖及细胞外基质合成减少、软骨细胞凋亡及细胞外基质降解[3]。关节损伤会导致细胞内自由基和活性氧水平升高,而线粒体是自由基攻击的主要靶点之一[4]。线粒体代谢紊乱会进一步促进活性氧生成,形成恶性循环。活性氧水平升高会引发软骨和滑膜的低度炎症,促使细胞外基质降解酶分泌增加,加速软骨降解;同时还会下调软骨特异性合成代谢基因(如聚集蛋白聚糖基因ACAN、Ⅱ型胶原蛋白α1链基因COL2A1)的表达,最终损害软骨细胞功能和关节结构[5,6]。目前,骨关节炎尚无根治方法,且由于疾病机制复杂,现有治疗手段无法阻止关节结构损伤,最多只能适度缓解症状[7]。
在线粒体是细胞内至关重要的细胞器,在分解代谢、合成代谢、细胞凋亡及信号转导过程中发挥核心作用。值得注意的是,在相对缺氧的微环境中,线粒体介导的有氧呼吸对软骨细胞能量代谢尤为关键[8]。随着骨关节炎进展,氧化应激会导致线粒体损伤,降低线粒体呼吸能力。这种线粒体代谢紊乱会进一步促进活性氧生成,加剧炎症反应和细胞外基质降解,形成加速软骨退变的恶性循环[9]。线粒体自噬是线粒体质量控制的主要机制,可选择性清除功能障碍的线粒体,从而降低软骨细胞的氧化应激和炎症水平[10]。因此,开发针对线粒体的新型骨关节炎干预策略具有重要前景,有望在亚细胞水平阻止软骨退变。
氢气治疗是一种极具潜力的治疗策略,其利用分子氢(H₂)作为安全的抗氧化剂,通过特异性清除活性氧中的羟基自由基,发挥抗氧化应激、抗炎及抗凋亡作用[11,12]。与一氧化氮(NO)、一氧化碳(CO)和硫化氢(H₂S)不同,氢气不会干扰红细胞的携氧能力,即使在高浓度下也无中毒风险[13]。此外,氢气可轻松穿透细胞膜,快速到达细胞核和线粒体,有效清除线粒体中过量的活性氧。研究表明,氢气可通过保护线粒体和调控线粒体自噬,对多种疾病发挥保护作用[14]。目前,分子氢主要以富氢水或氢气吸入的形式用于治疗,已证实其可通过选择性抗氧化机制保护脑缺血再灌注损伤[15]。然而,氢气溶解度低、扩散性强的特点,使其转化应用面临重大挑战。氨硼烷(Ammonia Borane, AB)的氢含量高达19.6 wt%,是公认的安全高效储氢释氢介质,可在酸性环境中通过缓慢反应持续供氢[16]。在骨关节炎的酸性微环境中,氨硼烷不仅能作为持续氢源,还可帮助调节关节内pH值[17]。
近年来,纳米酶系统因具有优异的活性氧清除能力,成为替代传统酶治疗多种炎症疾病的理想候选[18]。普鲁士蓝(Prussian Blue, PB)由Fe²⁺和Fe³⁺形成六氰合铁酸盐,具有多种酶活性,可高效清除活性氧。重要的是,普鲁士蓝具有良好的生物安全性,已被美国食品药品监督管理局(FDA)批准作为抗凝剂用于铊中毒的临床治疗[19,20]。多项研究证实,普鲁士蓝纳米酶可降低细胞内活性氧水平,发挥显著抗炎作用[21,22]。硒是维持氧化还原稳态的必需营养素和微量元素,大量研究表明,补充硒可作为改善骨关节炎进展的潜在治疗策略[23]。
本研究构建了一种基于富硒零价普鲁士蓝(Se-HMPB)的新型多功能纳米酶,该纳米酶可自发释放氢气,用于骨关节炎治疗(方案1)。首先合成具有中空腔结构的HMPB,随后在其表面沉积亚硒酸钠(Na₂SeO₃)层,并通过抗坏血酸将其还原为零价硒,制备得到Se-HMPB纳米酶颗粒;接着负载可持续释氢的氨硼烷,得到Se-HMPB@AB。该复合物具有优异的抗氧化应激性能,可有效减少线粒体活性氧蓄积,促进线粒体自噬;最后用硫酸软骨素(COS)包裹整个纳米酶——硫酸软骨素可抑制参与结缔组织代谢的细胞外蛋白酶,同时刺激软骨细胞合成蛋白聚糖,从而缓解骨关节炎[24]。多功能纳米酶Se-HMPB@AB@COS具有出色的线粒体保护和抗氧化应激能力,可保护软骨细胞、抑制细胞外基质降解,为骨关节炎治疗提供了一种极具潜力的策略。
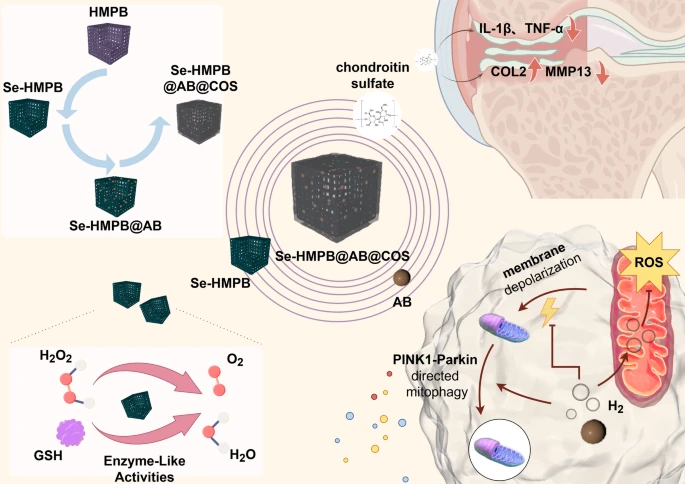
图1 Se-HMPB@AB@COS纳米酶的合成路径示意图
该纳米酶通过清除活性氧、抑制炎症、保护线粒体及促进基质合成,在骨关节炎治疗中展现出优异的软骨保护效果
方法
材料与试剂
聚乙烯吡咯烷酮(PVP K30)、抗坏血酸(VC)、亚硒酸钠(Na₂SeO₃)、氨硼烷(AB)、硫酸软骨素(COS)和过氧化氢(H₂O₂)购自阿拉丁试剂(上海)有限公司;铁氰化钾(K₃[Fe(CN)₆]·3H₂O)和盐酸(HCl)购自国药集团化学试剂有限公司;磷酸盐缓冲液(PBS)和杜氏改良 eagle 培养基(DMEM)购自大连美仑生物技术有限公司;0.25%胰蛋白酶-EDTA和青霉素-链霉素混合液购自苏州新赛美生物科技有限公司;胎牛血清购自上海威正翔禹生物科技有限公司;Ⅱ型胶原蛋白兔多克隆抗体(pAb)和基质金属蛋白酶13(MMP13)兔多克隆抗体购自Affinity Biosciences公司;Pink1兔多克隆抗体、Parkin小鼠单克隆抗体(mAb)、Lamp2小鼠单克隆抗体、Tomm20兔多克隆抗体、LC3B兔多克隆抗体和COX-2小鼠单克隆抗体购自Proteintech集团有限公司;P53兔多克隆抗体购自Cell Signaling Technology公司;小鼠白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)酶联免疫吸附测定(ELISA)试剂盒(货号U96-1494E、U96-3112E)购自上海优必比生物科技有限公司。
Se-HMPB@AB@COS纳米复合材料的制备
HMPB的制备在已有方法基础上稍作改良[25]:将198 mg K₃[Fe(CN)₆]和4.5 g PVP K30加入60 ml 0.01 M HCl溶液中,搅拌至形成澄清溶液,室温下继续搅拌30分钟;随后在80℃下静置加热20小时,不搅拌;反应结束后,通过离心(12000转/分钟,10分钟)收集普鲁士蓝(PB)颗粒,用乙醇和去离子水洗涤;取30 mg PB和300 mg PVP加入30 ml 1 M HCl溶液中,磁力搅拌,室温下反应4小时;将混合液转移至聚四氟乙烯反应釜中,140℃加热3小时;最后离心(12000转/分钟,10分钟)收集HMPB,用乙醇洗涤3次。
将等体积的Na₂SeO₃溶液(6 mg/ml)加入HMPB溶液(2 mg/ml)中,室温搅拌30分钟;缓慢加入等体积的VC溶液(12 mg/ml),室温反应3小时;离心收集Se-HMPB纳米复合材料,用去离子水洗涤后,通过透析袋(分子量截留值3500 Da)透析纯化。
将160 mg氨硼烷(AB)加入1 ml Se-HMPB溶液(10 mg/ml)中,室温搅拌24小时;离心收集Se-HMPB@AB纳米复合材料,用去离子水洗涤。
将1 ml硫酸软骨素(COS)溶液(2 mg/ml)加入1 ml Se-HMPB@AB溶液(1 mg/ml)中,搅拌12小时;离心收集Se-HMPB@AB@COS,用去离子水洗涤3次。
材料表征
采用布鲁克D8 Advance X射线衍射仪(Cu Kα辐射,λ=0.154 nm)分析样品的晶体结构;使用日本电子株式会社JEM-2100透射电子显微镜(加速电压200 kV)拍摄透射电镜(TEM)图像;通过日立U-2900分光光度计测定紫外-可见(UV-Vis)吸收光谱;利用安东帕Litesizer TM 500仪器测定样品的动态光散射(DLS)和ζ电位;采用赛默飞世尔ESCALAB 250Xi X射线光电子能谱仪(Al Kα激发源,1486.6 eV)获取X射线光电子能谱(XPS)。
Se-HMPB纳米复合材料中氨硼烷(AB)负载量的测定
采用热重分析(TGA)测定Se-HMPB中AB的负载量:取10 mg Se-HMPB@AB或Se-HMPB纳米复合材料,经冷冻干燥机过夜干燥;在氮气氛围下,以283 K/分钟的升温速率,将样品从298 K加热至1073 K,进行热重分析。
Se-HMPB@AB@COS纳米复合材料的氢气及离子释放测定
采用气相色谱(GC)建立不同体积氢气的标准曲线:首先制备不同pH值(pH 6.5和pH 7.4)的磷酸盐缓冲液(PBS),将其加入100 ml氩气环境下的搅拌反应釜中;向反应釜中加入30 mg Se-HMPB@AB@COS;在不同时间点抽取0.1 ml气体,通过Trace GC Ultra气相色谱系统定量测定氢气释放量。
为探究不同pH条件下硒(Se)和铁(Fe)离子的释放规律:将4 mg冷冻干燥的Se-HMPB@AB@COS纳米材料分散于2 ml不同pH值(pH 7.4和pH 5.6)的PBS溶液中,37℃振荡孵育;在预设时间点取样,离心(10000转/分钟,10分钟)后收集上清液;采用电感耦合等离子体发射光谱仪(ICP-OES)测定上清液中Se和Fe离子的含量,通过累积加法绘制离子释放的时间依赖性曲线。
体内氢气检测:将新鲜制备的5 mM亚甲基蓝(MB,Solarbio,中国)储备液与铂纳米颗粒(Sigma,德国)按1:4比例稀释,得到终浓度为1 mM的MB溶液;将干燥的Se-HMPB@AB@COS纳米酶溶解于该溶液中,用于关节内注射。亚甲基蓝在664 nm处有特征吸收峰,其吸光度下降与氢气释放相关[26,27],通过测定吸收峰强度降低程度定量分析纳米酶释放的氢气量。(体内氢气的释放,一定要使用气相色谱进行确认,否则可能只是测定的氢原子或还原能力。)
谷胱甘肽(GSH)消耗检测
以5,5'-二硫代双(2-硝基苯甲酸)(DTNB)为显色底物,评估Se-HMPB@AB@COS纳米复合材料对谷胱甘肽的消耗情况。实验设置6组:(1)阴性对照组:去离子水+1 mM GSH;(2)Se-HMPB@AB@COS组:400 μg/ml Se-HMPB@AB@COS +1 mM GSH;(3)阳性对照组:1 mM H₂O₂ +2 mM GSH;(4)Se-HMPB@AB组:400 μg/ml Se-HMPB@AB +1 mM GSH;(5)Se-HMPB组:400 μg/ml Se-HMPB +1 mM GSH;(6)HMPB组:400 μg/ml HMPB +1 mM GSH。各组在避光条件下孵育6小时后,向上清液中加入100 μl 1 mM DTNB,继续孵育5分钟,最后测定450 nm处的吸光度。
超氧化物歧化酶(SOD)样活性检测
采用超氧化物歧化酶(水溶性四氮唑盐-8)检测试剂盒,通过紫外-可见分光光度计在325 nm处测定不同处理组的吸光度,评估纳米酶的SOD样活性。
使用总超氧化物歧化酶检测试剂盒(WST-8法)验证纳米酶对超氧阴离子(O₂•⁻)的清除能力,构建酶促反应动力学曲线。实验严格按照试剂盒说明书操作:孵育30分钟后,离心收集上清液,用紫外-可见分光光度计测定450 nm处的吸光度。
Se-HMPB@AB@COS的自由基清除能力检测
2-苯基-4,4,5,5-四甲基咪唑啉-1-氧自由基(PTIO•)是一种氧中心自由基,可用于评价纳米酶的自由基清除性能。首先在PBS缓冲液中制备PTIO储备液,调整浓度至约0.18 mg/ml;取0.5 ml不同浓度的Se-HMPB@AB@COS溶液,分别与0.5 ml PTIO溶液混合;室温孵育1小时后,用紫外-可见分光光度计在557 nm特征波长处测定混合液中PTIO的吸光度。
动物实验
本研究方案已获得复旦大学附属浦东医院动物伦理委员会批准(批准号:20230920-2)。所有实验使用的C57小鼠购自北京查尔斯河实验动物技术有限公司,实验操作严格遵循ARRIVE指南[28],并尽最大努力减少小鼠的痛苦。
选取10周龄雄性野生型C57BL/6小鼠,对其右膝关节行前交叉韧带切断术(ACLT),通过建立机械不稳模型诱导实验性骨关节炎。将小鼠随机分为5组:假手术+生理盐水处理组、ACLT手术+生理盐水处理组、ACLT手术+Se-HMPB纳米颗粒处理组、ACLT手术+Se-HMPB@AB处理组、ACLT手术+Se-HMPB@AB@COS处理组。使用33号针头(Hamilton公司)和10 μl CASTIGHT注射器(Hamilton公司)对小鼠进行关节内纳米材料注射。在注射后2、4、6、12、24、48和72小时,通过活体成像检测荧光强度,并采用ICP-OES测定组织中铁和硒离子含量,以此监测纳米酶在小鼠膝关节内的蓄积和代谢情况。
组织学评估
在评估大体形态变化后,样本用乙二胺四乙酸(EDTA)脱钙至少两周。随后,对样本进行脱水、石蜡包埋处理,并切成4微米厚的切片。采用番红O-固绿染色法和苏木精-伊红(H&E)染色法对切片进行染色,以评估细胞形态和基质含量。
组织免疫荧光染色
免疫荧光染色步骤如下:将切片置于60℃烤箱中烘干2小时,随后用3%过氧化氢(H₂O₂)和0.5%曲拉通X-100(Triton X-100)处理。在室温下,用10%牛血清白蛋白(BSA)封闭非特异性结合位点1小时。之后,将切片与特异性一抗在4℃下孵育过夜。最后,加入山羊抗兔/鼠IgG H&L(Alexa Fluor® 488/594)二抗孵育,完成染色后在显微镜下观察切片,并选取合适区域进行成像。
显微计算机断层扫描(Micro-CT)检测
取小鼠右侧膝关节,经固定后进行Micro-CT扫描,扫描分辨率为6.534165微米,曝光时间为350毫秒。使用三维重建软件NRecon(软件版本V1.7.4.2,德国布鲁克公司)对所选图像进行重建;采用CTAnalyser软件(软件版本1.20.3.0,德国布鲁克公司)分析感兴趣区域(ROI)。设置统一参数后,通过软件计算组织的骨赘大小与成熟度、总体积(TV)、骨体积(BV)、体积比(BV/TV)及软骨下骨板厚度等参数。
结合Micro-CT检测结果与组织学评估结果,由3名不知情(盲法)的评估者采用国际骨关节炎研究协会(OARSI)评分系统对样本进行分级。
酶联免疫吸附测定(ELISA)
动物实验结束后,收集小鼠血清。按照试剂盒说明书,测定小鼠血清中白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的水平。
细胞培养与细胞活力检测
ATDC5细胞系购自上海CellVerse公司,由上海百奥维凡生物科技有限公司进行细胞鉴定。根据美国典型培养物保藏中心(ATCC)的说明书进行细胞培养。
采用细胞计数试剂盒-8(CCK-8,上海翊圣生物科技有限公司)检测细胞毒性:将ATDC5细胞以每孔1×10⁴个细胞的密度接种于96孔板,在37℃下培养24小时。分别用过氧化氢(H₂O₂)、H₂O₂+Se-HMPB、H₂O₂+Se-HMPB@AB、H₂O₂+Se-HMPB@AB@COS处理细胞后,置于正常培养条件下再孵育24小时。随后,每孔加入10微升CCK-8试剂,孵育30分钟,最后测定450纳米波长处的吸光度值。
线粒体膜电位(Δψm)检测
将ATDC5细胞接种于6孔板,孵育过夜后进行不同处理。之后,在避光条件下,用JC-1染色液于37℃孵育细胞20分钟,通过流式细胞术进行分析。线粒体膜电位(Δψm)的检测采用JC-1线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司),具体操作按试剂盒说明进行。
细胞凋亡检测
简要步骤如下:将ATDC5细胞接种于6孔板,培养24小时后进行不同处理。采用 Annexin V-FITC 凋亡检测试剂盒(上海碧云天生物技术有限公司)检测细胞凋亡情况,并用流式细胞仪(美国BD生物科学公司)进行分析。
细胞内活性氧(ROS)检测
采用2,7-二氯二氢荧光素二乙酸酯(DCFH-DA,美国MedChemExpress公司,新泽西州蒙茅斯章克申)检测细胞内活性氧水平。在避光条件下,用10纳摩尔/升的DCFH-DA于37℃孵育细胞0.5小时,用磷酸盐缓冲液(PBS)洗涤后,通过流式细胞仪(美国BD生物科学公司)进行检测。
丙二醛(MDA)、超氧化物歧化酶(SOD)及谷胱甘肽(GSH)检测
将细胞接种于6孔板,经不同处理后,收集指定组别的细胞裂解液。采用对应的检测试剂盒,按照试剂盒说明书分别测定谷胱甘肽(GSH)、丙二醛(MDA)和超氧化物歧化酶(SOD)的水平。
三磷酸腺苷(ATP)水平检测
采用增强型ATP检测试剂盒(上海碧云天生物技术有限公司)测定软骨细胞内的ATP水平。将细胞接种于6孔板,培养24小时后进行不同处理;再孵育24小时后,用ATP释放试剂裂解细胞内容物。将上清液转移至不透光的96孔板中,每孔加入100微升ATP检测液,使用多功能酶标仪测定发光强度。最后,根据细胞蛋白质浓度校正样本制备过程中因蛋白质含量差异导致的误差。
细胞免疫荧光染色
经处理的细胞用4%多聚甲醛固定15分钟后,用磷酸盐缓冲液(PBS)洗涤,再用曲拉通X-100(Triton X-100)通透处理5分钟。随后,用封闭液封闭细胞1小时;一抗按试剂盒说明书稀释后,于4℃下孵育细胞过夜。用PBST(含吐温-20的PBS)洗涤3次后,加入山羊抗兔/鼠IgG H&L(Alexa Fluor® 488/594)二抗,在室温(RT)下共孵育1小时。PBST洗涤完成后,滴加含4',6-二脒基-2-苯基吲哚(DAPI)的抗荧光淬灭封片液(北京索莱宝科技有限公司),最后用激光共聚焦显微镜观察分析细胞。
衰老相关β-半乳糖苷酶(SA-β-Gal)染色
分别采用SPiDER-βGal衰老检测试剂(日本同仁化学研究所)和衰老β-半乳糖苷酶染色试剂盒(上海碧云天生物技术有限公司)检测细胞衰老情况。细胞经不同处理后,按照不同试剂盒厂家提供的实验方案进行操作,最后在显微镜下观察结果。
线粒体自噬流检测
pCNP-mTagRFP-mWasabi-LC3慢病毒购自上海吉凯基因医学科技股份有限公司。将细胞接种于6孔板,随后与慢病毒工作液共孵育24小时;24小时后,用嘌呤霉素筛选阳性细胞。细胞经不同处理后,用共聚焦显微镜观察线粒体自噬流变化。
蛋白质印迹法(Western blot)分析
对ATDC5细胞进行相同处理后,用含蛋白酶抑制剂的RIPA裂解液提取蛋白质。随后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并将蛋白质转移至硝酸纤维素膜(美国密理博公司)上。用5%牛血清白蛋白(BSA)封闭膜2小时后,加入一抗于4℃下孵育过夜;之后,加入二抗在室温下孵育2小时,最后进行显影。采用Image J软件对增强化学发光(ECL)成像结果进行观察和分析。
统计学分析
连续变量以“均值±标准误(mean±SEM)”表示。采用双因素方差分析(two-way ANOVA)结合图基检验(Tukey’s test)及非配对t检验,评估不同时间点各组间的差异显著性。每项统计学分析中,每组至少包含3个独立样本。统计学分析采用GraphPad Prism 9.0软件(美国加利福尼亚州圣迭戈)进行。差异显著性判定标准为:*、P<0.05,**、#P<0.001,***、##P<0.0001。
结果与讨论
释氢纳米酶的合成与结构表征
本研究通过合理且高效的设计,合成了负载氨硼烷(AB)并包裹硫酸软骨素(COS)的释氢纳米酶,旨在增强骨关节炎(OA)治疗中的基质合成与抗炎活性。参照已有方法[29],首先合成普鲁士蓝纳米颗粒(PB NPs),随后在140℃下对其进行4小时刻蚀,构建中空介孔结构(HMPB)。之后,对该纳米颗粒进行亚硒酸钠(Na₂SeO₃)还原、AB负载及COS包裹处理,最终得到目标纳米酶Se-HMPB@AB@COS(图1A)。透射电子显微镜(TEM)图像显示,PB平均粒径为93 nm,呈清晰的立方体结构(图1B);刻蚀后,PB转变为具有中空腔体的HMPB结构。通过在HMPB表面包覆亚硒酸钠层,再经抗坏血酸将其还原为零价硒,随后负载AB,得到Se-HMPB@AB(图S1A);最后通过包覆COS,成功合成Se-HMPB@AB@COS。此外,元素 mappings结果显示,Se-HMPB@AB@COS中存在Fe、C、O、N、Se、B、S元素的分布(图1C)。

图2 释氢纳米酶的结构表征
(A)Se-HMPB@AB@COS的合成示意图;(B)PB、HMPB、Se-HMPB及Se-HMPB@AB@COS的TEM图像(比例尺=50 nm);(C)Se-HMPB@AB@COS的元素 mappings图像(比例尺=100 nm)
此外,通过动态光散射(DLS)验证了PB、Se-HMPB及Se-HMPB@AB@COS的水合粒径,其平均直径分别为215.05 nm、158.43 nm、255.69 nm(图3A)。包覆COS后,Se-HMPB@AB的表面zeta电位从-24.719 mV变为-36.947 mV(图3B)。拉曼光谱显示,HMPB与Se-HMPB均出现特征峰(图3C)。如图S1B所示,Se-HMPB@AB@COS的傅里叶变换红外(FTIR)光谱在1224 cm⁻¹和1381 cm⁻¹处出现特征峰,分别对应COS中S=O键和AB中NH₂基团的伸缩振动。
X射线衍射(XRD)结果显示,PB、HMPB及Se-HMPB纳米复合材料在17.48°、24.84°、35.41°、39.7°、43.74°和57.5°处均出现共同衍射峰,对应PB的(200)、(220)、(400)、(420)、(422)和(620)晶面(JCPDS卡片号73-0687)(图3D)。此外,X射线光电子能谱(XPS)分析表明,Se-HMPB@AB@COS中存在Se⁰以及Fe²⁺和Fe³⁺(图3E、F、S1G)。根据N₂吸附-脱附等温线,纳米颗粒的布鲁auer-埃米特-特勒(BET)比表面积有所降低,从HMPB的196.39 m²/g降至Se-HMPB的14.13 m²/g(图S1C、D);通过巴雷特-乔伊纳-哈伦达(BJH)法测定的孔径分布也从HMPB的8.95 nm变为Se-HMPB的4.59 nm(图S1E、F)。图1G中的热重(TG)曲线显示,Se-HMPB@AB中AB的负载量为9.05%(质量分数)。通过电感耦合等离子体发射光谱(ICP-OES)测定元素浓度,结果显示Se-HMPB@AB@COS中Se的质量分数为16.05%。
进一步通过气相色谱(GC)研究了Se-HMPB@AB@COS在不同pH(pH 6.5和pH 7.4)条件下的释氢行为。GC分析得到氢气的保留时间为1.271 min,并绘制了氢气标准曲线(图3H)。如图3I所示,pH 7.4条件下仅检测到少量氢气释放;而在pH 6.5条件下,60分钟后检测到大量氢气释放,表明Se-HMPB@AB@COS的释氢行为具有pH依赖性。同时,采用ICP-MS分析监测了不同pH条件下纳米酶的离子释放情况,结果一致显示,低pH条件下离子释放速率加快,从而使纳米酶具有更强的抗氧化能力(图S2)。随后,使用5,5'-二硫代双(2-硝基苯甲酸)(DTNB)检测谷胱甘肽(GSH)的消耗情况(图3J、S1H)。与其他组相比,Se-HMPB@AB@COS组的紫外-可见吸收光谱强度最高,且对GSH水平的清除作用最低。这一现象可解释为:在酸性条件下,Se-HMPB@AB@COS组可产生氢气,将氧化型谷胱甘肽(GSSG)有效还原为GSH,从而促进DTNB与GSH的反应。
鉴于超氧阴离子(O₂•⁻)是活性氧(ROS)的主要成分,而超氧化物歧化酶(SOD)作为细胞抗氧化防御的关键酶,可通过歧化作用将有毒的O₂•⁻转化为过氧化氢(H₂O₂)和氧气(O₂)。实验结果显示,Se-HMPB@AB@COS对O₂•⁻和2-苯基-4,4,5,5-四甲基咪唑啉-1-氧自由基(PTIO•)的清除能力显著提升(图3K、L、S3),表明氢气和COS可能增强了Se-HMPB@AB@COS的SOD模拟活性。
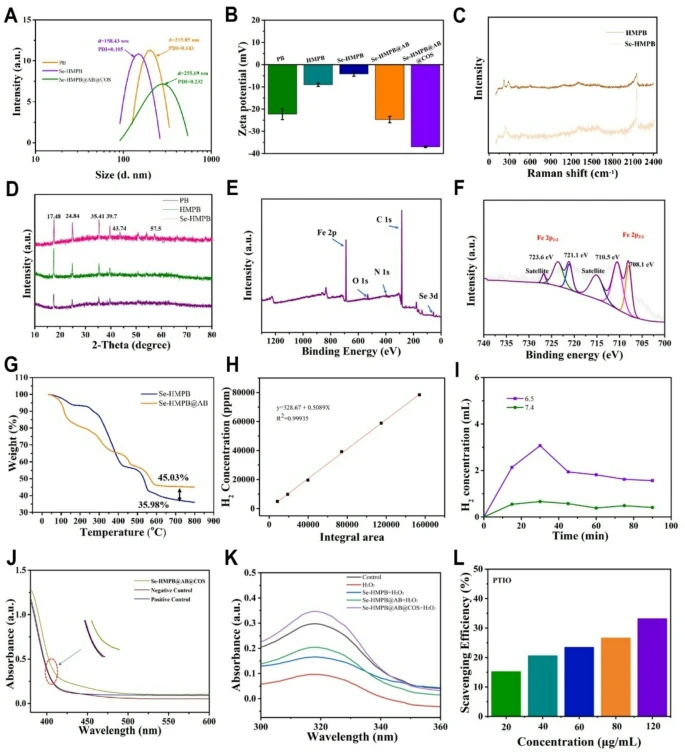
图3 释氢纳米酶的表征
(A)PB、Se-HMPB及Se-HMPB@AB@COS的水合粒径;(B)PB、HMPB、Se-HMPB、Se-HMPB@AB及Se-HMPB@AB@COS的表面zeta电位;(C)HMPB与Se-HMPB的拉曼光谱;(D)PB、HMPB及Se-HMPB的XRD图谱;(E、F)Se-HMPB@AB@COS中Se⁰、Fe²⁺及Fe³⁺的XPS分析;(G)AB与Se-HMPB@AB的TG曲线;(H、I)通过GC测定Se-HMPB@AB@COS在不同pH(pH 6.5和pH 7.4)条件下的释氢行为;(J)通过DTNB实验监测GSH消耗情况;(K)释氢纳米酶的SOD模拟活性;(L)纳米酶对PTIO•自由基的清除能力评估
#释氢纳米酶的细胞毒性及其对氧化应激的保护作用
采用细胞计数试剂盒-8(CCK8)评估Se-HMPB@AB@COS纳米酶的细胞毒性。如图4A所示,Se-HMPB、Se-HMPB@AB及Se-HMPB@AB@COS均表现出良好的生物相容性和极低的细胞毒性:低浓度时,纳米酶的细胞毒性可忽略不计,且其强大的抗氧化应激能力可促进细胞增殖,使细胞活力高于未处理组;高浓度(100 μg/ml以上)时,纳米酶仅表现出微弱的细胞毒性,远低于半数抑制浓度(IC50)。值得注意的是,与其他纳米酶相比,包覆硫酸软骨素的纳米酶在高浓度下仍保持显著更低的细胞毒性,即使在200 μg/ml浓度下,细胞活力仍维持在82.9%。
此外,通过流式细胞术研究了包覆硫酸软骨素的纳米酶对不同浓度H₂O₂诱导的ROS的拯救作用(图S4)。低浓度下,随着纳米酶浓度升高,其对细胞ROS的抑制作用增强;在20-40 μg/ml浓度范围内,纳米酶对细胞ROS的抑制效果最佳。基于上述结果,最终选择20 μg/ml作为后续实验的治疗浓度。
为评估Se-HMPB@AB@COS纳米酶对软骨细胞的治疗效果,通过添加H₂O₂构建高氧化应激诱导的炎症微环境。如图4A所示,H₂O₂处理组的细胞活力显著下降,表明H₂O₂诱导的高ROS水平对细胞造成严重损伤;而添加纳米酶后,细胞活力显著提升,且氢气释放表现出更明显的细胞保护作用。
2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)是一种用于检测ROS的荧光探针,其本身无荧光,可自由穿过细胞膜进入细胞;在细胞内ROS作用下,无荧光的DCFH会被氧化为具有荧光的DCF[30]。如图4B、S5所示,在相同浓度下,Se-HMPB@AB@COS对细胞内ROS的清除能力显著强于Se-HMPB和Se-HMPB@AB。丙二醛(MDA)作为氧化反应的关键副产物,是评估氧化应激的有效标志物[31],其水平变化可有效反映一段时间内细胞内的整体ROS水平。如图4C所示,H₂O₂处理24小时后,细胞内MDA水平显著升高;而添加纳米酶后,这一变化被逆转,表明H₂O₂诱导的高ROS水平得到有效抑制,氧化反应副产物减少,细胞进一步损伤被阻止。
谷胱甘肽(GSH)是细胞抗氧化系统的重要组成部分,在清除过量ROS和外源物质解毒过程中,细胞内GSH水平会显著下降。如图4C所示,Se-HMPB纳米酶可有效逆转H₂O₂氧化导致的GSH水平下降;且在相同浓度下,与Se-HMPB和Se-HMPB@AB相比,Se-HMPB@AB@COS能更显著地提升被H₂O₂氧化的GSH水平。Se-HMPB本身具有丰富的氧化还原电位,可表现出多种类酶活性(如SOD活性),能催化超氧化物转化为超氧阴离子(O₂•⁻)和过氧化氢[32]。采用吸光度(OD)检测试剂盒评估纳米酶对O₂•⁻的清除能力,结果显示Se-HMPB@AB@COS的清除能力优于另外两种材料。纳米酶的SOD模拟活性与O₂•⁻的清除直接相关,表明氢气的治疗作用显著增强了Se-HMPB@AB@COS的SOD模拟活性。
ROS可介导脂质过氧化,产生4-羟基壬烯醛等相关产物,进而导致包括凋亡在内的多种细胞死亡形式[33]。采用膜联蛋白V(Annexin V)与碘化丙啶(PI)双染色法检测细胞凋亡阶段,以进一步评估Se-HMPB@AB@COS的保护作用。如图4D所示,H₂O₂模型组的凋亡细胞比例(尤其是早期凋亡)显著升高;而与纳米酶共孵育后,凋亡细胞比例显著下降。其中,Se-HMPB@AB@COS对细胞的保护作用最强:与H₂O₂模型组相比,早期凋亡率从31.3%降至7.05%,晚期凋亡率从24.9%降至5.59%,表明释氢纳米酶具有显著的细胞保护作用。
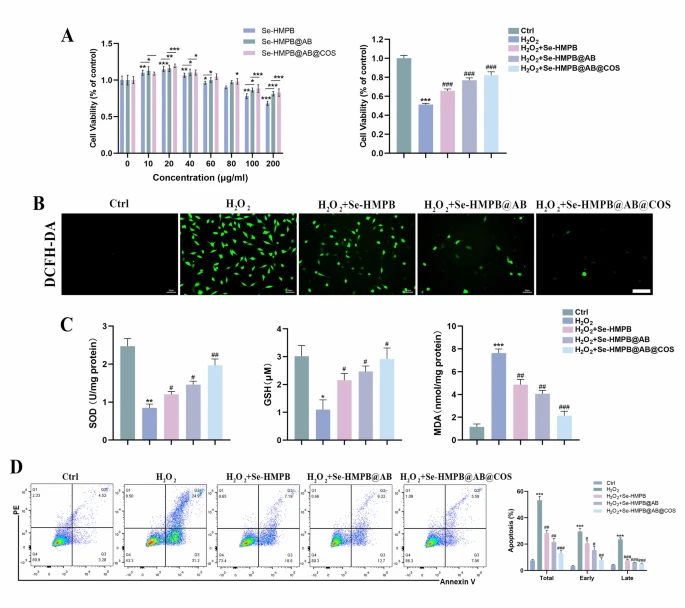
图4 释氢纳米酶对H₂O₂诱导的软骨细胞氧化损伤的保护作用
(A)Se-HMPB、Se-HMPB@AB及Se-HMPB@AB@COS处理24小时后软骨细胞的活力,以及H₂O₂条件下不同纳米酶处理后的软骨细胞活力(每组n=6个独立生物学重复);(B)不同处理后软骨细胞中DCFH-DA染色的ROS荧光图像(比例尺=100 μm,每组n=3个独立生物学重复);(C)不同处理后软骨细胞中GSH水平、MDA含量及SOD活性(每组n=3个独立生物学重复);(D)H₂O₂条件下不同纳米酶逆转软骨细胞凋亡的Annexin V-FITC/PI双染色结果(每组n=3个独立生物学重复)。所有定量数据均以“均值±标准误(mean±SEM)”表示;采用单因素方差分析(one-way ANOVA)结合图基-克莱默检验(Tukey-Kramer test)进行统计分析;NS表示无显著性差异,*、p<0.05,**、#p<0.001,***、##p<0.0001
释氢纳米酶对线粒体功能的保护作用
线粒体是细胞内多种重要生命活动的核心场所,其功能包括但不限于电子传递与氧化磷酸化、三羧酸循环(TCA循环)、脂肪酸β-氧化、氨基酸合成、钙稳态,以及铁代谢(尤其是血红素和铁硫簇的生物合成)[34]。在细胞内,线粒体是绝大多数ROS的产生来源(电子传递过程中不可避免的副产物);而遗憾的是,线粒体自身极易受到ROS介导的氧化损伤,进而导致线粒体功能障碍[35]。值得注意的是,线粒体关键功能的丧失或受损主要表现为线粒体膜去极化(或线粒体膜电位丧失)、ROS产生异常,以及三磷酸腺苷(ATP)生成减少[36]。
在图5A中,首先通过线粒体膜电位(MMP)检测评估线粒体功能。MMP一直是反映细胞功能状态的重要指标,氧化还原稳态失衡会破坏线粒体膜稳定性,导致MMP降低[37]。ATDC5细胞经H₂O₂处理后,可观察到高比例的单体(51%)和最低比例的聚集体;而Se-HMPB通过抑制氧化应激对线粒体发挥保护作用,聚集体比例更高、单体比例更低(36%)。氢气可轻松穿透细胞内的线粒体膜,清除线粒体内过量的ROS。研究表明,氢气的保护作用可能主要依赖于其独特的穿透能力,通过激活Kelch样环氧氯丙烷相关蛋白1-核因子E2相关因子2(Keap1-Nrf2)II相抗氧化系统来调节线粒体稳态[38]。Xie等人的研究显示,氢气治疗可提高小鼠的7天存活率和认知功能,并显著增强线粒体功能(如MMP、ATP水平、复合体I活性)[39]。实验结果显示,Se-HMPB@AB和Se-HMPB@AB@COS纳米酶均表现出更优异的线粒体保护功能:在JC-1实验中,两者的单体比例(分别为26.9%和18.1%)均低于单纯的Se-HMPB。
线粒体最重要的功能是通过呼吸作用产生能量,而ROS水平升高会使线粒体代谢中的关键酶(如α-酮戊二酸脱氢酶、顺乌头酸酶)失活,导致ATP生成减少[40]。对H₂O₂损伤的软骨细胞施加纳米酶后,ATP浓度得到有效恢复;其中Se-HMPB@AB@COS组的ATP水平更高,甚至接近对照组(ctrl组),表明Se-HMPB@AB@COS可有效保护线粒体功能(图5B)。
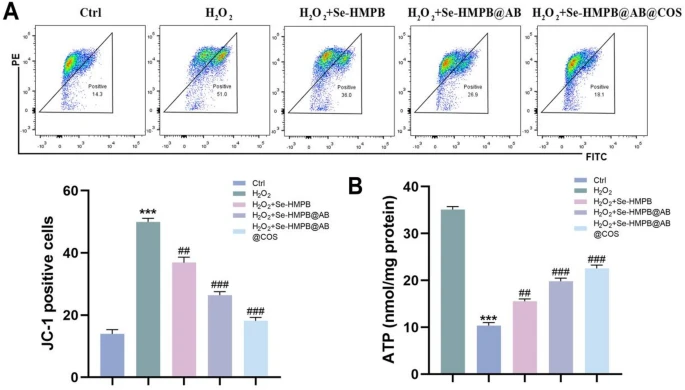
图 5释氢纳米酶可逆转线粒体功能障碍
(A)采用流式细胞术对不同处理后软骨细胞的线粒体膜电位进行定量分析。每组包含3个独立生物学重复。
(B)H₂O₂条件下,经Se-HMPB、Se-HMPB@AB和Se-HMPB@AB@COS处理的ATDC5细胞的ATP水平。每组包含3个独立生物学重复。
所有定量数据均以“均值±标准误(mean±SEM)”表示;采用单因素方差分析(one-way ANOVA)结合图基-克莱默检验(Tukey-Kramer test)进行统计分析;NS表示无显著性差异,#p<0.001,***、##p<0.0001。
释氢纳米酶通过线粒体自噬调控细胞衰老
骨关节炎(OA)的发生发展与关节组织内衰老细胞数量增加相关。衰老是一种特定的细胞状态,其特征为细胞周期永久性停滞,且向周围微环境持续释放有害的促炎分子,这一现象被称为衰老相关分泌表型(SASP)。该表型会导致细胞增殖能力下降、组织再生受损及功能障碍[41]。在关节中,衰老诱导的细胞代谢重编程会触发骨关节炎发病机制,并随时间推移加剧骨关节炎的严重程度。
首先,我们采用P53免疫荧光染色和衰老相关β-半乳糖苷酶(SA-β-Gal)检测来评估细胞衰老。在ATDC5细胞中,通过低浓度H₂O₂(5 μm)诱导细胞衰老,导致细胞核内P53表达显著增加(图6A、S6A)。同样,SA-β-Gal染色阳性的衰老细胞比例也显著升高(图6B)。然而,经Se-HMPB、Se-HMPB@AB和Se-HMPB@AB@COS纳米酶处理后,P53表达显著降低;同时,释氢纳米酶有效缓解了H₂O₂孵育诱导的SA-β-Gal染色阳性细胞比例升高,进一步表明其在减轻细胞衰老方面的有效性。
为更直观、详细地了解细胞衰老情况,我们采用新型SPiDER-βGal试剂(可在单细胞水平分析衰老)进行检测。由图6C可见,H₂O₂组细胞的SA-β-半乳糖苷酶水平显著升高;而添加纳米酶后,细胞衰老水平显著降低。值得注意的是,氢气治疗的效果更为显著,可有效逆转细胞衰老。
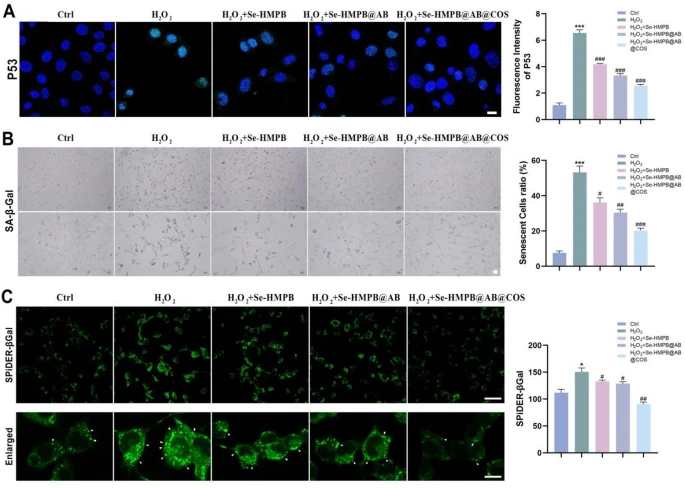
图6 释氢纳米酶可有效缓解软骨细胞衰老
(A)H₂O₂条件下,经不同纳米酶孵育后软骨细胞的代表性荧光图像及定量分析。绿色荧光代表P53蛋白,蓝色荧光代表细胞核(DAPI染色)。比例尺=10 μm。每组包含3个独立生物学重复。
(B)SA-β-Gal染色的代表性图像及衰老阳性细胞占软骨细胞总数的比例。比例尺=30 μm。每组包含3个独立生物学重复。
(C)新型SPiDER-βGal试剂在单细胞水平分析衰老的代表性图像。比例尺=50 μm和10 μm。每组包含3个独立生物学重复。
所有定量数据均以“均值±标准误(mean±SEM)”表示;采用单因素方差分析(one-way ANOVA)结合图基-克莱默检验(Tukey-Kramer test)进行统计分析;NS表示无显著性差异,*、p<0.05,#p<0.001,***、##p<0.0001。
线粒体自噬是通过自噬机制选择性清除受损或功能障碍线粒体的过程,在维持线粒体质量控制和稳态中发挥关键作用[42]。线粒体自噬对骨关节炎(OA)的进展至关重要:在骨关节炎发展过程中,线粒体功能障碍会导致活性氧(ROS)负荷增加和线粒体自噬水平降低;而线粒体自噬减少会导致受损线粒体无法被有效清除,进而加剧组织损伤并推动骨关节炎进一步发展[43]。此外,在衰老过程中,线粒体功能会逐渐下降,表现为ROS生成增加、线粒体DNA(mtDNA)突变、蛋白质氧化、能量代谢异常及线粒体自噬减少[44]。线粒体自噬减少的直接后果是线粒体质量控制失效;由于线粒体质量控制崩溃和线粒体缺陷累积,功能障碍线粒体不断聚集,最终导致细胞衰老和死亡[45]。
在图7A中,我们采用线粒体标志蛋白Tomm20和溶酶体标志蛋白Lamp2对细胞进行双荧光染色。结果显示,H₂O₂组中Tomm20的荧光表达显著增强,表明受损线粒体聚集;而Lamp2(一种高度保守且普遍存在的线粒体自噬关键蛋白)的荧光在H₂O₂组中显著减弱,反映线粒体自噬水平降低[46]。经Se-HMPB纳米酶处理后,Tomm20荧光减弱,Lamp2荧光增强;值得注意的是,Se-HMPB@AB处理后荧光强度变化更为显著(Tomm20荧光降低、Lamp2荧光增强),表明氢气治疗可有效增强线粒体自噬并恢复细胞稳态;而Se-HMPB@AB@COS纳米酶对线粒体自噬的增强效果最为显著。
PINK1-Parkin-LC3通路是线粒体自噬中的关键通路:在受损线粒体中,PINK1会在线粒体外膜聚集,招募Parkin并使其磷酸化,进而介导其与LC3结合,最终实现受损线粒体的降解[47]。为进一步证实细胞内线粒体自噬的发生,我们对该过程中的两个关键蛋白Parkin和LC3B进行双荧光共定位分析(图7B、D)。结果显示,H₂O₂处理后,Parkin和LC3B的表达水平均显著降低,且二者共定位系数显著下降,表明线粒体自噬活性受到抑制;而纳米酶可有效增强这两种线粒体自噬相关蛋白的表达,并显著提高其共定位水平。此外,氢气治疗对线粒体自噬具有显著的刺激作用,表现为蛋白共定位水平进一步升高,凸显其作为线粒体自噬强效增强剂的潜力。
监测自噬流是分析自噬的关键手段,而利用串联荧光标记LC3(mTagRFP-mWasabi-LC3)是监测自噬流的便捷方法[48]。该方法基于Wasabi和mRFP两种荧光蛋白的pH稳定性差异:Wasabi对酸敏感,而mRFP的荧光表达具有稳定性。当自噬体进入第二阶段并与溶酶体融合形成自噬溶酶体时,自噬溶酶体内的酸性环境会导致Wasabi荧光淬灭,据此可检测线粒体自噬流。结果显示,细胞受损后,线粒体自噬发生水平显著下降(图7C),红色和绿色斑点均显著减少,且绿色斑点减少更为明显,表明早期线粒体自噬水平大幅降低;而添加纳米酶后,绿色斑点数量显著增加,表明早期线粒体自噬得以恢复;此外,氢气治疗可使红色和绿色斑点数量均显著回升,明显促进线粒体自噬恢复。
随后,通过蛋白质印迹法(Western blot)进行蛋白水平验证,结果显示纳米酶处理可显著增强Pink1和Parkin的表达水平,且氢气治疗的效果更为显著,从而有效增强线粒体自噬(图7E)。最后,我们评估了软骨细胞损伤治疗过程中Ⅱ型胶原蛋白(COLII)和基质金属蛋白酶13(MMP13)的变化,结果显示Se-HMPB@AB@COS纳米酶在逆转H₂O₂诱导的软骨损伤方面效果最为显著(图7E)。上述结果表明,释氢纳米酶可显著促进线粒体自噬,有助于减轻细胞衰老,延缓骨关节炎进展。
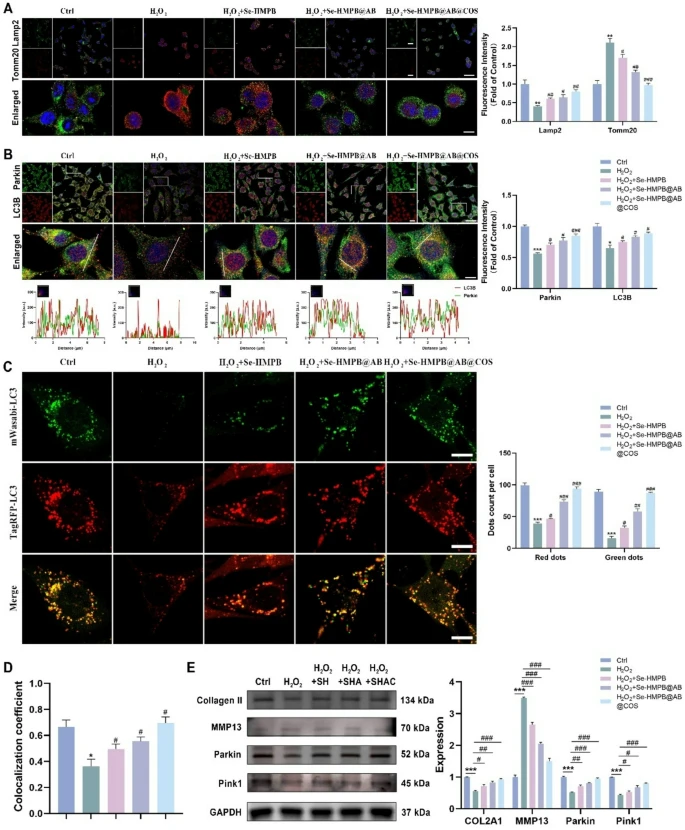
图7 释氢纳米酶可清除受损线粒体并促进线粒体自噬
(A)抗Lamp2(绿色)与抗Tomm20(红色)共染色细胞的代表性图像及荧光定量分析。比例尺=50 μm和5 μm。每组包含3个独立生物学重复。
(B)抗Parkin(绿色)与抗LC3B(红色)共染色细胞的代表性图像及荧光定量分析。比例尺=50 μm和5 μm。每组包含3个独立生物学重复。
(C)采用pCNP-mTagRFP-mWasabi-LC3慢病毒检测细胞线粒体自噬流的代表性荧光图像及定量分析。比例尺=20 μm。每组包含3个独立生物学重复。
(D)Parkin与LC3B蛋白的共定位系数分析。每组包含3个独立生物学重复。
(E)通过蛋白质印迹法检测并定量Ⅱ型胶原蛋白(COLII)、基质金属蛋白酶13(MMP13)、Parkin和Pink1的蛋白水平。每组包含3个独立生物学重复。
所有定量数据均以“均值±标准误(mean±SEM)”表示;采用单因素方差分析(one-way ANOVA)结合图基-克莱默检验(Tukey-Kramer test)进行统计分析;NS表示无显著性差异,*、p<0.05,**、#p<0.001,***、##p<0.0001。
释氢纳米酶缓解C57BL/6小鼠骨关节炎进展
为进一步研究释氢纳米酶在体内对骨关节炎的缓解作用,我们通过前交叉韧带切断术(ACLT)建立小鼠骨关节炎模型,并采用不同纳米颗粒对其进行治疗。如图7A所示,术后2周通过关节内注射给予纳米酶(5 mg/ml,10 μl),每2天注射1次,持续2周。作为对照,接受ACLT手术的骨关节炎模型小鼠(OA膝关节)和假手术小鼠(正常膝关节)在相同时间点注射生理盐水。ACLT手术后8周处死小鼠。对心、肝、脾、肺、肾5个重要脏器的HE染色结果表明,该纳米酶在体内无明显毒性(图S6B)。通过膝关节活体成像及关节内硒(Se)、铁(Fe)含量检测发现,纳米酶可在关节腔内发挥长效作用(图7B、C)。同时,采用亚甲基蓝还原法,我们成功检测到关节腔内纳米酶释放的氢气(图S8)。
通过显微计算机断层扫描(Micro-CT)图像重建对各组小鼠关节进行观察,结果显示ACLT组小鼠关节间隙变窄、软骨退变显著且骨赘形成增多(图8D);而添加纳米酶后,上述情况显著改善,其中氢气治疗可使骨骼形态更接近正常组,骨赘形成更少且成熟度更低;Se-HMPB@AB@COS中硫酸软骨素的辅助作用进一步缓解了软骨退变。骨赘评分主要体现在骨赘的大小和成熟度上:ACLT组形成明显骨赘,且大小和成熟度均较高,表明模型构建成功;纳米酶治疗后,骨赘大小和成熟度显著降低,而氢气治疗的治疗效果更为显著(图8F)。此外,所有5组小鼠的软骨下骨板厚度(SBP.Th)测量趋势与骨赘评分结果一致(图8F)。
在小鼠骨关节炎模型中,骨体积/组织体积(BV/TV)是量化骨组织体积与总体积比值的关键参数,通常以百分比表示,计算公式为骨体积除以总体积[49]。定量结果显示,ACLT组和假手术(Sham)组的BV/TV值分别为32.1%和62.9%;Se-HMPB组和Se-HMPB@AB组的BV/TV值分别为36.7%和42.6%;值得注意的是,Se-HMPB@AB@COS纳米酶组的BV/TV值为48.7%,最接近假手术组(图8F)。
随后,我们对术后8周收集的膝关节标本进行固定、包埋和切片,然后通过苏木精-伊红(H&E)染色和番红O-固绿(SO-FG)染色进行组织学观察(图7E)。H&E染色结果显示,ACLT组关节表面出现裂纹和变形,这是关节软骨侵蚀最严重的两种表现;Se-HMPB组和Se-HMPB@AB组也存在一定程度的侵蚀,但Se-HMPB@AB组软骨表面损伤较轻,而Se-HMPB@AB@COS组软骨形态完整性最佳,与假手术组相似。SO-FG染色结果显示,ACLT组糖胺聚糖和蛋白聚糖含量显著降低;而经纳米酶治疗后,上述成分含量显著恢复。结合三维CT扫描和组织学染色结果,采用国际骨关节炎研究协会(OARSI)评分量表评估骨关节炎严重程度:与ACLT组相比,Se-HMPB组和Se-HMPB@AB组的OARSI评分分别降低13.4%和41.5%;氢气治疗对骨关节炎产生极其显著的治疗效果,其中Se-HMPB@AB@COS组的OARSI评分降低最为显著,降幅达59.7%。
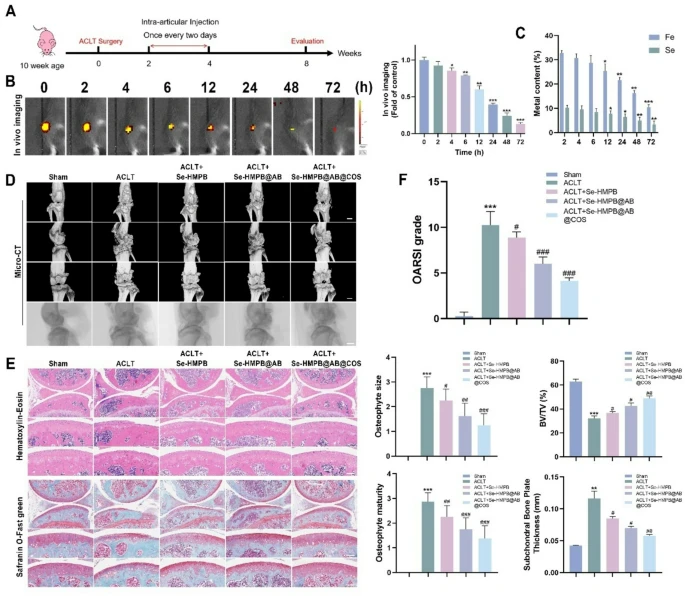
图8 释氢纳米酶在体内缓解骨关节炎的影像学与组织学评估
(A)释氢纳米酶治疗骨关节炎小鼠的方案。
(B)关节腔内72小时活体成像的代表性荧光图像及相应定量分析。
(C)采用电感耦合等离子体发射光谱仪(ICP-OES)检测膝关节内硒(Se)和铁(Fe)含量。
(D)术后8周不同治疗组小鼠膝关节的代表性Micro-CT图像。比例尺=1 mm。每组包含6只小鼠。
(E)小鼠膝关节H&E染色和SO-FG染色的代表性图像。比例尺=100 μm。每组包含3个独立生物学重复。
(F)通过OARSI评分系统、骨赘形成(骨赘大小和成熟度)、骨体积/组织体积(BV/TV)及胫骨软骨下骨板厚度评估骨关节炎样表型的严重程度。每组包含6只小鼠。
所有定量数据均以“均值±标准误(mean±SEM)”表示;采用单因素方差分析(one-way ANOVA)结合图基-克莱默检验(Tukey-Kramer test)进行统计分析;NS表示无显著性差异,*、p<0.05,**、#p<0.001,***、##p<0.0001。
炎症和退行性改变在骨关节炎(OA)的发生发展中起关键作用。在慢性促炎环境中,软骨细胞会表现出分解代谢和促炎表型,导致蛋白水解酶和促炎细胞因子(如IL-1β、TNF-α)过量产生。这些细胞因子会降低软骨细胞合成细胞外基质(ECM)的能力,同时显著增强其分解代谢活性,最终导致细胞外基质降解和骨关节炎进展[50]。
我们采用酶联免疫吸附测定(ELISA)试剂盒检测小鼠膝关节内IL-1β和TNF-α的水平,结果显示ACLT组这两种细胞因子水平显著升高,表明炎症反应增强。免疫荧光染色结果也显示,ACLT组中炎症蛋白COX-2的表达显著增加;同时,我们观察到细胞外基质降解蛋白MMP13的表达升高,而合成蛋白COLII的表达降低(图9A、B)。MMP13不仅是骨关节炎中的关键基质降解酶,其表达水平还常被用作评估骨关节炎严重程度的指标;此外,MMP13可有效降解关节软骨中的主要胶原成分——Ⅱ型胶原蛋白[51]。
纳米酶治疗有效降低了组织中的炎症水平:促炎细胞因子分泌减少,炎症蛋白COX-2表达降低;其中释氢纳米酶(Se-HMPB@AB和Se-HMPB@AB@COS)的治疗效果更为显著,表明氢气治疗在骨关节炎治疗中可有效缓解炎症。此外,氢气治疗显著减少MMP13蛋白分泌,增强COLII蛋白合成;Se-HMPB@AB@COS组诱导的Ⅱ型胶原蛋白分泌量最高,接近正常组水平。我们还检测了组织中线粒体自噬蛋白Pink1和Parkin的表达水平,结果与COLII表达趋势一致,表明纳米酶可有效保护线粒体,而氢气治疗可有效预防线粒体功能障碍并促进自噬。
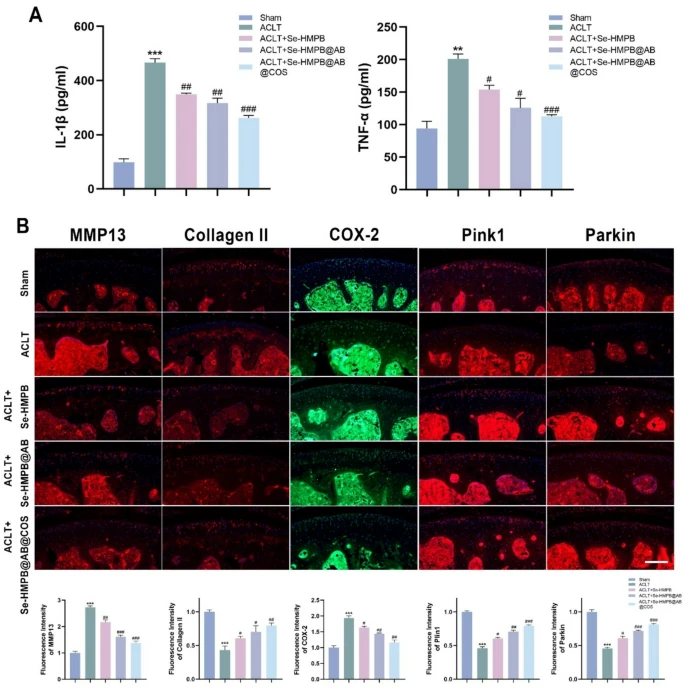
图9 释氢纳米酶抑制骨关节炎小鼠的炎症反应并增强线粒体自噬
(A)不同处理后骨关节炎小鼠血清中IL-1β和TNF-α相对水平的相应分析。每组包含6只小鼠。
(B)膝关节切片经抗MMP13(红色)、抗Ⅱ型胶原蛋白(红色)、抗COX-2(绿色)、抗Parkin(红色)、抗Pink1(红色)染色及细胞核DAPI(蓝色)染色的代表性荧光图像及定量分析。比例尺=100 μm。每组包含3个独立生物学重复。
所有定量数据均以“均值±标准误(mean±SEM)”表示;采用单因素方差分析(one-way ANOVA)结合图基-克莱默检验(Tukey-Kramer test)进行统计分析;NS表示无显著性差异,p<0.05,**、#p<0.001,***、##p<0.0001。
结论
本研究创新性地采用纳米酶药物递送系统,实现了氢气治疗在骨关节炎治疗中的持续应用。富零价硒普鲁士蓝(Se-HMPB)纳米酶可发挥抗氧化应激作用,此外还能通过载药实现氢气治疗,在增强抗氧化应激能力的同时保护线粒体功能。本研究进一步探讨并证实,在骨关节炎中,氢气治疗可促进线粒体自噬,抑制软骨细胞衰老。
为满足实际应用需求,我们采用硫酸软骨素对纳米材料进行包裹,增强了纳米酶促进细胞外基质合成、抑制基质降解的能力,符合临床需求。基于上述研究,我们成功合成了Se-HMPB@AB@COS释氢纳米酶,该纳米酶具有强大的抗氧化性能,可显著抑制骨关节炎中的炎症反应;此外,它还能保护线粒体功能,通过线粒体自噬清除受损线粒体,显著抑制衰老表型,延缓骨关节炎进展。这些发现表明,纳米治疗和氢气治疗作为骨关节炎的新型治疗方式,具有广阔的应用前景。
https://wap.sciencenet.cn/blog-41174-1505720.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:氢气通过调节肠道菌群缓解炎症性肠病