博文
氢气通过调节肠道菌群缓解炎症性肠病
||
氢气通过调节肠道菌群缓解炎症性肠病
肠道菌群作为氢气通过调控TLR4/NF-κB与Nrf2通路缓解结肠炎的核心介导者
作者信息:
山西医科大学基础医学院,
山西省人民医院临床检验科,
山西医科大学细胞生理学教育部重点实验室,
研究亮点
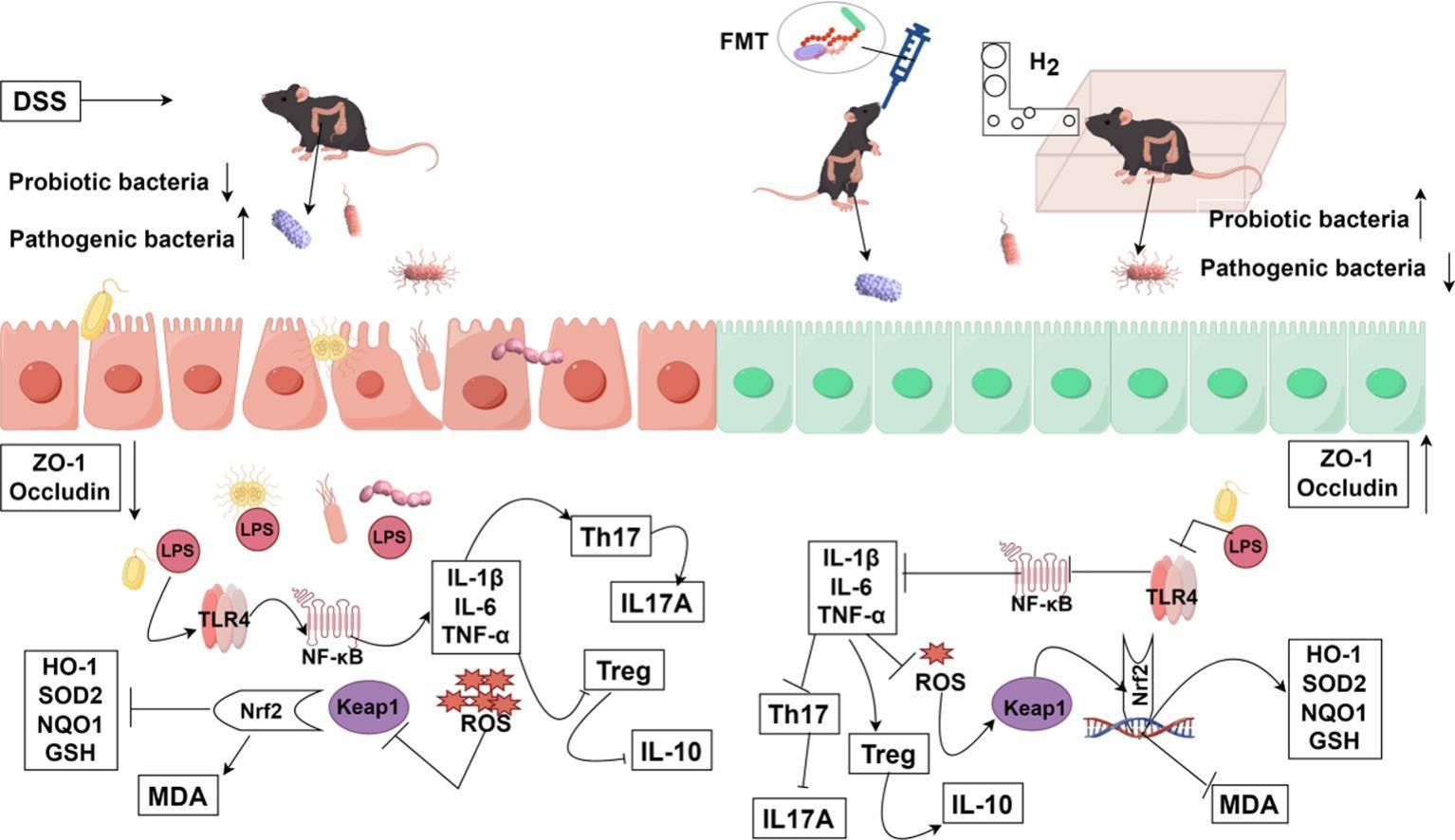
- 氢气吸入可通过重塑肠道菌群、抑制潜在致病菌、富集潜在有益菌,从而缓解结肠炎。
- 氢气处理后,黏蛋白生成增加且紧密连接蛋白(ZO-1/闭合蛋白)表达上调,肠道屏障完整性得以恢复。
- 氢气可平衡调节性T细胞(Treg)与辅助性T细胞17(Th17)的免疫稳态,抑制核因子κB(NF-κB)信号通路,同时激活核因子E2相关因子2(Nrf2)抗氧化通路。
- 粪菌移植(FMT)验证结果证实,氢气的治疗效应通过重构肠道微生物生态系统介导实现。
炎症性肠病(IBD)是一种胃肠道慢性复发性自身免疫性疾病,其发病机制尚未完全阐明,治疗手段也十分有限。尽管氢气(H₂)已在包括炎症性肠病在内的多种疾病中显示出治疗效果,但其作用机制(尤其是与肠道菌群的相互作用)仍不明确。本研究发现,氢气吸入可通过抑制潜在致病菌(如肠杆菌科、大肠埃希菌-志贺菌属)的增殖、促进潜在有益菌(如拟杆菌属、乳杆菌科)的富集,有效逆转葡聚糖硫酸钠(DSS)诱导的肠道菌群失调,进而恢复微生物稳态。
此外,氢气吸入可增加杯状细胞密度与黏液生成,上调紧密连接蛋白(ZO-1和闭合蛋白)的表达,修复肠道屏障完整性;同时可平衡Treg/Th17细胞比例,纠正免疫失调。在分子水平上,氢气吸入可抑制TLR4/NF-κB信号通路,激活Kelch样环氧氯丙烷相关蛋白1(Keap1)/Nrf2抗氧化轴,从而减少促炎细胞因子与氧化应激标志物的产生,同时提高抗氧化酶水平,最终缓解结肠损伤。
综上,氢气的缓解效应可能通过以下途径介导:重塑肠道菌群、修复上皮屏障、抑制炎症信号通路、激活抗氧化通路。粪菌移植(FMT)实验进一步验证了上述发现。本研究将氢气的治疗效果与肠道菌群的结构及功能重编程相关联,表明微生物生态恢复是氢气缓解结肠炎的核心机制,为氢气吸入在炎症性肠病治疗中的应用提供了机制基础。
图形摘要
炎症性肠病(IBD)是一种结肠慢性炎症性疾病,以黏膜持续性炎症和免疫细胞异常浸润为特征,可导致溃疡、糜烂和纤维化[1]。其临床表现包括腹泻、腹痛、便血和全身炎症反应,严重影响患者生活质量,甚至存在致命风险。尽管病因尚未明确,但炎症性肠病的发生可能与免疫失调、肠道菌群失衡、环境诱因及遗传易感性相关,这些因素共同破坏肠道屏障完整性,引发炎症和氧化性组织损伤[2,3]。
免疫失衡在炎症性肠病中起核心作用,尤其是辅助性T细胞17(Th17)和调节性T细胞(Treg)的分化与功能异常[4]。Th17反应过度激活且Treg功能受损,会加剧肠道炎症——患者体内白细胞介素-17(IL-17)水平升高、Treg数量减少,均与此相关[5,6]。NF-κB通路是炎症性肠病发病机制中的关键通路:肠道屏障受损时,脂多糖(LPS)通过TLR4/髓样分化因子88(MyD88)激活NF-κB,促使其入核并调控促炎细胞因子(如肿瘤坏死因子-α TNF-α、白细胞介素-6 IL-6、白细胞介素-1β IL-1β)的转录[7,8]。该通路还会破坏紧密连接、促进上皮细胞凋亡、加速微生物移位[9,10]。同时,氧化应激通过活性氧(ROS)和活性氮(RNS)加剧损伤,这些物质会破坏脂质、蛋白质和DNA,并与炎症级联反应协同作用[11,12]。Keap1/Nrf2抗氧化系统失调会导致炎症抑制不足、细胞保护基因激活受阻,进一步加速疾病进展[13,14]。
此外,肠道菌群失调在炎症性肠病的发病和进展中起着关键作用,临床研究、遗传学研究和动物模型研究均一致证实其参与免疫调节过程[15,16,17]。炎症性肠病患者的肠道微生物多样性显著降低,表现为致病共生菌(如黏附侵袭性大肠埃希菌AIEC)增多,而有益益生菌(如双歧杆菌属、乳杆菌属)减少。这种生态失衡会破坏肠道免疫稳态,促进Th17过度激活、抑制Treg细胞功能,从而导致慢性炎症持续存在[18]。特定细菌的变化与肠道通透性增加相关,而菌群失调衍生的功能性代谢通路会进一步加剧屏障功能障碍。例如,AIEC可入侵肠道上皮细胞,激活TLR4/NF-κB信号通路,刺激促炎细胞因子释放,最终破坏屏障完整性;此外,AIEC还可能分泌酶或毒素降解黏膜层,加重上皮损伤[19]。
目前,炎症性肠病的治疗主要依赖药物干预,手术切除仅用于药物难治性病例或严重并发症。常用药物包括氨基水杨酸制剂、糖皮质激素、免疫调节剂和生物制剂;然而,这些药物不仅会带来长期不良反应(如肝肾功能损害、骨质疏松),还会造成沉重的经济负担[20]。因此,亟需开发简单可行、成本效益高的预防和治疗策略。
氢分子(H₂)是一种内源性气体分子,具有低分子量、无色无味、生理惰性等特点,已在多种疾病中显示出治疗潜力,其机制包括抗氧化应激、抗炎、抗凋亡[21,22,23,24,25]。在炎症性肠病模型中,氢气也表现出疗效[26]。从机制上看,氢气通过以下途径发挥保护作用:(1)选择性清除羟基自由基(·OH)和过氧亚硝基阴离子(ONOO⁻),通过降低丙二醛(MDA)水平、提高超氧化物歧化酶(SOD)和谷胱甘肽(GSH)活性来缓解氧化应激[27];(2)下调TLR4/MyD88信号通路,抑制促炎细胞因子释放[28];(3)通过降低内质网应激蛋白(p-eIF2α/ATF4/CHOP)水平,抑制未折叠蛋白反应[29];(4)上调紧密连接蛋白表达,降低肠道通透性,增加杯状细胞数量和黏液分泌,共同促进屏障修复[26];(5)维持有利于益生菌增殖和菌群重建的厌氧微环境[28,30]。
在临床和动物研究中,氢气的主要给药途径包括吸入、富氢水(HRW)口服/注射和氢气浴。尽管富氢水因便携性和安全性常被使用[31],但存在显著局限性:水溶性低(常温下约0.8 mM)、稳定性差(维持时间<12小时)[32]、代谢半衰期短(血药浓度峰值持续时间<10分钟)[33],且制备方案和剂量标准不统一。这些因素影响了数据的可比性,给临床标准化带来挑战。相比之下,氢气吸入利用其极小的分子尺寸实现无障碍跨膜扩散,可精准靶向线粒体等亚细胞结构;该方式具有递送浓度高、滞留时间长、操作简单等优势,有效克服了富氢水的局限性。
尽管氢气在抗氧化、抗炎方面显示出治疗潜力,但其通过肠道菌群修复肠道屏障、调节免疫稳态的机制仍不明确。本研究发现,氢气吸入可显著缓解葡聚糖硫酸钠(DSS)诱导的小鼠结肠炎:氢气上调紧密连接蛋白(ZO-1和闭合蛋白)表达,刺激杯状细胞增殖,增加黏蛋白合成,共同恢复肠道屏障完整性;进而抑制LPS/TLR4/NF-κB介导的炎症级联反应,激活Keap1/Nrf2抗氧化信号通路,恢复Treg/Th17免疫稳态,有效减轻肠道炎症浸润和氧化应激损伤。通过分析粪便肠道菌群变化及粪菌移植(FMT)实验,进一步评估并证实:氢气主要通过调节肠道菌群缓解炎症性肠病。
https://wap.sciencenet.cn/blog-41174-1505999.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:微针经皮氢气疗法!