博文
线粒体基因修改技术日趋成熟  精选
精选
|

插图:大卫·帕金斯(David Parkins)
CRISPR基因编辑技术已渗透到现代生物学的各个领域,却未能触及细胞的每一个角落。尽管研究人员已利用该系统开发出镰状细胞贫血症和血液癌症的治疗方法、破解了多细胞生物的发育奥秘,还发现了数千种此前被忽视的蛋白质的功能,但CRISPR仍有一个难以触及的“盲区”——线粒体。
线粒体内部的环状DNA无法通过这类技术进行编辑,这意味着对线粒体DNA(mtDNA)的精准修饰始终难以实现,令人懊恼。英国剑桥大学遗传学家米哈乌·明祖克(Michal Minczuk)表示:“线粒体错过了12年前爆发的CRISPR-Cas9革命。”
明祖克指出,研究人员迫切希望能够对线粒体DNA进行操作。线粒体是呈豆状的细胞器,不仅为细胞供能,还承担着多种细胞功能。研究线粒体DNA是理解能量代谢与交换(代谢健康的核心机制)的关键。此外,线粒体DNA上已发现超过300种突变,这些突变会引发线粒体疾病——这类遗传性疾病目前无法治愈,症状多样,可能导致患者失明、失聪、肌肉功能异常,甚至引发癫痫发作1,每5000人中约有1人受其影响。
由于CRISPR无法解决这些问题,研究人员一直在寻找其他能精准编辑线粒体基因组的方法。过去几年,相关研究取得了一些突破:新开发的工具已被证实能助力构建精准的线粒体疾病动物模型。韩国大田市韩国科学技术院(KAIST)致力于线粒体DNA编辑工具研发的化学生物学家金镇秀(Jin-Soo Kim)表示:“这一领域的进展令人瞩目。”
研究人员认为,若能让线粒体DNA编辑技术达到足够的安全性和精准度,最终有望用于治疗甚至治愈这类遗传性疾病。金镇秀说:“这将是一项医学突破。”
细菌起源
线粒体的具体起源尚无定论,但主流理论认为,约15亿年前,一种名为古菌的单细胞微生物吞噬了一种能在其体内存活的游离细菌,线粒体的演化故事由此开启。这一事件标志着真核生物的诞生——真核生物是包含植物、动物、真菌等在内的庞大生物类群,其细胞内的细胞器均具有膜结构包裹。被吞噬的细菌在适应新“家园”的过程中,保留了其特有的环状DNA,但随着时间推移,它将大部分基因转移到了宿主的核基因组中。
在演化出人类及其他动物的谱系中,这种基因转移使寄生细菌的基因组不断精简,最终仅保留37个基因,其中13个基因负责编码能量代谢相关的蛋白质——至此,这种细菌彻底演变为专门的细胞器(线粒体)。
动物体内留存的少量线粒体DNA,与核DNA(人类核DNA约编码20000个基因)存在关键差异。首先,线粒体DNA通常仅通过母系遗传。其次,每个线粒体中可能含有多个线粒体DNA拷贝,且线粒体自身具备一套完整的机制,可利用自身DNA合成RNA和蛋白质。
此外,线粒体DNA的突变率远高于核DNA,据估计是核DNA的10-20倍。部分原因在于,线粒体在正常供能过程中会产生大量具有损伤性的活性氧(不稳定分子),线粒体DNA需持续应对这些活性氧的“攻击”;另一个原因是,线粒体DNA缺乏组蛋白(一种保护和包装核DNA的蛋白质)的保护。
与核DNA相比,线粒体DNA的自我修复机制十分简陋。细胞核可通过多种修复机制快速修复断裂的DNA链,而线粒体仅能修复部分缺陷,对于多数受损的DNA,线粒体通常会直接将其清除。这种差异极大地限制了基因编辑工具的选择——因为几乎所有针对核DNA的编辑工具,都依赖核DNA自身的修复通路发挥作用。
美国得克萨斯大学奥斯汀分校分子生物学家斯蒂芬·埃克(Stephen Ekker)表示:“开发线粒体DNA修饰方法的难度众所周知。当你尝试编辑线粒体DNA时,就会发现它的细菌起源特性。”
研究人员编辑线粒体基因组时面临的最大障碍,在于线粒体被一层膜结构“封锁”,外源核酸无法进入细胞器内部。尽管有迹象表明,依赖RNA引导定位的CRISPR基因编辑工具可能突破这一屏障,但多数研究人员对此仍持怀疑态度。
“剪切-清除”策略
不过,研究人员仍找到了其他突破口。早在CRISPR成为研究工具的十多年前,线粒体领域的研究者就开始尝试使用其他编辑工具——这些工具可穿透线粒体膜,促使线粒体清除有问题的DNA2。
每个细胞中都含有大量线粒体基因组:一个细胞可包含数千个线粒体,每个线粒体又携带多个线粒体DNA拷贝。健康线粒体DNA与突变线粒体DNA常共存于同一细胞中,这种状态被称为“异质性”。研究发现,当特定组织或细胞类型中突变线粒体DNA的比例达到60%-80%时,线粒体疾病的症状便会显现3。
若能减少细胞中突变线粒体DNA的拷贝数,或许就能消除疾病。为此,研究人员采用锌指核酸酶(ZFN)和转录激活因子样效应核酸酶(TALEN)这两种酶,对双链线粒体DNA进行剪切。针对核DNA的靶向剪切,可引导断裂的DNA链在修复过程中去除有害突变并重新连接;但线粒体中被剪切的DNA会被直接清除。这种清除机制会触发剩余完好的线粒体DNA进行自我复制,从而维持线粒体DNA的总量稳定。
美国佛罗里达大学迈阿密分校遗传学家卡洛斯·莫拉莱斯(Carlos Moraes)解释道:“在多数情况下,随着正常线粒体DNA的复制,突变拷贝的比例会降至安全水平,这能弥补被清除的突变DNA的空缺。”
尽管这种方法已取得进展,但仍停留在实验室阶段。即便未来能进入临床,该技术对某些线粒体疾病也无能为力——例如莱伯氏遗传性视神经病变(LHON,一种导致快速视力丧失的罕见疾病),这类疾病的突变常存在于患者所有的线粒体DNA拷贝中。
研究人员需要的是一种既能实现超越“剪切”的功能,又不依赖向导RNA的工具。
无CRISPR依赖的碱基编辑
2012年,CRISPR-Cas9作为基因编辑工具问世后,迅速成为各类研究的“首选工具”:向导RNA引导Cas9酶定位到特定DNA序列,随后Cas9酶对该序列进行剪切,DNA在自我修复过程中引入基因变异。
2016年,这项技术的实用性进一步提升。美国马萨诸塞州剑桥市麻省理工学院-哈佛大学布罗德研究所的化学生物学家戴维·刘(David Liu)及其团队,开发出一种更精准的技术——碱基编辑⁴。该技术通过改造Cas9酶,并借助脱氨酶(一种可将DNA中一种碱基转换为另一种碱基的酶),实现碱基的定向替换,例如将胞嘧啶(C)转换为胸腺嘧啶(T),或将腺嘌呤(A)转换为鸟嘌呤(G)。
尽管碱基编辑及其他CRISPR相关技术在核DNA编辑中取得了成功,但戴维·刘及其他研究团队始终无法将其应用于线粒体DNA。由于CRISPR的向导RNA难以穿透线粒体的双层膜,利用精准工具编辑线粒体DNA的想法一度成为“空想”。戴维·刘坦言:“我们在这方面并未取得太多进展。”
2018年,解决方案意外出现。当时任职于美国西雅图华盛顿大学的微生物学家约瑟夫·莫古斯(Joseph Mougous)及其团队,偶然发现了一种由洋葱伯克霍尔德菌(Burkholderia cenocepacia)产生的毒素。这种酶是细菌攻击其他微生物的“致命武器”,最终可导致目标细菌基因组中所有的C碱基转换为T碱基⁵。
如今任职于美国康涅狄格州纽黑文市耶鲁大学的莫古斯,通过邮件联系戴维·刘,询问这种名为DddA的酶是否对其研究有帮助。戴维·刘回忆道:“我立刻意识到它的用途——用于线粒体DNA的碱基编辑!”
但将所有C碱基转换为T碱基会导致细胞死亡,因此戴维·刘团队开始着手“驯服这头野兽”。他们将DddA拆分为两段无活性的片段,只有当这两段片段在特定方向上结合,并被引导至目标线粒体DNA序列时,酶的活性才会恢复,从而实现对线粒体DNA的定向编辑。此外,团队没有使用向导RNA,而是改造了TALEN中的蛋白质,通过该蛋白质引导DddA片段定位到目标序列(详见“编辑过程”)。
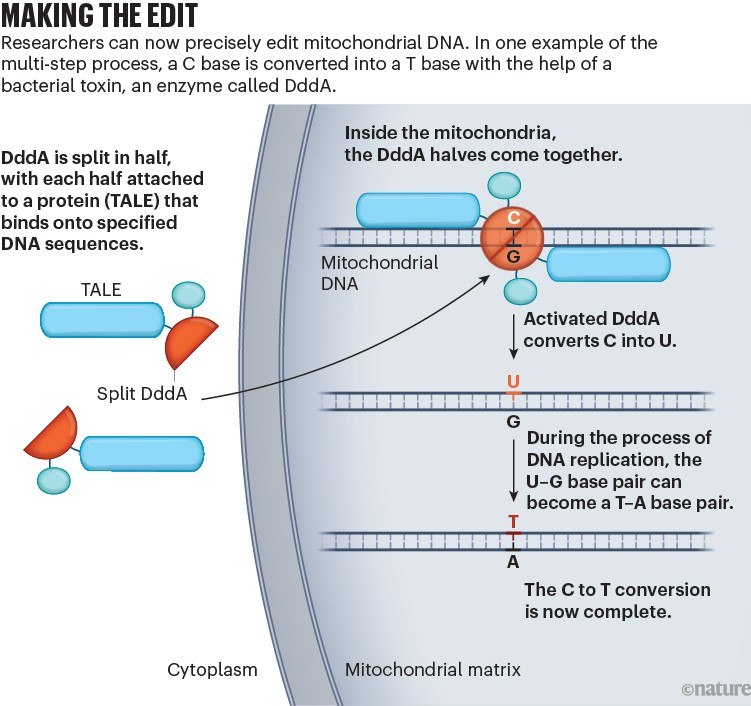
借助这种线粒体DNA碱基编辑工具,戴维·刘团队在实验室培养的人类细胞中成功引入了5种线粒体突变。曾是该团队研究生、现任职于新加坡科技研究局(A*STAR)的化学生物学家贝弗莉·莫克(Beverly Mok)回忆,实现这一技术突破时的兴奋感至今仍清晰可见:“当你发现了一件曾被认为困难或不可能实现的事情时,那种‘顿悟’的时刻,无疑是科研中最有成就感的经历之一。”
但这种线粒体DNA碱基编辑工具仅能实现C到T的转换,无法作用于其他碱基。2022年,金镇秀团队开发出另一种碱基编辑工具,可实现A到G的转换——这一修正方式可修复已知致病性线粒体DNA突变中的40%以上⁶。该工具将DddA与另一种源自大肠杆菌的改造酶结合,与C-T碱基编辑工具类似,它不依赖RNA,而是通过定制化蛋白质结合到DNA的特定位置。
目前,该团队正调整这种A-G碱基编辑工具,使其能靶向导致线粒体疾病(如莱伯氏遗传性视神经病变、影响多器官的线粒体脑肌病伴高乳酸血症和卒中样发作综合征MELAS,以及引发癫痫的严重神经系统疾病 Leigh病)的突变位点。
荷兰乌得勒支大学医学中心专攻线粒体疾病的儿科医生萨比娜·富克斯(Sabine Fuchs)指出,要让这类工具在实验室中更具通用性,并最终应用于临床,研究人员还需开发能靶向更多突变类型的精准编辑工具。她表示:“目前我们能修复的突变仍只是特定的一小部分。”
研究人员同时也在致力于防止碱基编辑工具对目标序列外的DNA进行误编辑⁷,要实现这一目标,部分还需进一步理解这些编辑工具如何调控碱基转换过程。
构建更优质的疾病模型
目前,研究人员已开始利用这些碱基编辑工具构建线粒体疾病动物模型。
2024年1月,北京大学生物学家张晓雪及其团队对现有碱基编辑工具进行优化,成功构建出两种线粒体疾病小鼠模型:一种是Leigh病模型(突变小鼠心率降低,与人类患者症状相似),另一种是莱伯氏遗传性视神经病变模型(小鼠表现为失明)⁸。
数月后,上海华东师范大学生物学家陈亮及其团队利用编辑工具,在大鼠胚胎的另一个基因中引入Leigh病突变⁹,同时开发了另一种编辑工具,可在子代大鼠中逆转该突变。携带突变的大鼠出生后出现肌肉无力和心脏异常;而当子代大鼠的突变被修正后,其体内健康线粒体DNA的比例平均恢复了一半以上,症状也明显减轻。
研究人员还对利用碱基编辑工具解答线粒体生物学基础问题充满期待。例如,莫拉莱斯团队正通过编辑线粒体DNA,研究其如何表达能编码多种蛋白质的长链单RNA分子——这种现象在核DNA中十分罕见。莫拉莱斯表示:“目前没人能充分理解这一过程。”
临床转化的挑战
将线粒体DNA编辑技术推向临床,面临着许多与CRISPR编辑技术类似的障碍。富克斯指出,除了要确保线粒体DNA编辑工具在人体中具有足够的安全性和精准度,研究人员还需找到将工具递送至目标器官和细胞的最佳方式。她解释道:“线粒体疾病会影响身体多个系统,虽然肝脏等器官相对容易靶向,但大脑、心脏和肌肉等组织的递送难度更大。”
这些局限并未阻止生物技术初创公司开发线粒体DNA编辑工具以治疗线粒体疾病的步伐。埃克在马里兰州罗克维尔市创立的 Primera Therapeutics 公司,正专注于开发可定制的单碱基突变碱基编辑工具;其他公司如北卡罗来纳州达勒姆市的基因编辑公司 Precision BioSciences,则在研发可调节线粒体DNA异质性程度的核酸酶。此外,明祖克和金镇秀也已成立专注于线粒体治疗的生物技术公司。
从CRISPR技术问世到2023年首个获政府批准的CRISPR疗法(名为Casgevy,用于治疗镰状细胞病及相关血液疾病β-地中海贫血),耗时超过10年。研究人员表示,线粒体DNA编辑工具要进入临床,可能至少还需要10年时间。
不过,目前正在开发的疾病模型,可能在更早阶段为线粒体疾病患者带来益处。这些模型不仅有助于研究人员理解疾病的基础生物学机制,还能为无需基因编辑的靶向治疗提供测试平台。
莫古斯期待未来能出现更多线粒体DNA碱基编辑工具,为线粒体基因组的研究提供更多方法。他表示:“看到我们在这一领域的初步发现发展成一个独立的研究领域,真是令人欣慰。”
https://wap.sciencenet.cn/blog-41174-1505975.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:氢气通过调节肠道菌群缓解炎症性肠病