博文
北美H5N1疫情未造成更严重死亡的三种理论解释
|
为何北美H5N1疫情未造成更严重死亡的三种理论解释
由H5N1病毒引发的高致病性禽流感于20世纪90年代末在东亚出现,随后传播至欧洲、非洲和中东地区,在野生鸟类与家禽中流行,偶尔还会溢出感染哺乳动物和人类。根据病毒表面关键入侵蛋白——血凝素(hemagglutinin)编码基因的差异,这些病毒可被划分为不同的遗传分支(clade)。2021年,其中一个分支(2.3.4.4b分支)从欧洲传入加拿大,并迅速扩散,不到两年便抵达南美洲最南端,导致海鸟和海洋哺乳动物(包括南美海狮*Otaria flavescens*与南象海豹*Mirounga leonina*)大规模死亡[1]。然而,在此次H5N1疫情中,人类致死率远低于以往疫情。若该病毒进化出人际传播能力,理解当前致死率下降的原因将对制定有效应对策略至关重要。
尽管H5N1病毒在非人类动物中广泛传播(包括商业家禽、家庭散养鸡群、奶牛及多种野生动物),但2.3.4.4b分支感染人类的案例仍较为罕见。据观察,美国报告的病例致死率(CFR)为70例中1例死亡(1.4%)[2],远低于以往H5N1疫情中约50%的致死率(见图)[3]。尽管目前人际传播仍罕见或未发生,但病毒在其他哺乳动物中传播范围的扩大,增加了其进化出人际传播能力的风险。一旦这种能力形成,理解当前疫情人类致死率低于以往的原因便会成为关键。目前主要有三种理论可对此进行解释。
1. 分子水平假说:美洲流行的H5N1病毒本质上更温和
该假说认为,在美洲流行的H5N1病毒,其致病性本质上低于在亚洲和非洲流行的毒株,但支持这一观点的证据并不充分。所有H5型流感病毒的主要致病机制均与血凝素相关:血凝素需经宿主蛋白酶切割为两个亚基,才能实现细胞入侵。在低致病性流感病毒中,切割位点仅含一个碱性氨基酸(精氨酸或赖氨酸),这使得切割过程仅能由类胰蛋白酶(主要存在于哺乳动物呼吸道和鸟类肠道中)完成;而部分病毒的切割位点会获得多个碱性氨基酸,形成所谓的“多碱性切割位点”。这种修饰允许病毒被弗林蛋白酶样蛋白酶(在组织中分布更广泛)切割,从而在鸟类和哺乳动物体内引发全身性感染。美洲流行的H5型病毒均携带这种多碱性切割位点,而这正是高致病性禽流感的标志性特征[4]。
此外,其他一些分子标志物(尤其是聚合酶碱性蛋白2(PB2)编码基因的突变)也会影响病毒致病性。例如,PB2蛋白第627位氨基酸由谷氨酸变为赖氨酸(E627K),可提高病毒在哺乳动物细胞中的聚合酶活性;第701位氨基酸由天冬氨酸变为天冬酰胺(D701N),则能增强病毒复制能力并促进其进入细胞核。美洲流行的H5型病毒大多不含E627K突变,但从哺乳动物体内分离的毒株通常携带D701N突变,这表明病毒仍在持续适应哺乳动物宿主[5]。
综上,这些发现表明,分子水平假说仅能部分解释当前疫情中观察到的较低病例致死率。尽管在鸟类中流行的美洲H5N1变异株缺少一些与哺乳动物致病性相关的突变,但它们与以往高致病性H5N1病毒仍高度相似——尤其是保留了多碱性切割位点这一关键特征。
人类感染H5N1流感全球病例情况
H5N1病毒于1997年首次在香港出现,当时共报告18例人类感染病例,其中6人死亡(致死率33.3%)。2003年,人类感染病例再次出现,2004年疫情扩散至亚洲多地,随后传播至欧洲、非洲和中东,2021年进入美洲。1997年至2021年期间,在病例数超过10例的年份中,全球年度病例致死率介于29%(2015年)至75%(2008年)之间。自H5N1病毒进入美洲后,受美国大量病例(死亡数相对较少)的影响,全球病例致死率已降至10%以下(2021-2024年)。
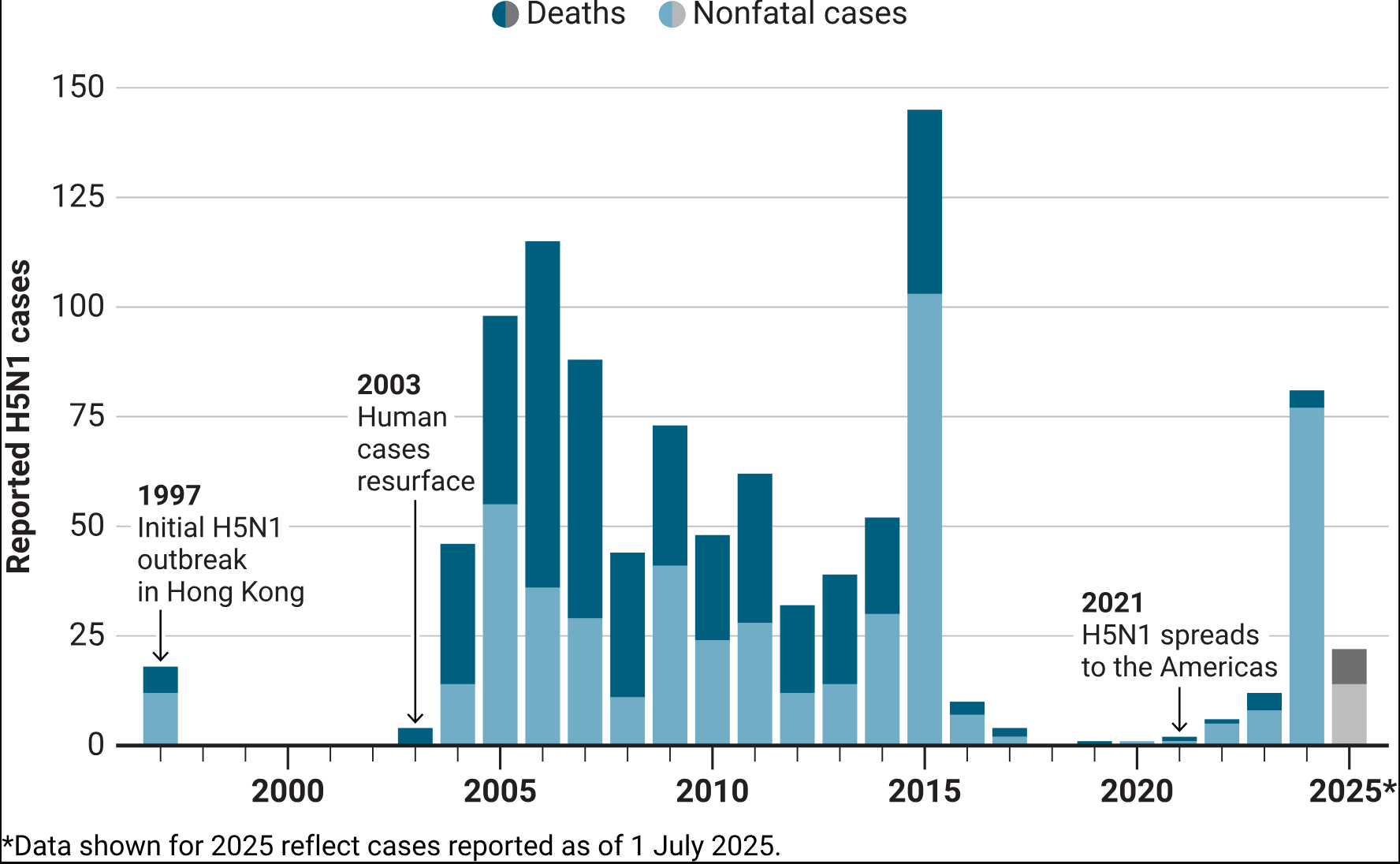
来源:(图表)V. 彭尼(V. PENNEY)/《科学》;(数据)世界卫生组织全球流感规划署(THE WORLD HEALTH ORGANIZATION GLOBAL INFLUENZA PROGRAMME)
2. 流行病学假说:以往疫情存在大量未被检测的感染病例
病例致死率(CFR)通过已报告病例数和死亡数计算得出,未纳入未确诊感染病例;而感染致死率(IFR)则指死亡数占总感染数(包括未报告病例)的比例,因此无法直接观测。基于此,流行病学假说认为:北美地区当前H5N1的感染致死率与以往疫情并无差异,以往H5N1疫情中存在大量未被检测到的感染病例,才导致当前病例致死率看似更低。
科学家普遍认为,由于存在漏报情况,世界卫生组织(WHO)报告的病例致死率无法准确反映真实感染致死率,但对漏报偏差的程度存在争议[6,7]。在埃及尼罗河三角洲开展的一项研究发现,在750名家禽从业者或家庭养鸡者中,有15人(2.1%)携带H5N1病毒抗体。若将这一比例推广到埃及数百万饲养家禽的农村人口中,意味着可能有上万甚至数十万人曾感染该病毒但未被统计。若该结果属实,埃及地区H5N1的感染致死率可能接近0.1%[7,8]。
然而,并非所有证据都支持这一观点。一项针对香港和土耳其疫情的综述研究(两地均开展了密集的监测和后续血清学调查)得出结论:“H5N1无症状或轻症感染可能既不常见也不广泛”,并估算感染致死率介于14%至33%之间[9]。同样,一项涵盖66项全球血清学调查的荟萃分析发现,亚临床感染和轻症感染较为罕见[10]。
2024年,美国疾病控制与预防中心(CDC)开展的两项血清学调查,为“H5N1感染常表现为无症状或仅引发轻症”这一观点提供了支持[11,12]。第一项调查于6月至8月期间针对密歇根州和科罗拉多州的奶牛场工人,参与者均来自过去90天内曾出现高致病性H5型病毒检测阳性奶牛的牧场。结果显示,115名参与者中有8人(7.0%)携带H5型病毒抗体,但他们此前均未察觉自己曾被感染。第二项调查于9月开展,在参加美国牛病医师协会(AABP)年会的牛病兽医中采集了150份血清样本,其中3份(2%)检测出H5型病毒抗体,且这3人均未明确接触过感染牛只。
在美国牛病医师协会调查开展时,已知有4例人类感染病例与接触奶牛相关,目前这一数字已增至原来的10倍[2]。若将这一10倍增长比例应用于美国牛病医师协会成员中H5型病毒抗体阳性比例,可推测该协会约5000名成员中,目前约有20%曾被感染。若将这些未报告感染病例纳入美洲疫情的病例致死率计算,分母会显著增大,估算感染致死率将降至约0.1%。综上,这些发现表明,无症状或未被检测到的H5N1感染可能比以往认知的更为普遍。
3. 免疫学假说:季节性流感免疫交叉保护降低H5N1致病性
该假说认为,人类此前感染季节性H1N1流感(即每年多人感染的“普通流感”)后,对其神经氨酸酶(N1)产生的免疫力,可能降低了H5N1感染的严重程度。当前在人类中流行的H1N1病毒源自2009年大流行毒株,其N1基因来源于欧亚猪流感病毒,而该猪流感病毒的N1基因则是在1979年左右从野生鸟类病毒中获得的。2009年之前的H1N1病毒,其N1基因至少自1918年起就在人类中进化,因此与H5N1病毒的N1基因差异更大。此外,2009年之前,H3N2是主要的季节性流感毒株,人类接触N1的频率较低,且当时接触的N1与H5N1病毒的N1相似度更低。
2009年H1N1大流行前后人类感染H5N1的病例趋势,与这一假说基本一致。2003年至2009年,世界卫生组织全球记录的H5N1病例共468例(年均67例);而2011年至2021年,病例数降至348例(年均32例)——尽管在此期间H5N1病毒在亚洲和欧洲的传播范围已大幅扩大[3]。病例致死率的变化也与N1免疫力的积累相符:1997年至2009年,H5N1病例致死率为59%;2010年至2015年降至44%;2016年至2023年进一步降至33%;而在病毒传入美洲后的2024年至2025年,全球病例致死率仅为15%。
同样,在H5N1病毒最初在亚洲、非洲和欧洲传播期间(2006-2013年),流行病学家发现报告病例中年轻人占比过高。一种合理的解释是,年长者因此前感染过季节性H1N1病毒而获得了部分保护。不过,由于不同地区人口年龄结构存在差异,仅人口结构因素也可能导致观察到的年龄分布模式。这一可能性可作为一个有效的零假设:若H5N1病例的年龄分布仅由人口结构导致,那么仅基于年龄结构的模型应能很好地拟合数据。然而,纳入交叉免疫因素的模型,对特定年龄组病例数据的拟合效果始终优于仅依赖年龄结构的模型[13]。
2020年针对香港人群的一项血清学实验,为该理论提供了更强有力的支持。研究人员对比了受试者血清对大流行H1N1病毒和2.3.4.4b分支H5N1病毒的抗体反应,发现血清对H1血凝素和两种病毒的N1神经氨酸酶均产生了较强抗体反应,但对H5血凝素无反应[14]。这表明,此前感染流感病毒可诱导人体对H1和N1产生免疫力,但无法对H5产生免疫保护。当研究人员使用2009年(大流行H1N1病毒广泛传播前)采集的血清重复该实验时,发现血清对两种病毒抗原的抗体反应均极弱,这意味着对H5N1病毒神经氨酸酶的交叉反应性,可能源自大流行H1N1病毒,而非更早流行的流感毒株。
三种假说的关联性与疫情应对启示
上述三种假说(分子水平、流行病学、免疫学)并非相互排斥。当前H5N1疫情人类致死率较低,很可能是病毒分子差异、流行病学统计偏差以及人群免疫特征变化共同作用的结果。然而,即便2.3.4.4b分支H5N1病毒的真实感染致死率“仅为”0.1%至1%(这一水平由流行病学假说提出,远低于世界卫生组织数据显示的致死率),一旦引发大流行,其规模仍可能造成巨大影响。
病毒的快速进化进一步加剧了大流行风险。自进入美洲以来,H5N1病毒已以惊人的速度适应新物种和新环境。尽管目前尚未获得高效人际传播能力,但任何一个流行分支都可能进化出这种能力,进而引发与新冠疫情相当的严重大流行。这种进化转变需要关键适应性突变,例如血凝素蛋白发生改变以增强对人类呼吸道受体的结合能力。流感病毒此前曾发生过此类突变:在实验室实验中,源自牛的H5N1病毒仅需一个突变,就能将受体结合对象从鸟类型转为类人类型[15]。
从历史上看,包括人类在内的哺乳动物一直是H5N1病毒的“终末宿主”,极少能将病毒进一步传播,但目前已开始出现例外情况。除美国新出现的牛感染分支外,至少还有两个分支的H5N1病毒已获得在哺乳动物间持续传播的能力[1]。其一发生在西班牙和芬兰的毛皮养殖场,美洲水貂(*Neovison vison*)、狐狸(*Vulpes* spp.)和貉(*Nyctereutes procyonoides*)均被感染。基因分析显示,这些病毒在从共同来源溢出感染哺乳动物后,积累了与哺乳动物适应相关的突变;对家养雪貂的实验证实,这些变异株可在个体间传播。其二发生在南美洲的海洋哺乳动物中,采集到的病毒具有极高的相似度,表明存在一个适应哺乳动物的传播分支[1]。
理解当前H5N1疫情人类致死率较低的原因,不仅具有科学意义,更是指导公共卫生应急准备的关键。基于上述分析,可确定以下优先工作方向:
1. 扩大血清学调查范围:在美国及其他H5N1流行地区,开展更广泛的血清学调查,明确人类无症状感染和未确诊感染的真实规模;
2. 加强动物监测协作:扩大动物监测范围(尤其是在家养动物与野生动物接触的界面),研究病毒跨物种传播过程中的适应机制,及时发现新变异株;
3. 开展关键实验研究:在严格生物安全规程下,开展实验以深入阐明病毒在哺乳动物中的传播能力、致病性及交叉免疫情况,评估大流行风险。对于所有高风险病毒学研究(尤其是功能获得性研究),必须保持完全透明,并接受监管机构和科学界的监督,以维护公众信任,确保研究收益大于风险。
这些政策行动至关重要,因为H5N1病毒的进化仍在持续。目前可能存在其他阻碍病毒适应人类的屏障,但我们尚不清楚这些屏障的“高度”,也无法预测它们何时会“消失”[4]。但可以确定的是,每一次新的H5N1感染(无论是水禽、家禽、奶牛、海洋哺乳动物、野生食肉动物还是家庭宠物),都为病毒提供了新的突变机会。病毒每进入一个新宿主或新生态环境,都会积累遗传突变,改变其进化轨迹;而每新增一例人类感染,病毒获得“持续人际传播能力”相关突变的概率就会增加。有一点毋庸置疑:H5N1病毒的进化不会停止。
https://wap.sciencenet.cn/blog-41174-1503885.html
上一篇:纳米气泡热酸稳定性研究
下一篇:想要突破性科学研究?多吸纳新手