博文
氢气减轻帕金森病果蝇的认知功能下降
||
题目:氢气通过激活 Nrf2/HO 通路减轻长期七氟醚暴露后帕金森病果蝇的认知功能下降
帕金森病(PD)是进展最快的神经系统疾病,因此帕金森病患者对手术及麻醉护理的需求预计将不断增加。七氟醚是目前最常用的挥发性麻醉药,对人类及动物的新生期大脑具有神经毒性。此外,以七氟醚为基础的麻醉可能诱发帕金森病患者出现术后谵妄(POD)。为此,本研究通过建立帕金森病-术后谵妄(PD-POD)果蝇模型,旨在寻找一种能有效治疗七氟醚诱导帕金森病患者神经毒性的方法。
研究发现,小分子气体——氢气(H₂)可改善长期七氟醚暴露后帕金森病果蝇的学习记忆障碍,并延长其寿命。吸入氢气后,PD-POD果蝇的行为表现指数提升了30%。此外,吸入氢气还能降低帕金森病果蝇大脑的氧化应激水平,提高电子传递链(ETC)效率、氧化磷酸化(OXPHOS)效率及三磷酸腺苷(ATP)合成量,提示线粒体功能得到增强。
另外,帕金森病果蝇在七氟醚暴露后吸入氢气,其大脑中核因子E2相关因子2(Nrf2)的核内水平及其下游靶基因血红素加氧酶(HO)的表达均显著升高。因此,氢气可能通过激活Nrf2/HO通路发挥抗氧化作用,从而降低长期七氟醚处理后帕金森病果蝇大脑的氧化应激水平及细胞凋亡率。
综上,吸入氢气或许是一种有效且便捷的方法,可用于减轻长期七氟醚暴露引起的神经毒性效应或术后谵妄。
Li M, Ma B, Liang S, Pan X, Xie J, Wang H, Guo J. Hydrogen activated the Nrf2/HO pathway to alleviate the cognitive decline in PD Drosophila after long-term sevoflurane exposure. Neurotoxicol Teratol. 2025 Oct 6:107560.
1. 引言
帕金森病(PD)是仅次于阿尔茨海默病的第二大常见进行性神经退行性疾病。帕金森病的神经病理特征包括α-突触核蛋白聚集、路易小体形成,以及黑质-纹状体多巴胺能神经元的选择性丢失,进而导致纹状体多巴胺缺乏(Lawrence等,2022)。多巴胺能药物治疗可缓解静止性震颤、运动迟缓、肌肉僵直等运动症状,但无法阻止帕金森病的进展(Bloem等,2021)。晚期帕金森病患者常选择神经外科干预手段,如深部脑刺激术(Armstrong、Okun,2020;Tanaka等,2018)。据估计,到2030年,帕金森病的患病率将翻倍,全球患病人口将达930万(Aarsland等,2021;Dorsey等,2018)。
帕金森病患者群体的扩大,预计将同步增加对麻醉和手术的需求。
七氟醚是一种具有芳香气味的挥发性麻醉药,因其具备血气系数低(0.69)、诱导迅速、苏醒时间短等诸多优势,常被用于全身麻醉的诱导与维持(Huang等,2021)。然而,长期(超过4小时)或反复接触七氟醚,可能导致包括人类在内的动物出现神经病理改变和认知障碍(Lu等,2016;Walkden等,2020;Xie等,2024;Zhao等,2025)。在临床试验中,Yang等发现,帕金森病患者的七氟醚清醒最低肺泡浓度显著低于非帕金森病人群,这表明帕金森病患者对七氟醚更为敏感(Yang等,2021)。Zhou等的一项研究显示,在62例接受以七氟醚为基础的全身麻醉下深部脑刺激术的帕金森病患者中,有13例出现术后谵妄(POD)(Zhou等,2022)。术后谵妄的表现包括认知障碍,症状可能在麻醉苏醒后持续至术后或麻醉后7天内(Evered等,2018;Vacas等,2022)。术后谵妄与七氟醚的神经毒性作用密切相关(Wang, C.M.等,2021)。因此,寻找有效缓解七氟醚所致认知障碍的方法至关重要。
氢气(H₂)分子量小,易穿过细胞膜扩散至细胞质和细胞器,且能通过血脑屏障(Chen等,2021)。近几十年的研究表明氢气具有神经保护作用。2007年,Ohsawa等报道,吸入2%~4%的氢气可保护大鼠大脑免受局灶性缺血再灌注损伤(Ohsawa等,2007)。多项研究显示,氢气治疗可能对多种神经系统疾病有益,且已证实氢气给药具有安全性(Chen等,2021)。此外,研究发现吸入2%的氢气可改善大鼠因麻醉和手术引发的认知障碍(Xin等,2017)。在新生大鼠中,氢气也被证实可减轻七氟醚的神经毒性(Shi等,2017)。然而,吸入氢气是否能缓解帕金森病动物模型在接受七氟醚处理后的认知变化,目前尚不明确。
氢气可能具有抗氧化活性,因为它能选择性清除活性最强的活性氧(ROS)——羟基自由基(Ohsawa等,2007)。此外,氢气可上调细胞抗氧化系统关键调控因子——NFE2样碱性亮氨酸拉链转录因子2(Nrf2)的表达,促进其从细胞质向细胞核转移,进而激活血红素加氧酶-1(HO-1)等下游抗氧化基因的表达(Yuan等,2018)。
尽管在帕金森病患者的黑质中观察到Nrf2/HO通路成员的过表达(Fao等,2019),但Nrf2启动子区域可增强转录的基因多态性与帕金森病风险降低相关(Chen等,2013;Todorovic等,2015)。Nrf2基因敲除小鼠对α-突触核蛋白过表达及1-甲基-4-苯基-1,2,3,6-四氢吡啶(可诱导小鼠出现帕金森病样症状)的敏感性升高(Chen等,2009;Lastres-Becker等,2012)。上调Nrf2/HO-1通路可保护小鼠免受帕金森病相关神经毒素的损伤(Wang, Y.等,2021)。然而,吸入七氟醚会抑制Nrf2/HO-1通路成员的表达(Xu等,2023)。本研究采用鱼藤酮诱导的帕金森病黑腹果蝇模型,旨在探究氢气治疗对七氟醚所致认知障碍的保护作用及其潜在机制。结果表明,吸入氢气可改善帕金森病果蝇因七氟醚引发的认知障碍。氢气的神经保护作用源于其对线粒体功能的改善、对Nrf2/HO通路的激活,以及随后对活性氧和细胞凋亡的抑制。这些发现揭示了吸入氢气在减轻七氟醚神经毒性和术后谵妄方面的治疗潜力。
2. 材料与方法
2.1 果蝇品系、鱼藤酮处理及麻醉处理
所有实验均采用野生型Canton Special(CS)黑腹果蝇(*Drosophila melanogaster*)。CS果蝇饲养于含玉米粉-琼脂培养基的标准培养环境中,温度维持在24℃,光照周期为12小时光照-12小时黑暗。果蝇羽化后,将25~30只雌性处女CS果蝇分为一组,饲养于一个培养管中。帕金森病模型的构建方法为:给7日龄雄性果蝇喂食含250μM鱼藤酮的培养基,持续7天。对照组果蝇喂食含0.1%二甲基亚砜(DMSO,鱼藤酮的溶剂)的培养基,并以2 L/min的流速通入空气处理7或8小时。由于含鱼藤酮的培养基稳定性较差,需尽快使用且每3天更换一次。帕金森病模型组(PD组)果蝇仅接受空气处理7或8小时。七氟醚处理组(sevoflurane组)的处理方式为:将帕金森病果蝇置于此前报道的麻醉装置中(Olufs等,2018),先暴露于含3%七氟醚的混合空气6小时,再暴露于纯空气1或2小时。七氟醚暴露后,氢气吸入组(H₂ inhalation组)果蝇继续在同一麻醉装置中,以相同流速接受含2%氢气的混合空气处理0.5小时、1小时或2小时。实验所用氢气通过电解水生成(中国保定清水源生物技术有限公司),氢气浓度采用便携式氢气检测仪(中国河南英特电气设备公司)检测。处理24小时后,对果蝇进行行为学分析和生化检测。实验流程如图1A所示。
2.2 糖关联嗅觉记忆T型迷宫测试
T型迷宫测试参照此前报道的方法进行(Liu等,2023)。简要步骤如下:测试前,将50只经处理的果蝇分为一组,转移至含浸有矿泉水的棉垫的试管中,饥饿16小时。用于糖关联嗅觉记忆测试的T型迷宫装置购自北京卓凯科技有限公司。使用石蜡油(美国密苏里州圣路易斯市Sigma-Aldrich公司)将4-甲基环己醇和3-辛醇这两种非吸引性气味稀释至1%浓度。条件化训练阶段:先将一组果蝇放入T型迷宫装置,通入无气味空气90秒;随后以750 mL/min的流速通入含第一种气味的空气,同时提供1.5 M蔗糖溶液,持续2分钟;接着通入无气味空气30秒;再通入含第二种气味但不含蔗糖的空气2分钟;最后通入无气味空气30秒。条件化训练结束30秒后开始测试,让果蝇在两种气味间进行2分钟的选择。为避免气味偏好性干扰,在不同组果蝇的条件化训练和测试过程中,两种气味的暴露顺序均进行互换。行为表现指数(PI)的计算方法为:(正确选择的果蝇数量-错误选择的果蝇数量)÷测试果蝇总数。通过两次重复测试获得两个表现指数,取平均值作为最终得分。
2.3 存活实验
每种处理条件下共选取150只果蝇,随机分为5组,每组饲养于一个含新鲜标准培养基的培养管中。每日记录存活果蝇数量,每3天将果蝇转移至含新鲜培养基的新培养管中。采用Kaplan-Meier法绘制存活曲线,并进行对数秩检验(log rank analysis)。
2.4 活性氧(ROS)定量检测
每种处理组收集30只果蝇头部,使用TGrinder研磨仪(中国北京天根生化科技有限公司)匀浆,随后以5000×g的转速离心。采用BCA蛋白定量试剂盒(中国北京 Biomed 生物技术有限公司)检测上清液中的蛋白质浓度。按照试剂盒说明书,向上清液(100μL)中加入终浓度为100μM的2',7'-二氯二氢荧光素二乙酸酯(DCFH-DA,中国上海碧云天生物技术有限公司),孵育后使用荧光酶标仪(美国马萨诸塞州沃尔瑟姆市赛默飞世尔科技公司)在激发波长485 nm、发射波长530 nm处检测荧光信号。荧光强度以蛋白质浓度进行标准化校正。
2.5 脂质过氧化检测
参照试剂盒说明书(中国上海碧云天生物技术有限公司)检测脂质过氧化产物丙二醛(MDA)的含量。简要步骤如下:每种处理组收集70只果蝇头部,在磷酸盐缓冲液(PBS)中匀浆,随后在4℃条件下以10000×g的转速离心10分钟。取上清液用于后续检测,使用Gen5检测仪(美国佛蒙特州威努斯基市BioTek公司)在532 nm波长处测定吸光度值。上清液中丙二醛的含量以BCA蛋白定量试剂盒(中国北京 Biomed 生物技术有限公司)检测的蛋白质浓度进行标准化校正。
2.6 细胞核与细胞质蛋白提取
每种处理组收集60只果蝇头部,在生理盐水中匀浆。以500×g的转速离心3分钟后,保留上清液,加入200μL细胞质蛋白提取液(中国北京索莱宝科技有限公司),涡旋混匀后以12000×g的转速离心10分钟,所得上清液即为细胞质蛋白组分。向离心后的沉淀中加入50μL细胞核蛋白提取液,涡旋混匀后以12000×g的转速离心10分钟,所得上清液即为细胞核蛋白组分,用于后续检测。
2.7 蛋白质印迹(Western blotting)实验
采用BCA蛋白定量试剂盒检测细胞核和细胞质蛋白的浓度。取等量的细胞核蛋白或细胞质蛋白,通过SDS-PAGE凝胶电泳(中国上海 Epizyme 生物技术有限公司)分离后,转移至硝酸纤维素膜上。用5%脱脂牛奶封闭膜后,加入一抗孵育(HO抗体,1:1000;Nrf2抗体,1:1000,美国加利福尼亚州尔湾市GeneTex公司;组蛋白H3抗体,1:3000;β-肌动蛋白抗体,1:3000,中国武汉Proteintech公司);洗涤后加入辣根过氧化物酶(HRP)标记的二抗孵育(羊抗兔二抗,1:5000,中国武汉Proteintech公司)。膜与ECL化学发光试剂(中国北京 Biomed 生物技术有限公司)孵育后,检测印迹信号,使用ImageJ软件(Java 1.8.0_172版本)对信号强度进行定量分析。
2.8 线粒体功能检测
每种处理组收集50只果蝇,在冰浴的线粒体分离缓冲液(含1 mM EDTA、70 mM蔗糖、10 mM HEPES、210 mM甘露醇)中,使用PBI Shredder SG3匀浆器匀浆。参照此前报道的方法(Rodrigues等,2018),对匀浆液进行过滤和离心,获得线粒体组分。将分离得到的线粒体加入Oxygraph-2k系统(奥地利因斯布鲁克市Oroboros仪器公司),检测线粒体复合体Ⅰ、复合体Ⅱ的活性及氧化磷酸化(OXPHOS)效率(Zhang等,2020)。简要步骤如下:向每个含2 mL线粒体呼吸缓冲液(组分:3 mM氯化镁六水合物、0.5 mM EGTA、20 mM牛磺酸、60 mM乳酸酸钾、20 mM HEPES、10 mM磷酸二氢钾、0.1%牛血清白蛋白、110 mM蔗糖)的反应室中加入线粒体,随后加入2 mM苹果酸和10 mM谷氨酸。待呼吸稳定后,加入不饱和腺苷二磷酸(ADP),线粒体进入呼吸状态3;当ADP完全消耗后,进入呼吸状态4。呼吸控制率(RCR)定义为状态3与状态4的呼吸速率比值。ADP/O值反映每个氧原子消耗的ADP量,通过加入ADP前后及ADP完全消耗后的氧浓度差值计算得出。随后,通过加入2 mM ADP、0.5 mM鱼藤酮、10 mM琥珀酸、8 mM细胞色素c和6.25 mM抗霉素A,检测分离线粒体的复合体Ⅰ和复合体Ⅱ活性。所有操作均在28℃、750 rpm持续搅拌条件下进行,使用DatLab 4.0软件分析数据。
2.9 末端脱氧核苷酸转移酶介导的缺口末端标记(TUNEL)实验
将包埋于OCT包埋剂(美国加利福尼亚州樱花公司)中的冷冻果蝇头部,使用切片机(德国沃尔多夫市GmbH公司)切成8μm厚的切片。将切片贴附于多聚赖氨酸处理过的载玻片上,用20μg/mL蛋白酶K消化后,加入1μL TUNEL试剂(中国上海碧云天生物技术有限公司),在37℃黑暗条件下孵育1小时。洗涤3次后,用含4',6-二脒基-2-苯基吲哚(DAPI)的抗荧光淬灭封片剂(美国阿拉巴马州某城市Southern Biotech公司)封片,随后在奥林巴斯FV3000共聚焦显微镜下观察。
2.10 统计学分析
所有实验数据均采用GraphPad Prism 9.5软件进行分析。多组符合高斯分布的数据采用单因素方差分析(one-way ANOVA)结合Tukey检验。结果以“均值±均值标准误”(mean ± standard error of the mean)表示。P<0.05被认为具有统计学显著性;ns表示无显著性差异;*P<0.05、**P<0.01、***P<0.001、****P<0.0001。
3. 结果
3.1 吸入氢气可改善帕金森病果蝇因七氟醚处理导致的认知障碍并延长其缩短的寿命
鱼藤酮是一种线粒体复合体Ⅰ抑制剂,可通过增加细胞凋亡和氧化损伤构建帕金森病模型(Coulom、Birman,2004)。我们观察到,果蝇喂食鱼藤酮7天后出现运动功能缺陷(图S1)。用3%七氟醚麻醉帕金森病果蝇6小时后,分别对其进行0.5小时、1小时或2小时的2%氢气吸入处理,并通过糖关联嗅觉记忆测试评估果蝇的认知能力。结果显示,帕金森病果蝇的学习记忆能力显著低于对照组,且经七氟醚处理后进一步下降(图1B)。吸入氢气0.5小时对七氟醚处理后的帕金森病果蝇认知能力改善作用微弱,而吸入氢气1小时可逆转麻醉导致的认知障碍(图1B);吸入氢气超过1小时,并未进一步改善麻醉后帕金森病果蝇的认知能力(图1B)。因此,后续实验均采用1小时氢气处理。
我们记录了不同处理条件下果蝇的寿命:帕金森病果蝇与二甲基亚砜(DMSO)处理组果蝇的寿命相近,但经七氟醚处理后寿命显著缩短(图1C);而七氟醚处理后吸入2%氢气,可延长帕金森病果蝇的寿命(图1C)。
3.2 吸入氢气可降低七氟醚处理后帕金森病果蝇头部的活性氧(ROS)水平
通过DCFH-DA荧光探针法和脂质过氧化实验检测发现,帕金森病果蝇头部的ROS和丙二醛(MDA)水平均高于对照组(图2);而七氟醚处理后,帕金森病果蝇头部的ROS和MDA水平进一步显著升高(图2)。作为一种氧化清除剂,吸入氢气可显著缓解七氟醚处理导致的帕金森病果蝇头部ROS和MDA水平升高(图2)。
3.3 吸入氢气可逆转七氟醚处理对帕金森病果蝇线粒体造成的损伤
线粒体是细胞主要的能量产生细胞器,在三磷酸腺苷(ATP)合成过程中会产生ROS。因此,我们采用Oxygraph-2k系统检测线粒体呼吸功能(图3A)。结果显示,帕金森病果蝇的线粒体复合体Ⅰ和复合体Ⅱ活性显著低于对照组,且七氟醚暴露会进一步抑制这两种复合体的活性(图3B、3C);同理,帕金森病果蝇的呼吸控制率(RCR)百分比和ADP/O值低于对照组,七氟醚处理后则进一步降低(图3D、3E)。然而,七氟醚暴露后吸入氢气,可逆转线粒体复合体Ⅰ和复合体Ⅱ的活性下降,并提高RCR百分比和ADP/O值(图3B、3C、3D、3E)。这表明吸入氢气可提高电子传递链(ETC)效率和氧化磷酸化(OXPHOS)效率,进而增强ATP合成和线粒体功能。
3.4 吸入氢气可上调七氟醚暴露后帕金森病果蝇的Nrf2/HO通路
Yuan等研究表明,在创伤性脑损伤大鼠模型中,富氢水可提高细胞核内Nrf2(NFE2样碱性亮氨酸拉链转录因子2)水平,进而激活其下游靶基因HO-1(血红素加氧酶-1)的表达(Yuan等,2018)。本研究通过提取细胞核和细胞质蛋白,采用蛋白质印迹(Western blotting)实验检测细胞核内Nrf2水平及细胞质中HO(果蝇体内与HO-1同源的蛋白)水平。结果显示,帕金森病组的Nrf2表达量比对照组低23%,经七氟醚处理后进一步降低27%(图4A及图S2补充图片);而氢气处理后,细胞核内Nrf2水平比七氟醚组高37%(图4A)。对于Nrf2的下游靶蛋白HO,与七氟醚组相比,吸入氢气可显著逆转其蛋白水平的下降(图4B及图S3补充图片)。这表明Nrf2/HO通路可能是氢气发挥作用的靶点。
3.5 氢气处理可减轻七氟醚处理导致的帕金森病果蝇脑部细胞凋亡
七氟醚暴露后,帕金森病果蝇脑部ROS水平升高引发氧化应激,可能导致细胞凋亡。因此,我们通过TUNEL实验检测果蝇脑部的细胞凋亡情况。结果显示,与仅经鱼藤酮处理的帕金森病组相比,七氟醚处理会诱导更多细胞凋亡(图5);而吸入氢气可显著减少七氟醚处理后帕金森病果蝇脑部的细胞凋亡(图5)。
4. 讨论
随着全球帕金森病患病率的快速上升,越来越多的帕金森病患者可能需要接受麻醉和手术。七氟醚作为临床最常用的吸入性麻醉药,可诱导帕金森病患者出现术后谵妄(POD)(Zhou等,2022),这一问题已引起公共卫生领域的关注。本研究观察到,鱼藤酮诱导的帕金森病果蝇存在认知缺陷,这与Dhanraj及其同事的研究结果一致(Dhanraj等,2018)。另有研究报道,转基因帕金森病模型果蝇也存在学习记忆障碍(Fatima等,2019;Rahul等,2020)。认知下降是帕金森病患者常见的非运动症状之一。尽管已有研究报道接受七氟醚麻醉的帕金森病患者会出现术后谵妄(Zhou等,2022),但目前尚无合适的动物模型用于探究该疾病的潜在生化机制。本研究发现,长期暴露于3%七氟醚会进一步加剧帕金森病果蝇的认知功能障碍并缩短其寿命,因此构建的“七氟醚诱导帕金森病-术后谵妄(PD-POD)果蝇模型”,或为理解七氟醚对帕金森病患者的神经毒性作用提供有力工具。
此外,吸入氢气可降低氧化应激水平并抑制细胞凋亡,从而逆转七氟醚处理导致的帕金森病果蝇认知障碍和寿命缩短(图6)。这表明氢气处理能有效对抗帕金森病模型中七氟醚诱导的神经毒性。此前研究显示,吸入2%氢气(该浓度安全性已得到验证,无需额外风险评估)的保护效果优于1%和4%氢气(Ohsawa等,2007),因此本研究在七氟醚处理后,对帕金森病果蝇进行了不同时长的2%氢气吸入处理。结果显示,氢气的保护作用具有时间依赖性:吸入1小时或2小时氢气可逆转七氟醚诱导的帕金森病果蝇学习记忆障碍,而较短的0.5小时吸入则不足以发挥保护作用。Yu、Liu及其同事的研究表明,吸入氢气后45分钟,脑部氢气浓度达到峰值(Liu等,2014;Yu等,2020)。在新生大鼠或小鼠模型中,氢气与七氟醚联合使用,可减轻七氟醚神经毒性导致的认知障碍和成年后的进食行为异常(Shi等,2017;Takaenoki等,2014;Yonamine等,2013)。鉴于七氟醚麻醉可诱导帕金森病患者出现术后谵妄,我们尝试寻找缓解七氟醚神经毒性的有效方法,并选择帕金森病果蝇模型测试了七氟醚暴露后吸入氢气的效果,最终证实吸入2%氢气1小时可保护果蝇免受七氟醚诱导的认知缺陷影响。
通过DCFH-DA荧光探针法和脂质过氧化实验检测发现,氢气可降低七氟醚处理后的氧化应激水平。尽管氢气神经保护作用的机制尚未完全明确,但已有研究证实,氢气可中和羟基自由基等有害ROS,且在活细胞中无直接物理作用(Ohsawa等,2007)。过量ROS会引发氧化损伤和炎症反应,对中枢神经系统造成严重损害(Chen等,2021);过量自由基释放还会导致脂质过氧化,破坏细胞及线粒体等细胞器的膜结构,最终引发细胞凋亡(Morella等,2022)。MDA水平与ROS诱导的损伤程度相关,是评估脂质过氧化的可靠指标。本研究观察到,七氟醚处理后帕金森病果蝇脑部的ROS、MDA水平及细胞凋亡均升高,这与此前关于七氟醚的研究结果一致(Liu等,2023;Peng等,2020);而吸入氢气可降低帕金森病果蝇脑部的氧化应激水平和细胞凋亡。
已有研究显示,七氟醚可部分抑制线粒体复合体Ⅰ的功能(Hanley等,2002);Keeney及其同事发现,帕金森病患者脑部复合体Ⅰ的催化活性降低(Keeney等,2006);且鱼藤酮诱导的帕金森病模型也会导致复合体Ⅰ活性受抑制。本研究发现,帕金森病或PD-POD果蝇的认知功能下降与线粒体功能障碍及氧化应激升高相关:七氟醚处理会抑制复合体Ⅰ和复合体Ⅱ的功能,降低RCR和ADP/O比值,损害线粒体功能;而吸入氢气可逆转这些对线粒体功能的不良影响,提高电子传递链活性和氧化磷酸化效率,增强ATP合成。线粒体功能增强进而减少了ROS的产生,因此氢气不仅能直接中和ROS,还可通过改善线粒体功能减少七氟醚处理后ROS的生成。
此外,七氟醚暴露后吸入氢气,可上调帕金森病果蝇头部Nrf2/HO信号通路的表达。Nrf2是已知的细胞抗氧化系统核心调控因子,可激活HO-1等细胞保护蛋白的表达,在多种神经系统疾病中发挥神经保护作用(Zhang等,2013)。HO-1是血红素分解代谢的限速酶,而血红素是多种氧化酶和过氧化物酶(负责代谢超氧化物和ROS)的必需成分(Schipper等,2019)。Nrf2的下游靶基因包括超氧化物歧化酶(SOD)、过氧化氢酶(catalase)和π型谷胱甘肽S-转移酶(GSTpi)。其中,GSTpi是黑质多巴胺能神经元中唯一表达的谷胱甘肽S-转移酶家族成员(Smeyne等,2007),且过表达GSTpi可保护Neuro2A细胞免受鱼藤酮诱导的神经毒性(Shi等,2009)。研究表明,鱼藤酮可抑制Nrf2及其下游靶基因(包括SOD和过氧化氢酶)的表达(Umer等,2025;Xiao等,2023);七氟醚也可抑制Nrf2及其靶酶(SOD和过氧化氢酶)的功能(Li等,2025;Liu等,2023),但七氟醚与GSTpi的关系尚不明确。体内外实验均证实,吸入氢气可上调Nrf2及其下游靶基因HO-1的表达(Liu等,2014;Murakami等,2017;Wang等,2020),这与本研究结果一致。然而,氢气处理调控Nrf2/HO通路表达和功能的分子机制尚未阐明。本研究仅检测了HO的表达,未检测SOD、过氧化氢酶尤其是GSTpi等其他靶蛋白,后续研究将重点开展这些指标的检测。
鱼藤酮诱导的帕金森病果蝇模型被广泛用于帕金森病发病机制和治疗研究(Chia等,2020)。鱼藤酮是一种杀虫剂,可通过破坏线粒体氧化磷酸化引发氧化应激(Innos、Hickey,2021)。尽管已有研究表明氢气在多种帕金森病动物模型中均有效(Chen等,2021),但本研究中,七氟醚暴露后吸入氢气并未改善帕金森病果蝇的运动能力(数据未展示)。有研究认为,饮用富氢水可能比其他氢气给药方式在帕金森病治疗中更有效(Noda等,2021),因此仍需进一步研究不同氢气给药途径的药代动力学差异。
5. 结论
氢气吸入的安全性已得到证实:它曾用于深海潜水员的混合气体中,且多项临床试验也验证了其安全性(Wu等,2023)。本研究表明,吸入2%氢气1小时可减轻七氟醚暴露导致的帕金森病果蝇认知障碍。氢气的保护作用源于其对线粒体功能的增强——这一过程可激活Nrf2/HO通路,进而降低ROS水平并抑制细胞凋亡。因此,本研究结果揭示,吸入氢气在缓解七氟醚诱导的神经毒性和术后谵妄方面具有显著的治疗潜力。
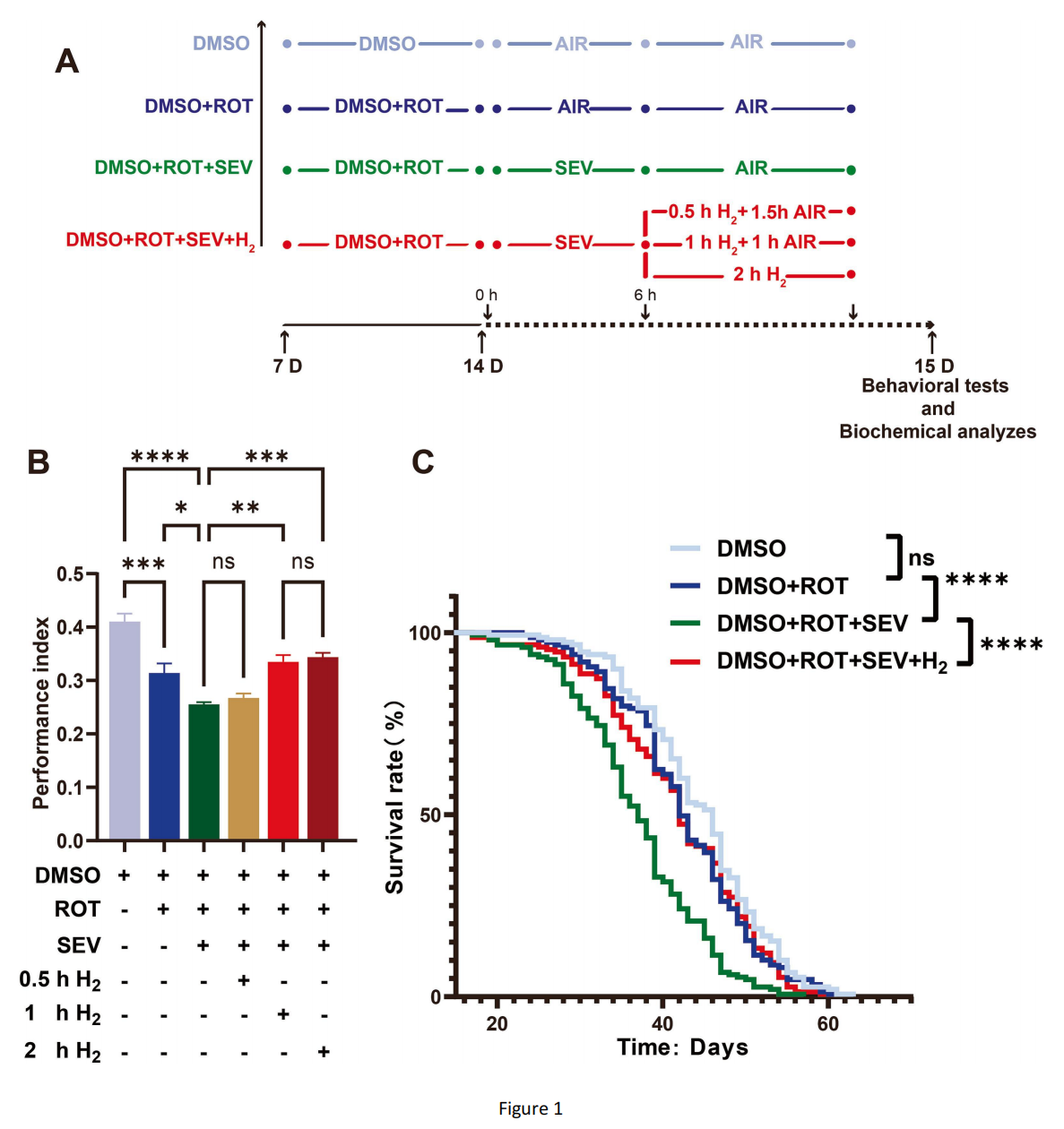
图1 氢气可改善七氟醚处理后帕金森病果蝇的认知缺陷并延长其寿命
(A)实验流程示意图。DMSO组(对照组):7日龄果蝇喂食含0.1% DMSO的培养基7天,并用空气处理8小时;DMSO+ROT组(帕金森病组):7日龄果蝇喂食含250μM鱼藤酮的培养基7天,并用空气处理8小时;DMSO+ROT+SEV组(七氟醚组):7日龄果蝇喂食含250μM鱼藤酮的培养基7天,并用七氟醚处理6小时+空气处理2小时;DMSO+ROT+SEV+H₂组(氢气组):7日龄果蝇喂食含250μM鱼藤酮的培养基7天,并用七氟醚处理6小时+氢气处理0.5/1/2小时+空气处理1.5/1/0小时。注:ROT=鱼藤酮,SEV=七氟醚。
(B)T型迷宫测试的表现指数(PI)。结果显示,吸入氢气1小时或2小时可逆转七氟醚诱导的帕金森病果蝇学习记忆障碍。其中,帕金森病组PI比对照组低23%,七氟醚组PI比帕金森病组低19%,1小时氢气组PI比七氟醚组高30%。T型迷宫测试重复4次,每次300只果蝇;数据采用单因素方差分析结合Tukey检验。
(C)不同处理条件下果蝇的存活率。结果显示,吸入氢气可延长七氟醚麻醉后帕金森病果蝇的寿命。存活曲线记录5次,每次120只果蝇;数据采用对数秩检验。
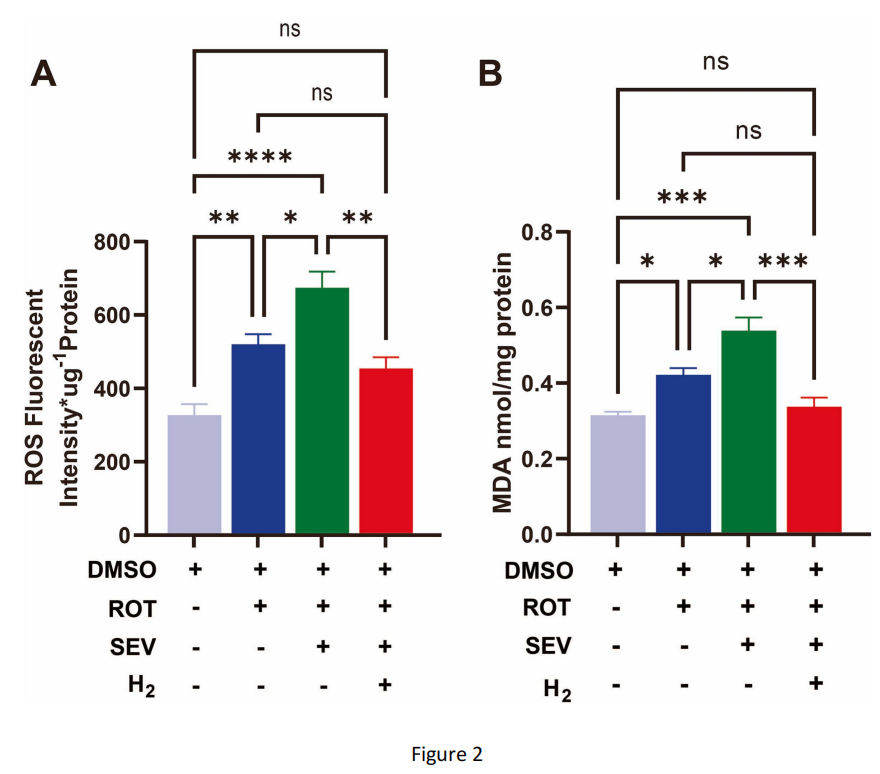
图2 氢气处理可降低七氟醚麻醉后帕金森病果蝇头部的氧化应激水平
(A)不同处理条件下帕金森病果蝇头部的活性氧(ROS)水平。七氟醚组的ROS水平比帕金森病组高30%,而氢气组的ROS水平比七氟醚组低33%。活性氧检测实验重复4次,每次120只果蝇;数据采用单因素方差分析(ANOVA)结合Tukey检验。
(B)不同处理条件下帕金森病果蝇头部的丙二醛(MDA)水平。七氟醚组的MDA水平比帕金森病组高27%,而氢气组的MDA水平比七氟醚组低37%。丙二醛检测实验重复4次,每次280只果蝇;数据采用单因素方差分析结合Tukey检验。
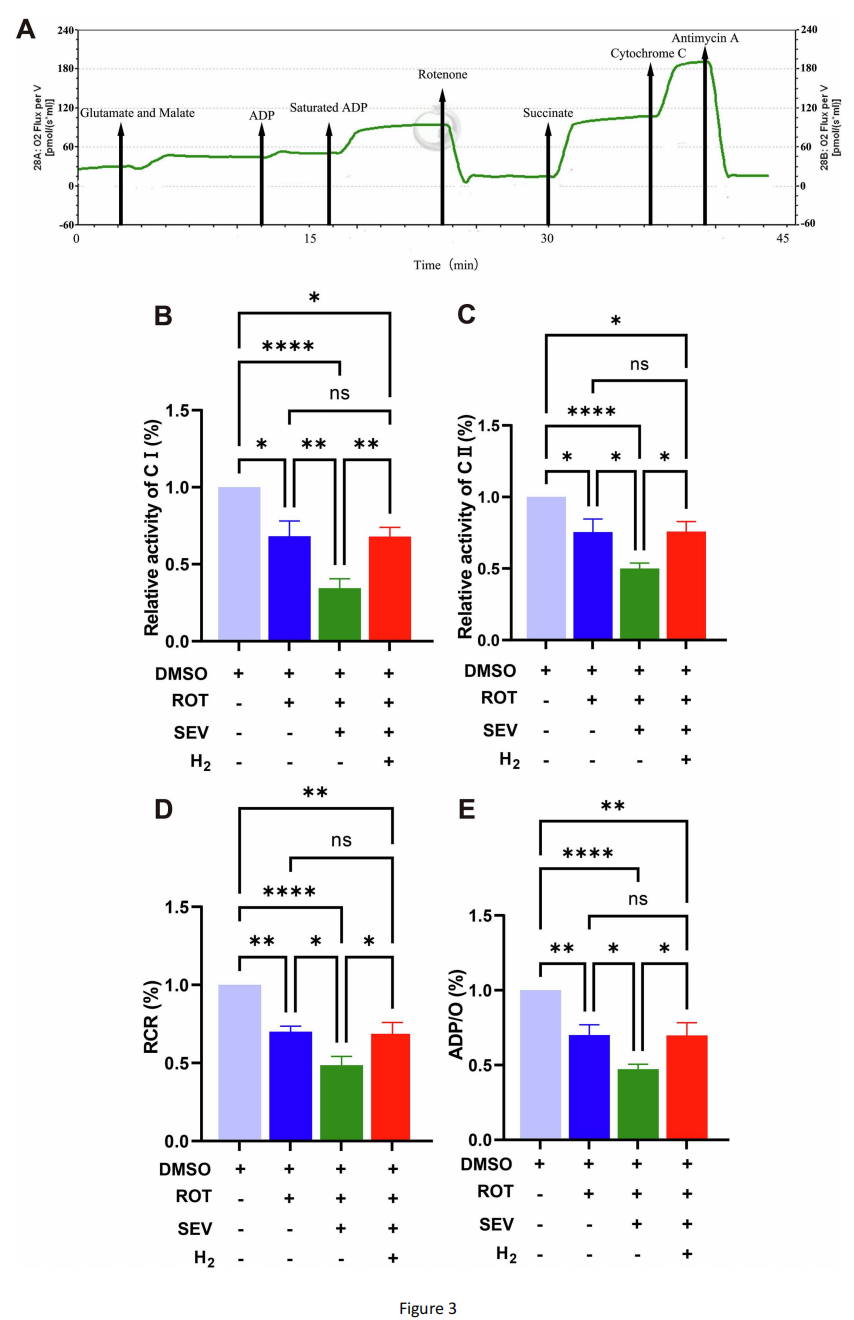
图3 氢气处理可增强七氟醚处理后帕金森病果蝇的线粒体功能
(A)采用多底物-抑制剂滴定方案评估线粒体功能的代表性轨迹图,该轨迹图显示了氧通量随时间的变化。
(B)线粒体复合体Ⅰ的相对活性。七氟醚组的复合体Ⅰ相对活性比帕金森病组低33%,而氢气组的复合体Ⅰ相对活性比七氟醚组高48%。
(C)线粒体复合体Ⅱ的相对活性。七氟醚组的复合体Ⅱ相对活性比帕金森病组低34%,而氢气组的复合体Ⅱ相对活性比七氟醚组高52%。
(D)呼吸控制率(RCR)。七氟醚组的呼吸控制率比帕金森病组低31%,而氢气组的呼吸控制率比七氟醚组高42%。
(E)ADP/O比值(代表每个氧原子参与合成的三磷酸腺苷(ATP)分子数)。七氟醚组的ADP/O比值比帕金森病组低33%,而氢气组的ADP/O比值比七氟醚组高48%。Oxygraph-2k检测实验重复6次,每次200只果蝇;数据采用单因素方差分析结合Tukey检验。
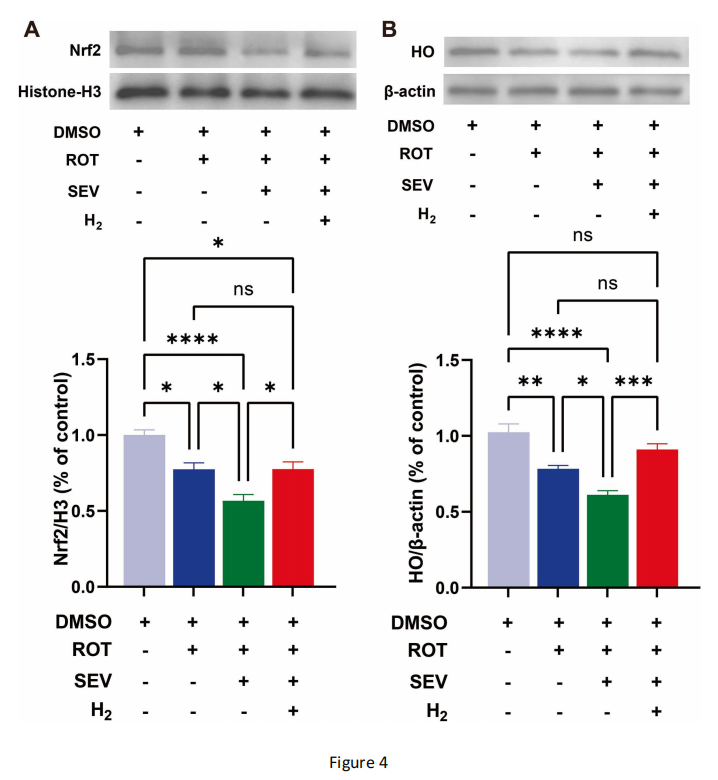
图4 氢气处理可激活七氟醚处理后帕金森病果蝇头部的Nrf2/HO通路
(A)通过蛋白质印迹(Western blotting)检测不同处理条件下帕金森病果蝇头部细胞核内Nrf2(NFE2样碱性亮氨酸拉链转录因子2)的水平。
(B)通过蛋白质印迹检测不同处理条件下帕金森病果蝇头部细胞质中HO(血红素加氧酶,果蝇体内与HO-1同源的蛋白)的表达水平。氢气组的HO表达量比七氟醚组高49%。采用ImageJ软件对印迹条带进行灰度定量分析;组蛋白H3(Histone-H3)作为细胞核内参蛋白,β-肌动蛋白(β-actin)作为细胞质内参蛋白;Nrf2和HO的表达水平均先与对照组进行标准化处理后再进行组间比较。蛋白质印迹实验重复4次,每次240只果蝇;数据采用单因素方差分析结合Tukey检验。
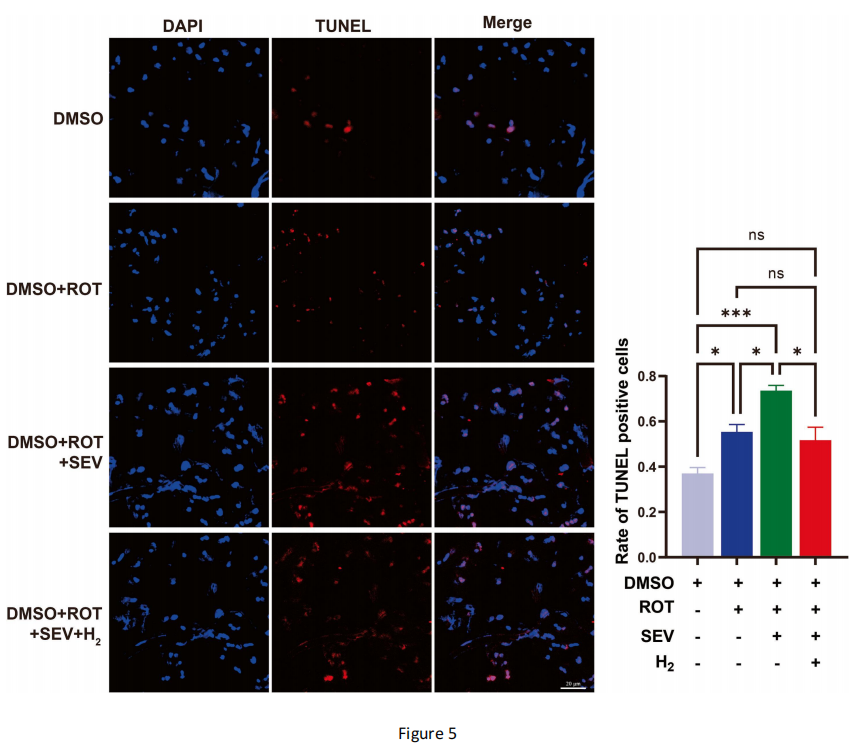
图5 氢气处理可抑制七氟醚处理后帕金森病果蝇脑部的细胞凋亡
采用末端脱氧核苷酸转移酶介导的缺口末端标记(TUNEL)实验评估果蝇脑部的细胞凋亡情况。红色荧光与4',6-二脒基-2-苯基吲哚(DAPI)荧光叠加区域代表TUNEL阳性细胞(即凋亡细胞)。TUNEL阳性细胞率计算公式为:TUNEL阳性细胞数÷DAPI阳性细胞数×100%。TUNEL实验重复3次,每次8只果蝇;七氟醚组的TUNEL阳性细胞率比帕金森病组高33%,而氢气组的TUNEL阳性细胞率比七氟醚组低30%。数据采用单因素方差分析结合Tukey检验;比例尺代表20微米(μm)。
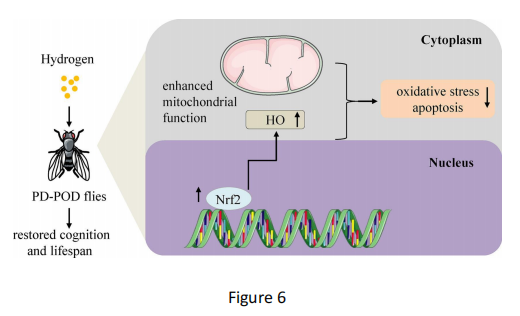
图6 氢气可改善七氟醚诱导的帕金森病-术后谵妄(PD-POD)果蝇的认知功能并延长其寿命
吸入2%氢气可增强七氟醚诱导的PD-POD果蝇的线粒体功能,并激活Nrf2/HO通路,从而降低该类果蝇的氧化应激水平和细胞凋亡率。
图S1 采用负趋地性实验评估帕金森病果蝇的运动功能(以攀爬指数表示)
攀爬能力评估方法:将25只果蝇一组,放入垂直玻璃柱(高15厘米、直径3厘米)中;恢复5分钟后,轻敲玻璃柱使果蝇落至柱底,随后记录其攀爬情况。将玻璃柱按高度分为4个象限,顶部象限记4分,底部象限记1分。攀爬指数计算公式为:(果蝇数量×对应象限分数)之和÷总果蝇数。该实验重复10次,每次100只果蝇。
图S2 蛋白质印迹检测Nrf2表达的重复实验结果
图S3 蛋白质印迹检测HO表达的重复实验结果
https://wap.sciencenet.cn/blog-41174-1505478.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:膳食脂质吸收的新机制:免疫细胞、肠道菌群与肠道上皮细胞的协同作用