博文
分子进出细胞核的活细胞超分辨率显微镜研究
|
分子进出细胞核的活细胞超分辨率显微镜研究
核孔复合物是细胞进入细胞核的通道。如今,一种体内成像技术能够追踪分子穿过这一复合物的方式。
宏观尺度上的生命现象仅源于纳米尺度上的分子动力学过程。在细胞内部,无数分子在几分之一秒的时间尺度内扩散、运输并相互作用。索(Sau)等人在《自然》杂志上发表的文章介绍了一种方法,使科学家能够在毫秒时间尺度上追踪分子进出细胞核的过程,并且具备纳米级的空间分辨率。
在具有细胞核的生物体细胞中,DNA 存储在细胞核这个隔间内,细胞核由一层称为核膜的双层膜包裹。DNA 在细胞核内转录成 RNA,然后 RNA 离开细胞核进入细胞质,在细胞质中用于合成蛋白质。在单个细胞中,每秒大约有 1000 个 RNA、蛋白质和其他分子可以在细胞核和细胞质之间进行交换。这种交换由一种称为核孔复合物(NPC)的大型蛋白质复合物调节,它起着通道的作用。大约有 1000 个核孔复合物嵌入在核膜中。
核孔复合物的内部可以看作是一扇门,其形状像一个圆柱体,直径为 50 至 70 纳米。核膜上的一组被称为核孔蛋白的蛋白质网络横跨这扇门,为一些分子形成了一个渗透屏障。这个屏障如何适应不同大小分子的运输是一个被广泛研究但尚未得到解答的问题。深入了解这种受到调控和具有选择性的运输过程,对于理解许多与核孔复合物功能紊乱相关的疾病至关重要,这些疾病包括神经退行性疾病和癌症。
对核孔复合物渗透屏障动态特性的实验表征面临着来自显微镜技术局限性的挑战。核孔复合物的结构已经通过冷冻电子显微镜确定,但这种技术不能用于活体样本,因此无法洞察单个核孔复合物的动态变化,因为它只能捕捉到单个时间点的情况。
单分子定位显微镜(SMLM)这种超分辨率光学显微镜技术使得对核孔蛋白的成像成为可能。光学显微镜适用于活细胞,此外,提供不同颜色的小型荧光分子(荧光团)可用于选择性标记和监测感兴趣的分子。
一种称为 MINFLUX 的技术是单分子定位显微镜(SMLM)的一种形式,在这种技术中,驱动荧光信号的激发光束呈环形,并且大致位于这个环形光束中心的一个荧光团会被追踪。然后,只需要来自激发光束的少量发射光就可以找到该荧光团。这有助于避免光漂白现象(在这种现象中荧光会消失),从而能够更长时间地对荧光信号进行成像。通过不断调整环形光束的三维位置,可以追踪荧光团的运动。因此,可以在纳米尺度和高时间分辨率下长时间地对荧光团进行三维追踪。这些优点使得 MINFLUX 成为三维单粒子追踪的首选方法。
索及其同事熟练地利用了这些追踪可能性,以深入了解核孔复合物的动态变化。在他们的双色三维 MINFLUX 实验中,作者使用一种颜色来代表核孔复合物的荧光信号作为参考。使用另一种颜色,他们追踪了相对于核孔复合物的蛋白质输入蛋白α(Imp α)(图 1)。输入蛋白α与蛋白质结合,通过核孔复合物将其导入细胞核,然后离开细胞核返回细胞质,再次与蛋白质结合。因此,这种方法提供了一种评估核输入和输出的方式。
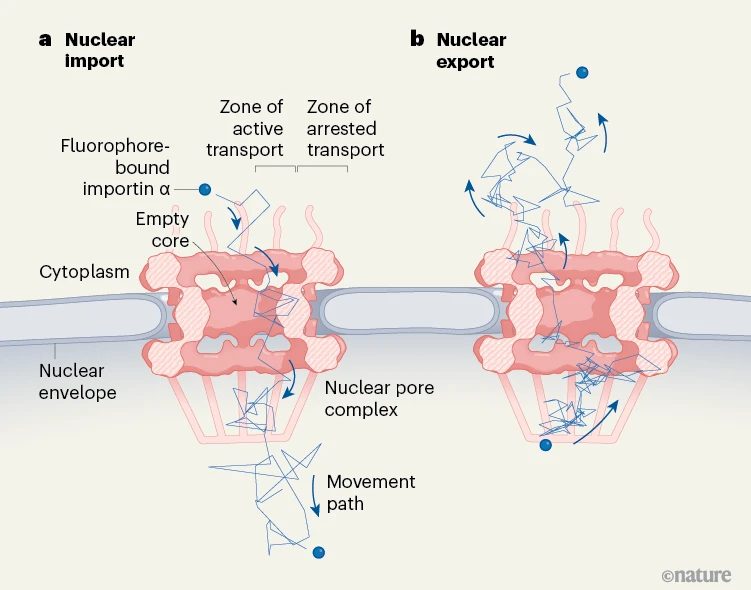
图 1 | 分子如何进出细胞核。索等人使用高分辨率显微镜研究活细胞,并追踪通过一种称为核孔复合物(NPC)的蛋白质复合物进出细胞核的分子。这种复合物位于一层称为核膜的双层膜中,核膜包围着细胞核。a,作者利用与感兴趣蛋白质结合的荧光团分子发出的荧光,追踪进入细胞核的物质。索等人监测了输入蛋白α的位置,该蛋白有助于将分子运入细胞核,然后返回细胞质。作者还使用了另一个荧光信号(未显示)来定位核孔复合物的一个组成部分,作为成像过程的一部分。此处添加了整个核孔复合物的横截面以供参考。索等人报告观察到了三个具有不同特征的区域。在核孔复合物的中心核心是一个与运输无关的空白区域。在核孔复合物的边缘,有一个活跃运输区域,而在核孔复合物的外围是一个运输停滞区域,蛋白质在此区域会暂停。b,作者还观察到了从细胞核的输出过程。(改编自参考文献 1 的扩展数据图 7t 和图 3d)
作者实现了 7 至 8 纳米的空间精度,峰值时间分辨率为 0.5 至 0.6 毫秒。尽管这已经令人印象深刻,但最值得注意的是,对于单个荧光团的轨迹,他们得到的测量点中位数为 18 个,持续时间约为 10 毫秒,其中有 6 个点是在核孔复合物内部采集到的。这与之前由于快速光漂白而报道的核孔复合物内部平均只有一个测量点的情况形成了鲜明对比。
这些详细的轨迹揭示了分子运动速度(与一个称为表观扩散系数的指标相关)的证据,其速度比之前报道的此类轨迹的证据慢 40 倍(意味着运动更缓慢)。此外,观察到与输入蛋白α结合的蛋白质的输入和输出都发生在距离核孔复合物核心 20 至 30 纳米的位置,使得核心区域没有输入蛋白α。有趣的是,没有发现明显的输入和输出通道。这与通过核孔复合物的反向运输在空间上是分离以避免碰撞的假设相悖。
索等人确实发现了一种不同的区分,即连续输入和停滞输入之间的区别(在停滞输入的情况下,输入蛋白会在核孔复合物的外围暂停)。基于这些发现,索及其同事提出了一种新的核输入和输出模型,在这个模型中,核孔复合物的入口被分为三个区域。核孔复合物的中心核心没有输入蛋白α,周围是一个活跃运输区域,再往外是核孔复合物外围的运输停滞区域。
索及其同事的工作为关于分子通过核孔复合物运输的持续讨论做出了贡献。作者的一个显著发现是在核孔复合物核心没有输入蛋白α。输入蛋白α是一种称为核转运蛋白的蛋白质,它与太大而无法在没有帮助的情况下通过核孔复合物渗透屏障扩散的分子结合。较小的分子可以在没有核转运蛋白帮助的情况下通过核孔复合物扩散。
有趣的是,在现有的一个模型中,有人提出由核转运蛋白促进的运输发生在核孔复合物的外围,而被动运输则通过核孔复合物的核心进行。索及其同事的工作虽然与所提出的外围促进运输相一致,但并没有提供关于被动运输的信息。因此,当获得关于被动运输的信息时,他们关于输入和输出在空间上重叠的结论可能需要修改。
然而,最重要的是,作者展示了使用三维 MINFLUX 技术追踪活细胞内分子的可能性。这为未来的研究铺平了道路,例如关于被动的核质运输的研究,这将使科学家能够更深入地了解核孔复合物运输的动态过程。
https://wap.sciencenet.cn/blog-41174-1479220.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:双气体纳米药物在青光眼治疗中的潜力