博文
炎症与氧化应激的协同作用促进糖尿病足溃疡的血管再生
|
炎症与氧化应激的协同作用促进糖尿病足溃疡的血管再生
摘要
患有严重下肢缺血的糖尿病足溃疡(DFU)患者面临截肢风险。DFU 患部组织常伴有氧化应激和过度炎症,加剧了伤口恶化。抗氧化损伤与抗炎的双重策略有望应对糖尿病伤口不愈合的难题。在此,我们提出一种双重治疗策略,即使用去铁胺(DFO)修饰益生菌——食窦魏斯氏菌(WC)。这种工程化益生菌(WC@DPA)旨在改善缺血微环境中的氧化应激,并促进内皮管状结构的形成与增殖。将WC@DPA凝胶应用于糖尿病小鼠的慢性伤口和缺血性后肢损伤时,它在调节氧化损伤、减轻局部血管炎症、促进肌肉组织修复和血管重建方面表现出色。我们相信,这种工程化益生菌为治疗与DFU相关的缺血性损伤提供了一种有前景的治疗途径。

图形摘要
1. 引言
糖尿病足溃疡(DFU)是糖尿病患者中普遍且严重的并发症,全球约有1860万人受其影响[1,2]。令人担忧的是,约85%的DFU患者面临截肢风险[3 - 5]。DFU患者的截肢率显著高于非糖尿病患者,是后者的10至20倍,这主要归因于严重的肢体缺血,它是下肢截肢的主要原因[6 - 8]。研究表明,糖尿病缺血肢体中的高血糖会催化产生大量有毒自由基。这些自由基会显著抑制缺氧诱导因子的活性,进而阻碍转录介导的组织修复、细胞生长和增殖[9 - 12]。鉴于DFU微环境具有氧化失衡和血管功能障碍的特点,采用一种旨在清除有毒自由基并促进血管再生的综合治疗策略或许会有成效。
然而,目前的血管重建技术在完全恢复缺血性足溃疡肢体血液循环方面往往效果不佳[13,14]。例如,外科搭桥手术虽有一定效果,但会造成广泛创伤,恢复时间长,且感染和血栓形成的风险较高。而血管成形术虽被认为是侵入性较小的选择,但其疗效通常较低[15 - 17]。尽管这些手术在某些严重肢体缺血病例中有效,但并非适用于所有患者。因此,局部血管再生成为关键需求,凸显了该领域对创新解决方案的迫切需求。
基于益生菌的疗法在临床研究中受到广泛关注,越来越多的研究表明利用工程菌促进伤口愈合具有一定潜力[18 - 20]。食窦魏斯氏菌(WC)作为一种用于口腔保健的益生菌,其抗炎和抗菌特性已得到认可[21,22]。研究显示,WC能在局部合成一氧化氮(NO),有助于调节心血管功能并刺激皮肤细胞活化,从而促进血管生成[23]。然而,由于糖尿病缺血肢体中的高血糖会催化产生大量有毒自由基,单独使用WC治疗糖尿病缺血肢体的效果并不理想。去铁胺(DFO)是一种经美国食品药品监督管理局(FDA)批准的铁螯合剂,已证实它能减少自由基生成,有助于伤口愈合并减少DFU中的组织坏死[24 - 27]。
在此,我们开发了一种工程化益生菌水凝胶,旨在克服DFU中肢体缺血带来的复杂挑战。这种创新疗法通过DFO脂质体与WC的策略性结合得以实现,二者形成共生关系(WC@DPA),可减轻氧化应激和过度炎症,最终促进DFU中的血管重建(方案1)。随后,将WC@DPA整合到透明质酸凝胶中,制成了一种高效的治疗性工程化益生菌凝胶(方案1)。WC@DPA凝胶具有独特的特性,如清除有害的羟基自由基、重新平衡氧化状态以及重塑DFU的慢性炎症环境。此外,WC本身能持续产生NO,有助于向缺血区域局部递送,这对改善下肢血液循环尤为有益。我们的实验证据有力地表明,DFO脂质体和释放NO的工程化WC的双重作用显著提高了细胞存活率、迁移能力,改善了氧化应激状况,并加速了血管生成和肌肉再生的重建过程。
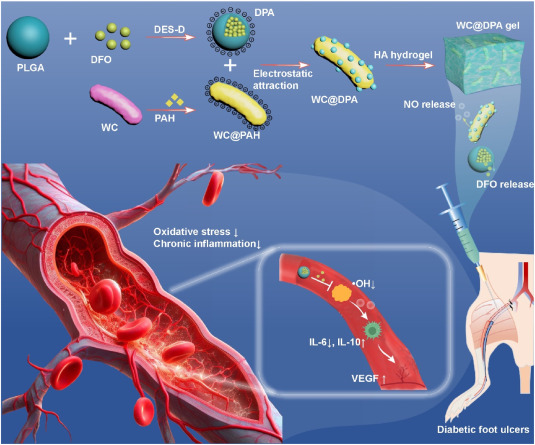
方案1:工程益生菌WC@DPA凝胶促进糖尿病足溃疡肢体缺血损伤后血管再生的示意图WC@DPA凝胶能够向缺血区域释放一氧化氮(NO)和去铁胺(DFO),以缓解氧化应激和慢性炎症。
1.1 材料与试剂
聚烯丙胺盐酸盐(PAH;分子量:17500 Da)、透明质酸(HA)、聚乳酸 - 乙醇酸共聚物(PLGA)和4',6 - 二脒基 - 2 - 苯基吲哚(DAPI)购自美国西格玛 - 奥德里奇公司。食窦魏斯氏菌(WC)取自中国河南的北纳创联微生物菌种技术研究中心。2',7' - 二氯二氢荧光素二乙酸酯(DCFH - DA)、死活细胞活力检测试剂盒和总一氧化氮检测试剂盒购自中国碧云天生物技术研究所。羟基自由基清除能力检测试剂盒购自中国生工生物工程股份有限公司。小鼠白细胞介素 - 6(IL - 6)/白细胞介素 - 10(IL - 10)酶联免疫吸附测定(ELISA)试剂盒购自中国伊莱瑞特生物科技股份有限公司。
1.2 DPA的制备与表征
采用双重乳液溶剂扩散(DES - D)法制备DPA脂质体。首先,将20 mg DFO溶解在1 mL 2.8%的聚乙烯醇(PVA)溶液中,然后与3 mL含3% PLGA的乙酸乙酯乳化[26]。使用探头式超声仪以25%的振幅超声处理120 s,形成初级乳液。接着将该乳液转移至10 mL 20%的蔗糖溶液中,再进行二次超声处理120 s。随后,将混合物在室温下搅拌过夜,以使乙酸乙酯完全蒸发。之后,通过9000 g离心10 min收集DFO脂质体,并用去离子水洗涤三次。
1.3 WC@DPA水凝胶的合成
首先通过添加PAH使WC带上正电荷,得到带正电的WC。接下来,将1 mL经PAH修饰的WC溶液与2 mg(1 mg/mL)的DPA在超纯水中混合,并轻轻振荡60 s。将所得溶液以6000 g离心3 min,获得工程益生菌WC@DPA。配制好的WC@DPA中含有1×10⁸ CFU/mL的WC和2 μM的DFO。透明质酸水凝胶的制备方法参照文献[28]。制备HA水凝胶时,将2.0 g HA溶解在100 mL去离子水中,然后加入6 mL甲基丙烯酸(MA)。将pH值调至7.25,并在4°C下进行酯化反应24 h。所得混合物用75%乙醇沉淀、透析并冻干。然后,将1%的2 - 甲基丙酮和10%的HA水凝胶加入到含有WC@DPA(10⁸ CFU/mL)的MRS培养基溶液中,接着用405 nm蓝光照射15 s。最后,将混合物置于室温下,得到WC@DPA凝胶。
1.4 溶胀率
将制备好的HA水凝胶冻干后,浸入磷酸盐缓冲液(PBS)中,并在37°C下定期取出。用滤纸吸干表面水分后称重。水凝胶的溶胀率计算公式如下:溶胀率(%)=(Wb - Wa)/ Wa × 100%其中,Wa和Wb分别代表水凝胶浸入PBS前后的重量。WC@DPA的溶胀率实验操作与HA水凝胶相同。每个样品重复测试三次。
1.5 流变学特性
使用HR 20流变仪评估WC@DPA水凝胶的储能模量(G')和损耗因子(G'')。在37°C下进行应变扫描测试,频率恒定为1%,范围从1至100 rad/s。
1.6 NO检测
将20 μM的NO敏感荧光探针DAR - 1加入到WC培养物中,然后将其置于MRS培养基中,在37°C下振荡培养[29]。使用酶标仪测量NO荧光强度(激发波长566 nm,发射波长586 nm)。此外,采用格里斯试剂法检测WC中的NO浓度。1.7 羟基自由基(•OH)检测在10 mL容量瓶中配制不同浓度的DFO溶液,以相应体积的蒸馏水作为空白对照。首先加入1 mL邻菲啰啉(5
2. 结果与讨论
2.1 WC@DPA的制备与表征
在初步研究中,我们使用DAR - 1荧光探针评估了活的WC产生一氧化氮(NO)的情况(图1a)[41]。结合格里斯试剂法检测的结果,我们的数据显示,浓度为1×10⁸ CFU/mL的WC产生的NO量最多(补充图1)。因此,后续实验选用了这一最佳浓度。如图1b所示,结果证实了WC具有产生NO的能力,这与我们之前的研究结论一致[23]。同时,我们的研究还通过羟基自由基检测实验验证了DFO的自由基清除能力。当DFO浓度达到4 μM时,它对羟基自由基有显著的清除作用,在2 μM时效果最为显著(图1b)。我们观察到,当浓度超过4 μM时,DFO在自由基清除方面没有表现出明显的额外效果。之后,我们精心制备了DPA脂质体,并进一步研究了其抗氧化能力,发现DFO和DPA之间没有显著差异(图1b)。确定的最佳浓度下的WC@DPA大小为122.4 nm(图1c)。为了使DPA能够结合到WC上,我们首先用生物相容性的PAH对WC的表面进行修饰,使其带上正电荷以便后续操作。此后,将带正电的WC与DPA脂质体结合,制备出生物杂合体WC@DPA,其zeta电位为 - 7.04 mV(图1d)。如图1e所示,透射电子显微镜(TEM)显示,WC最初表面光滑,在加入DPA脂质体后表面变成明显的颗粒状。这些结果证实了DPA与益生菌的有效合成。
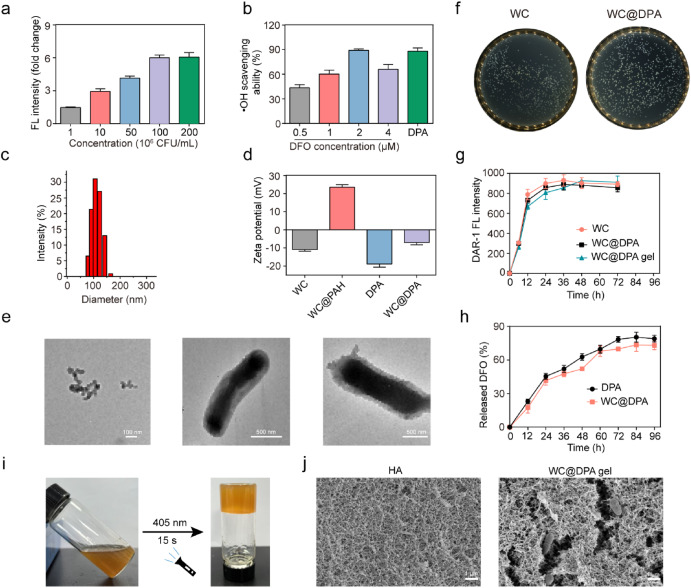
图1. WC@DPA凝胶的表征**
(a)不同浓度WC作用下,NO特异性探针DAR - 1的荧光(FL)强度。
(b)不同浓度DFO和DPA对•OH的清除效果。
(c)DPA脂质体的水化直径。
(d)WC@DPA制备过程中的Zeta电位变化。
(e)WC、DPA和WC@DPA的代表性透射电子显微镜(TEM)图像。
(f)WC和WC@DPA的细菌菌落图像。
(g)WC、DPA和WC@DPA中NO特异性探针DAR - 1的荧光(FL)强度。
(h)DPA和WC@DPA的DFO释放曲线。
(i)通过倒置玻璃管观察WC@DPA水凝胶的形成。
(j)HA和WC@DPA水凝胶的代表性扫描电子显微镜(SEM)图像。
为验证益生菌的生长活性,我们将WC和WC@DPA在MRS培养基中孵育24小时。结果表明,脂质体的加入并未阻碍益生菌的生长(图1f,补充图2)。此外,对NO产生量的比较分析显示,WC@DPA与其未修饰的WC之间无显著差异,这表明脂质体的特定修饰并未明显损害WC的功能(图1g)。为研究工程菌是否能促进DFO的持续释放,我们将负载DFO的PLGA脂质体益生菌加入PBS溶液中。从图1h可以明显看出,DFO在最初12小时内有20%的释放,48小时时释放量约为50%。随后的观察表明,在72小时之后呈现出逐渐且持续的药物释放曲线。最初的快速释放阶段可能是由于DFO通过脂质体的外层扩散,而长时间的释放阶段表明是从脂质体基质中持续渗出。此外,我们利用10%的HA对WC益生菌进行封装,这是因为HA具有生物相容性和良好的营养物质渗透性[28]。我们还对HA水凝胶的特性进行了表征。如图1i所示,通过倒置玻璃管观察到了WC@DPA水凝胶的形成。扫描电子显微镜(SEM)图像显示,HA水凝胶呈现出典型的交联多孔结构,而WC@DPA水凝胶中细菌被封装在水凝胶的孔隙内(图1j)。接下来,我们评估了HA和WC@DPA水凝胶的溶胀行为。它们在初始阶段重量迅速增加,在12小时达到溶胀平衡,同时保持凝胶稳定性(补充图3)。通过流变实验评估了水凝胶的粘弹性。为研究HA水凝胶作为伤口敷料的潜力,我们对HA和WC@DPA水凝胶进行了0.1% - 1000%的应变扫描。在0.1% - 40%的应变范围内,两种水凝胶均表现出弹性,且能恢复到原始状态。然而,当应变超过40%时,两种水凝胶都开始发生不可逆变形(补充图4)。此外,WC@DPA水凝胶具有出色的可注射性,适合后续的体内动物实验。
2.2 WC@DPA抑制氧化应激和炎症
氧化应激和慢性炎症相互作用,促进了糖尿病足溃疡(DFU)的发展[8]。我们通过将RAW264.7巨噬细胞暴露于过氧化氢($H_2O_2$),然后利用Transwell系统将其与WC@DPA共培养来观察这种效应(图2a)[42]。我们的DCFH - DA活性氧荧光染色实验表明,WC@DPA凝胶可以减轻$H_2O_2$诱导的氧化应激(图2b和c)[43]。巨噬细胞向促炎细胞(M1样)或抗炎细胞(M2样)表型的极化决定了慢性伤口的愈合过程。结合我们之前的研究,我们发现WC@DPA凝胶能有效将脂多糖(LPS)刺激的M1巨噬细胞极化为M2巨噬细胞,同时伴随着CD86表达的降低和CD206表达的增加(图2d和e)。这可能是因为去铁胺(DFO)是一种铁螯合剂,它可以通过螯合铁离子来降低铁水平,从而抑制M1型巨噬细胞的极化。在此基础上,我们还证明了WC@DPA凝胶可以有效降低促炎细胞因子(如IL - 6)的水平,并提高抗炎细胞因子IL - 10的水平(图2f和g),这表明NOX凝胶具有抗炎特性。

图2. WC@DPA凝胶在体外减轻炎症
(a)用WC@DPA凝胶治疗伤口的愈合过程示意图。
(b)经H₂O₂刺激的RAW264.7细胞中DCFH - DA探针荧光强度的代表性图像。
(c)经H₂O₂刺激的RAW264.7细胞中DCFH - DA探针荧光强度的定量分析。
(d)不同组中M1/M2水平的代表性图像。
(e)不同组中M1/M2水平的相对密度。
(f)不同组中经脂多糖(LPS)刺激的RAW264.7细胞中白细胞介素 - 6(IL - 6)的表达水平(n = 6)。
(g)不同组中经脂多糖(LPS)刺激的RAW264.7细胞中白细胞介素 - 10(IL - 10)的表达水平(n = 6)。
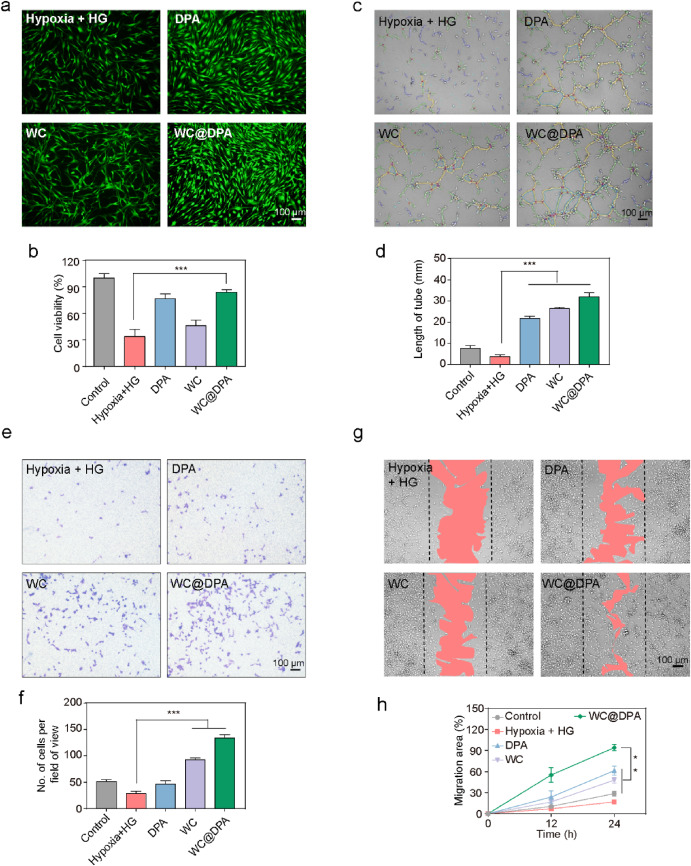
图3. WC@DPA凝胶在体外促进细胞增殖
(a)不同组在33 mM葡萄糖和6 h低氧条件下的人皮肤成纤维细胞(HSFs)代表性图像;
(b)不同组HSFs的细胞活力;
(c)人脐静脉内皮细胞(HUVECs)管腔形成的代表性图像;
(d)HUVECs管腔形成的定量分析;比例尺为100 μm;
(e)HUVECsTranswell迁移实验的代表性图像;
(f)HUVECsTranswell迁移实验的定量分析;
(g)HUVECs迁移的代表性图像;
(h)HUVECs迁移的定量分析。**P < 0.01;***P < 0.001。
2.4 WC@DPA加速糖尿病小鼠伤口愈合
本研究采用链脲佐菌素(STZ)诱导的糖尿病小鼠构建慢性糖尿病伤口模型,以研究其炎症调节作用和生物相容性[46]。STZ诱导的小鼠出现体重减轻和血糖降低等典型症状(补充图5)。在小鼠背部中央精确制造直径为10 mm的全层圆形伤口(补充图6a)[45]。通过定期拍照记录伤口愈合过程,并常规使用DPA、WC或WC@DPA凝胶进行治疗(图4a)。与非糖尿病(Non - DM)组相比,糖尿病小鼠的伤口愈合速度明显较慢。然而,使用WC@DPA治疗的伤口愈合进展最快(图4b和c,补充图6b)。
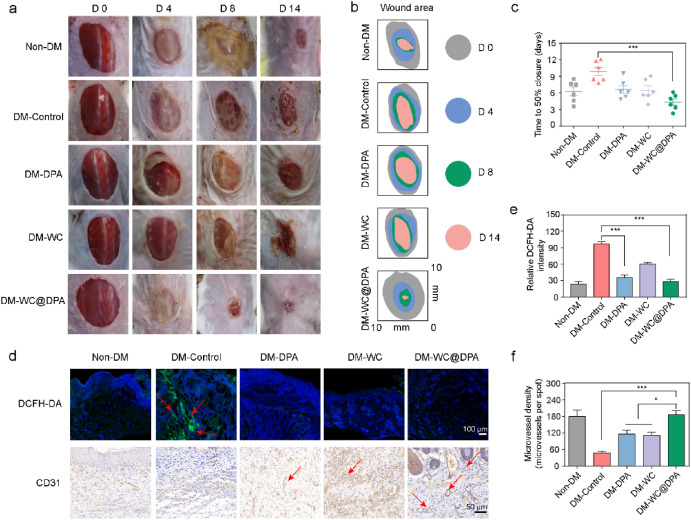
图4. WC@DPA凝胶在体外促进细胞增殖**
(a)不同组在33 mM葡萄糖和6 h低氧条件下的人皮肤成纤维细胞(HSFs)代表性图像;
(b)不同组HSFs的细胞活力;
(c)人脐静脉内皮细胞(HUVECs)管腔形成的代表性图像;
(d)HUVECs管腔形成的定量分析;比例尺为100 μm;
(e)HUVECsTranswell迁移实验的代表性图像;
(f)HUVECsTranswell迁移实验的定量分析;
(g)HUVECs迁移的代表性图像;
(h)HUVECs迁移的定量分析。**P < 0.01;***P < 0.001。
2.4 WC@DPA加速糖尿病小鼠伤口愈合
本研究采用链脲佐菌素(STZ)诱导的糖尿病小鼠构建慢性糖尿病伤口模型,以研究其炎症调节作用和生物相容性[46]。STZ诱导的小鼠出现体重减轻和血糖降低等典型症状(补充图5)。在小鼠背部中央精确制造直径为10 mm的全层圆形伤口(补充图6a)[45]。通过定期拍照记录伤口愈合过程,并常规使用DPA、WC或WC@DPA凝胶进行治疗(图4a)。与非糖尿病(Non - DM)组相比,糖尿病小鼠的伤口愈合速度明显较慢。然而,使用WC@DPA治疗的伤口愈合进展最快(图4b和c,补充图6b)。
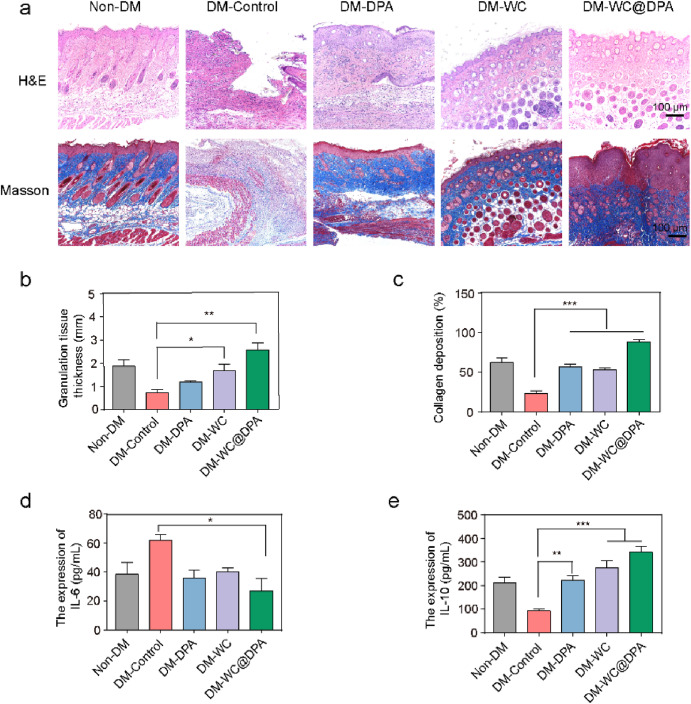
图5. WC@DPA凝胶加速组织再生
(a)第14天不同组伤口组织的苏木精 - 伊红(H&E)染色和Masson染色结果(n = 3);
(b)第14天不同组肉芽组织的定量分析(n = 3);
(c)第14天不同组胶原沉积的定量分析(n = 3);
(d、e)第6天不同组伤口组织中白细胞介素 - 6(IL - 6)和白细胞介素 - 10(IL - 10)的表达水平。*P < 0.05;**P < 0.01;***P < 0.001。
2.5 WC@DPA促进后肢缺血的血管愈合
采用患有下肢缺血性损伤的糖尿病小鼠作为糖尿病足溃疡(DFU)的模型是一种公认的标准方法,有助于深入了解该病的基本发病机制[48,49]。与现有文献一致,经链脲佐菌素(STZ)处理的小鼠主动脉血管壁出现脂质核心积聚增加和病变形成[50,51]。为进一步阐明血管愈合过程,我们研究了不同治疗方法对糖尿病小鼠下肢缺血区域肌肉修复和血管重塑的影响。
为评估WC@DPA对缺血性损伤的血管再生效果,我们对单侧后肢缺血性损伤的糖尿病小鼠分别施用DPA、WC和WC@DPA(图6a,补充图12)。激光多普勒血流灌注成像显示,未治疗组的血流逐渐减少,与之形成鲜明对比的是,WC@DPA治疗组的血流恢复显著增强(图6b和c)。H&E染色显示,糖尿病对照组(DM - Control)的肌束损伤严重,而接受WC@DPA治疗的小鼠的肌肉形态恢复良好,这与WC组和DPA组不同(图6d,补充图13)。随后的抗肌肉萎缩蛋白染色强调了WC@DPA凝胶在促进肌纤维修复方面的重要作用,与DPA组和WC组相比,抗肌肉萎缩蛋白阳性纤维数量增加[41](图6e和f,补充图14)。对肌纤维的横断面分析显示,所有实验组缺血肢体的肌纤维尺寸均小于非缺血肢体。值得注意的是,与DPA组和WC组相比,WC@DPA治疗的小鼠肌纤维形态完整、规则,显示出保护或修复作用。到第7天,WC@DPA组中CD31阳性毛细血管的密度明显高于DPA组和WC组,凸显了WC@DPA的促血管生成作用(图6g和h,补充图15)。我们的数据证实,施用WC@DPA可增加微血管密度,这与血管内皮生长因子(VEGF)的免疫荧光结果一致(补充图16)。
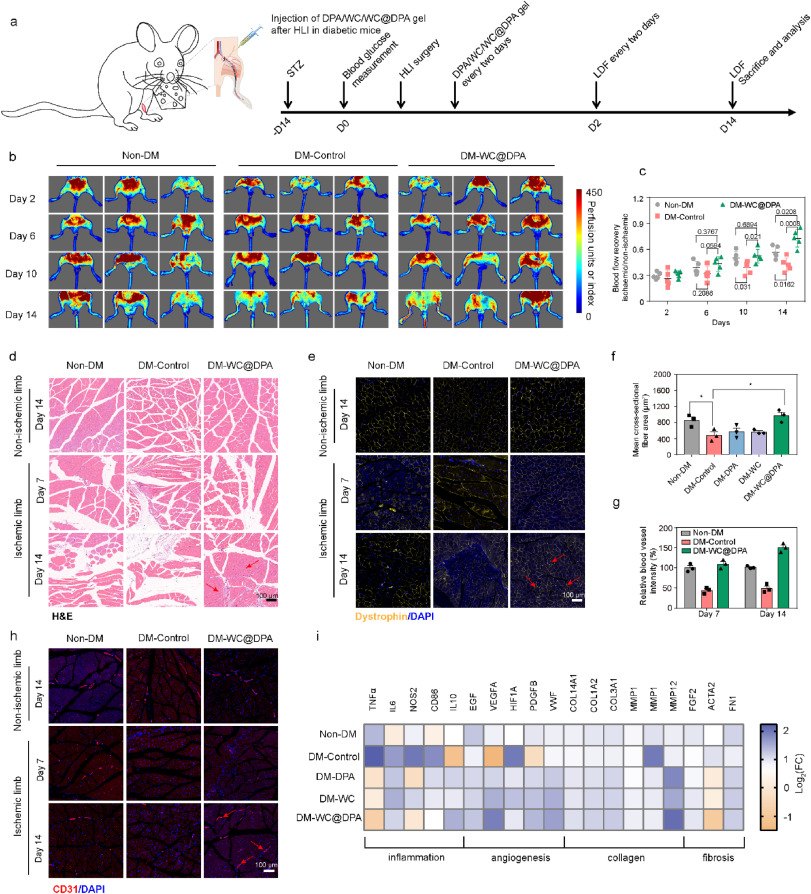
图6. WC@DPA凝胶加速血管生成
(a)糖尿病小鼠缺血肢体治疗过程的时间线;
(b)在第0、2、6、10和14天,接受或未接受WC@DPA凝胶治疗的缺血后肢的代表性激光多普勒血流灌注成像。左腿:非缺血;右腿:缺血。三次技术重复;
(c)以缺血/非缺血后肢血流灌注比值表示的血流灌注定量分析;
(d)不同组非缺血肢体和缺血肢体的苏木精 - 伊红(H&E)染色结果;
(e)不同组非缺血肢体和缺血肢体抗肌萎缩蛋白的免疫荧光图像;
(f)不同组非缺血肢体和缺血肢体抗肌萎缩蛋白的定量分析;
(g)不同组后肢突出显示血管CD31阳性内皮细胞的免疫荧光图像;
(h)不同组后肢突出显示血管CD31阳性内皮细胞的定量分析。阳性结果用红色箭头标记;
(i)缺血肢体mRNA表达倍数变化的热图。*P < 0.05。(关于此图注中颜色的解释,请读者参考本文的网络版本。)
此外,我们采用定量聚合酶链反应(q-PCR)检测来评估血管重建过程中基因表达的变化(图6i)。手术后14天,与非缺血后肢相比,未治疗的糖尿病小鼠缺血后肢中促炎细胞因子(TNFα、IL6和NOS2)的mRNA显著上调。相反,与治疗组相比,未治疗的缺血肢体中抗炎细胞因子IL10和TGFB的水平大幅降低。接受DPA和WC@DPA治疗的肢体中促炎细胞因子水平显著降低。对于参与血管生成的基因(EGF、PDGFB和VWF)和胶原蛋白合成的基因(COL1A2、COL3A1、COL14A1、MMP1、MMP12)[37,42],这些基因在非缺血后肢中表达甚微,而在接受治疗的糖尿病小鼠缺血肢体中明显激活。此外,WC@DPA治疗组中MMP1、MMP9和MMP12的表达水平降低,表明胶原纤维成熟度更高。尽管如此,WC@DPA组中参与血管生成和胶原蛋白生成的基因仍持续活跃,这表明修复和再生过程仍在进行。通过对细菌治疗组的组织进行吉姆萨染色,我们发现在治疗结束后没有残留细菌(补充图17)。
尽管去铁胺(DFO)在糖尿病伤口愈合中应用广泛,但未修饰的DFO无法促进糖尿病缺血性足溃疡的血管重建。作为对DFO的改进,我们开发了用DFO修饰的工程益生菌,用于释放去铁胺和一氧化氮(NO)气体,以改善缺血下肢的微环境。本研究为糖尿病缺血肢体的血管生成和肌肉再生提供了一种有效的方法。然而,我们也认识到这项研究存在一些局限性。首先,我们使用的链脲佐菌素(STZ)诱导的糖尿病小鼠后肢缺血模型可能无法完全模拟人类糖尿病足溃疡患者的情况,而且左股动脉和静脉的近端结扎模型可能无法造成严重的肢体缺血。为了更好地测试工程益生菌的协同治疗效果,未来的研究可以使用猪等大型动物,其病理生理学与人类更为接近。其次,本研究未探讨工程益生菌释放NO的剂量 - 反应效应。高浓度的NO可能存在NO毒性风险。在未来的研究中,我们将把工程益生菌应用于严重下肢缺血模型,并研究治疗持续时间对治疗效果的影响。
3. 结论
综上所述,我们成功开发了一种创新的工程益生菌,它通过策略性释放一氧化氮和去铁胺发挥协同双重作用。这些物质共同调节过度炎症和氧化应激,从而促进糖尿病足溃疡的血管生成。我们通过细致的体外和体内研究,包括在糖尿病慢性伤口和下肢缺血模型中的应用,证实了WC@DPA凝胶制剂的治疗潜力。值得注意的是,WC@DPA凝胶在治疗后第5天即可加速血管再生,与以往治疗方法相比有显著改善。此外,WC@DPA凝胶显著降低了促炎细胞因子的水平和有害自由基的存在,从而将持续的低度炎症转变为更有利于愈合的急性炎症反应。鉴于糖尿病足溃疡的顽固性,WC@DPA凝胶在各种伤口场景中具有广阔的治疗应用潜力,包括但不限于糖尿病伤口、烧伤、烫伤和压疮。
https://wap.sciencenet.cn/blog-41174-1472043.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:氢气纳米气泡水饮用的辐射防护作用研究