博文
[转载]hLife | 美国国家癌症研究所郑志明和Vladimir Majerciak研究团队破译质粒DNA转染激活双重免疫应答
||
质粒DNA转染是生物研究和基因治疗中的关键技术,但其对宿主细胞天然免疫系统的影响仍缺乏系统研究。哺乳动物细胞通过模式识别受体(PRRs)感知外源核酸(如DNA和RNA),激活下游信号通路以抵御病原体入侵。应激颗粒(Stress Granules, SG)和cGAS-DNA凝聚体(cGAS condensates, cGC)是两类重要的天然免疫应答结构:SG通过抑制翻译起始来应对细胞应激,而cGC则通过激活干扰素信号通路响应DNA入侵。然而,质粒DNA如何同时调控这两种结构及其相互作用目前仍不清楚。
近日,美国国立卫生研究院国家癌症研究所郑志明和Vladimir Majerciak研究团队在hLife上发表题为“Induction of translation-suppressive G3BP1+ stress granules and interferon-signaling cGAS condensates by transfected plasmid DNA”的研究论文(图1),该研究通过脂质体介导的质粒转染实验,结合荧光显微成像、siRNA敲低及病毒蛋白共表达等技术,揭示了质粒DNA触发宿主天然免疫的双重机制。

图1 论文标题及作者信息
质粒DNA作为基因递送工具,广泛被应用于基础研究与临床治疗,但其引发的天然免疫反应可能干扰实验结果或降低疗效。尽管SG与cGC均参与抗病毒防御,但二者如何被同时调控以及它们如何相互影响,此前尚未被阐明。本研究首次揭示,脂质体介导的质粒转染会同时激活两条独立免疫通路:其一,质粒转录产生的双链RNA通过PKR-eIF2α磷酸化触发SG形成,抑制蛋白质翻译;其二,质粒DNA直接激活cGAS-STING通路,形成干扰素信号相关的cGC。进一步研究发现,这两种免疫结构在单细胞水平上相互排斥,而病毒蛋白ORF57和ORF52可分别阻断SG与cGC的形成,显著提升转基因表达效率。
研究团队首先发现,质粒DNA剂量依赖性地诱导SG与cGC形成。在HeLa等细胞中,SG(以G3BP1为标志物)和cGC(以cGAS为标志物)的数量随质粒浓度增加显著上升,且这一现象与转染试剂的毒性并无相关性(图2)。

图2 质粒DNA在常用细胞系转染中诱导SG形成
进一步分析表明,SG的形成严格依赖质粒启动子驱动的转录活动:真核表达载体转染后,会激活PKR-eIF2α通路诱导SG(图3)。
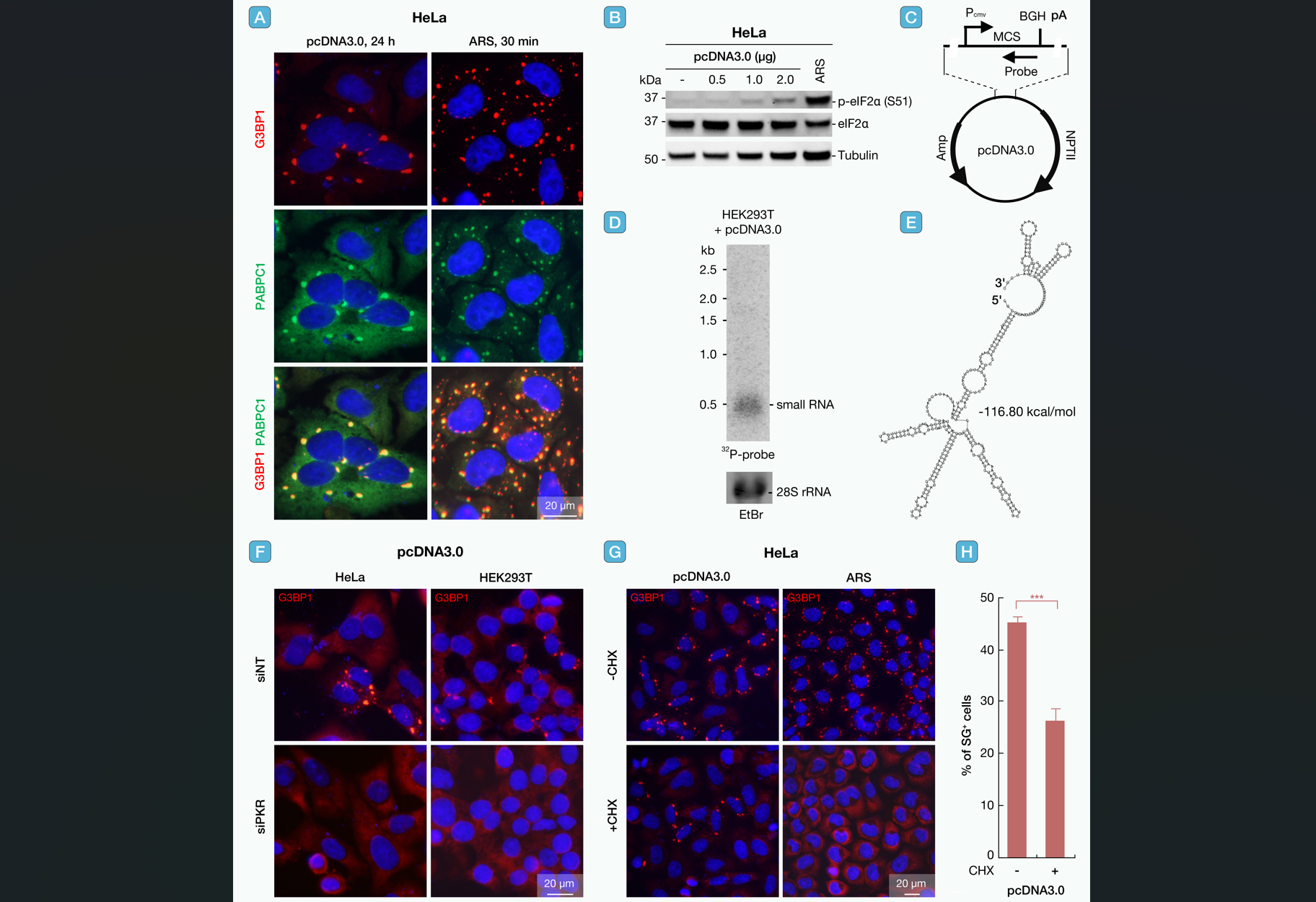
图3 质粒DNA诱导的SG形成依赖PKR激活
与此形成对比的是,cGC的激活仅需DNA本身,无启动子的原核质粒亦可触发。通过实验验证,敲低PKR或使用转录抑制剂,SG的形成可完全被阻断,而cGC通路不受影响(图4)。
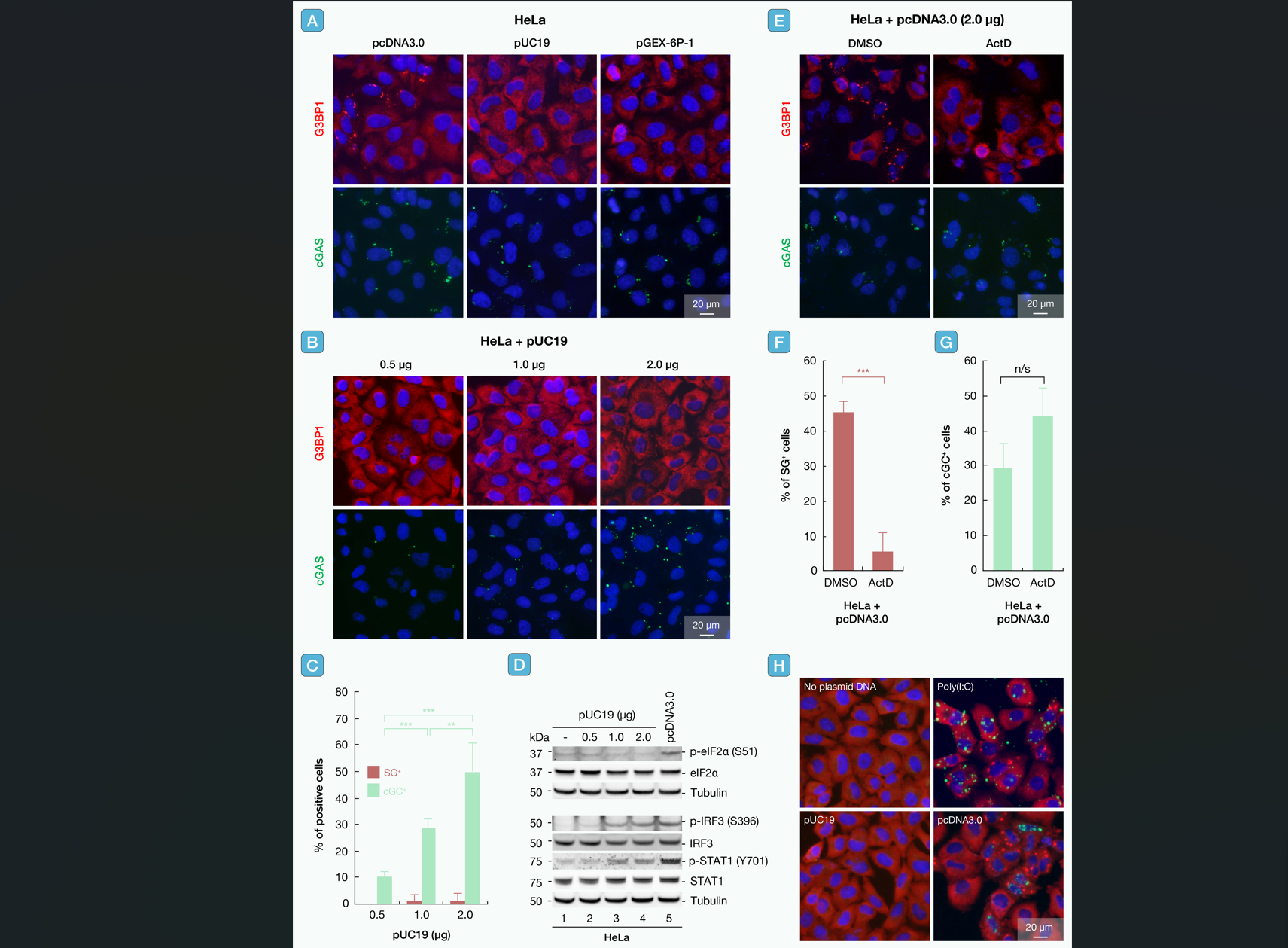
图4 SG的形成需质粒DNA主动转录,而cGC无需转录
值得注意的是,SG与cGC在单细胞中极少共存,仅约3%的细胞会同时出现两者,这也提示了天然免疫通路存在竞争性调控机制(图5)。
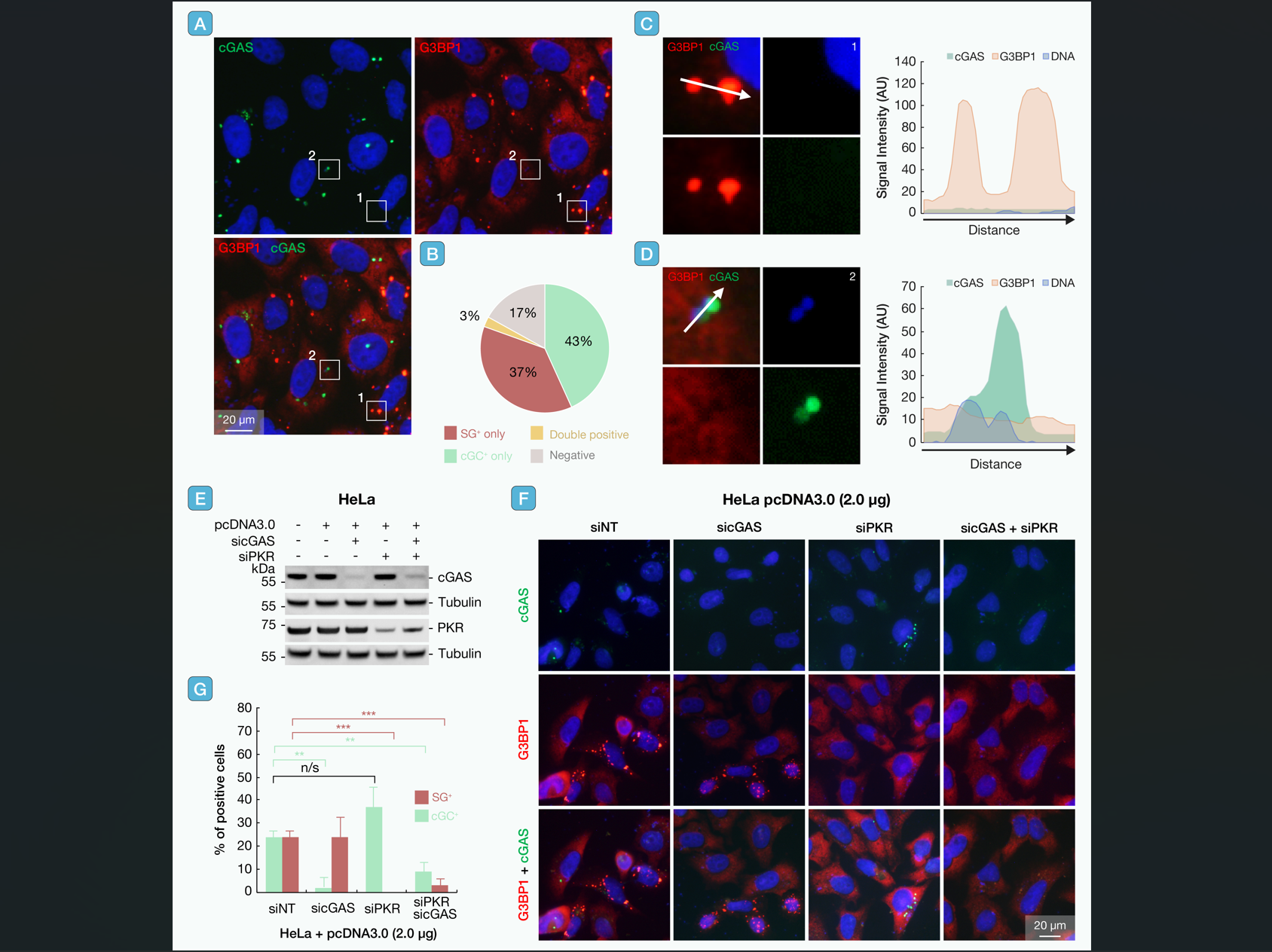
图5 质粒DNA诱导的SG与cGAS凝聚体在HeLa细胞中相互排斥
基于上述发现,研究团队利用卡波西肉瘤相关疱疹病毒(KSHV)蛋白ORF57和ORF52,分别抑制SG与cGC通路。结果显示,ORF57通过阻断PKR激活解除翻译抑制,显著提升了转基因表达效率,使报告基因表达量大幅增加(图6)。

图6 KSHV病毒蛋白拮抗质粒DNA诱导的SG与cGAS凝聚体形成
以上这些发现填补了质粒DNA免疫调控机制的空白。在理论层面,研究首次阐明SG与cGC的互斥性,为天然免疫通路的交互提供了新的理解(图7);在技术层面,利用病毒蛋白或基因编辑工具设计低免疫原性质粒,有望成为提升基因治疗效率的关键策略。

图7 质粒DNA转染激活双重免疫应答
这项研究不仅揭示了质粒DNA的“双刃剑”效应——既是基因递送工具,也是免疫激活触发器,更提出了精准调控免疫应答的创新策略,为提高基因治疗的安全性与高效性奠定基础。
*此微信稿为翻译稿,如有歧义请以英文原文为准。
作者简介
Vladimir Majerciak 资深科学家
第一作者
通讯作者
机构:美国国立卫生研究院国家癌症研究所
研究方向:病毒感染对人类癌症发展的贡献
郑志明 教授
第二作者
机构:美国国立卫生研究院国家癌症研究所
研究方向:蛋白与RNA相互作用及其调节病毒致癌过程
引用格式:Majerciak V, Zheng ZM. Induction of translation-suppressive G3BP1+ stress granules and interferon-signaling cGAS condensates by transfected plasmid DNA. hLife 2025; 3: 21–37. https://doi.org/10.1016/j.hlife.2024.11.005.
期刊简介
hLife 由高福院士、董晨院士和Jules A. Hoffmann教授(2011诺奖获得者)领衔,是中国科学院微生物研究所主办,中国生物工程学会,浙江大学陈廷骅大健康学院,西湖大学医学院,上海市免疫治疗创新研究院和广州霍夫曼免疫研究所联合支持,与国际出版商爱思唯尔合作的健康科学领域综合性英文期刊。
hLife 聚焦健康科学领域的前沿进展,旨在促进基础研究与临床应用的融合发展。期刊发表与医学相关各研究领域最新成果,学科领域包括(但不限于)病原生物学、流行病学、生理学、免疫学、结构生物学、疾病监测、肿瘤、药物、疫苗和健康政策等。
hLife是一本金色开放获取期刊,月刊出版;2022年成功入选“中国科技期刊卓越行动计划高起点新刊”;2023年11月正式创刊;2024年5月被DOAJ收录;2024年8月被Scopus收录。
2026年前hLife接收的稿件免收文章处理费(APC)。
期刊网址:
https://www.sciencedirect.com/journal/hlife
https://wap.sciencenet.cn/blog-3552961-1492336.html
上一篇:[转载]hLife 2025年第六期正式出版
下一篇:[转载]hLife | Ashif Iqubal等研究团队阐明小胶质细胞与阿尔茨海默病的神经炎症和认知障碍的关系