博文
[转载]hLife | Florent Ginhoux研究团队探讨3D模型助力人类诱导多能干细胞衍生小胶质细胞研究
||
小胶质细胞作为中枢神经系统的主要神经免疫细胞,占大脑总细胞数的10%–15%,具有显著的区域分布和基因表达差异,在不同脑区表现出功能特化。此前的研究表明,小胶质细胞功能障碍与多种精神疾病和神经退行性疾病密切相关,这促使研究人员开发靶向小胶质细胞的各种治疗策略。动物模型、2D细胞培养、人源小胶质细胞-小鼠嵌合体,以及含小胶质细胞的3D人脑类器官模型等多种方法已被应用于相关研究,尤其是3D人脑类器官模型为探究小胶质细胞在健康与疾病状态下的作用提供了生理相关性更高的平台。
近日,新加坡免疫学联网Florent Ginhoux研究团队在hLife发表了题为“Advancements in 3D models for studying human iPSC-microglia: Insights into neurodevelopment and neurological disorders” 的综述(图1),探讨了最新的用于生成人诱导小胶质细胞(iPSC-microglia)的3D模型,并评估了这些体外系统在解析大脑发育与神经疾病机制方面的潜力。

图1 论文标题及作者信息
小胶质细胞的3D模型
利用人诱导多能干细胞(hiPSCs)生成小胶质细胞具有显著优势,能够获得大量具有接近成体表型的小胶质细胞,以及可来源于不同疾病或遗传病患者的iPSC系,从而更有效地模拟特定神经炎症和神经退行性疾病的病理过程。小胶质细胞作为中枢神经系统的关键组成部分,需与其他脑细胞相互作用并通过多种信号通路维持脑内稳态,而传统的2D培养体系难以真实再现人脑中复杂的3D结构与细胞间互作环境,动物模型或嵌合系统又缺乏人类遗传背景及人源细胞间的特异性互动,因此,亟需整合多种人源细胞类型的创新模型,以更准确地呈现小胶质细胞的功能特性与动态行为,推动相关疾病研究的转化应用(图2)。
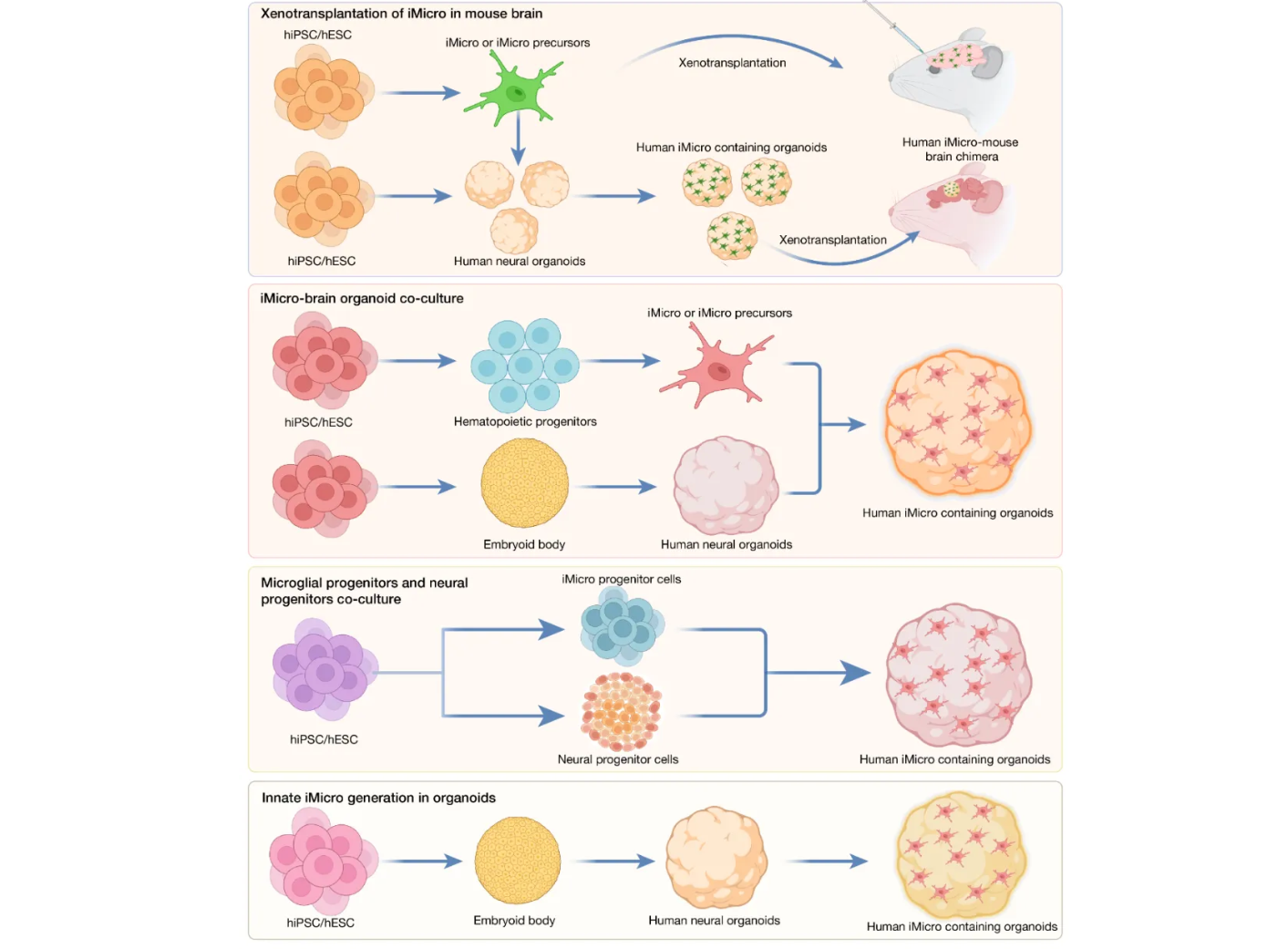
图2 hiPSCs衍生的小胶质细胞与神经组织的3D模型
将人诱导小胶质细胞异种移植至小鼠脑中
在探索小胶质细胞全脑相互作用及神经系统疾病建模的过程中,2D和3D培养体系的研究引发了广泛关注,为进一步解析人源小胶质细胞在复杂的小鼠中枢神经系统中的功能,研究人员开发了多种嵌合模型。Abud等首次证实,成熟的人诱导小胶质细胞(iMicro)可成功植入MITRG小鼠皮层并长期存活,表明其具备整合进既有神经网络的能力;后续研究显示,将iMicro或人胎儿小胶质细胞移植至阿尔茨海默病(AD)小鼠海马体后,这些细胞能有效吞噬清除纤维状淀粉样β(Aβ)斑块,展现出潜在的治疗能力;Hasselmann和Mancuso等进一步证实iPSC来源的造血祖细胞可在体内分化为具有人源基因表达特征并响应病理刺激的iMicro;Fattorelli等通过优化诱导方案显著提高了移植效率与嵌合水平,而Svoboda与Jin等则分别发现移植后的小胶质细胞能再现人脑样基因表达与形态特征,并揭示其在唐氏综合征(DS)模型中的独特表现;Xu等观察到前巨噬细胞(PMPs)在脑内沿血管聚集,并持续增殖达六个月;Schafer等最新开发了一种异种移植人小胶质细胞(hMicros)的方法,不仅支持hMicros的发育成熟,还有效减少其非生理性激活状态,从而更真实地反映其在生理与病理条件下的功能反应,为深入理解人源小胶质细胞在脑疾病中的作用提供了先进的平台。
小胶质细胞与类脑器官共培养:从发育到功能的多维度探索
为深入研究小胶质细胞与类脑器官的相互作用,科研人员建立了多种共培养体系。Abud等将hiPSC诱导的iMicro与类脑器官共培养,发现其能成功整合入类脑器官的3D结构,并对损伤刺激产生功能性响应;Lin等进一步利用该模型揭示APOE4对小胶质功能的影响,而Abreu等则通过含有小胶质细胞的脑球体(μBS)模型验证了共培养系统在炎症响应中的特异性。Speicher和Popova等分别采用转录因子诱导、原代胎儿小胶质细胞植入等方法优化共培养策略,并通过转录组分析显示,3D共培养的小胶质细胞比2D培养更接近真实人源小胶质细胞特征,且在不同脑区表现出迁移能力和免疫代谢的差异;Song与Bejoy等研究还发现,区域特异性共培养可影响TNF-α 表达、ROS生成及糖酵解通路等关键功能。Park等通过将类巨噬细胞iMac与类脑器官共培养,观察到其向iMicro 转变并促进神经元成熟,尤其是在胆固醇转运方面发挥了重要作用。
此外,部分研究尝试从发育角度模拟小胶质细胞的自然起源,如将中胚层祖细胞或红系-髓系祖细胞(EMP)引入类器官,使其分化为具有吞噬和突触调控能力的Iba1阳性小胶质细胞,并参与血管样结构的形成和神经成熟。Sabate-Soler等首次在中脑类器官中实现hiPSC来源小胶质细胞的整合,单细胞核转录组测序(snRNA-seq)显示其不仅具备典型免疫特征,还能影响其他细胞类型的氧化应激与突触重塑过程。Xu等提出的PMP与神经前体细胞(NPC)共培养策略实现了区域特异性类器官中小胶质细胞的内源性嵌合,并展现了其在清除凋亡细胞、突触修剪和免疫调节中的多重功能;Jin等则将此方法应用于唐氏综合征(DS)模型,揭示了DS小胶质细胞在突触修剪过程中的异常表现。Ormel和Cakir等进一步优化培养条件,通过调整heparin浓度或PU.1过表达,使类器官自发产生更接近胎儿期小胶质细胞特征的细胞群体,从而显著提升其生理相关性。
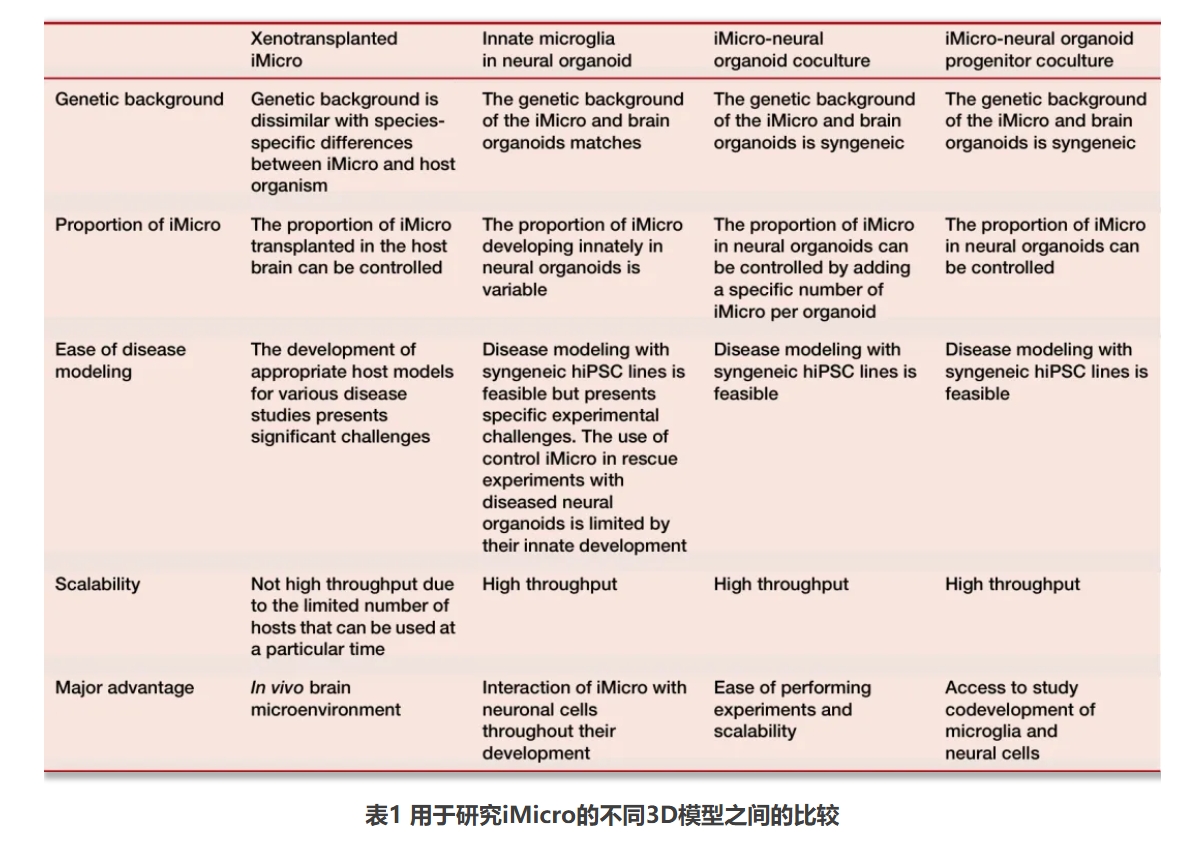
这些共培养模型不仅加深了我们对小胶质细胞发育、区域异质性和功能多样性的理解,也为构建更具人类疾病模拟潜力的神经免疫交互平台提供了关键技术支撑。表1列出了与特定iMicro模型相关的遗传背景、可扩展性以及实验疾病建模难易程度等方面的信息。
小胶质细胞类器官模型在神经发育与疾病研究中的应用
将iMicro整合入其天然组织微环境中,是研究小胶质细胞与神经元复杂互作的重要进展,尤其在生理与病理条件下均具重要意义。当前主要采用两种策略:一是构建嵌合体模型,将iMicro移植至小鼠大脑;二是利用神经细胞培养或类脑器官进行体外研究。其中,与iPSC来源类脑器官的同源共培养尤为有前景,结合同基因型对照,可更精准模拟神经系统疾病,深入解析iMicro在不同发育阶段及疾病背景下的结构与功能特征。Song等发现来源于背侧与腹侧脑区的类器官中的小胶质细胞迁移与炎症反应存在差异;Ao等则开发了类器官芯片系统,显著改善类器官微环境,并观察到共培养中的细胞因子分泌显著增强。
此外,研究表明iMicro通过胆固醇转运调控神经前体细胞代谢与生长,揭示其在早期脑发育中的关键作用,并能影响中脑类器官的神经元兴奋性与突触生长。Bai等建立的单细胞代谢成像平台进一步揭示了小胶质细胞在脂质代谢相关疾病中的异常表现。针对神经发育障碍,含小胶质细胞的类器官也被用于模拟孕期感染和母体免疫激活对微胶功能的影响,以探讨其在神经发育障碍(NDD)中的致病机制。
在神经退行性疾病研究中,小胶质细胞类器官模型同样展现出广泛应用。在AD研究中,APOE4变异被证实会削弱小胶质细胞吞噬能力,而TREM2、SORL1等风险基因的失活也显著影响小胶质细胞对Aβ的响应。Jin等还揭示唐氏综合征(DS)患者来源的小胶质细胞与AD高发之间的关联。研究还发现,小胶质细胞来源的心磷脂可促进Aβ内吞,其水平下降可能与AD的发生密切相关。Kuhn等利用携带家族性AD突变的iPSC构建类器官,发现小胶质细胞缺失可缓解突触损失,强调小胶质细胞在神经炎症中的核心作用。Park等进一步揭示TREM2通过识别外翻的磷脂酰丝氨酸(ePtdSer)促进Aβ清除,而在散发与家族性AD模型中该机制受损。在帕金森病(PD)研究中,Geng等通过α-突触核蛋白PFFs处理的人源中脑类器官与MLKL敲除小鼠模型,证实MLKL抑制可减轻神经炎症与神经元损伤,提示其作为潜在治疗靶点的价值。
不仅如此,小胶质细胞类器官模型在神经发育障碍与免疫相关疾病研究中也展现出广泛应用价值。在自闭症谱系障碍(ASD)研究中,Scn2a基因缺陷小鼠及相应人源类脑器官模型均显示小胶质细胞存在突触过度清除现象,揭示其在ASD发病机制中的关键作用。在多发性硬化(MS)方面,Fagiani等构建的前脑类器官结合患者脑脊液暴露实验,成功模拟慢性活动性MS中少突胶质细胞死亡和炎症反应,凸显该模型在药物筛选中的潜力。针对罕见遗传性炎症疾病Aicardi–Goutières综合征(AGS),研究利用干细胞来源的小胶质样细胞揭示TREX1基因在胆固醇代谢、小胶质形态与吞噬功能中的重要作用,并发现阿托伐他汀药物可部分逆转其缺陷,为治疗提供新思路。
在感染性疾病研究中,含iMicro的类器官系统为解析宿主-病原互作提供了有力工具。Zika病毒研究表明,iMicro不仅促进病毒向神经元扩散,还加剧了类器官的发育障碍;而胎儿单核/巨噬细胞与小胶质细胞在母胎传播中作用不同,后者具有更强的神经保护能力。Rubella病毒感染研究则揭示小胶质细胞为主要靶细胞,并调控非小胶质细胞的干扰素反应。在HIV研究中,整合iMicro的类脑器官模型再现了HIV感染引发的神经炎症及神经元功能障碍,并揭示即使抗病毒治疗后,持续的I型干扰素信号仍与轻度神经认知障碍密切相关。此外,在视网膜类器官中,小胶质细胞也被用于研究视网膜母细胞瘤中RB1缺失对免疫微环境的影响,结果发现RB1缺失可增强小胶质细胞的促炎因子释放并破坏视网膜结构,提示其为潜在治疗靶点。
总结与展望
小胶质细胞作为中枢神经系统的核心免疫细胞,在脑发育与稳态维持中发挥多重关键作用,其功能异常已被广泛关联到包括阿尔茨海默病、帕金森病在内的神经退行性疾病,以及精神分裂症、双相情感障碍和自闭症等精神疾病。近年来,hiPSC来源小胶质细胞与类脑器官共培养技术的发展极大推动了该领域的研究进展。这类模型在基因表达和功能表型上高度模拟体内小胶质细胞,并可通过共培养前体细胞再现其成熟过程及其与神经元之间的互作,为解析小胶质细胞在生理与病理状态下的角色提供了有力工具。
然而,当前模型仍面临诸多挑战,如难以稳定维持小胶质细胞的功能一致性,不同来源的hiPSC衍生小胶质细胞存在异质性,亟需建立系统性的评估标准以确保其身份特征与生物学功能。此外,类器官缺乏血管化导致缺氧、营养不足及代谢废物堆积,限制了类器官的生长与神经发育建模的准确性。未来整合同源血管系统将显著提升模型可靠性。尽管如此,hiPSC来源小胶质细胞仍因其保留人类特异性特征和适用于高通量筛选而成为研究神经疾病的重要平台,通过多维度功能验证有望进一步提升其在脑健康与疾病机制探索中的应用价值。
*此微信稿为翻译稿,如有歧义请以英文原文为准。
作者简介
Satish Kumar Tiwari 助理教授
第一作者
机构:新加坡免疫学联网
研究方向:利用hiPSC衍生的类脑器官研究小胶质细胞在人类神经发育中的作用
Florent Ginhoux 教授
通讯作者
机构:新加坡免疫学联网、上海市免疫学研究所
研究方向:巨噬细胞和树突状细胞在人体和小鼠中的发生和分化
引用格式:Tiwari SK, Ginhoux F. Advancements in 3D models for studying human iPSC-microglia: Insights into neurodevelopment and neurological disorders. hLife 2025; 3: 204–215.
期刊简介
hLife 由高福院士、董晨院士和Jules A. Hoffmann教授(2011诺奖获得者)领衔,是中国科学院微生物研究所主办,中国生物工程学会,浙江大学陈廷骅大健康学院,西湖大学医学院,上海市免疫治疗创新研究院和广州霍夫曼免疫研究所联合支持,与国际出版商爱思唯尔合作的健康科学领域综合性英文期刊。
hLife 聚焦健康科学领域的前沿进展,旨在促进基础研究与临床应用的融合发展。期刊发表与医学相关各研究领域最新成果,学科领域包括(但不限于)病原生物学、流行病学、生理学、免疫学、结构生物学、疾病监测、肿瘤、药物、疫苗和健康政策等。
hLife是一本金色开放获取期刊,月刊出版;2022年成功入选“中国科技期刊卓越行动计划高起点新刊”;2023年11月正式创刊;2024年5月被DOAJ收录;2024年8月被Scopus收录。
2026年前hLife接收的稿件免收文章处理费(APC)。
期刊网址:
https://www.sciencedirect.com/journal/hlife
https://wap.sciencenet.cn/blog-3552961-1492330.html
上一篇:[转载]专刊邀稿 | Brain–Computer Interfaces and Neural Network Disorder
下一篇:[转载]hLife 2025年第六期正式出版