博文
氢气通过改善高尔基体应激介导的自噬、炎症和凋亡,保护脓毒症诱导的心肌病
||
氢气通过改善高尔基体应激介导的自噬、炎症和凋亡,保护脓毒症诱导的心肌病
摘要
背景与目的
脓毒症诱导的心肌病(SIC)是脓毒症患者死亡的主要原因。氢气(H₂)在脓毒症诱导的心肌病中具有心脏保护作用,但其具体机制尚不明确。因此,我们探究了2%氢气治疗是否通过抑制高尔基体应激来减轻脓毒症诱导的心肌病,并研究了这种保护作用背后的具体分子通路。
实验方法
对雄性C57BL/6J小鼠进行盲肠结扎穿孔(CLP)以建立脓毒症模型。我们通过测量7天存活率、心功能、心肌损伤酶以及心肌苏木精-伊红(H&E)染色,来评估2%氢气对脓毒症诱导的心肌病的作用。利用免疫荧光和电子显微镜观察高尔基体(GA)的形态变化。此外,使用高尔基体应激特异性激动剂(布雷菲德菌素A),观察吸入2%氢气的治疗效果是否会被逆转。最后,我们检测了自噬、炎症和凋亡相关指标,以探究2%氢气如何影响高尔基体应激的下游机制。
主要结果
盲肠结扎穿孔后,小鼠的7天存活率下降,心功能恶化,心肌损伤酶升高。高尔基体应激与自噬、炎症和凋亡水平升高相关。吸入2%氢气后,这些水平均降低。然而,使用高尔基体应激特异性激动剂布雷菲德菌素A,可逆转2%氢气的治疗效果。
结论与意义
我们发现2%氢气对脓毒症诱导的心肌病具有保护作用,其机制与改善高尔基体应激介导的自噬、炎症和凋亡有关。
Meng S, Liu J, Luo Y, Fan Y, Wang Z, Song Y, Pei S, Huang X, Zhao L, Xie K. Molecular hydrogen protects against sepsis-induced cardiomyopathy through improving Golgi stress-mediated autophagy, inflammation and apoptosis. Br J Pharmacol. 2025 Jul 27. doi: 10.1111/bph.70132. Epub ahead of print. PMID: 40717465.
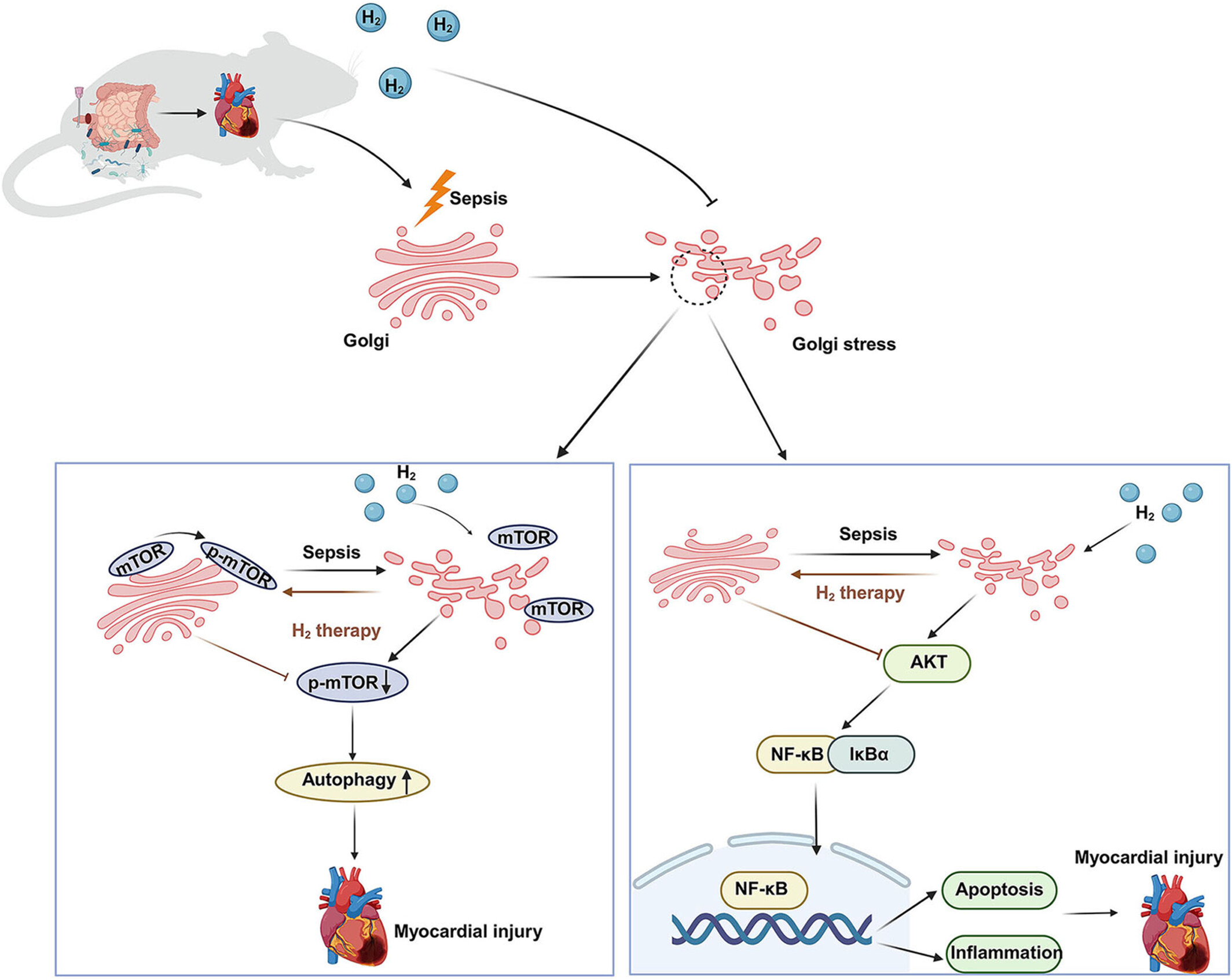
图文摘要
1 引言
脓毒症是一种严重的感染性炎症反应,常进展为多器官功能障碍,威胁患者生命(Lin等,2020)。脓毒症诱导的心肌病(SIC)是脓毒症的主要并发症,其特征为左心室收缩功能受损和射血分数降低(Wang等,2022)。脓毒症患者中脓毒症诱导的心肌病的发病率和死亡率分别为60%和70%(Martin等,2019)。脓毒症诱导的心肌病的发病机制尚未完全明确,但被认为涉及复杂的机制,如炎症、凋亡、自噬、氧化应激、线粒体功能障碍和钙离子失衡(Cui等,2024;Hollenberg和Singer,2021)。尽管脓毒症诱导的心肌病发病率高且病情严重,但目前尚无有效的预防策略或治疗干预措施(Martin等,2019)。因此,需要深入了解脓毒症诱导的心肌病的发病机制并确定治疗靶点。
高尔基体(GA)是一种高度有序的带状结构,通常位于细胞核附近,在脂质和蛋白质的修饰、分选以及运输到合适的细胞目的地方面起着关键作用(Casey等,2018;Hicks和Machamer,2005)。高尔基体参与多种生化过程,如应激反应、自噬、凋亡和炎症(Kulkarni-Gosavi等,2019)。高尔基体应激被定义为高尔基体结构和功能的损伤,可由多种因素引起(Jiang等,2011)。高尔基体应激与哮喘、癌症和急性肺损伤的发病机制有关(Tang等,2022;Wang等,2015;Xu等,2024)。Xu等发现高尔基体应激是哮喘的潜在机制,抑制高尔基体应激可显著减少自噬和哮喘症状(Xu等,2024)。Wang等基于肿瘤进展过程中观察到的高尔基体形态变化,利用定位于高尔基体的环氧合酶作为标志物,在手术中指导肿瘤切除(Wang等,2015)。Tang等在高尔基体上使用硝基还原酶标记物来诊断急性肺损伤并评估治疗效果(Tang等,2022)。高尔基体应激在脓毒症中的作用日益受到关注(Dusabimana等,2023;Li等,2021;Meng等,2024)。例如,抑制高尔基体应激介导的凋亡和炎症可改善脓毒症引起的肾脏和肝脏损伤(Dusabimana等,2023)。同样,HIF-1α/HO-1治疗通过调节高尔基体应激减轻脂多糖诱导的急性肺损伤(Li等,2021)。此外,高尔基体应激是脓毒症诱导的心肌病的关键机制(Meng等,2024)。然而,高尔基体应激背后具体的下游机制仍不明确,抑制高尔基体应激是脓毒症诱导的心肌病治疗的重要靶点。因此,进一步研究高尔基体应激的下游机制至关重要。
氢气(H₂)是一种无色、无味、透明的气体,是最轻且含量最丰富的气体(Qi等,2021)。氢气可以清除羟基自由基、活性氧(ROS)和活性氮物种(RNS),减轻脑缺血再灌注损伤(Ohsawa等,2007)。氢气还具有抗炎和抗凋亡作用,可增强线粒体功能并保护内质网(Qi等,2021)。此外,氢气对脓毒症相关脑病(Qi、Liu等,2023)、神经性疼痛(Chen等,2015)、脓毒症诱导的急性肺损伤(Chen等,2021)和脓毒症诱导的心肌病(Cui等,2024)具有保护作用。氢气影响脓毒症诱导的心肌病的治疗机制涉及自噬(Cui等,2024),但其具体机制仍不清楚。因此,我们旨在研究氢气是否能抑制高尔基体应激,并探究这一过程的下游机制。
2 方法
2.1 动物
SPF级C57BL/6J小鼠(雄性,6-8周龄,体重25-30g)购自中国医学科学院实验动物中心(北京,中国)。实验开始前,小鼠在新环境(温度22-25°C,湿度50-60%)中适应1周。食物和水自由获取。本研究中的实验程序经天津医科大学实验动物伦理委员会批准(IRB2022-DWFL-587)。所有动物实验均严格按照《体内实验动物研究报告指南》(ARRIVE)(Percie等,2020)和《英国药理学杂志》(BJP,Lilley等,2020)的建议进行。采用吸入麻醉(Meng等,2024)。将液体异氟烷(R510-22-10,瑞沃德生命科学有限公司,中国)装入小动物麻醉机(R500IE,瑞沃德生命科学有限公司,中国),维持2%的浓度,通过持续吸入诱导麻醉。随后进行手术操作。实验结束后,在麻醉状态下通过颈椎脱臼法处死每只小鼠(Tao等,2024)。
本研究选择雄性小鼠,是因为它们在盲肠结扎穿孔模型中的变异性低于雌性小鼠。脓毒症涉及器官功能障碍,由炎症风暴和免疫失调引发。然而,成年雌性小鼠的性激素水平波动较大,这会影响它们对盲肠结扎穿孔诱导的炎症的耐受性,并导致免疫失衡(Rittirsch等,2009;Shi等,2024)。此外,雌性性激素对脓毒症诱导的心肌病有保护作用(Xerri等,2022)。因此,与大多数研究一致,本研究选择雄性小鼠作为实验对象(Chen等,2022;Fang等,2024)。
2.2 实验方案
本研究分为两个实验。
实验1:探究氢气是否对脓毒症诱导的心肌病具有保护作用并抑制高尔基体应激。
小鼠被随机分为四组(每组n=38):假手术组(Sham组)、假手术+氢气处理组(Sham+H₂组)、盲肠结扎穿孔组(CLP组)和盲肠结扎穿孔+氢气处理组(CLP+H₂组)。Sham+H₂组和CLP+H₂组分别在术后1小时和6小时吸入2%氢气,每次1小时。我们从每组中随机选择20只小鼠,测量术后7天的存活率。术后48小时,从每组中选取6只小鼠评估小鼠脓毒症评分(MSS)。对6只小鼠进行超声心动图检查。在麻醉状态下收集血液和心脏样本。分离血清以测量心肌损伤酶(心肌肌钙蛋白:cTnI和肌酸激酶:CK-MB)的水平,并收集心脏组织用于蛋白质印迹(WB)和定量聚合酶链反应(qPCR)。此外,从每组中随机选择6只小鼠进行HE染色以评估心肌病理,进行免疫荧光染色以观察高尔基体应激的变化。最后,使用每组6只小鼠的样本进行电子显微镜检查,观察自噬体和高尔基体的形态。
实验2:探究氢气是否通过减少高尔基体应激介导的自噬、炎症和凋亡来改善脓毒症诱导的心肌病。
小鼠被随机分为四组(每组n=38):盲肠结扎穿孔组(CLP组)、盲肠结扎穿孔+氢气组(CLP+H₂组)、盲肠结扎穿孔+布雷菲德菌素A组(CLP+BFA组)和盲肠结扎穿孔+氢气+布雷菲德菌素A组(CLP+H₂+BFA组)。向CLP+BFA组腹腔注射布雷菲德菌素A(BFA,CAS#20350-15-6,Sigma,美国),剂量为1mg/kg,注射后6小时处死小鼠(Meng等,2024)。CLP+H₂+BFA组在术后1小时和6小时吸入2%氢气,每次1小时,并按上述方法注射布雷菲德菌素A。由于二甲基亚砜(DMSO)是布雷菲德菌素A的溶剂,在处死小鼠前6小时,向CLP组和CLP+H₂组注射等量的二甲基亚砜。四组的检测指标与实验1一致。
2.3 盲肠结扎穿孔(CLP)模型
用2%异氟烷麻醉小鼠,对腹部中线进行消毒,做一个1cm的切口(如前所述,Meng等,2024)。暴露盲肠,然后进行50%结扎,并用21G针头穿刺。将盲肠放回腹腔,并挤出少量肠内容物。缝合腹部,将小鼠放在37°C的加热毯上直至苏醒,并皮下注射1ml 0.9%生理盐水。
2.4 2%氢气吸入治疗
如前所述,将小鼠置于带有流入和流出口的密闭玻璃容器中(Cui等,2024)。向玻璃容器中通入2%氢气与空气的混合气体。氢气由氢气发生器(型号AMS-H-03;Asclepius Meditec有限公司,上海,中国)产生,氢气浓度由PG610氢气浓度检测仪(英特电气设备有限公司,河南,中国)测量。
2.5 心脏超声
用2%异氟烷麻醉小鼠,将其置于超声操作板上(Visual Sonics Vero 2100,加拿大)。使用MS400超声探头获取左心室长轴视图。随后观察并记录左心室收缩末期和舒张末期内径(分别为LVESD和LVEDD)及容积(分别为LVESV和LVEDV),以及左心室射血分数(LVEF)和左心室缩短分数(LVFS)。
2.6 心肌HE染色
术后48小时取出小鼠心脏,在4%多聚甲醛中固定24小时,随后进行梯度脱水和石蜡包埋。将石蜡块切成5μm厚的切片,按照HE染色 protocol(G1120,Solarbio,中国)进行染色。由两名对实验组别不知情的病理学家根据脓毒症诱导的心肌病评分标准(Gosavi等,2018)对心脏切片进行评估。
2.7 酶联免疫吸附测定(ELISA)检测
采用ELISA法检测心肌组织中炎症因子(TNF-α、IL-1β和IL-6)的水平以及小鼠血清中心肌损伤酶(CK-MB和cTnI)的水平。将心肌组织匀浆并离心,获取上清液用于检测炎症因子。使用TNF-α ELISA试剂盒(mlC50536-1,mlbio,上海,中国)、IL-6 ELISA试剂盒(ml098430,mlbio,上海,中国)和IL-1β ELISA试剂盒(mlC50300-1,mlbio,上海,中国)检测上清液。收集每组的血液样本,室温孵育后离心,检测心肌损伤酶的水平。使用所得上清液检测cTnI(ml092662,mlbio,上海,中国)和CK-MB(ml037723,mlbio,上海,中国)的水平。
2.8 免疫荧光
我们的免疫荧光程序符合《英国药理学杂志》关于蛋白质印迹和免疫组织化学的指南(Alexander等,2018)。按照与HE染色相同的步骤制备心脏切片用于免疫荧光。将切片与一抗GM-130在4°C下孵育过夜,然后与荧光二抗在37°C下孵育1小时。最后,将DAPI(S2110,Solarbio,北京,中国)滴加到切片上,在37°C下孵育5分钟。使用荧光显微镜(IX53,Olympus,东京,日本)观察并计算完整高尔基体的碎裂率(Gosavi等,2018)。实验中使用的抗体如下
表1. 实验中使用的抗体。
2.9 TUNEL染色
我们对心脏石蜡切片进行脱蜡和水化处理,然后按照TUNEL检测试剂盒(KGA1405-100,江苏凯基生物技术股份有限公司)的说明,加入100μl蛋白酶K工作液。切片用磷酸盐缓冲液(PBS)冲洗,加入50μl TdT酶反应液,随后在37°C避光孵育60分钟。我们向每张切片加入50μl链霉亲和素-荧光素标记液,在湿盒中37°C避光孵育30分钟。最后,用4',6-二脒基-2-苯基吲哚(DAPI)对细胞核进行复染,并在显微镜(IX53,奥林巴斯,日本)下观察。凋亡指数按同一视野中末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)阳性细胞与DAPI阳性细胞的比例计算(Wu等,2020)。
2.10 透射电镜观察
将心脏切成1cm的小块,置于2.5%戊二醛中,4°C过夜。脱水和包埋后,使用超薄切片机(ULTRACUT;徕卡)将这些小块切成100nm的切片。切片用醋酸铀和柠檬酸铅染色。最后,使用透射电镜(日立,东京,日本)评估高尔基体形态和自噬体数量。
2.11 蛋白质印迹法
蛋白质印迹法按照《英国药理学杂志》中关于蛋白质印迹和免疫组织化学的指南进行(Alexander等,2018)。每组心肌组织用蛋白裂解缓冲液(放射免疫沉淀测定缓冲液[RIPA]:苯甲基磺酰氟[PMSF] = 100:1)裂解。测定提取的蛋白质浓度,加入上样缓冲液(P1040,Solarbio,中国),随后煮沸。然后每组蛋白质在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上进行电泳,并将蛋白质转移到聚偏氟乙烯(PVDF)膜(FFP39,碧云天,上海,中国)上。我们用5%脱脂牛奶封闭膜,然后在4°C下与一抗孵育过夜。第二天,膜用 tris缓冲盐水吐温(TBST)洗涤三次,每次5分钟,然后加入二抗。最后,用增强化学发光试剂盒结合蛋白条带,并在暗处孵育。使用ImageJ测量蛋白条带的灰度值,每组蛋白质表达水平以甘油醛-3-磷酸脱氢酶(GAPDH)的表达水平为参照进行标准化。实验中使用的抗体列于表1。
2.12 实时定量聚合酶链反应
从心肌组织中提取总RNA,并根据RT Easy TM II(版本1.0-1403,Foregene,中国)的制造商说明合成cDNA。使用SYBR Green Pro Taq HS试剂盒(AG11701,爱必信生物技术,广州,中国)进行实时PCR。PCR混合物的总体积为10μl,包括4.8μl cDNA、0.2μl引物和5μl无RNA酶水。cDNA和引物浓度分别为20ng/μl和0.5μM。所用的特异性引物列于表2。目标基因的表达水平以GAPDH的表达水平为参照进行标准化。
表2. 本研究中目标基因的特异性引物。
2.13 统计学方法
研究设计和数据分析符合药理学研究中的建议(Curtis等,2025)。实验中的所有动物均随机分组,每组n≥6。这一估计基于先前的类似研究(Meng等,2024)。所有实验动物被随机分配到各组,实验结果在盲态下评估,数据分析人员对每组的治疗措施不知情。数据以均数±标准差表示,并使用SPSS 27.0软件进行分析。数据呈正态分布,多组比较采用单因素方差分析(ANOVA),随后进行Tukey检验。只有当F值达到P<0.05且不存在显著的方差不齐时,才进行事后检验。使用Kaplan-Meier分析和对数秩检验评估小鼠的7天存活率。使用GraphPad Prism 9(RRID:SCR_000306)绘制数据图表。P<0.05表示差异具有统计学意义。
2.14 材料
高尔基体应激激动剂布雷菲德菌素A(CAS#20350-15-6)购自Sigma-Aldrich(美国密苏里州圣路易斯)。TNF-α(mlC50536-1)、IL-6(ml098430)和IL-1β(mlC50300-1)ELISA试剂盒购自mlbio(中国生物技术有限公司)。DAPI(S2110)、RIPA缓冲液(R0010)、PMSF(P0100)和上样缓冲液(P1040)购自Solarbio(北京,中国)。
2.15 靶点和配体的命名
本文中的关键蛋白质靶点和配体与《IUPHAR/BPS药理学指南》(http://www.guidetopharmacology.org)中的相应条目超链接,并永久存档于《2023/24药理学简明指南》(Alexander、Fabbro等,2023;Alexander、Kelly等,2023)。
3 结果
3.1 氢气吸入对脓毒症诱导的心肌病(SIC)具有保护作用
我们在盲肠结扎穿孔(CLP)手术后让小鼠吸入氢气,以探究氢气对心肌的保护作用(图1a)。我们评估了小鼠的整体状况,观察到CLP组的7天存活率低于假手术组,而小鼠脓毒症评分(MSS)高于假手术组(图1b、c)。当小鼠吸入氢气后,7天存活率和MSS评分均得到改善。使用HE染色和评分评估心肌病理损伤(图1d、e)。与假手术组相比,CLP组出现水肿、心肌纤维断裂、炎症细胞浸润,病理评分显著升高。与CLP组相比,氢气治疗显著减轻了诱导的心肌组织损伤,并降低了病理评分。评估血清中肌酸激酶同工酶(CK-MB)(图1f)和心肌肌钙蛋白I(cTnI)(图1g)水平以反映心肌损伤。CLP组的血清CK-MB和cTnI水平高于假手术组,吸入氢气后两者均降低。通过超声心动图检测心功能(图1h-n)。CLP组的左心室射血分数(LVEF)和左心室缩短分数(LVFS)低于假手术组;然而,经过氢气治疗后,这两个参数均有所恢复。此外,CLP组的左心室收缩末期内径(LVESD)、左心室收缩末期容积(LVESV)、左心室舒张末期容积(LVEDV)和左心室舒张末期内径(LVEDD)高于假手术组。与CLP组相比,氢气治疗减轻了LVESD和LVESV的增加,但对LVEDV或LVEDD没有影响。
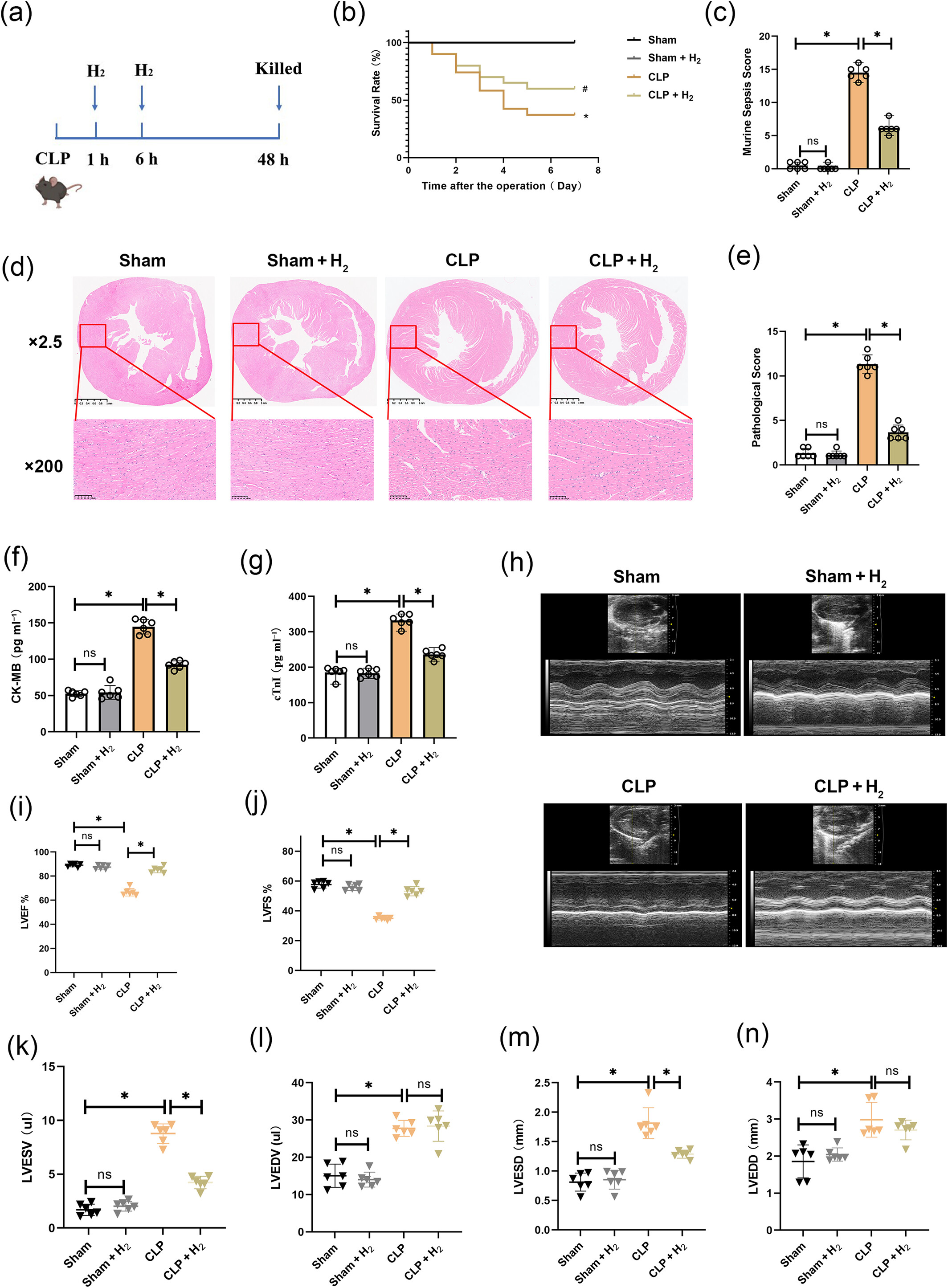
图1
氢气对脓毒症诱导的心肌病(SIC)具有保护作用。(a)小鼠吸入氢气的应用流程。(b)小鼠的7天存活率(n=20)。与假手术组相比,*P<0.05;与CLP组相比,#P<0.05。(c)MSS评分(n=6)。(d和e)心肌HE染色及病理评分;低倍镜下,比例尺代表1μm;高倍镜下,比例尺代表100μm(n=6)。(f和g)血清中心肌损伤酶CK-MB和cTnI的水平(n=6)。(h)小鼠的心脏超声图像(n=6)。(i)左心室射血分数(LVEF)(n=6)。(j)左心室缩短分数(LVFS)(n=6)。(k)左心室收缩末期容积(LVESV)(n=6)。(l)左心室舒张末期容积(LVEDV)(n=6)。(m)左心室收缩末期内径(LVESD)(n=6)。(n)左心室舒张末期内径(LVEDD)(n=6)。所有数据均以均数±标准差表示。两组比较,*P<0.05。CLP,盲肠结扎穿孔。
3.2 氢气吸入抑制脓毒症诱导的心肌病(SIC)中的高尔基体应激
GM-130、Golgin97和GOLPH3是三种代表性的高尔基体蛋白。GM-130和Golgin97参与维持高尔基体形态,而GOLPH3与高尔基体应激相关。与假手术组相比,CLP组中GM-130和Golgin97的表达水平下调,而GOLPH3的表达水平上调(图2a-d)。经过氢气治疗后,上述所有水平均恢复。同样,氢气治疗后,GM-130和Golgin97的mRNA表达水平升高(图2e-f),而GOLPH3的mRNA表达水平降低(图2g)。此外,使用GM-130的绿色荧光染色观察高尔基体的形态变化,GM-130是高尔基体形态的标志。在假手术组和假手术+氢气组中,高尔基体密集分布在核周区域(图2h、i)。相比之下,CLP组的高尔基体在细胞质中破碎成点状结构,碎裂率更高。氢气治疗后,部分高尔基体的形态恢复正常,碎裂率降低。使用电镜捕捉心肌组织中高尔基体的图像。图2j显示,在假手术组和假手术+氢气组中,高尔基体呈长条状,而CLP组的高尔基体肿胀并形成小堆叠。氢气治疗后,高尔基体肿胀减轻,并逐渐恢复为长条状。
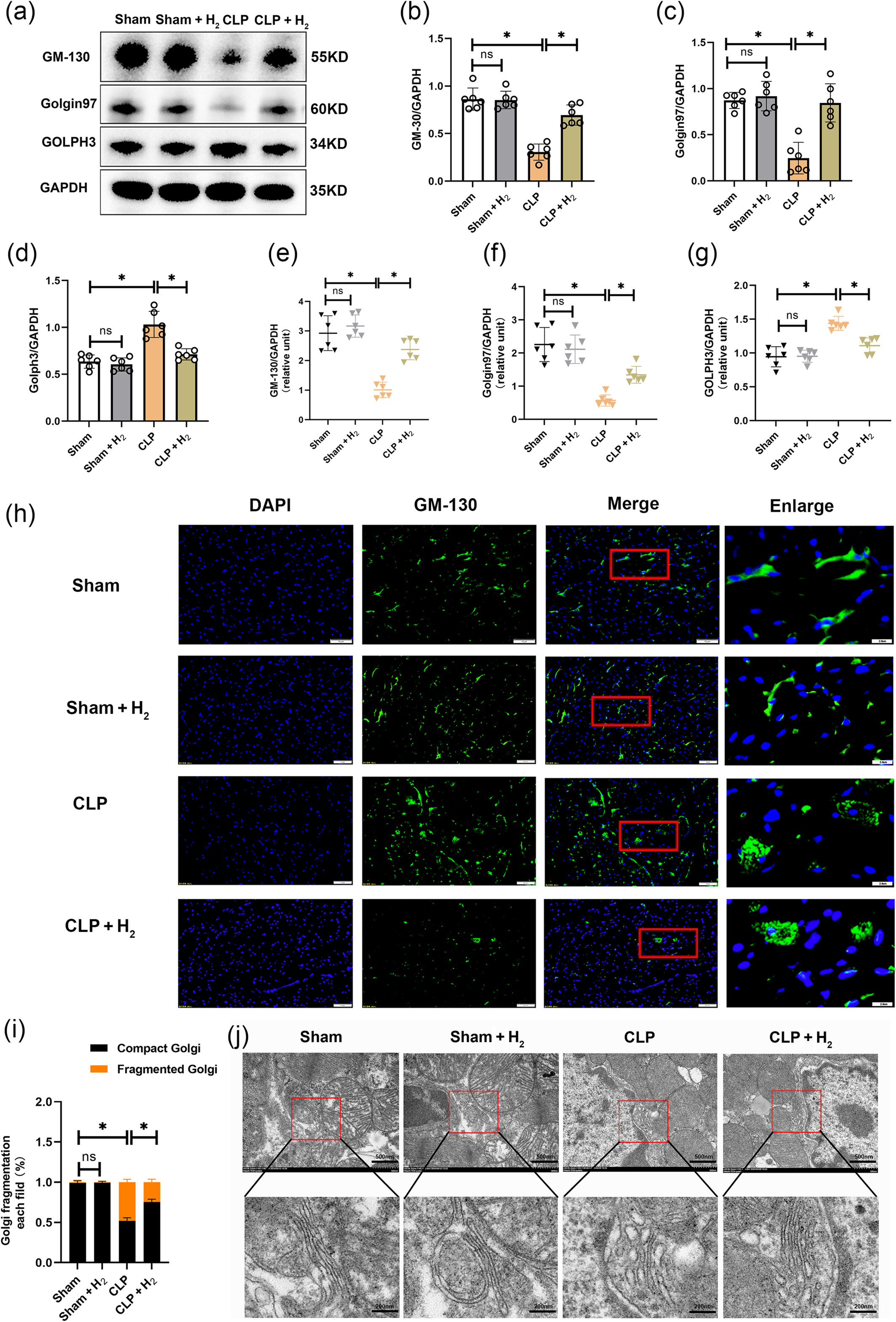
图2
氢气抑制高尔基体应激。(a)GM-130、Golgin97、GOLPH3和GAPDH蛋白的蛋白质印迹图像(n=6)。(b)GM-130蛋白的分析(n=6)。(c)Golgin97蛋白的分析(n=6)。(d)GOLPH3蛋白的分析(n=6)。(e)GM-130的mRNA表达(n=6)。(f)Golgin97的mRNA表达(n=6)。(g)GOLPH3的mRNA表达(n=6)。(h和i)高尔基体(GA)形态的免疫荧光染色及其碎裂率分析,比例尺=10μm(n=6)。(j)高尔基体形态的电镜图像,比例尺=500nm(n=6)。所有数据均以均数±标准差表示。两组比较,*P<0.05。CLP,盲肠结扎穿孔。
3.3 氢气吸入改善脓毒症诱导的心肌病(SIC)中的自噬
雷帕霉素靶蛋白(mTOR)是自噬的负调控因子,LC3B II/I用于在蛋白质水平评估自噬,P62(Sequestosome 1)是自噬的底物。因此,mTOR、LC3B II/I和P62与自噬密切相关。CLP组中磷酸化mTOR(p-mTOR)和P62水平下调,而LC3B II/I表达水平升高(图3a-d)。氢气治疗后,这些蛋白质的表达水平得到改善。还使用LC3作为免疫荧光标记来量化自噬水平。CLP组的绿色LC3荧光(图3e、f)高于假手术组,但氢气治疗后CLP组的绿色LC3荧光降低。使用透射电镜进一步观察自噬体(图3g、h)。与假手术组相比,CLP组的自噬体数量显著增加,氢气治疗后减少。
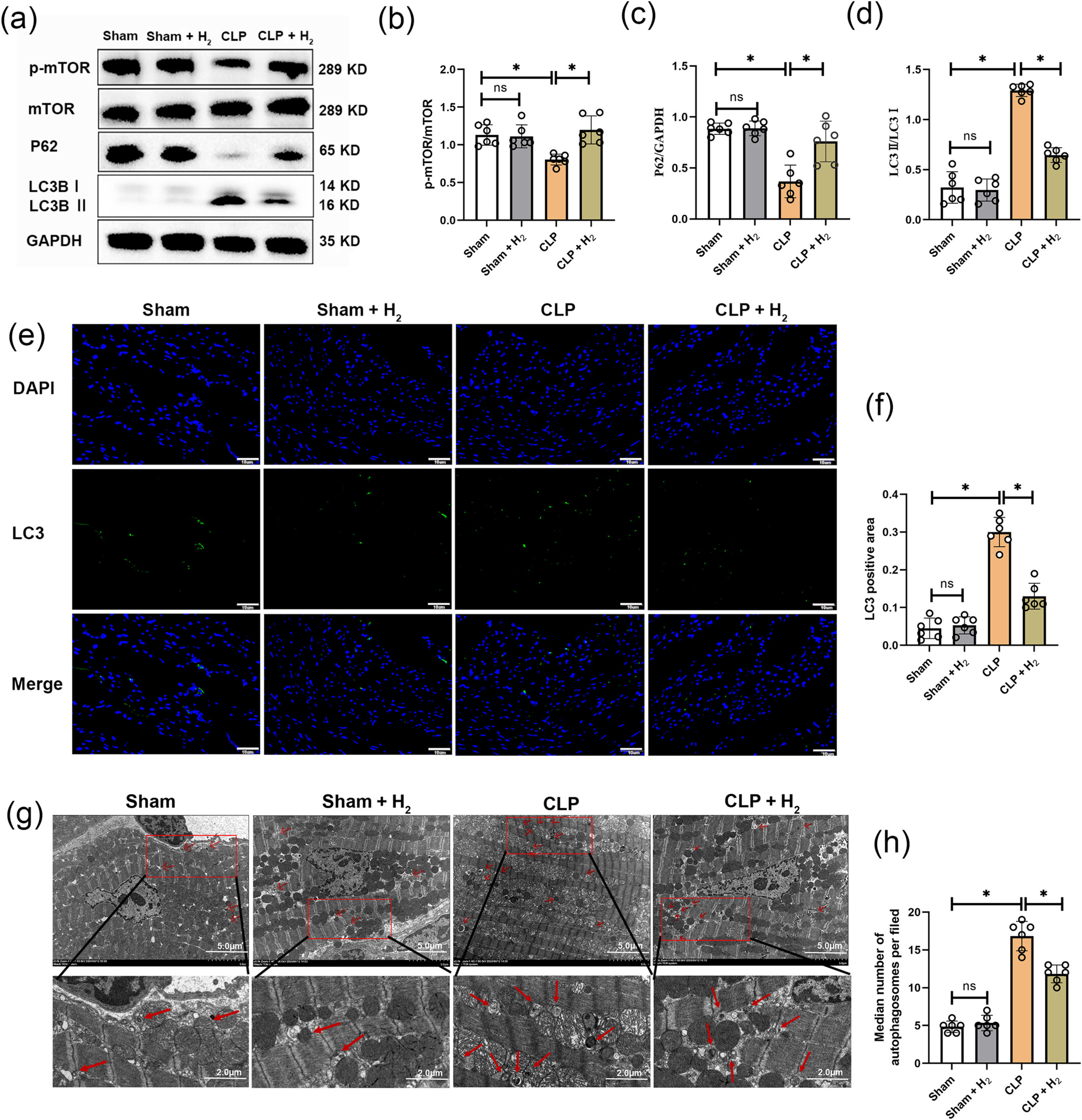
图3
氢气改善心肌自噬。(a)磷酸化mTOR(p-mTOR)、mTOR、P62、LC3B II/I和GAPDH蛋白表达的蛋白质印迹图像(n=6)。(b)p-mTOR/mTOR蛋白水平的分析(n=6)。(c)P62蛋白的分析(n=6)。(d)LC3B II/I蛋白的分析(n=6)。(e和f)LC3的免疫荧光染色及其阳性面积分析,比例尺=10μm(n=6)。(g)自噬体的电镜图像,红色箭头所示为自噬体,比例尺=5μm(n=6)。(h)每组自噬体数量的分析(n=6)。所有数据均以均数±标准差表示。两组比较,*P<0.05。CLP,盲肠结扎穿孔。
3.4 氢气吸入减少脓毒症诱导的心肌病(SIC)中的凋亡和炎症
与假手术组相比,CLP组中凋亡蛋白BAX的表达水平升高,而抗凋亡蛋白Bcl-2的表达降低(图4a-c)。氢气治疗后,这两个参数均得到改善。此外,对凋亡标志物caspase-3进行绿色荧光染色以进一步分析(图4d、e)。CLP组中指示caspase-3水平的绿色荧光强度显著高于假手术组,但氢气治疗后降低。同时,使用TUNEL染色评估心肌细胞凋亡(图4f、g),结果显示CLP组中有大量TUNEL阳性心肌细胞。然而,氢气治疗后这一数量减少。
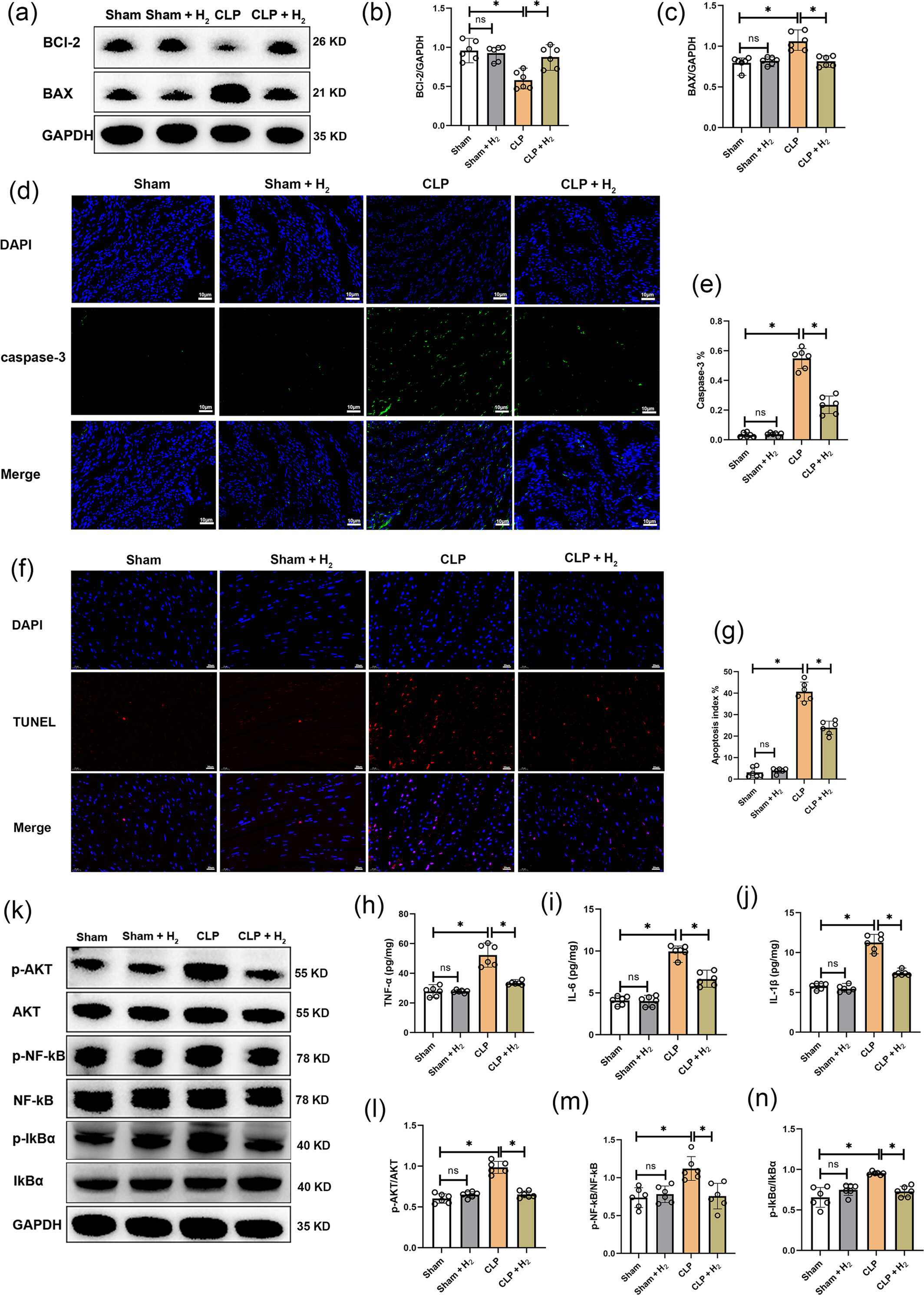
图4
氢气抑制心肌细胞凋亡和炎症反应。(a)Bcl-2、BAX和GAPDH蛋白的蛋白质印迹图像(n=6)。(b)Bcl-2蛋白的分析(n=6)。(c)BAX蛋白的分析(n=6)。(d和e)caspase-3的免疫荧光染色及其分析,比例尺=10μm(n=6)。(f和g)TUNEL染色及其分析,比例尺=20μm(n=6)。(h-j)心肌炎症因子TNF-α、IL-6和IL-1β的表达(n=6)。(k)p-AKT、AKT、p-NF-κB、NF-κB、p-IκBα、IκBα和GAPDH蛋白表达的蛋白质印迹图像(n=6)。(l)p-AKT/AKT蛋白比值分析(n=6)。(m)p-NF-κB/NF-κB蛋白水平分析(n=6)。(n)p-IκBα/IκBα蛋白比值分析(n=6)。所有数据均以均数±标准差表示。两组比较,*P<0.05。CLP,盲肠结扎穿孔。
我们还评估了小鼠心肌组织中炎症因子(包括TNF-α、IL-6和IL-1β)的水平(图4h-j)。CLP组的TNF-α、IL-6和IL-1β表达水平高于假手术组,而氢气治疗降低了TNF-α、IL-6和IL-1β的水平。我们还检测了与炎症和凋亡密切相关的AKT/NF-κB信号通路。图4k-n显示,CLP组的p-AKT、p-NF-κB和p-IκBα水平较高,而氢气治疗降低了这些指标的升高。
3.5 布雷菲德菌素A(BFA)加剧高尔基体应激,而氢气可缓解高尔基体应激
BFA是一种特异性的高尔基体应激激动剂。图5a-g显示,与CLP组相比,CLP+BFA组中GM-130和Golgin97的蛋白质和mRNA表达水平更低,而GOLPH3的水平显著更高。吸入氢气后,CLP+H₂+BFA组中这三种基因的蛋白质和mRNA表达水平均有所改善。使用免疫荧光进一步研究高尔基体形态(图5h、i)。与CLP组相比,CLP+BFA组的高尔基体碎裂成更密集的点状结构,且碎裂的高尔基体比例更大。然而,CLP+H₂+BFA组的高尔基体形态得到恢复,碎裂比例降低。此外,我们发现CLP+BFA组的高尔基体形成具有相同池数的小堆叠,这比CLP组的高尔基体形态更明显。相比之下,CLP+H₂+BFA组的小堆叠更少,高尔基体结构逐渐恢复(图5j)。

图5
氢气逆转布雷菲德菌素A(BFA)对高尔基体应激的兴奋作用。(a)GM-130、Golgin97、GOLPH3和GAPDH蛋白的蛋白质印迹图像(n=6)。(b)GM-130蛋白的分析(n=6)。(c)Golgin97蛋白的分析(n=6)。(d)GOLPH3蛋白的分析(n=6)。(e)GM-130的mRNA表达(n=6)。(f)Golgin97的mRNA表达(n=6)。(g)GOLPH3的mRNA表达(n=6)。(h和i)高尔基体(GA)形态的免疫荧光染色及其碎裂率分析,比例尺=10μm(n=6)。(j)高尔基体形态的电镜图像,比例尺=500nm(n=6)。所有数据均以均数±标准差表示。两组比较,*P<0.05。CLP,盲肠结扎穿孔。
3.6 高尔基体应激激活加剧脓毒症诱导的心肌病(SIC),并逆转氢气治疗对脓毒症诱导的心肌病的保护作用
我们应用高尔基体应激特异性激动剂BFA,以观察氢气的保护作用是否通过抑制高尔基体应激实现,以及该保护作用是否可被逆转。此外,还利用BFA来确定高尔基体应激是否会加剧脓毒症诱导的心肌病(图6a)。CLP+BFA组的7天存活率低于CLP组,且小鼠脓毒症评分(MSS)高于CLP组,这表明BFA加剧了小鼠的整体损伤。与CLP组和CLP+BFA组相比,氢气治疗后CLP+H₂组和CLP+H₂+BFA组的7天存活率和MSS评分均有所改善(图6b、c)。然而,与CLP+H₂组相比,CLP+H₂+BFA组的7天存活率降低,MSS评分升高,这表明氢气的保护作用被逆转。此外,心肌病理检查结果显示,BFA加重了心肌损伤,表现为纤维断裂增多、炎症细胞浸润增加、病理评分升高,同时CK-MB和cTnI水平也升高。CLP+H₂组和CLP+H₂+BFA组经氢气治疗后,这些不良影响得到缓解,但当应用BFA时,氢气治疗带来的改善被显著逆转(图6d-g)。心功能评估结果进一步表明,BFA加剧了脓毒症诱导的心肌病,CLP+BFA组的心功能指标更差,包括LVEF和LVFS降低,以及LVESV、LVEDV、LVESD和LVEDD升高。氢气治疗改善了CLP+H₂组和CLP+H₂+BFA组的LVEF、LVFS、LVESV和LVESD,而LVEDV和LVEDD未受影响。值得注意的是,在CLP+H₂+BFA组中,BFA逆转了氢气对所有指标(包括LVEDV和LVEDD)的保护作用(图6h-n)。
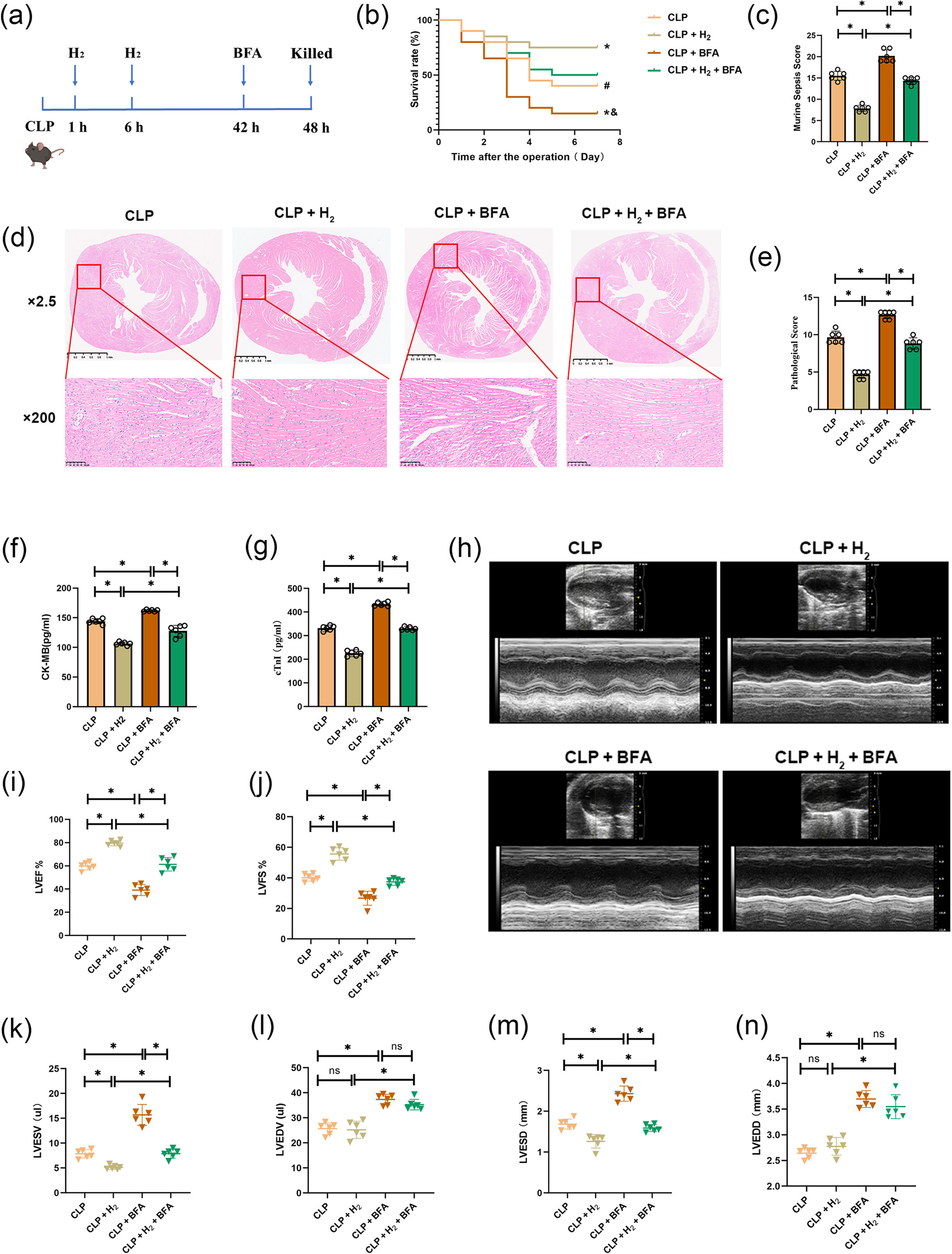
图6
氢气通过抑制高尔基体应激对脓毒症诱导的心肌病(SIC)具有保护作用。(a)BFA和氢气在小鼠中的应用流程。(b)小鼠的7天存活率(n=20)。与CLP组相比,*P<0.05;与CLP+BFA组相比,#P<0.05;与CLP+H₂+布雷菲德菌素A(BFA)组相比,&P<0.05。(c)MSS评分(n=6)。(d和e)心肌HE染色及病理评分;低倍镜下,比例尺代表1μm;高倍镜下,比例尺代表100μm(n=6)。(f和g)血清中心肌损伤酶CK-MB和cTnI的水平(n=6)。(h)小鼠的心脏超声图像(n=6)。(i)左心室射血分数(LVEF)(n=6)。(j)左心室缩短分数(LVFS)(n=6)。(k)左心室收缩末期容积(LVESV)(n=6)。(l)左心室舒张末期容积(LVEDV)(n=6)。(m)左心室收缩末期内径(LVESD)(n=6)。(n)左心室舒张末期内径(LVEDD)(n=6)。所有数据均以均数±标准差表示。两组比较,*P<0.05。CLP,盲肠结扎穿孔;MSS,小鼠脓毒症评分。
3.7 高尔基体应激激活增加自噬,并逆转氢气对自噬的抑制作用
与CLP组相比,CLP+BFA组中p-mTOR和P62水平降低,LC3B II/I比值升高,这表明BFA增加了自噬(图7a-d)。CLP+BFA组中LC3荧光增强和自噬体数量增多进一步支持了这一发现(图7e-h)。与CLP组和CLP+BFA组相比,氢气治疗在CLP+H₂组和CLP+H₂+BFA组中有效减少了自噬,并改善了上述指标。然而,与CLP+H₂组相比,CLP+H₂+BFA组中p-mTOR和P62水平下调,LC3B II/I比值升高,LC3荧光增强,自噬体数量增多,这表明BFA逆转了氢气对自噬的抑制作用。
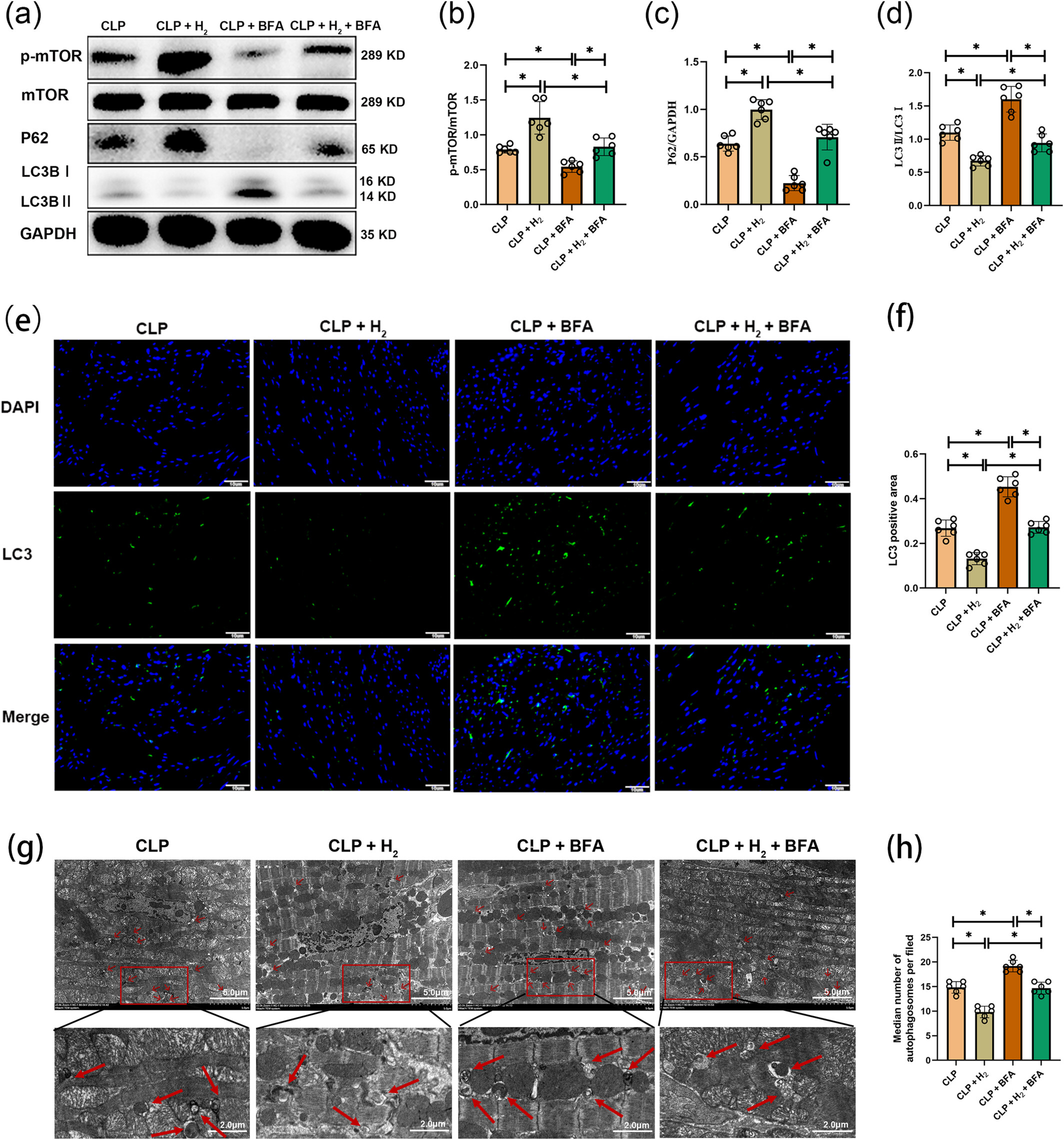
图7
氢气吸入通过改善高尔基体应激介导的自噬,对脓毒症诱导的心肌病(SIC)具有保护作用。(a)p-mTOR、mTOR、P62、LC3B II/I和GAPDH蛋白表达的蛋白质印迹图像(n=6)。(b)p-mTOR/mTOR蛋白水平的分析(n=6)。(c)P62蛋白的分析(n=6)。(d)LC3B II/I蛋白的分析(n=6)。(e和f)LC3的免疫荧光染色及其阳性面积分析,比例尺=10μm(n=6)。(g)自噬体的电镜图像,红色箭头所示为自噬体,比例尺=5μm(n=6)。(h)每组自噬体数量的分析(n=6)。所有数据均以均数±标准差表示。两组比较,*P<0.05。CLP,盲肠结扎穿孔。
3.8 高尔基体应激激活增加心肌炎症和凋亡,同时逆转氢气对这些过程的抑制作用
与CLP组相比,CLP+BFA组中凋亡蛋白BAX水平更高,caspase-3荧光更强,TUNEL阳性心肌细胞更多,而抗凋亡蛋白Bcl-2水平降低(图8a-g)。在CLP+H₂组和CLP+H₂+BFA组中,吸入氢气显著增加了Bcl-2的表达,并降低了凋亡标志物的水平。然而,与CLP+H₂组相比,CLP+H₂+BFA组中氢气的这些保护作用被逆转。
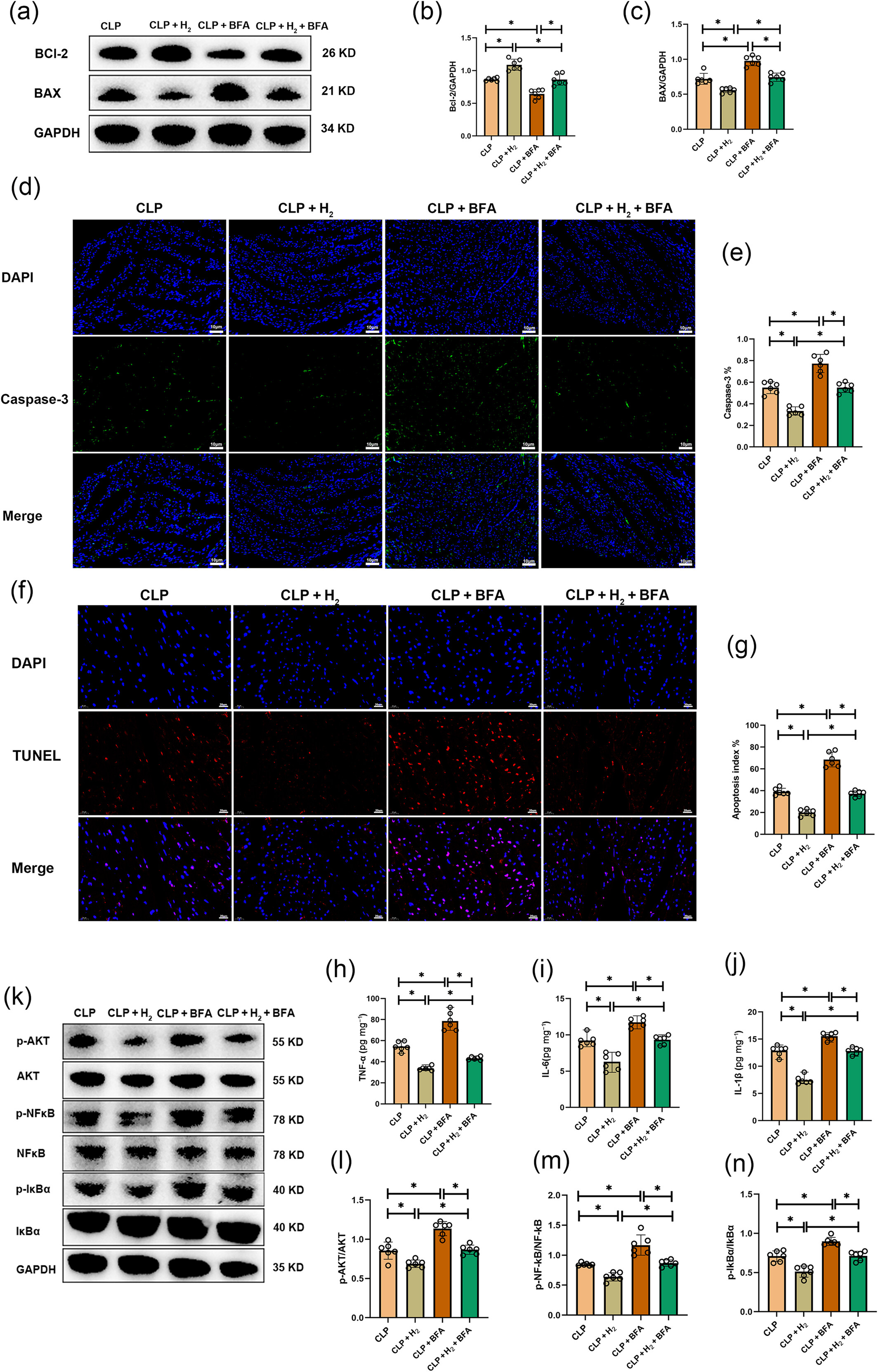
图8
氢气吸入通过抑制高尔基体应激介导的炎症和凋亡,对脓毒症诱导的心肌病(SIC)具有保护作用。(a)Bcl-2、BAX和GAPDH蛋白的蛋白质印迹图像(n=6)。(b)Bcl-2蛋白的分析(n=6)。(c)BAX蛋白的分析(n=6)。(d和e)caspase-3的免疫荧光染色及其分析,比例尺=10μm(n=6)。(f和g)TUNEL染色及其分析,比例尺=20μm(n=6)。(h-j)心肌炎症因子TNF-α、IL-6和IL-1β的表达(n=6)。(k)p-AKT、AKT、p-NF-κB、NF-κB、p-IκBα、IκBα和GAPDH蛋白表达的蛋白质印迹图像(n=6)。(l)p-AKT/AKT蛋白比值分析(n=6)。(m)p-NF-κB/NF-κB蛋白水平分析(n=6)。(n)p-IκBα/IκBα蛋白比值分析(n=6)。所有数据均以均数±标准差表示。两组比较,*P<0.05。CLP,盲肠结扎穿孔。
我们检测了心肌炎症因子(图8h-j):CLP+BFA组中TNF-α、IL-6和IL-1β的水平高于CLP组。氢气治疗降低了这些组中这些炎症标志物的水平。然而,与CLP+H₂组相比,CLP+H₂+BFA组中TNF-α、IL-6和IL-1β的水平再次升高,这表明BFA逆转了氢气的抗炎作用。此外,与CLP组相比,CLP+BFA组中p-AKT、p-NF-κB和p-IκBα的表达水平升高,而氢气治疗降低了这些表达水平。毫无疑问,与CLP+H₂组相比,CLP+H₂+BFA组中BFA再次逆转了氢气的保护作用,使这些标志物的表达升高(图8k-n)。
4 讨论
在本研究中,我们发现高尔基体应激激动剂BFA通过增加自噬、炎症和凋亡加剧了脓毒症诱导的心肌病,这表明高尔基体应激通过这些途径在脓毒症诱导的心肌病中起着关键作用。氢气治疗显著降低了7天死亡率和小鼠脓毒症评分,恢复了心功能,并减轻了高尔基体应激。然而,联合应用BFA消除了氢气的所有保护作用。这些发现表明,氢气通过抑制高尔基体应激介导的自噬、炎症和凋亡来减轻脓毒症诱导的心肌病。从机制上讲,高尔基体应激介导的炎症和凋亡与AKT/NF-κB通路相关,而自噬与mTOR调控相关。
心脏是脓毒症中最易受损的器官之一,其发病率高达60%(Martin等,2019)。在脓毒症诱导的心肌病中,心功能恶化,组织灌注不足,患者病情迅速恶化,死亡率高达70%(Qi、Song等,2023)。因此,在临床上早期识别脓毒症患者的心脏功能障碍具有重要意义。以LVEF和LVFS降低为特征的左心室功能障碍也是脓毒症诱导的心肌病患者死亡率增加的预测因素(Li等,2023)。盲肠结扎穿孔模型已被广泛用于研究脓毒症引起的器官损伤(Cui等,2024;Meng等,2024)。在我们的研究中,接受盲肠结扎穿孔手术的小鼠心功能受损,表现为LVEF和LVFS降低,血清CK-MB和cTnI水平升高,心肌组织病理评分增加,这证实了盲肠结扎穿孔模型成功诱导了脓毒症诱导的心肌病。然而,脓毒症诱导的心肌病的潜在机制仍不清楚,尽管其确切的分子机制正在研究中。
高尔基体是负责蛋白质修饰、分选和运输的重要细胞器(Casey等,2018;Hicks和Machamer,2005)。高尔基体的结构和功能损伤(通常称为高尔基体应激)已被广泛认为与脓毒症诱导的器官损伤(包括肺(Li等,2021)、肝(Dusabimana等,2023)、肾(Dusabimana等,2023)和心脏(Meng等,2024))的发病机制有关。在这些疾病中,GM-130、Golgin97和GOLPH3常被用作高尔基体应激的标志物。GM-130是一种顺式高尔基体蛋白,是高尔基体形态的特征性标志物,参与有丝分裂期间高尔基体的解体和重组(Nakamura,2010)。Li等报道,在脓毒症诱导的肺损伤中,GM-130的表达水平降低,高尔基体碎裂,GM-130荧光染色证实了这一点(Qi等,2021)。同样,位于反式高尔基体侧的Golgin97是另一种影响高尔基体形态的蛋白,其表达也降低。GOLPH3是一种与高尔基体应激相关的蛋白,参与囊泡运输,位于高尔基体池的反式侧(Kuna和Field,2019)。沉默GOLPH3减轻了脓毒症条件下高尔基体应激介导的肾和肝损伤(Dusabimana等,2023)。我们的研究结果与这些研究一致,均报道在脓毒症诱导的心肌病中,GM-130和Golgin97的表达降低,而GOLPH3的表达增加。
当使用BFA时,高尔基体蛋白表达的变化比CLP组更明显。此外,GM-130荧光染色和高尔基体电镜观察显示,高尔基体碎裂伴随着心肌损伤的加剧。这些发现表明,高尔基体应激是脓毒症诱导的心肌病的关键机制。然而,高尔基体应激导致脓毒症诱导的心肌病的确切途径仍不清楚,需要进一步探索其下游机制。
高尔基体形态的改变与自噬的诱导密切相关(Gosavi等,2018)。然而,自噬在心脏中的作用仍不明确。适当的自噬对机体有益,而过度自噬会导致心肌损伤,其影响取决于自噬的强度和持续时间(Shiroorkar等,2020)。此外,抑制自噬对脓毒症诱导的心肌病具有保护作用(Li等,2019;Yang等,2018)。自噬的诱导和调控是高度复杂的过程,通常涉及哺乳动物雷帕霉素靶蛋白(mTOR)(Shang等,2019)。mTOR是自噬的负调控因子,与高尔基体蛋白Golgin245相互作用(Gosavi等,2018)。当高尔基体完整性受损时,Golgin245与mTOR的相互作用减弱,破坏mTOR信号通路并降低p-mTOR水平,从而触发自噬,这也是阿尔茨海默病发病机制中的一个相关机制(Gosavi等,2018)。此外,GOLPH3蛋白调控自噬。抑制GOLPH3的表达减少自噬,从而对神经细胞的缺氧复氧损伤具有保护作用(Shiroorkar等,2020)。在我们的研究中,我们发现在脓毒症诱导的心肌病中,p-mTOR的表达水平显著降低,自噬相关蛋白的表达、LC3荧光以及自噬体的数量均增加。应用BFA后,这些自噬标志物的表达进一步增加。这些发现表明,高尔基体应激在脓毒症诱导的心肌病中介导自噬。
炎症因子和心肌细胞凋亡在心肌损伤中起着至关重要的作用(Shang等,2019)。炎症和凋亡涉及许多通路,其中之一是NF-κB通路。脓毒症时NF-κB通路被激活,迅速进入细胞核并触发多种细胞因子(如TNF-α、IL-6和IL-1β)水平的增加,导致凋亡和组织损伤(Hochstadt等,2011)。此外,IκBα在细胞质中与NF-κB结合,有效隔离NF-κB,阻止其进入细胞核。AKT是激活NF-κB的上游酶。抑制AKT/NF-κB
https://wap.sciencenet.cn/blog-41174-1495659.html
上一篇:氢(氢化镁)增强声动力疗法
下一篇:探寻意识的多种可能形式