博文
STTT: 重庆医科大学揭示代谢酶PHGDH非经典RBP功能促进肝癌进展的新机制
|
原发性肝癌位居我国常见恶性肿瘤第四位及肿瘤致死病因第二位,严重威胁人民的生命健康。其中,肝细胞癌(hepatocellular carcinoma,HCC)病例占比高达90%。近年来,与代谢综合征、糖尿病等相关的非酒精性脂肪肝炎已经成为增速最快的HCC病因。由于HCC发病隐匿,多数患者确诊时已至中晚期,现有晚期治疗常因耐药或免疫耐受导致患者预后差、生存率低。因此,深入探索肝癌新的治疗靶点,开发临床治疗新策略具有重要临床意义。
代谢异常是恶性肿瘤的重要特征。肿瘤细胞会重塑代谢网络以满足快速增殖的需求。传统观点认为,代谢重编程主要通过调节代谢酶的表达水平或活性(经典功能),改变代谢产物水平来影响肿瘤进展。然而,越来越多的研究发现,肿瘤细胞还能调节代谢酶的“非经典”(或“兼职”)功能参与肿瘤进展,例如介导蛋白质翻译后修饰或与信号转导蛋白发生互作等,将代谢影响扩展到更广泛的细胞功能层面,从多维度调控肿瘤的发生发展过程。近年来研究还发现代谢酶还可直接作为RNA结合蛋白(RNA binding proteins, RBPs)发挥非经典的RNA结合功能。RBP通过RNA结合结构域(RNA-binding domain,RBD)参与RNA代谢的全方位调控,包括转录、稳定性、翻译、剪接及定位等。在肝癌发生发展过程中,RBP在转录和转录后水平影响了从脂肪变性、纤维化、肝硬化和早期肝癌各个不同阶段。然而,目前代谢酶在肝癌中兼具RBP功能的研究十分有限。深入解析代谢酶的RBP功能以及对肝癌的调节机制有助于拓宽对肿瘤代谢的认识,并为抗肿瘤治疗提供新的靶点和思路。
2025年7月18日,重庆医科大学科研团队在Signal Transduction and Targeted Therapy杂志在线发表题为“Phosphoglycerate dehydrogenase stabilizes protein kinase C delta type mRNA to promote hepatocellular carcinoma progression”的研究论文。程彬博士后、彭湃副研究员、陈诗博士为论文共同第一作者,黄爱龙教授、唐霓教授、汪凯研究员为共同通讯作者。该研究首次揭示丝氨酸合成代谢关键酶——磷酸甘油酸脱氢酶(PHGDH)作为RNA结合蛋白的全新功能,并创新性开发靶向PHGDH RNA结合活性的"诱饵寡核苷酸"联合疗法,为肝癌靶向治疗提供了新策略。
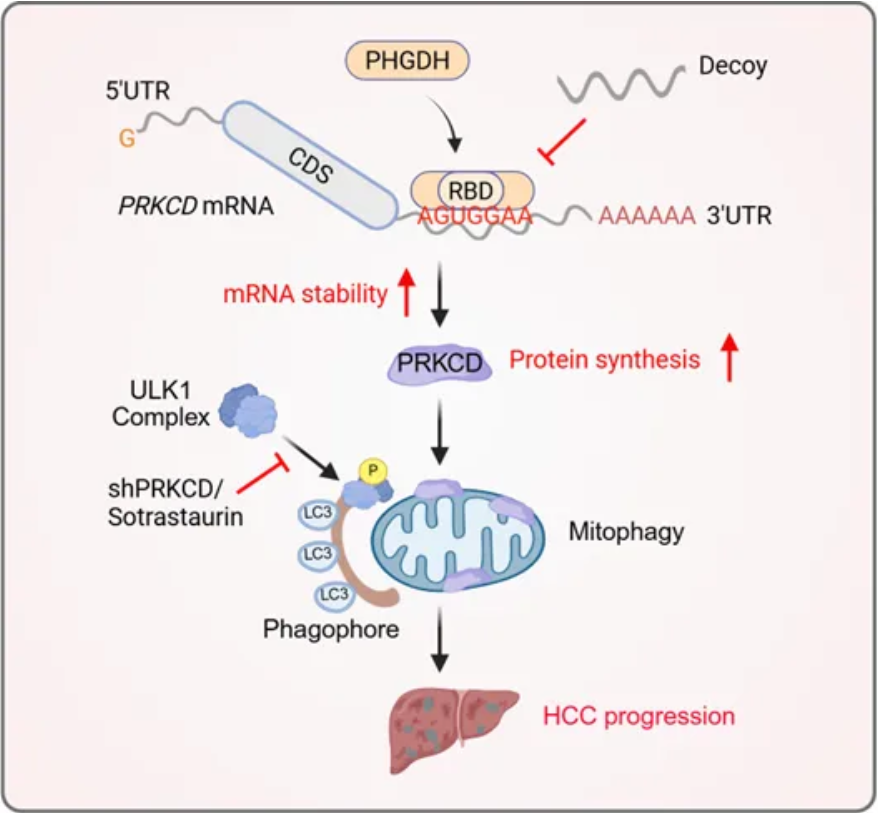
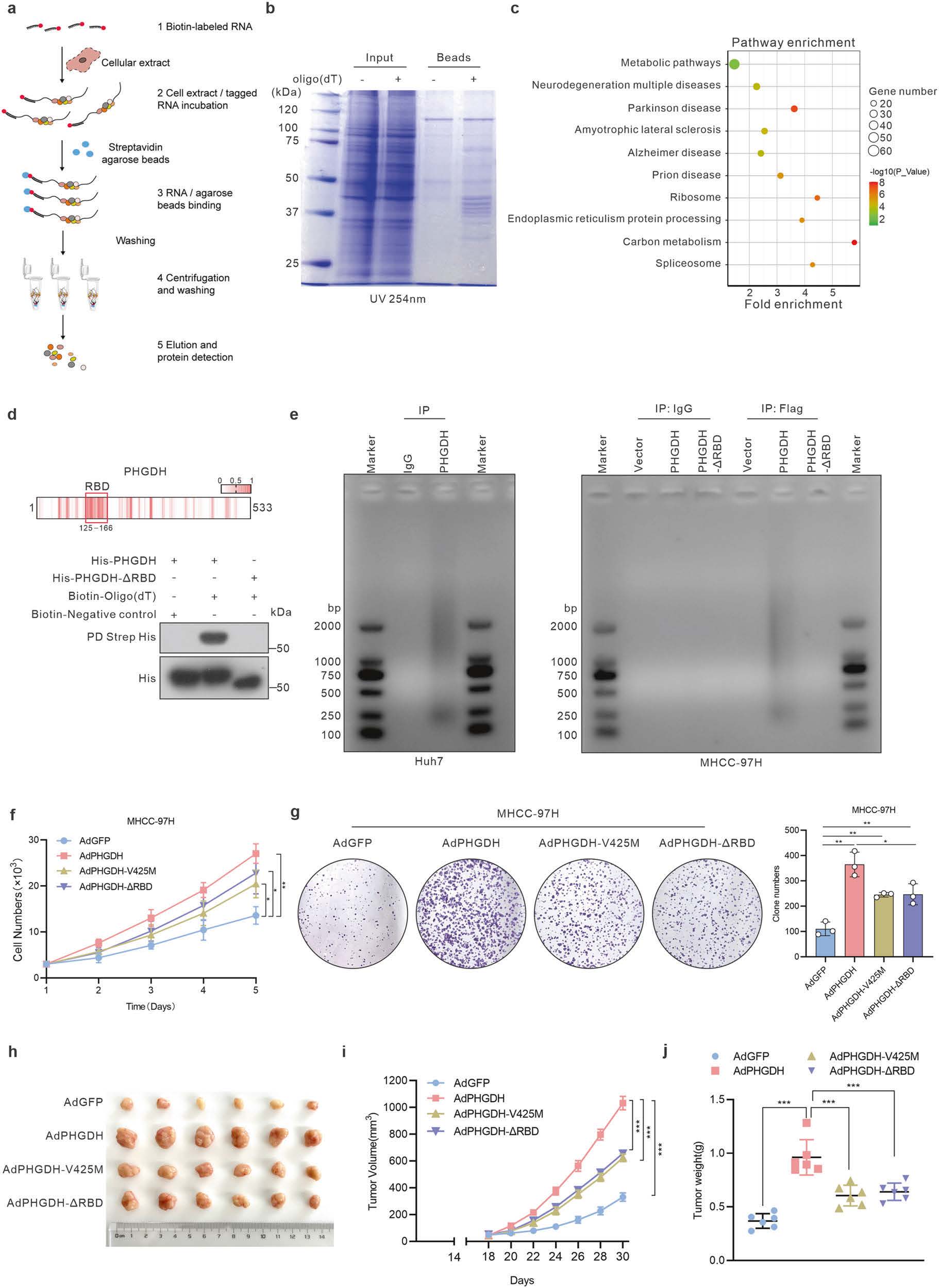
为鉴定更多的mRNA结合蛋白,研究团队采用RNA-蛋白质互作组捕获技术,首次在肝癌细胞中进行了系统性筛选。经质谱分析与KEGG通路富集分析发现,肝癌中与mRNA结合的蛋白显著富集于代谢相关通路,包括已知具有RBP功能的代谢酶(如IDH1、MDH2)。尤为重要的是,研究团队首次发现丝氨酸合成代谢关键酶PHGDH也具有RNA结合能力。尽管PHGDH在多种肿瘤恶性进展中发挥重要作用,但其RNA结合功能此前未见报道。该团队通过生物信息学预测结合实验验证,首次鉴定PHGDH的125-166氨基酸区域为其功能性RNA结合结构域(RNA-binding domains, RBDs),这是该酶中全新发现的RNA结合结构域,缺失该区域显著抑制了PHGDH对肝癌细胞的促增殖作用。随后,研究团队通过RIP-seq高通量筛选发现,PHGDH下游靶基因显著富集于自噬及线粒体自噬通路。联合RIP-qPCR、RNA pull-down和RNA荧光原位杂交等技术证实:PHGDH通过其RBD特异性识别PRKCD mRNA的3'-UTR特定基序"AGUGGAA",显著增强后者mRNA稳定性,最终上调PRKCD蛋白表达。PRKCD是线粒体自噬的正向调节因子,PHGDH通过PRKCD招募ULK1复合体触发线粒体自噬,清除受损线粒体并抑制凋亡,驱动肝癌进展。该研究首次阐明代谢酶PHGDH通过RNA结合功能直接调控线粒体自噬的分子机制。
磷酸甘油酸脱氢酶通过结合mRNA促进肝癌细胞增殖
RBP通过与多个基因相互作用形成复杂网络,有选择地靶向RBP调控的促癌基因对于靶向治疗的效果至关重要。RNA诱饵寡核苷酸(Decoy oligonucleotides)是一种有效的靶向治疗策略。它能够直接靶向RBP的RNA结合位点,高效阻断其促癌活性,同时不影响蛋白质的其他生物功能。团队基于上述机制开发了特异性靶向PHGDH RBP功能的诱饵寡核苷酸。该诱饵寡核苷酸有效的阻断了PHGDH与PRKCD mRNA的结合,从而减弱PHGDH对PRKCD mRNA的稳定作用及蛋白表达的上调,最终通过调节线粒体自噬抑制肝癌进展。此外,在多种肝癌动物模型中,诱饵寡核苷酸单独给药即能有效抑制肝癌肿瘤进展,联合sorafenib或PRKCD抑制剂sotrastaurin更展现出协同增效的抗肿瘤作用,为肝癌的靶向治疗提供了新策略。
该研究首次将代谢重编程、RNA调控与线粒体自噬有机整合,解析了代谢酶PHGDH通过全新RBP功能调控RNA代谢的分子机制,极大拓展了对代谢酶非经典功能的认识,揭示肝癌发生发展的关键通路。基于该机制设计的靶向PHGDH-RNA结合的诱饵寡核苷酸,联合现有临床药物(sorafenib/sotrastaurin)可协同抑制肝癌肿瘤进展,为肝癌靶向治疗提供了靶向RNA-蛋白质互作的新思路。
原文摘要:
Metabolic reprogramming not only reshapes cellular bioenergetics but also profoundly influences RNA metabolism through metabolite signaling and the RNA-binding activities of metabolic enzymes. Emerging evidence highlights that certain metabolic enzymes act as RNA-binding proteins (RBPs) to regulate gene expression and promote tumor progression. However, the non-catalytic post-transcriptional regulatory functions of metabolic enzymes in hepatocellular carcinoma (HCC) remain largely unexplored. In this study, we performed RNA-protein interactome profiling to identify potential non-canonical RBPs in HCC cells and established phosphoglycerate dehydrogenase (PHGDH) as a functional RBP. We further uncovered a previously unrecognized RNA-binding domain in PHGDH that directly binds cellular mRNAs and plays a key role in HCC cell proliferation. Mechanistically, PHGDH bound directly to the 3’untranslated region (3’UTR) of protein kinase C delta type (PRKCD) mRNA via its RNA-binding domain, thereby stabilizing the transcript and elevating PRKCD protein levels. PHGDH-dependent PRKCD upregulation promoted HCC progression by inducing mitophagy and inhibiting apoptosis. Additionally, decoy oligonucleotides that specifically block the RNA-binding activity of PHGDH markedly impaired its regulation of target genes and suppress HCC cell proliferation. Combination therapy using decoy oligonucleotides or the PRKCD inhibitor sotrastaurin with sorafenib synergistically inhibited HCC progression. Collectively, our findings reveal a non-canonical role of PHGDH in regulating mRNA metabolism and modulating mitophagy. Targeting the RNA-binding activity of PHGDH with decoy oligonucleotides represents a promising therapeutic strategy for HCC.
原文链接:https://www.nature.com/articles/s41392-025-02304-w
https://wap.sciencenet.cn/blog-446272-1495261.html
上一篇:[转载]NCB: 裴华东/韩苏夏团队合作发现O-GlcNAc糖基化修饰调控铁死亡与肿瘤耐药的新机制
下一篇:[转载]Dev Cell: 王佳谊/唐道林/于永春/周谦君团队揭示O-GlcNAc修饰型TR11B驱动肺癌恶性增殖的机制