博文
[转载]NCB: 裴华东/韩苏夏团队合作发现O-GlcNAc糖基化修饰调控铁死亡与肿瘤耐药的新机制
||
铁死亡(ferroptosis)是一种依赖铁离子积累和脂质过氧化的新型细胞死亡方式,与肿瘤发生和放化疗应答密切相关。尽管活性氧(ROS)被广泛认为在脂质过氧化及铁死亡中发挥关键作用,但耐药癌细胞如何感知ROS,并逆转药物诱导的细胞死亡(包括但不限于铁死亡)的机制仍不清楚。
2025年7月18日,美国Georgetown University裴华东教授团队与西安交通大学第一附属医院韩苏夏教授团队合作,在Nature Cell Biology发表题为 “A ROS-mediated Oxidation-O-GlcNAcylation cascade governs ferroptosis” 的研究论文,首次系统揭示了在肝细胞癌中,O-GlcNAc转移酶(OGT)可作为ROS感应器的机制。研究发现,OGT在受到氧化修饰后被激活,进而O-GlcNAc修饰转录因子FOXK2,促进其核转位,并上调抗铁死亡关键基因SLC7A11的表达,从而抑制铁死亡,增强肝癌细胞对放化疗的耐受性。

O-GlcNAc糖基化是一种重要的蛋白质翻译后修饰(PTM),由O-GlcNAc转移酶(OGT)将UDP-GlcNAc添加至靶蛋白的丝氨酸(Ser)或苏氨酸(Thr)残基上【1】。前不久,Ma Junfeng团队和裴华东团队也合作发现O-GlcNAc修饰也可发生在蛋白质的酪氨酸残基(Tyr)上【2】。O-GlcNAc糖基化修饰可动态调控基因转录、蛋白功能及稳定性,同时对营养状态和氧化应激具有感应作用,并广泛参与细胞中的关键信号通路和代谢调控【3】。已有研究表明,O-GlcNAc修饰与铁死亡密切相关【4】,但背后的分子机理还不完全清楚。裴华东及其合作者研究发现,在铁死亡诱导或氧化应激条件下,肝癌细胞中O-GlcNAc修饰水平显著升高,然而OGT和OGA蛋白表达水平未发生明显变化,铁死亡也未影响O-GlcNAc供体分子UDP-GlcNAc的含量,提示O-GlcNAc修饰水平上升可能源于OGT酶活性的增强。进一步通过LC-MS/MS分析发现,活性氧(ROS)升高可氧化OGT催化结构域中保守的Cys845位点,形成亚磺酸化修饰。Cys845的亚磺酸化修饰显著增强OGT的酶活性,从而促进底物蛋白的O-GlcNAc修饰。
进一步研究表明,OGT通过促进SLC7A11的转录,增强细胞对胱氨酸的摄取,从而抵抗铁死亡。敲低OGT可显著下调SLC7A11的表达,而过表达OGT或抑制其去糖基化酶OGA则可增强SLC7A11的表达水平。功能研究显示,OGT敲低可降低细胞对半胱氨酸的摄取,导致谷胱甘肽(GSH)含量下降,同时促进脂质过氧化物的积累,从而增强细胞对Erastin的敏感性。机制研究进一步发现,OGT通过O-GlcNAc修饰转录因子FOXK2,增强其对SLC7A11的转录。LC-MS/MS分析显示,FOXK2在Ser424位点发生O-GlcNAc修饰,这一修饰促进其与核转运蛋白importin α7/8的相互作用,从而增强FOXK2的核定位能力。进入细胞核后的FOXK2可特异性结合于SLC7A11启动子区域,显著上调该胱氨酸转运体的表达,进而促进胱氨酸摄取、维持GSH合成、清除脂质ROS,从而有效抑制铁死亡。
缺失FOXK2的O-GlcNAc修饰显著削弱其在体内外促进肝细胞癌(HCC)生长的能力。无论是敲除FOXK2还是表达不可被修饰的突变体(S424A),均可显著抑制小鼠移植瘤的生长;而铁死亡抑制剂UAMC-3203可部分逆转这一抑瘤效应。 在临床样本中,肝细胞癌组织中OGT、FOXK2和SLC7A11的表达均明显上调,且FOXK2与SLC7A11蛋白水平、OGT与SLC7A11蛋白水平呈显著正相关。此外,研究还发现,缺失FOXK2 O-GlcNAc修饰可增强细胞对5-FU和放疗的敏感性。在多种放化疗耐受的HCC细胞模型中,ROS水平、OGT活性、FOXK2 O-GlcNAc修饰和SLC7A11表达水平均显著上调,提示OGT–FOXK2–SLC7A11信号轴在肿瘤细胞获得放化疗耐受性中起关键作用。
综上所述,本研究揭示在耐药肝癌细胞中,OGT被显著激活,并作为ROS的感应器,驱动O-GlcNAc信号增强。激活的ROS–OGT–FOXK2–SLC7A11信号轴通过抑制铁死亡,促进癌细胞放化疗耐药。靶向该通路有望重新激活铁死亡,为克服肿瘤耐药提供全新策略(图一)。
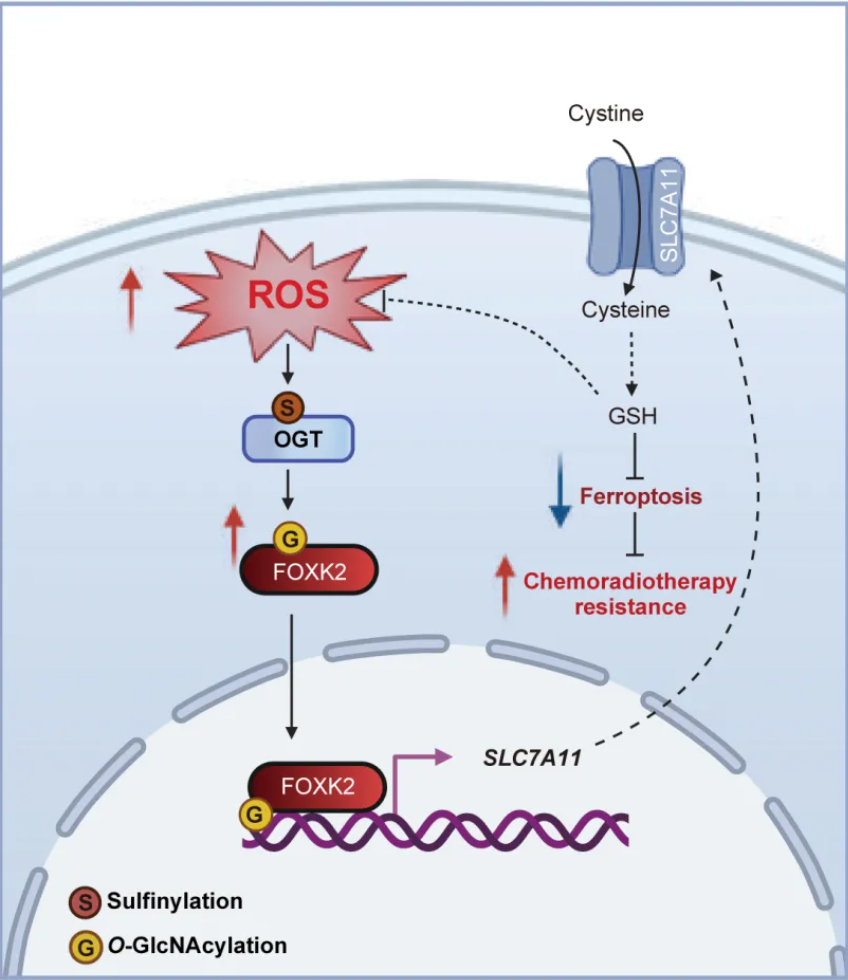
图一:ROS通过O-GlcNAc调控铁死亡和肿瘤放化疗应答的工作模式图。
西安交通大学第一附属医院与乔治城大学联合培养博士研究生张赫萌、博士研究生马佳琳为本文共同第一作者。乔治城大学医学中心裴华东教授、西安交通大学第一附属医院韩苏夏教授、武汉大学人民医院李娟娟教授与张恒教授,以及乔治城大学医学中心马俊峰教授为共同通讯作者。此外,乔治城大学的Gary Kupfer教授、Peng Yihan博士等合作者也对本研究作出了重要贡献。
摘要:Reactive oxygen species (ROS) play a crucial role in lipid peroxidation and the initiation of ferroptosis, markedly affecting chemotherapeutic drug resistance. However, the mechanisms by which ROS function and are sensed remain poorly understood. In this study, we identified O-GlcNAc transferase (OGT), a key enzyme in protein O-GlcNAcylation, as a sensor for ROS during ferroptosis. The ROS-induced oxidation of OGT at C845 in its catalytic domain activates the enzyme. Once activated, OGT O-GlcNAcylates FOXK2, enhancing its interaction with importin α, which facilitates FOXK2’s nuclear translocation and binding to the SLC7A11 promoter region. This, in turn, boosts SLC7A11 transcription, thereby inhibiting ferroptosis. The elevated OGT–FOXK2–SLC7A11 axis contributes to tumorigenesis and resistance to chemoradiotherapy in hepatocellular carcinoma (HCC). Our findings elucidate a ROS-induced oxidation-O-GlcNAcylation cascade that integrates ROS signalling, O-GlcNAcylation, FOXK2-mediated SLC7A11 transcription and resistance to both ferroptosis and chemoradiotherapy.
原文链接:https://www.nature.com/articles/s41556-025-01722-w
参考文献:
(1)Yang, X. & Qian, K. Protein O-GlcNAcylation: emerging mechanisms and functions. Nat Rev Mol Cell Biol 18, 452–465 (2017).
(2)Hou, C. et al. Ultradeep O-GlcNAc proteomics reveals widespread O-GlcNAcylation on tyrosine residues of proteins. Proceedings of the National Academy of Sciences 121, e2409501121 (2024).
(3)Wells, L. & Hart, G. W. O-GlcNAcylation: A major nutrient/stress sensor that regulates cellular physiology. Journal of Biological Chemistry 300, 107635 (2024).
(4)Yu, F. et al. Dynamic O-GlcNAcylation coordinates ferritinophagy and mitophagy to activate ferroptosis. Cell Discov 8, 1–17 (2022).
https://wap.sciencenet.cn/blog-446272-1494333.html
上一篇:[转载]【文献学习】延胡索酸(富马酸)整合疾病中的代谢和免疫
下一篇:STTT: 重庆医科大学揭示代谢酶PHGDH非经典RBP功能促进肝癌进展的新机制