博文
氢气对新生猪缺血缺氧后心脏功能的改善作用
||
本文作者来自日本香川大学,目前正在SR投稿过程。
氢气在转化型窒息仔猪模型中对心输出量的影响
约80%患有缺氧缺血性脑病(HIE)的新生儿存在心血管功能障碍,由于脑血流和代谢紊乱,容易发生迟发性损伤。我们之前报道过氢气(H₂)的神经保护作用。本研究探讨了吸入氢气对仔猪缺氧缺血(HI)后心功能的影响。17头日龄≤24小时的仔猪经历约40分钟的缺氧缺血损伤,复苏10分钟后,分为缺氧缺血组(HI组,n=10)和缺氧缺血+氢气吸入组(HI-H₂组,吸入2.2-2.7%氢气6小时,n=7)。我们通过经胸超声心动图检查了缺氧缺血损伤后6小时内双心室每搏输出量(SV)和心输出量(CO)。缺氧缺血组(n=10)的每搏输出量和心输出量先短暂升高,随后下降。相比之下,缺氧缺血+氢气组(n=7)的右心室每搏输出量和心输出量显著增加,左心室参数轻度下降。值得注意的是,损伤后5小时,缺氧缺血+氢气组的右心室每搏输出量和心输出量显著更高。在仔猪缺氧缺血损伤后6小时内,于早期复苏阶段开始吸入2.1-2.7%的氢气,可增加右心室每搏输出量和心输出量。
引言
出生前后发生的缺氧缺血(HI)损伤可能导致脑病,其特征为出生时需要复苏、神经抑制、惊厥和脑电图异常1˒2。胎盘血流或氧气供应的任何中断都可能导致多器官功能障碍3。由于缺氧缺血对心肌的损伤,这类婴儿患者的心血管功能障碍日益受到关注⁴˒⁵。例如,窒息新生儿心输出量低,心肌收缩力下降,出现全身性低血压和肺动脉高压。
最近有报道称,右心衰竭是影响缺氧缺血性脑病(HIE)神经预后的因素之一⁶˒⁷。这些新生儿心输出量低,心肌收缩力下降,伴有全身性低血压和肺动脉高压⁸。因此,婴儿缺氧缺血性脑病的心血管管理近来不得不考虑右心衰竭,但从复苏阶段就可实施的心血管管理方法很少。
氢气是一种极小的分子,极易转移到组织中。据报道,其发挥作用的浓度约为3%,在此浓度下不会引发燃烧,且能产生效果⁹。Ohsawa等人首次报道,氢气可选择性清除自由基,并通过其抗氧化特性发挥神经保护和心肌细胞保护作用1⁰。我们也通过新生仔猪模型报道,与单纯亚低温治疗相比,亚低温联合氢气治疗可改善缺氧缺血损伤后24小时内的脑血流动力学和氧合变化,并加速至第5天的神经运动功能恢复11。然而,氢气对缺氧缺血损伤后除脑以外的其他器官(尤其是心脏)的影响尚不明确。此外,有研究表明,氢气可能通过降低肺血管阻力(且不抑制血管内皮的一氧化氮生成)来治疗持续性肺动脉高压。但目前尚无研究揭示氢气对缺氧缺血后心脏功能的直接保护和改善作用。本研究采用新生仔猪模型,探讨了吸入6小时氢气对缺氧缺血损伤后双心室心输出量的影响。
结果
损伤后双半球脑电图(LAEEG)的平均持续时间(±标准差)在两组间无显著差异(HI组:21.6±12.5分钟;HI-H₂组:16.9±6.3分钟)。心率(HR)和平均动脉血压(MABP)在缺氧缺血损伤后1小时恢复至基线水平,且两组间无显著差异(图1A-D和图2)。血气数据方面,损伤后两组的数值无显著差异。血红蛋白水平方面,HI-H₂组在损伤后3小时和6小时显著高于基线水平,且高于HI组(表1,p<0.05)。
**表1 HI组和HI-H₂组在损伤前、损伤结束时及损伤后1小时、3小时、6小时的血气、乳酸、葡萄糖和血红蛋白数据**
*p<0.05,**p<0.01,***p<0.001,****p<0.0001(与HI组相比);#p<0.05,##p<0.01,###p<0.001,####p<0.0001(与基线相比),采用双因素方差分析及Tukey事后检验。
HI组中,两种心输出量在即将复苏时均达到最低水平,随后有所上升。左心输出量从1小时开始逐渐下降,在损伤后4小时显著低于基线值。同时,右心输出量从0.5小时开始下降,在损伤后2小时达到最小值,随后上升,但在5小时再次下降,6小时又有所回升(图1E、G)。然而,HI-H₂组中,左心输出量在复苏后处于中等水平,与基线相比无显著下降(图1F)。右心输出量在复苏后逐渐增加,在损伤后2小时超过基线,于5小时达到峰值(图1H)。
尽管损伤后6小时左心室每搏输出量和心输出量在两组间无差异(图3A、C),但HI-H₂组的右心室每搏输出量、右心室流出道速度时间积分(图3B、图4)和右心输出量均高于HI组,其中心输出量在5小时时差异显著(图3D)。
讨论
本研究中,HI组仔猪在损伤后左心输出量明显下降,右心输出量持续低于基线。相比之下,HI-H₂组中,尽管左心输出量如HI组一样有所下降,但下降程度较轻,且右心输出量逐渐增加,尤其在损伤后5小时显著高于HI组。这是首次报道氢气可增强右心功能,且值得注意的是,吸入氢气后1小时即可观察到效果,并在6小时吸入期间持续存在。氢气吸入增加右心输出量可能存在以下几个原因。
首先,我们认为肺血管阻力可能是影响右心输出量的因素之一。缺氧缺血后,肺血管阻力通常会增加12˒13,新生儿窒息常并发持续性肺动脉高压1⁴。缺氧会导致内皮素与一氧化氮(NO)的比例失衡(内皮素占优),通过内皮功能障碍和一氧化氮生成减少引起血管收缩。此外,若缺氧持续存在,一氧化氮合酶的上调会受到抑制,导致肺血管舒张所需的一氧化氮不足⁴。这也解释了为何吸入一氧化氮治疗效果显著。本研究中,HI-H₂组的右心室流出道速度时间积分高于HI组。有研究报道,右心室流出道速度时间积分可反映急性心力衰竭患者的肺血管阻力(PVR)1⁵,且右心室流出道速度时间积分较低的患者肺血管阻力更高1⁵˒1⁶。这可能反映了氢气可降低肺动脉血管阻力。尽管氢气降低肺动脉血管阻力的机制尚不清楚,但Kishimoto等人已证实,在大鼠模型中,氢气可通过抑制巨噬细胞聚集、减少氧化应激以及调节转录因子3和活化T细胞核因子轴的激活剂,减轻野百合碱诱导的肺动脉高压1⁷。体内会产生多种活性氧,包括羟基自由基、过氧亚硝酸根、过氧化物和超氧阴离子,但目前尚不清楚哪种活性氧在肺动脉高压的发生和发展中实际发挥作用。以往的相关研究主要集中在抗氧化剂的使用,而对涉及哪种活性氧或其参与程度的研究较少1⁷。富氢水因其抗氧化能力和减轻肺部炎症反应,对肺动脉高压具有保护作用1⁸,尽管该现象的病理机制在时间上存在差异。
亚低温可能诱发肺血管收缩,并可能导致或加重新生儿持续性肺动脉高压(PPHN)1⁹。亚低温相关的心功能减弱会导致心率减慢,这也可能减少肺血流量,从而可能诱发新生儿持续性肺动脉高压。
本研究中,氢气对左心输出量的影响不如对右心输出量明显,但与未吸入氢气的仔猪相比,其下降程度较轻。左心输出量的这种轻微下降可能至少在一定程度上增加了对右心的灌注,从而有助于右心输出量的增加。Hayashida等人已报道,在大鼠缺血再灌注模型中,吸入氢气可在复苏后30分钟改善左心室功能2⁰,并指出自主循环恢复后2小时的白细胞介素-6升高被氢气吸入显著抑制。因此,本研究中氢气吸入的抗炎作用可能也在早期发挥了效果,并可能有助于左心输出量的增加。然而,在本模型中,我们未观察到复苏期间动脉导管未闭,且不能排除动脉导管分流的可能性。
氢气因能清除氧自由基(一种自由基)而被认为具有抗氧化作用。通过这种抗氧化作用,氢气可减轻心肌细胞损伤,有助于增强心脏功能1⁰。此外,有研究提出,在心肌梗死模型中,氢气吸入治疗可能在缺血再灌注损伤期间发挥抗凋亡作用。氢气吸入治疗对心肌细胞具有保护作用,可能有助于维持心脏功能21。氢气的其他益处包括抗炎特性22和保护线粒体功能23,这可能有助于维持心脏功能并促进每搏心输出量的增加。
氢气治疗不仅能减轻脑损伤,还能改善缺氧缺血性脑病新生儿的心脏功能。此外,氢气吸入治疗可通过降低肺血管阻力同时治疗持续性肺动脉高压。将氢气接入呼吸回路即可轻松进行吸入治疗。所用氢气浓度低,爆炸风险小,因此能安全快速地启动治疗。
本研究存在一些局限性。首先,由于仅在损伤后进行了6小时的氢气吸入,我们只能评估其短期效果。另一方面,在该新生仔猪模型中,早在损伤后1-2小时,超声心动图就显示吸入氢气可增加右心输出量。在临床实践中,若在复苏后早期开始吸入氢气,可能在几小时内通过超声心动图证实心血管效果的改善。此外,近年来,缺氧缺血性脑病新生儿的右心功能障碍与神经预后已成为研究热点⁷˒2⁴。因此,缺氧缺血性脑病新生儿在出生后早期进行氢气治疗可能有助于稳定心血管功能,进而可能产生长期的神经保护作用。我们已报道,在仔猪模型中,24小时氢气吸入联合亚低温治疗可改善24小时时脑循环氧代谢的变化2⁵、减少癫痫发作负荷2⁶,并在损伤后第5天发挥神经保护作用11˒2⁵˒2⁷。其次,仔猪与人类出生后的髓鞘形成模式存在差异2⁸,由于仔猪的髓鞘形成更早,缺氧时出现的脑电图模式可能有所不同。
方法
动物实验流程
本研究使用了17头日龄≤24小时、体重1.5-2.1kg的新生仔猪(Camborough®;日本香川县大和畜产)。
麻醉、通气和生理指标监测
首先使用1-2%异氟烷(空气作为载气)通过面罩对仔猪进行麻醉。随后对每头仔猪进行气管插管,使用婴儿呼吸机进行机械通气。通过新生儿脐导管分别插管脐静脉和脐动脉,用于输液和血压监测/采血。插管后,给予泮库溴铵初始剂量0.1mg/kg,随后以0.1mg/kg/h的速度持续输注以诱导肌肉松弛。给予枸橼酸芬太尼初始剂量10μg/kg,随后以5μg/kg/h的速度持续输注以维持麻醉。通过脐静脉以4mL/kg/h的速度持续输注含2.7%葡萄糖的电解质维持液(KN3B;大塚制药株式会社,东京)。在实验的关键时间点和临床需要时采集动脉血样本。将仔猪置于辐射保暖台,维持直肠温度均值(标准差±SD)为39.0±0.5°C。吸入气体通过混合氧气和氮气制备,以获得实验所需的氧浓度。调整通气参数以维持动脉氧分压(PaO₂)和动脉二氧化碳分压在正常范围内。
超声心动图评估
使用Xario100S超声诊断仪(佳能医疗系统株式会社,大田原市)和12MHz多频扇形探头进行超声心动图评估。从胸骨旁短轴观和长轴观,将脉冲多普勒取样容积置于主动脉瓣或肺动脉瓣正上方,测量左心室和右心室流出道的血流速度模式。离线描记多普勒血流,计算右心室每搏输出量、左心室每搏输出量和右心室流出道速度时间积分。左、右心室心输出量通过每搏输出量乘以心率计算得出。
缺氧缺血损伤方案
由于我们先前的研究已详细报道了相关内容11˒2⁵⁻2⁷,此处仅简要概述缺氧缺血损伤方案。在初始麻醉诱导后稳定至少120分钟,通过将呼吸机吸入氧浓度降至4%诱导缺氧。为获得低振幅整合脑电图(<5μV),必要时进一步降低吸入氧浓度,并进行调整以避免心肺骤停。从低振幅整合脑电图出现开始,持续损伤30分钟。损伤期间,逐步降低(每次1%)或提高(每次1%)吸入氧浓度,以维持低振幅整合脑电图、心率(>130次/分钟)和平均动脉血压(>基线的70%)。维持低振幅整合脑电图20分钟。在30分钟损伤的最后10分钟,若平均动脉血压超过基线的70%,则通过降低吸入氧浓度诱导低血压。当脑血容量值降至30%以下和/或平均动脉血压降至基线的70%以下时进行复苏。通过吸入100%氧气终止缺氧。使用碳酸氢钠纠正碱缺失(碱剩余低于-5.0mEq/L),以维持pH在7.3-7.5。吸入100%氧气10分钟后,逐渐降低呼吸机频率和吸入氧浓度,以维持血氧饱和度在95-98%。使用血气分析仪(ABL90 FLEX PLUS;雷度米特公司,哥本哈根)测量血气、葡萄糖、乳酸和血红蛋白水平。
损伤后治疗
缺氧缺血损伤后,17头仔猪被随机分为两组:单纯缺氧缺血损伤组(HI组;n=10)和缺氧缺血损伤+氢气组(HI-H₂组;吸入2.1-2.7%氢气6小时,n=7)。氢气吸入使用两种气瓶,一种含有3.8%氢气和96.2%氮气的混合气体,另一种为100%氧气,与先前研究一致11˒12˒1⁴。氢气浓度取决于每头仔猪的需氧量。因此,治疗期间氢气浓度通常在2.1-2.7%之间(吸入氧浓度范围0.21-0.4)。通过呼吸机输送氢气,持续6小时。使用便携式气体监测仪(TP-70D;理研计器株式会社,东京)测量氢气浓度。所有仔猪在损伤后6小时的麻醉-通气期间,置于辐射保暖台,持续监测直肠温度,维持在正常范围(38°C-39°C)。
数据分析
使用GraphPad Prism 9.3.1(GraphPad Software,拉霍亚,加利福尼亚州)进行所有统计分析。所有数值以HI组和HI-H₂组损伤后的生理和血气数据的平均值±标准差表示。采用双因素重复测量方差分析,随后进行Tukey事后检验,比较两组在每个时间点的生理数据、血气数据以及心率、平均动脉血压、每搏输出量、心输出量、右心室流出道速度时间积分的测量值。p<0.05被认为具有统计学意义。
伦理审批
本研究方案经香川大学动物护理和使用委员会批准(15070-1),并按照《动物研究:体内实验报告指南》(ARRIVE)及所有其他适用指南和规定进行。
结论
在本研究中,我们使用缺氧缺血性脑病的转化型仔猪模型,探讨了吸入氢气对缺氧缺血损伤后6小时内左、右心室心输出量和每搏输出量的影响。吸入氢气从损伤后1小时开始使右心输出量和每搏输出量明显增加,在5小时时显著升高。氢气使右心室流出道速度时间积分增加,提示氢气可能降低肺血管阻力并改善右心室功能障碍。
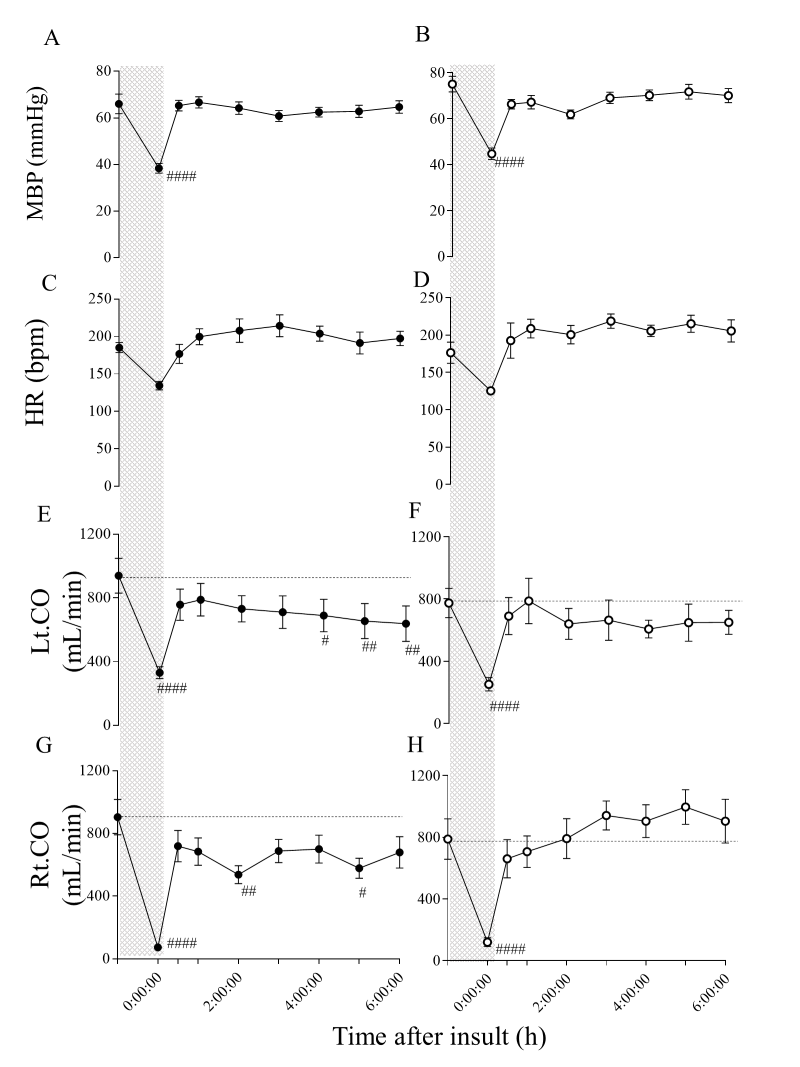
Figure 1.
Time course of changes in the physiological parameters MBP, HR and Lt. and Rt.CO before and within 6 h after HI insult in HI and HI-H2 groups.
The shaded area indicates HI insult and dotted lines indicate baselines. Closed circle (●), HI group (n=10); open circle (〇), HI-H2 group (n=7). p <0.05, ##p< 0.01, ####p <0.0005 vs. baseline. Mean blood pressure (MBP) in HI (A) and HI-H2 (B) groups. Heart rate (HR) in HI (C) and HI-H2 (D) groups. Lt. and Rt. cardiac output (CO) in HI (E, G) and
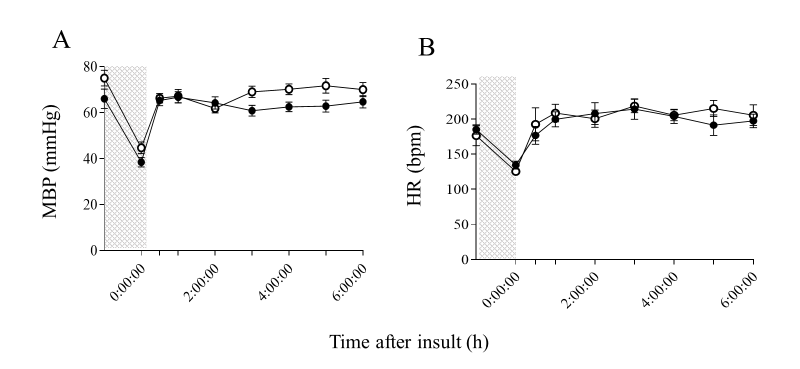
Figure 2.
Comparison of MBP (A) and HR (B) in HI and HI-H2 groups before and within 6 h after insult.
The shaded area indicates HI insult and dotted lines indicate baselines. Closed circle (●), HI group (n=10); open circle
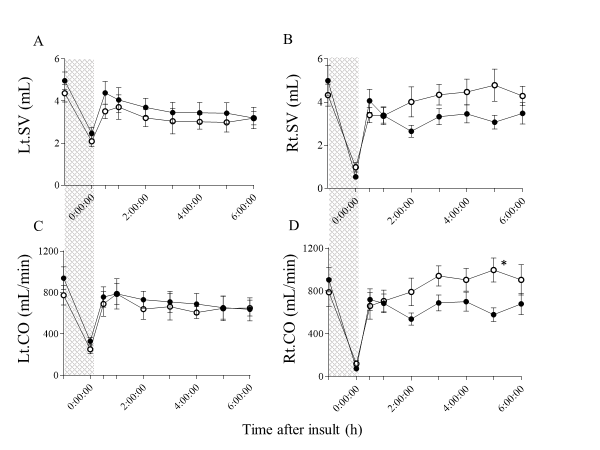
Figure 3.
Comparison of ventricular SV (A, B) and CO (C, D) in HI and HI-H2 groups before and within 6 h after insult.
The shaded area indicates HI insult and dotted lines indicate baselines. Closed circle (●), HI group (n=10); open circle
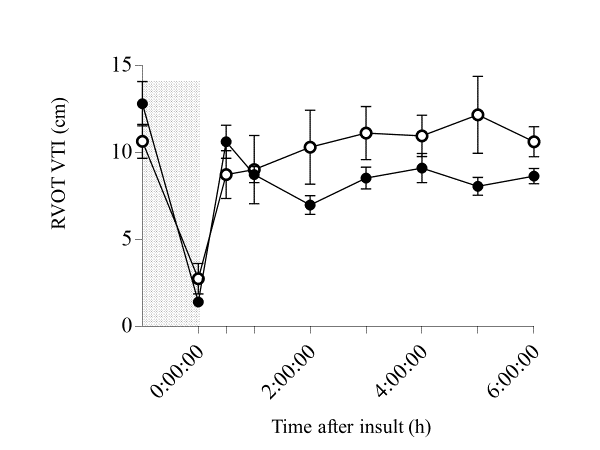
Figure 4.
Comparison of RVOT VTI in HI and HI-H2 groups before and within 6 h after insult.
The shaded area indicates HI insult and dotted lines indicate baselines. Closed circle (●), HI group (n=10); open circle (
https://wap.sciencenet.cn/blog-41174-1492577.html
上一篇:结合微藻与氢氧化细菌的新型光-化能自养系统用于从二氧化碳生产微生物蛋白
下一篇:涡轮增压NK细胞在自身免疫性疾病治疗中展现前景