博文
体内电解槽植入释放氢气治疗疾病的创新概念
||
相关报道:《新晋院士,ACS Nano副主编,又一篇Nature大子刊!》
田博之教授,芝加哥大学化学系教授,美国医学与生物工程院院士(2024),现任ACS Nano副主编。田教授所领导的团队长期探索生物和半导体系统之间的分子-纳米界面,重点研究兴趣在于新材料合成和器件概念设计方面,在Nature、Science及其子刊等顶级国际期刊上发表了丰硕的研究成果。

田教授自身的人生经历也堪称传奇。他以全国化学奥赛一等奖得主身份保送复旦大学化学系本硕(3+3)连读。在复旦期间,师从赵东元院士发表了多达25篇论文,其中包括了Nature Materials在内的6篇第一作者论文,此外还持有7项第一发明人专利。由于出色的成绩,他最终被复旦大学破格授予博士学位。复旦毕业以后,他同年获得哈佛大学全额奖学金,师从极具影响力的科学家、美国科学院院士Charles M. Lieber。在读期间,他又发了2篇NS正刊文章和2篇NS大子刊文章。他曾被美国麻省理工学院评委2012年度“世界顶尖青年创新家”,2016年被美国总统奥巴马授予的“青年科学家总统奖”,同年也获得了“斯隆研究奖”。
可穿戴‘氢气贴’,局部抗氧化救心护肤
氢气(H₂)作为一种小分子气体,不仅是燃料电池和工业合成的重要原料,在生物医学领域也展现出惊人的潜力——尤其是在缺血-再灌注(I/R)损伤中,它能中和过量活性氧(ROS),保护心脏、皮肤等组织。然而,传统氢气治疗方式(如吸入、饮用氢水、氢盐注射)要么需要笨重设备、要么全身给药缺乏靶向,要么侵入性强、不适合长期反复使用。更重要的是,氢气的储存和释放本就困难:易泄漏、易燃,而且常需高压或低温储存。这些问题限制了氢气疗法在临床的落地应用。
在此,芝加哥大学田博之教授、Wen Li 联合加州大学洛杉矶分校金丽华副教授提出了一种便携式水凝胶电化学电池——用柔软、含水的高分子网络包裹电极,在温和条件下按需电解产氢。水凝胶既是电解质,又是氢气“海绵”,能局部存储并缓慢释放到组织表面,实现可控、可持续的局部给药。作者系统研究了水凝胶成分对产氢速率、气泡形态、储存能力的影响,并在体外细胞、离体心脏及小鼠皮肤压疮模型中验证了抗氧化保护效果。更令人期待的是,他们还将装置做成无线可穿戴贴片(H-Pad),能针对心脏手术后或长期卧床患者的局部ROS损伤进行精准干预。相关成果以“Hydrogen evolution and dynamics in hydrogel electrochemical cells for ischemia–reperfusion therapy”为题发表在《Nature Chemical Engineering》上,第一作者为Wen Li,Jing Zhang为共同一作
论文题目:用于缺血再灌注治疗的水凝胶电化学电池中的析氢反应及氢气动态变化
氢分子(H₂)可保护器官免受与缺血再灌注(I/R)损伤相关的活性氧(ROS)破坏。现有的氢气递送方法(如气体吸入、饮用富氢水)以全身为作用目标,且在给药过程中存在氢气泄漏问题。本研究设计了一种便携式水凝胶电化学电池,该电池可通过析氢反应(HER)实现按需产氢。该系统能够实现氢气的可控生成、局部储存以及向组织-装置界面的持续扩散,具有更优的可控性和持续性。我们对水凝胶系统中的析氢反应及氢气动态变化展开深入研究,评估了水凝胶聚合物组成对析氢反应动力学、气泡形态及氢气储存的影响。通过以下实验验证了该系统的保护作用:(1)体外实验(心肌细胞和角质形成细胞);(2)离体实验(缺血再灌注心脏);(3)体内实验(皮肤缺血再灌注压疮)。这些研究结果表明,水凝胶电化学电池设计在缺血再灌注治疗中实现高效、持续氢气递送的潜力,该设计或可广泛应用于其他气体疗法及药物递送研究领域。
氢气(H₂)在众多领域中不可或缺,包括燃料电池¹、工业化学合成²及生物医学治疗³。氢气分子体积小且具有易燃性,这给工业和生物医学领域的氢气储存与释放带来了挑战。传统制氢方法(如蒸汽重整或电解⁴)需要苛刻的物理或化学条件、庞大的设备,且需在低温或高压环境下储存⁴。氢气疗法利用氢气中和活性氧(ROS)的能力以抵御缺血再灌注(I/R)损伤³,⁵,但上述传统制氢过程无法满足氢气疗法的需求——该疗法需要温和、便携且可控的递送系统。目前临床试验中采用的氢气递送方法(如气体吸入⁵、饮用富氢水⁶及注射富氢盐水⁷)存在显著局限性:吸入法受吸入气体中氢气占比限制,且无法实现持续、组织特异性的剂量控制;饮用富氢水虽无创且便捷,但难以控制给药的氢气浓度,同样缺乏递送的时空精准性;注射富氢盐水可实现更精准的局部递送,但本质上属于有创操作,不适用于反复或长期治疗(补充表1)⁸。其他方法(如光催化⁹、藻菌系统¹⁰、镁基植入物¹¹及原电池¹²)在小鼠实验中显示出一定潜力,但在动态生物条件下外部可控性有限且产氢速率不稳定,无法满足精准、持续治疗的需求。这些挑战凸显了先进电化学工程方法的必要性——需结合材料工程、界面动力学及分子传输技术,实现生物医学应用中氢气的可控生成与持续递送。
本研究设计了一种水凝胶电化学电池,可在温和、便携且可控的条件下实现氢气的可控生成、局部储存与持续扩散。水凝胶是一类富含水分、具有弹性且适应性强的材料,是生物电子学与生物系统对接的理想候选材料¹³,同时也是析氢反应(HER)研究中尚未充分探索的体系。作为软性材料,水凝胶对气体具有高渗透性,因此非常适用于气体治疗¹⁴,¹⁵。在传统的液态电解质析氢反应中,氢气泡易逃逸,导致其在生物系统中的扩散和利用效率低下(图1a,上)。与之相反,水凝胶的三维(3D)水-聚合物网络可支持析氢反应,并能快速、有效地捕获氢气泡,实现安全、持续的氢气扩散,提升生物界面递送效果(图1a,下)。本研究对比了水凝胶电解质系统与液态电解质系统中的析氢反应及氢气动态变化,评估了水凝胶聚合物组成对电化学动力学、气体形态及气体储存的影响。
我们在无细胞系统、体外心肌细胞(CMs)及角质形成细胞实验中,证实了该系统中和活性氧、防止氧化损伤的功效(图1b(ii))。为开展组织-水凝胶评估,我们开发了一种膜电极组件-水凝胶(MEA-水凝胶)装置:将两个钛网电极附着在全氟磺酸(Nafion)质子交换膜的两侧,并将其嵌入水凝胶中,构建出紧凑便携的电化学电池(图1b(iv))。水凝胶作为生物相容性支架,可捕获氢气并控制其向组织-装置界面释放,从而在离体缺血再灌注心脏模型(图1b(i),(iii))和体内皮肤压疮模型(图1b(v))中实现局部、持续的氢气递送。我们集成了无线柔性印刷电路板(PCB),为MEA-水凝胶装置提供恒定电流——我们预计该设计可让患者或临床医生实现氢气生成的按需控制与剂量调整(图1b(vi)-(viii))。
水凝胶电化学电池平台为缺血再灌注损伤治疗提供了一种具有前景的简洁方案。水凝胶本身兼具三大关键功能:氢气生成、储存与扩散,并将这些过程有效整合到单一系统中。这种多功能性不仅简化了传统氢气疗法,还降低了成本,同时实现了便携、无线的治疗方案。除氢气疗法外,该平台既能在水凝胶内部促进电化学反应,又能实现局部气体捕获与持续扩散,这使其成为一种多功能系统,有望在其他气体疗法及药物递送研究中实现更广泛的应用。
研究结果
水凝胶电解质中的氢气生成、储存与扩散
由于铂(Pt)具有优异的催化效率和生物相容性¹⁶⁻¹⁸,本研究选择铂作为析氢反应的电催化剂。扫描电子显微镜/能量色散X射线光谱分析证实,铂纳米颗粒已成功附着在钛(Ti)电极表面(补充图1a)。线性扫描伏安法(LSV)、电化学阻抗谱(EIS)等电化学表征结果显示,与裸钛电极相比,钛-铂(Ti-Pt)电极具有更高的电流密度和更低的阻抗(补充图1b,c)。Ti-Pt电极的塔菲尔(Tafel)斜率降低,表明其反应动力学和催化活性得到提升(补充图1d)。计时电位法(CP)测试显示,该电极在12小时内保持稳定的反应动力学(补充图1e)。
为在软性、生物相容性平台中实现析氢反应,我们选择聚乙烯醇(PVA)水凝胶作为电解质基质。聚乙烯醇可通过冻融过程实现物理交联,无需化学交联剂——这对电化学稳定性至关重要,因为化学交联剂在析氢反应过程中可能发生氧化或还原反应,损害电极完整性和水凝胶力学性能。我们通过测量氢气在聚合物溶液中的溶解度,进一步评估了聚乙烯醇水凝胶与氢气的相互作用。结果显示,与不含聚合物的硫酸钠(Na₂SO₄)溶液相比,添加聚乙烯醇、明胶或海藻酸盐等聚合物后,氢气饱和浓度降低(补充图2),这可能是由于可用于气体溶解的自由水含量减少所致。聚合物浓度越高,氢气溶解度的降低越显著:当聚乙烯醇含量从3%增至6%时,溶解的氢气浓度进一步下降。值得注意的是,在相同质量比下,不同类型聚合物对氢气溶解度的影响差异相对较小。
为评估电极在水凝胶环境中的性能,我们采用冻融法对聚合物进行物理交联,合成了不同聚合物浓度(在0.1mol/L硫酸钠溶液中分别含3%、6%和10%聚乙烯醇)的聚乙烯醇水凝胶。液态电解质与水凝胶电解质的关键区别在于析氢反应过程中的气泡动态变化:在不含聚乙烯醇的0.1mol/L硫酸钠溶液中,当浮力超过气泡与电极的附着力时,气泡会发生逃逸(补充视频1)¹⁹;而在水凝胶中,弹性力可将气泡捕获在水凝胶基质内部或电极-水凝胶界面处(补充视频2-4)。若使用未经冻融交联的聚乙烯醇前驱体溶液,无法在数分钟至数小时的时间尺度内实现氢气的有效捕获(补充视频5),这表明聚合物基质在氢气气泡的长期保留中发挥重要作用。水凝胶网络中的气体捕获和电解质扩散受限会导致电流密度降低、阻抗增加及动态不稳定性(图2a-d)。
气泡形态取决于水凝胶的聚合物含量和模量:在3%水凝胶(模量最低;补充图3、4)中,气泡保持离散状态;聚合物含量更高(因此模量更高)的水凝胶在相同施加应力下的应变变化更小(补充图5),这会将气泡压缩至更靠近电极表面的位置,进而导致水凝胶与电极剥离并形成氢气通道(图2e,f),力学模拟结果也证实了这一现象(补充图6)。氢气通道的形成会阻碍催化位点,减少可用电极表面积,导致随着水凝胶聚合物含量的增加,电流密度进一步降低、阻抗进一步增加(图2a,b及补充图7)²⁰,²¹。
我们采用兰德尔(Randles)等效电路模型对图2b中的电化学阻抗谱(EIS)曲线进行拟合,其中Rs代表溶液电阻,RCT代表电荷转移电阻,CPE代表常相位元件。模拟结果显示,随着水凝胶聚合物含量的增加,Rs和RCT升高,CPE降低(补充表2)——这是由于在更致密的聚合物网络中,电极表面积减少且电解质扩散受限所致。此外,由于捕获气体的介电常数(约为1)远低于水的介电常数(约为78.2),界面电容也随之降低。电化学阻抗时间谱(EITS)结果显示,随着时间推移,水凝胶电解质中的气泡积累会导致实阻抗、虚阻抗和总阻抗均升高,而液态电解质则表现出稳定特性(图2c及补充图8)。
在向Ti-Pt电极施加恒定电流时,6%和10%水凝胶样品出现电压振荡(图2d);10%水凝胶样品在EITS测试中也观察到类似的阻抗振荡(图2c及补充图8)。视频分析发现了相应的力学振荡(补充视频3、4及补充图9),这是由于在钛-水凝胶-空气界面处,氢气通道中发生准周期性气体泄漏,从而引发动态不稳定性(补充视频6及补充图10)。与之相反,3%水凝胶未出现电压或力学振荡——这是因为气泡在界面处保持离散状态,未形成相互连接的氢气通道(补充视频2及补充图11)。在相同充电条件下,这种稳定性使3%水凝胶的气体泄漏量远低于6%和10%水凝胶(图2g及补充图12、13)。若将聚合物含量进一步降至2%,冻融后得到的将是液体而非凝胶,无法有效捕获气体(补充图14);使用不含交联基质的3%聚乙烯醇前驱体溶液同样无法有效捕获气体(补充图15)。在3%聚乙烯醇水凝胶中增加冻融循环次数会减小孔径,导致氢气扩散速率减慢、氢气保留量降低(补充图16)。综合电化学性能和气体储存能力,我们最终选择经过1次冻融循环的3%聚乙烯醇水凝胶作为后续研究的电解质。
目前的氢气疗法依赖封闭环境,需将细胞或动物置于具有特定氢气和氧气浓度的密闭舱室中³,⁵,²²,²³。这种方法的临床应用价值有限,原因在于患者需保持固定体位,且氢气易燃性存在潜在安全风险。本研究利用水凝胶的气体捕获机制,开发了一种用于持续氢气递送的开放式电化学装置。对在-0.5mA电流下处理5分钟、分别浸没于3%水凝胶和硫酸钠溶液电解质中的Ti-Pt导线进行显微计算机断层扫描(micro-CT)分析,结果显示:水凝胶中捕获的气体体积达17.6mm³,而溶液中气体保留量极少(图2h)——该结果与常温常压下18.7mm³的理论产气量高度吻合。但需注意的是,显微CT观察到的捕获气体可能包含溶解的环境气体(如氧气、氮气、二氧化碳),而非仅为氢气,因此与气相色谱(GC)测得的氢气泄漏结果可能存在轻微偏差。
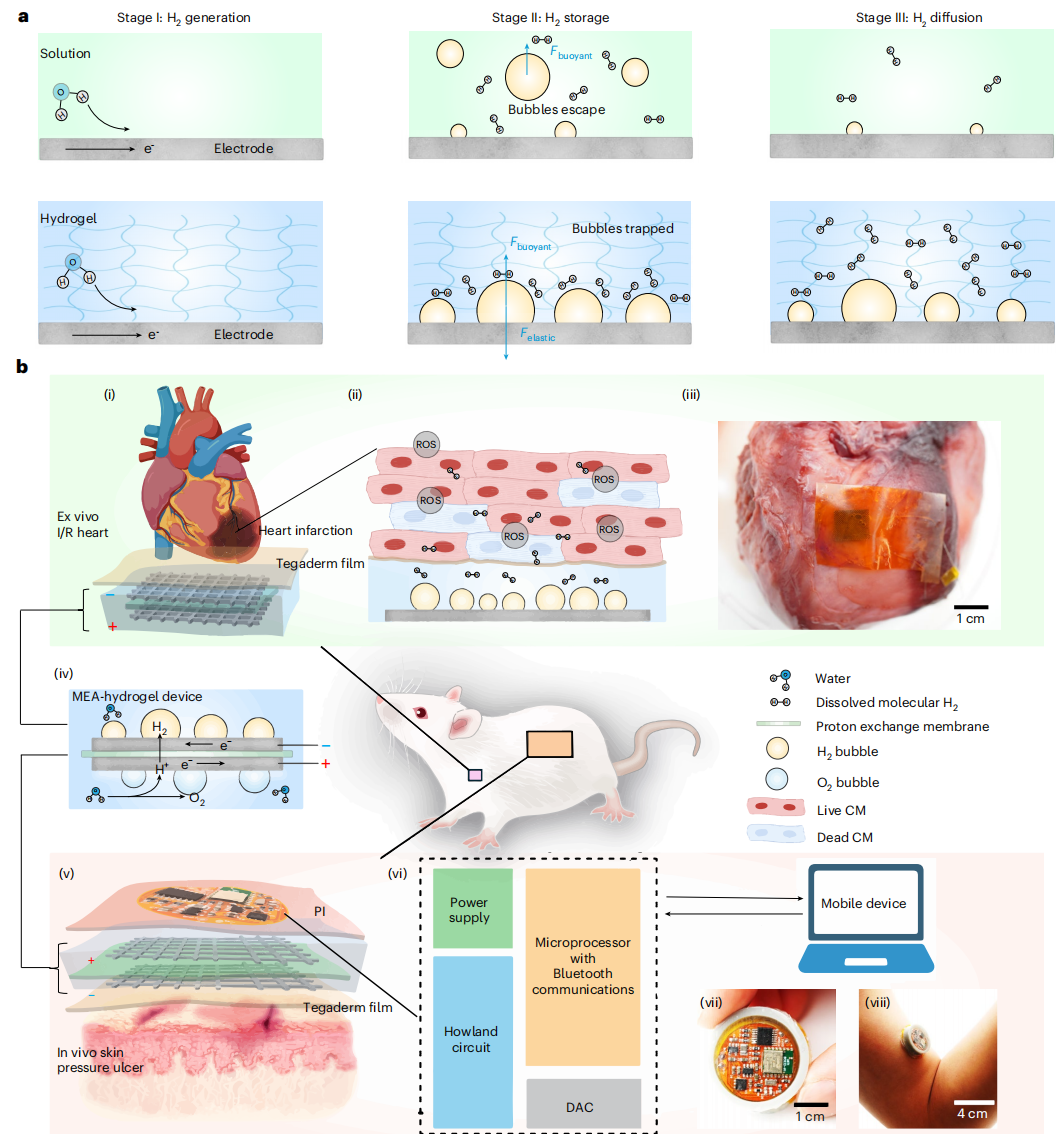
图1 | 水凝胶电化学电池中的氢气(H₂)生成、储存与扩散
a. 在溶液及水凝胶电解质中,通过析氢反应(HER)实现氢气的生成、储存与扩散过程。
b. 器官特异性装置平台。(i)和(ii)在心肌细胞(CMs)中,水凝胶电化学电池生成的氢气可通过中和活性氧(ROS),发挥抗缺血再灌注(I/R)损伤的保护作用。(iii)附着于猪心脏表面的膜电极组件-水凝胶(MEA–hydrogel)。(iv)膜电极组件-水凝胶装置的结构及析氢反应过程。(v)用于预防压疮损伤的H-Pad装置,整合了膜电极组件-水凝胶与柔性无线印刷电路板(PCB)。(vi)为膜电极组件-水凝胶装置提供恒定电流的柔性印刷电路板系统设计。DAC:数模转换器(digital-to-analog converter)。(vii)和(viii)便携式H-Pad贴片装置,包含Tegaderm薄膜、膜电极组件-水凝胶、聚酰亚胺(PI)薄膜、电池、柔性印刷电路板及3D打印环。b图通过BioRender.com绘制。
水凝胶的气体保留特性与氢气递送的抗氧化作用
水凝胶的气体保留特性使其具备独特的氢气(H₂)扩散曲线。为更深入探究水凝胶介导的氢气扩散机制,我们设计了一套氢气传感装置:该装置采用钛网电极以提高产氢量,并通过3M Tegaderm薄膜密封的腔室将电化学电池与含传感器的溶液分隔开(补充图17a)。钛网-水凝胶电化学电池的制备流程如下:先在钛网表面电沉积铂(Pt)纳米颗粒,再在其表面涂覆一层1.3毫米厚的3%聚乙烯醇(PVA)水凝胶。正如预期,模拟结果(补充图18)显示,水凝胶厚度会同时影响氢气的峰值浓度与保护时长。
对氢气透过Tegaderm薄膜的扩散过程进行实际测量发现,与硫酸钠(Na₂SO₄)溶液相比,水凝胶涂层不仅能使氢气浓度峰值更高,还能实现氢气的持续释放——在仅0.5毫安时(mAh)的低能量输入下,有效治疗时长(氢气浓度[H₂]>25微摩尔/升)³从0.65小时延长至23.5小时,延长幅度近36倍(图2i)。水凝胶实现的氢气持续扩散与治疗浓度,表明其在提高氢气利用效率方面具有潜力。通过光学成像观察钛网上的氢气泡发现,气泡尺寸随时间逐渐减小(补充图19);有趣的是,当气泡缩小至某一阈值以下后,其尺寸便趋于稳定。这种稳定性可能源于水凝胶网络中的残余弹性形变——在捕获气体产生的长期机械应力作用下,水凝胶网络无法完全恢复原状。
此外,通过调节施加电流可进一步调控氢气递送曲线,这体现了水凝胶在临床氢气疗法中的多功能性(图2j)。图2k展示了典型治疗场景下氢气扩散的数值模拟结果:基于9.33微摩尔氢气(相当于5毫安电流持续6分钟的产氢量)的生成量,模型预测Tegaderm薄膜表面的氢气浓度在85分钟时达到约480微摩尔/升的峰值,随后随时间逐渐下降(补充图17b)。图2k(底部)进一步呈现了Tegaderm薄膜表面及其上方1厘米处的氢气浓度时空分布曲线。结果表明,越靠近水凝胶界面,氢气浓度峰值出现得越早、数值越高;而距离越远的区域,峰值出现越晚、浓度越低。这一现象凸显了氢气递送固有的局部性特征——在无外部对流或压力驱动传输的情况下,氢气的渗透深度有限。值得注意的是,24小时后水凝胶中仍残留溶解态氢气,这表明其在长期治疗应用中具有潜在价值。
水凝胶递送氢气缓解氧化损伤
羟基自由基(•OH)是一种反应活性极强的破坏性活性氧(ROS),对蛋白质、DNA等富电子生物分子具有高亲和力²⁴。为测试钛网-水凝胶电化学电池清除羟基自由基的效率,我们在无细胞系统中利用芬顿反应(Fe²⁺ + H₂O₂ = Fe³⁺ + •OH + OH⁻)展开实验:在特定时间点向高氯酸亚铁(Fe(ClO₄)₂)溶液中加入过氧化氢(H₂O₂),即可生成羟基自由基³。实验中采用羟基苯基荧光素作为荧光探针,用于监测羟基自由基浓度的变化。
如图3a、b所示,向高氯酸亚铁溶液中加入过氧化氢后,羟基自由基水平迅速升高;而加入等体积磷酸盐缓冲液(PBS)则无此效应。若先用钛网-水凝胶电化学电池递送的氢气预处理高氯酸亚铁溶液,羟基自由基水平会显著降低,这证实了氢气在中和羟基自由基方面的有效性。
在开展器官层面实验前,为验证氢气在体外细胞模型中的作用,我们利用铜基芬顿反应构建了细胞模型——该反应可将细胞内源性过氧化氢转化为羟基自由基,从而诱导严重的氧化应激(图3c、d)³。将心肌细胞(CMs)或人永生化角质形成细胞(HaCaT细胞)接种在Tegaderm薄膜上,该薄膜允许氢气扩散,但可阻止电解质交换与电流泄漏(补充图20)。钛网-水凝胶装置可生成、储存氢气,并将其释放至细胞中(图3c)。值得注意的是,由于Tegaderm薄膜具有透气不透液的特性,在装置运行期间及运行后,其腔室内的pH值始终保持稳定(补充图21a);且随着氢气开始扩散并取代溶液中的氧气(O₂),氧气水平逐渐下降(补充图21b)。这种设计既保证了氢气可扩散至组织中,又能有效隔离水凝胶,避免其直接接触生物电解质、蛋白质及组织液。
通过CellROX与H₂DCFDA探针检测细胞内活性氧水平发现:与对照组相比,经铜离子(Cu)与维生素C(Vc)(Cu+Vc)处理的细胞中活性氧水平显著升高;而暴露于氢气后,细胞内活性氧水平明显降低(图3e、f及补充图22-24)。
我们采用碘化丙啶(PI)/霍奇斯特(Hoechst)染色法与PI流式细胞术,评估了Cu+Vc诱导氧化应激下心肌细胞与HaCaT细胞的存活率。结果显示,氢气处理可将心肌细胞死亡率从约60%降至约25%(图3g及补充图25),将HaCaT细胞死亡率从约70%降至约30%(补充图26、27)。流式细胞术结果进一步证实了心肌细胞中的这一现象(图3h、i)。
为排除电刺激对实验结果的潜在影响,我们额外设计了对照实验:使用两个无催化剂的钛网,在两电极间施加2伏电压。结果显示,Cu+Vc组与Cu+Vc+电刺激组的心肌细胞死亡率无显著差异(补充图28)。
在经Cu+Vc诱导氧化应激的心肌细胞中,氢气处理组的炎症标志物NLRP3(核苷酸结合寡聚化结构域样受体蛋白3)与半胱天冬酶-1(caspase-1)的表达水平较未处理对照组显著降低(图3j、k及补充图29、30);而假手术组与单纯氢气处理组之间无显著差异。这些结果表明,通过钛网-水凝胶生物电子系统递送的氢气可调控核因子-κB(NF-κB)信号通路,从而减轻炎症反应、保护细胞免受氧化损伤并提高细胞存活率(图3l)²⁵。
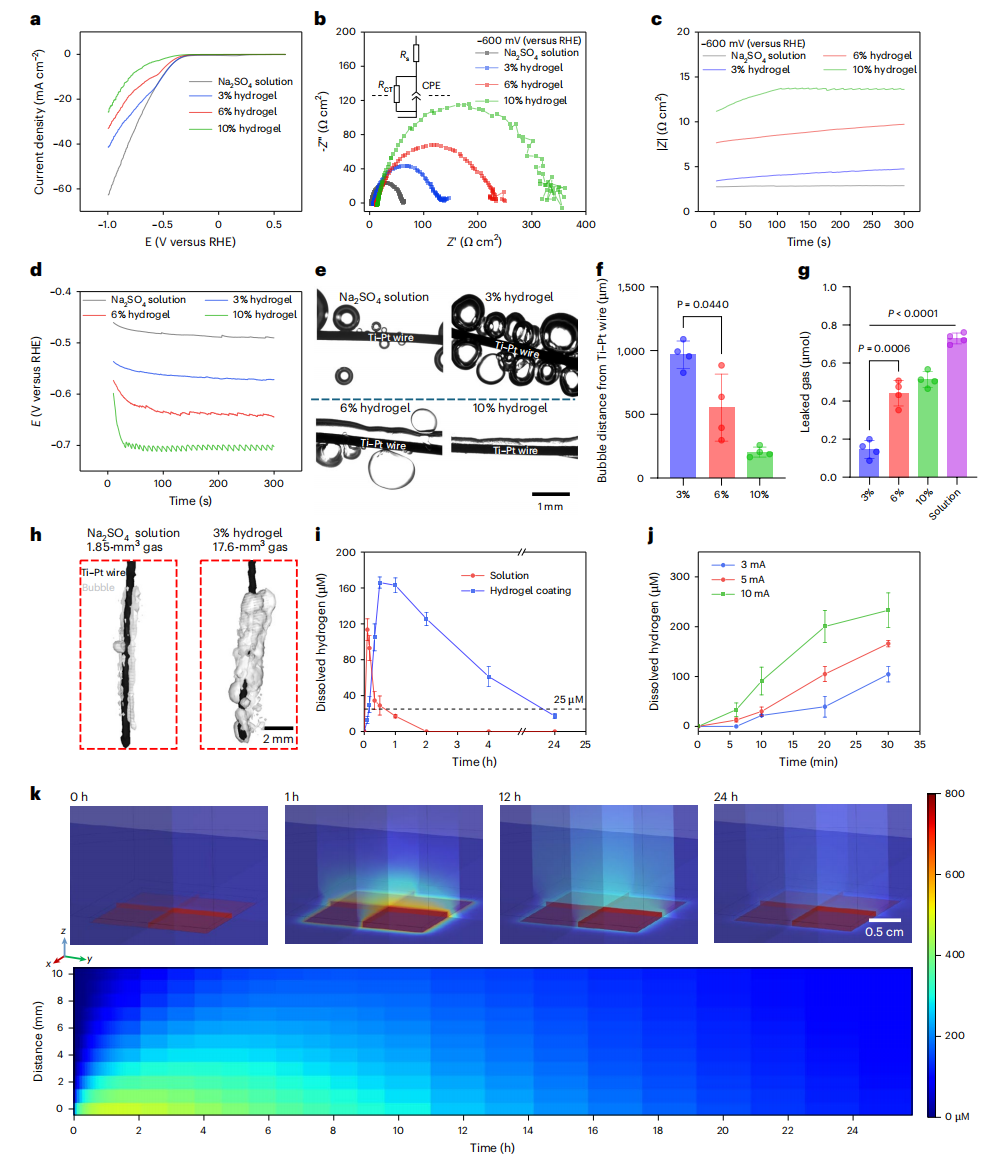 图2 | 钛-铂(Ti-Pt)电极在溶液及水凝胶电解质中的特性表征
图2 | 钛-铂(Ti-Pt)电极在溶液及水凝胶电解质中的特性表征
a. 钛-铂电极在硫酸钠(Na₂SO₄)溶液与水凝胶中的线性扫描伏安曲线(LSV)。
b. 钛-铂电极在相对于可逆氢电极(RHE)为-600毫伏、频率范围100千赫兹至0.1赫兹条件下的电化学阻抗谱(EIS)。CPE:常相位元件。
c. 钛-铂电极在相对于可逆氢电极为-600毫伏、频率10千赫兹条件下的电化学阻抗时间谱(EITS)。
d. 钛-铂电极反应动力学的计时电位法(CP)测试:电流密度为-4.4毫安/平方厘米,持续5分钟。
e. 不同电解质中气泡结构与钛-铂导线的成像图:电流密度为-4.4毫安/平方厘米,持续5分钟。
f. 不同水凝胶中最远端气泡与电极的距离(独立实验,样本量n=4)。3%水凝胶组与6%水凝胶组的P值=0.0440。
g. 硫酸钠溶液与水凝胶中氢气(H₂)向空气中的泄漏情况:充电电流为-0.5毫安,持续5分钟(独立实验,样本量n=4)。3%水凝胶组与6%水凝胶组的P值=0.0006;3%水凝胶组与溶液组的P值<0.0001。
h. 显微计算机断层扫描(Micro-CT)结果:对比3%水凝胶与溶液电解质中的氢气捕获情况。
i. 钛网表面涂覆溶液或水凝胶时的氢气扩散曲线:充电电流为-5毫安,持续6分钟。图中显示不同时间点氢气传感器检测到的溶解态氢气浓度(独立实验,样本量n=3)。
j. 不同充电电流下(持续6分钟)的溶解态氢气浓度(独立实验,样本量n=3)。
k. 水凝胶内捕获9.33微摩尔氢气时,0小时、1小时、12小时、24小时的氢气扩散模拟图(上);以及0小时至24小时内,Tegaderm薄膜表面至其上方1厘米区域的氢气浓度热图(下)。0毫米处为Tegaderm薄膜位置。
数据以“平均值±标准差”表示。f、g中的P值通过单因素方差分析(ordinary one-way ANOVA)结合图基多重比较检验(Tukey’s multiple comparisons test)计算得出。
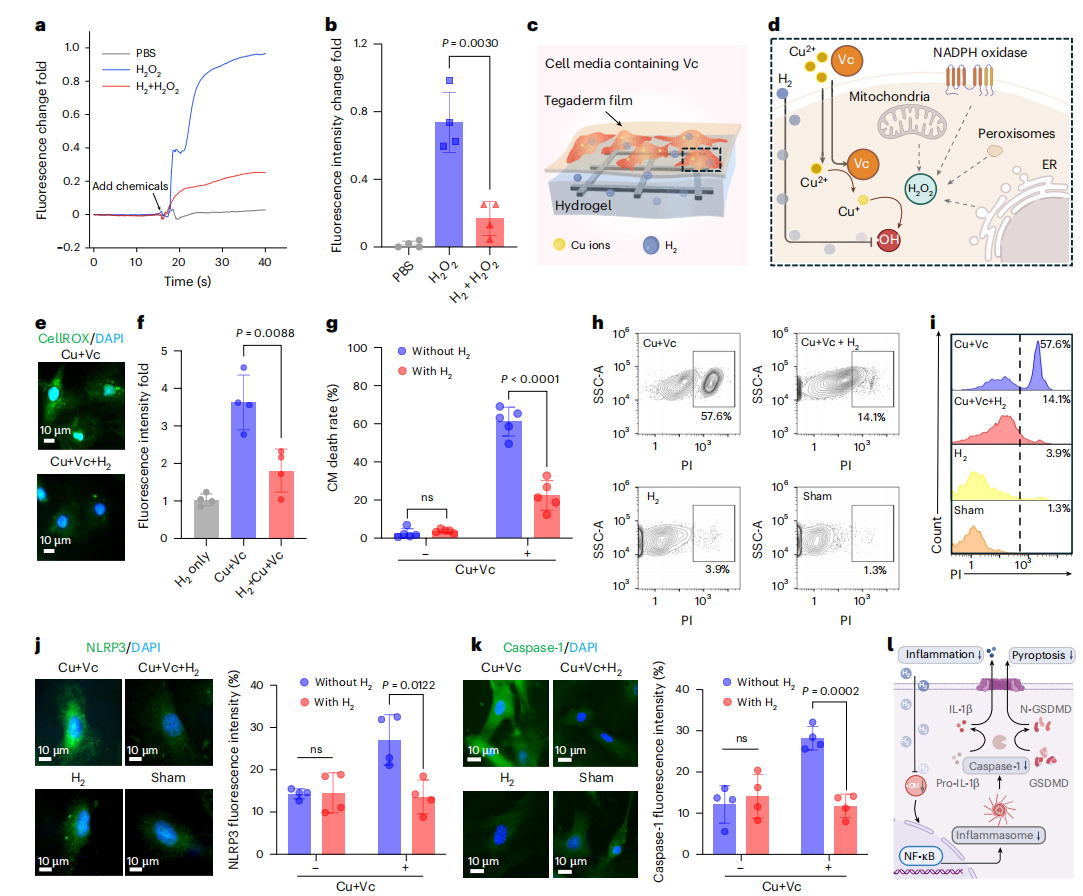 图3 | 水凝胶电化学电池递送氢气缓解无细胞系统及体外细胞环境中的氧化损伤
图3 | 水凝胶电化学电池递送氢气缓解无细胞系统及体外细胞环境中的氧化损伤
a、b. 无细胞系统中芬顿反应产生的羟基自由基(•OH)水平(有无氢气预处理):a为荧光强度倍数变化图,b为荧光强度倍数变化定量结果(独立实验,样本量n=4)。H₂O₂组与H₂+H₂O₂组的P值=0.0030。荧光强度通过羟基苯基荧光素检测得出。H₂+H₂O₂组在加入过氧化氢(H₂O₂)前,先用钛网-水凝胶装置进行30分钟氢气预处理。
c. 钛网-水凝胶电化学电池产生氢气,清除心肌细胞(CMs)中铜基芬顿反应生成的活性氧(ROS)的示意图。
d. 铜基芬顿反应机制图:将细胞内过氧化氢转化为羟基自由基,诱导氧化应激。
e. CellROX染色结果显示,氢气处理可降低铜基芬顿反应诱导的心肌细胞内活性氧水平。
f. 经铜离子+维生素C(Cu+Vc)处理的心肌细胞(有无氢气预处理)中CellROX荧光强度的定量结果(独立实验,样本量n=4)。Cu+Vc组与H₂+Cu+Vc组的P值=0.0088。
g. 通过碘化丙啶(PI)/霍奇斯特(Hoechst)染色评估有无Cu+Vc及氢气处理的心肌细胞存活率:根据染色图像对细胞存活率进行定量(独立实验,样本量n=5)。无Cu+Vc时,有无氢气处理组的P值=0.3411;有Cu+Vc时,有无氢气处理组的P值<0.0001。
h. 有无Cu+Vc及氢气处理的心肌细胞中,PI染色的侧向散射面积(SSC-A)流式细胞术分析结果。
i. 与h中数据对应的心肌细胞PI染色流式细胞术直方图。
j. 有无Cu+Vc及氢气处理的心肌细胞中NLRP3(核苷酸结合寡聚化结构域样受体蛋白3)免疫荧光染色结果:右侧为NLRP3表达的荧光定量分析(独立实验,样本量n=4)。无Cu+Vc时,有无氢气处理组的P值=0.9298;有Cu+Vc时,有无氢气处理组的P值=0.0122。
k. 有无Cu+Vc及氢气处理的心肌细胞中半胱天冬酶-1(caspase-1)免疫荧光染色结果:右侧为caspase-1表达的荧光定量分析(独立实验,样本量n=4)。无Cu+Vc时,有无氢气处理组的P值=0.5948;有Cu+Vc时,有无氢气处理组的P值=0.0002。
l. 氢气处理对炎症小体表达及caspase-1活性影响的示意图,突出其对细胞炎症反应与存活率的作用。
数据以“平均值±标准差”表示。g、j、k中的P值通过双样本t检验(two-tailed,双侧检验)计算得出;b、f中的P值通过单因素方差分析结合图基多重比较检验计算得出。d、l图通过BioRender.com绘制。
膜电极组件-水凝胶(MEA-水凝胶)递送氢气缓解心脏缺血再灌注损伤
为探究水凝胶生物电子装置在组织层面的治疗潜力,我们采用了临床相关的心肌缺血再灌注(I/R)损伤模型——该模型的特征是活性氧大量生成,且组织损伤加剧²⁶,²⁷。我们将膜电极组件-水凝胶设计为独立式水凝胶生物电子装置,无需外部参比电极与对电极(图4a,底部)。这套紧凑型系统的结构如下:在全氟磺酸(Nafion)质子交换膜的两侧分别设置钛-铂(Ti-Pt)与钛-氧化铱(Ti-IrO₂)网电极,所有组件均嵌入水凝胶基质中,最终形成可用于水分解的便携式生物电子装置(补充图31)。我们通过全面评估,证实了氧化铱催化剂的稳定性及析氧反应效率(补充图32)。质子通过质子交换膜传导,驱动阴极侧钛-铂电极产生氢气。在相应电极上电沉积铂与氧化铱,可提升电化学性能并降低阻抗(图4b及补充图33)。尽管水凝胶涂层会略微降低膜电极组件装置的性能,但它能提供有益的气体捕获与扩散特性——这对治疗性氢气递送至关重要。我们对膜电极组件-水凝胶装置的最大氢气储存容量进行了评估,证实其足以容纳5毫安电流充电6分钟所产生的氢气量(补充图34a)。我们进一步验证了该装置的重复产氢能力(补充图34b)与气体捕获效率:即使经过多次充电,水凝胶仍能保持约80%的气体捕获效率及稳定的力学性能(补充图34c、d及补充图35)。为评估装置的使用安全性,我们开展了明火暴露测试(补充视频7及补充图36):氢气产生后未观察到持续燃烧现象,表明水凝胶基质可通过不可燃的方式安全缓冲并释放氢气。
我们采用Langendorff缺血再灌注模型,评估了膜电极组件-水凝胶装置的治疗效果(图4a、c)²⁸。将充满生理盐水的球囊插入离体Langendorff心脏的左心室,以实时监测左心室压力(LVP)。心脏先用泰罗德(Tyrode’s)缓冲液灌注1小时,随后通过停止灌注30分钟诱导缺血损伤,再恢复灌注45分钟。缺血期间,将离体心脏置于Tegaderm腔室上,下方放置膜电极组件-水凝胶装置;通过5毫安电流短暂充电6分钟,在水凝胶内生成氢气,使其能持续释放至心脏组织中。我们利用Tegaderm腔室内的3D扫描大鼠心脏模型进行氢气扩散模拟,结果显示:在30分钟缺血期内,与Tegaderm薄膜接触的心脏区域可获得大量氢气(补充图37),而这些氢气能够清除再灌注后激增的局部羟基自由基类活性氧²⁶,²⁹。缺血再灌注损伤后,用氯化三苯基四氮唑(TTC)对心脏切片进行染色以检测梗死区域,结果显示:与未接受氢气处理的对照组相比,氢气处理组心脏的梗死面积显著减小(图4d、e)。
功能评估结果进一步证实了上述组织学发现。左心室压力测量与频谱分析显示:氢气处理组心脏在再灌注开始后3分钟内,即可恢复规律的收缩活动,不仅收缩压力强劲,收缩周期也保持稳定(图4f、g)。再灌注45分钟后,氢气处理组心脏的心率、左心室压力及心电图(ECG)模式均与健康的损伤前对照组接近;而未处理的缺血再灌注心脏则表现出心律失常与收缩力减弱(图4i)。为验证该方法的实用性,我们进一步证实:该装置可附着于心脏外膜,向心脏组织递送氢气并改善心脏功能(补充图38)。
为直接评估电传导情况,我们采用柔性16通道微电极阵列记录心外膜电位(图4h)。再灌注后的等时线图显示:缺血再灌注心脏的激活显著延迟,而氢气处理组心脏的电传导模式延迟时间更短(图4i)。
综上,这些结果证实:通过膜电极组件-水凝胶生物电子装置产生的氢气,能够有效保护心脏免受缺血再灌注损伤。该治疗方法可减小梗死面积、促进心脏收缩功能恢复并修复电传导。这些进展凸显了该装置作为临床相关生物电子解决方案的潜力——可用于治疗氧化应激诱导的心脏损伤,对患有严重冠状动脉疾病或需接受大型心脏手术等心脏组织损伤高风险患者具有重要价值³⁰。
便携式H-Pad递送氢气治疗缺血再灌注性皮肤压疮
压疮(褥疮)是全球范围内的医疗挑战,会给患者带来严重不适并降低生活质量,但这一并发症在公共卫生领域受到的关注相对有限。尽管新型敷料与治疗方法不断发展,但其额外获益有限,且压疮治疗仍存在方案模糊、耗时久等问题,因此迫切需要改进预防与治疗策略³¹。本研究在此背景下,提出了一种用于减轻压力性损伤、改善临床预后的水凝胶生物电子装置。
压疮的病理生理机制与机械负荷(如压力、剪切力、摩擦力)及长期制动相关,这些因素会导致血流受限与局部缺血³²。缺血会损害线粒体电子传递链,引发活性氧大量生成;当患者改变体位、血流恢复时,再灌注会进一步加剧活性氧的产生³³。活性氧的激增会突破组织的抗氧化防御系统,引发氧化应激与炎症反应,干扰细胞因子信号传导并延缓伤口愈合,最终导致组织坏死。
为开发具有临床转化价值的解决方案,我们研发了H-Pad系统(图5)——这是一种可持续的氢气递送平台,将膜电极组件-水凝胶与柔性无线印刷电路板(PCB)集成在一起。该印刷电路板可实现稳定的电流输出、电压测量及基于蓝牙的通信功能(图5a、b及补充图39、40)。印刷电路板的功能框图(图5a及补充图41)包含一枚微芯片,可控制数模转换器并通过豪兰(Howland)电路调节电流,从而实现氢气的可控生成。
我们采用已报道的实验方案在小鼠背部皮肤诱导压疮³⁴:通过两块磁铁压迫皮肤6小时,随后移除磁铁以诱导缺血再灌注损伤(图5c及补充图42)。实验组(氢气组,5只小鼠)接受H-Pad治疗(图5d),对照组(5只小鼠)仅覆盖Tegaderm薄膜。我们开发了一个用户界面(补充图43)以控制系统:在损伤后最初36小时内,每12小时施加5毫安电流、持续6分钟,共重复3次(补充图42)。该治疗方案专门针对再灌注后活性氧激增的关键时期。通过观察聚酰亚胺(PI)薄膜下方产生的气泡,可直观确认氢气正在主动生成(图5c)。在Tegaderm薄膜的保护下,水凝胶不会发生溶胀(因该薄膜具有防水性,补充图44)。
对伤口进行7天的评估发现:氢气处理组的伤口在第2天和第4天出现短暂发红,随后伤口面积缩小并逐渐愈合(图5e、h);而对照组伤口则表现出进行性苍白、环状炎症及坏死。热成像结果显示,氢气处理组伤口的局部温度更高(图5f、g及补充图45),表明该组的组织灌注与代谢功能得到改善。苏木精-伊红(H&E)染色结果显示,氢气处理组与对照组在组织结构和炎症反应方面存在显著差异(图5i):对照组表现出严重的真皮与表皮损伤,伴有大量水肿和液体渗出,提示炎症反应加剧;而氢气处理组的组织损伤明显减轻,水肿消退,炎性病灶缩小(图5k及补充图46),真皮厚度增加(图5j),且可见表皮再生迹象(补充图47)。
为评估单纯电刺激是否对观察到的治疗效果有贡献,我们增设了第二个对照组:将不含电催化剂的膜电极组件-水凝胶装置置于皮肤表面,在损伤后最初36小时内,每12小时施加2伏外部恒定电压、持续6分钟,共重复3次。结果显示,无催化剂膜电极组件组的伤口愈合情况与未处理对照组相似,包括皮肤进行性苍白、红色炎性环形成及皮肤表面温度显著降低;组织学分析进一步显示该组炎性病灶更大、真皮更薄,表明在无氢气生成的情况下,装置无保护或再生作用(补充图48)。
CD4免疫组化染色结果显示,氢气组的CD4⁺T细胞数量更少,提示炎症反应减轻(图5l、m及补充图49);而CD31免疫组化染色结果显示,氢气处理组组织中的新生血管显著增多(图5n、o及补充图49)。对氧化应激信号下游靶点NQO1(醌氧化还原酶1)的进一步染色显示,与对照组相比,氢气组的NQO1信号显著降低,这表明氢气递送可有效缓解活性氧诱导的应激反应(补充图50)。
综上,这些结果证实:基于氢气的治疗可减轻活性氧诱导的损伤、缓解炎症反应并促进血管生成,为压疮治疗提供了一种具有潜力的干预手段。
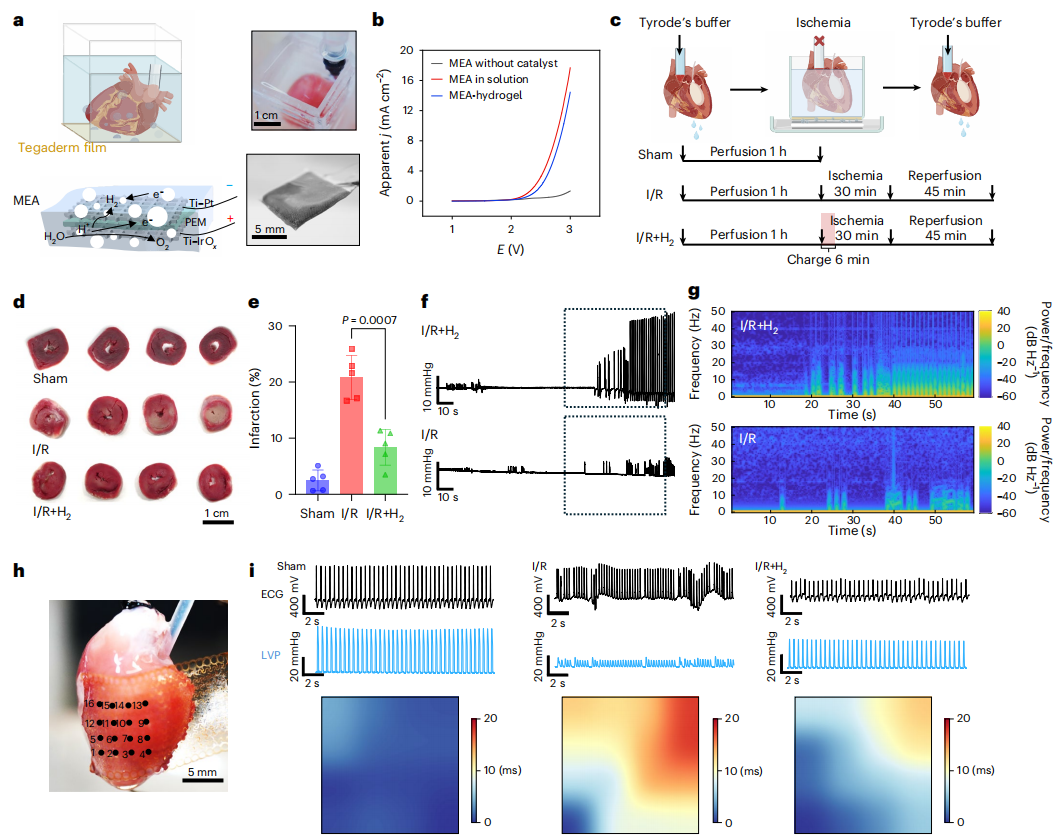
图4 | 膜电极组件-水凝胶递送氢气保护离体心脏组织及功能免受缺血再灌注损伤
a. 膜电极组件-水凝胶装置的示意图及实物图,以及用于产生氢气治疗离体缺血心脏的实验装置。
b. 三种膜电极组件样本(未电沉积铂或氧化铱、浸泡于硫酸钠溶液、涂覆3%聚乙烯醇水凝胶)在1伏至3伏电压范围内的线性扫描伏安曲线。图中绘制了表观电流密度与阴阳两极间电压的关系。
c. 离体大鼠心脏的实验装置与方案。氢气治疗步骤:将离体大鼠心脏浸泡在37°C的泰罗德缓冲液中以维持生理温度,置于Tegaderm薄膜上;在缺血开始时,将膜电极组件-水凝胶装置置于Tegaderm薄膜下方,以5毫安电流充电6分钟。
d. 氯化三苯基四氮唑(TTC)染色心脏切片的代表性图像。白色区域表示梗死面积。
e. 各组梗死面积的定量结果(独立实验,样本量n=5)。数据以“平均值±标准差”表示。P值通过单因素方差分析结合图基多重比较检验计算得出。缺血再灌注组与缺血再灌注+氢气组的P值=0.0007。
f. 再灌注开始后,有无氢气处理的离体大鼠心脏左心室压力(LVP)测量结果(独立实验,样本量n=3)。
g. f中虚线框标注的左心室压力信号的频谱图。
h. 用于记录离体大鼠心脏心电图的多通道电极阵列实物图。
i. 假手术组、缺血再灌注组及氢气处理缺血再灌注组心脏的左心室压力、心电图及心电图传导延迟记录结果(独立实验,样本量n=3)。
a、c图通过BioRender.com绘制。
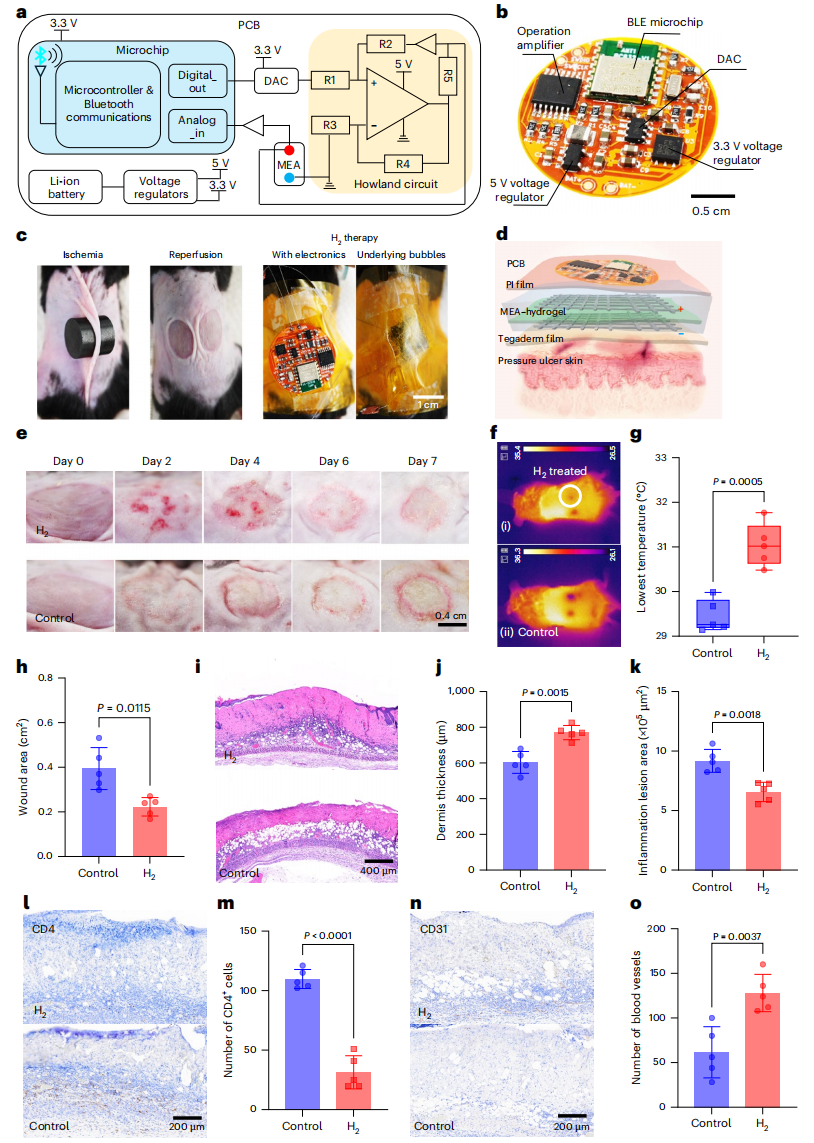
图5 | 利用便携式H-Pad生物电子装置递送氢气(H₂)在体治疗缺血再灌注(I/R)性皮肤压疮
a. 印刷电路板(PCB)主要组件的功能框图。
b. 印刷电路板上的主要组件。BLE:低功耗蓝牙(Bluetooth Low Energy)。
c. 展示缺血、再灌注及氢气治疗操作过程的数字图像。
d. 用于治疗皮肤压疮的H-Pad系统。从下至上依次为:Tegaderm薄膜、膜电极组件-水凝胶(MEA–hydrogel)装置、聚酰亚胺(PI)薄膜及印刷电路板。
e. 不同时间点背部皮肤压疮的代表性图像。
f. 第7天氢气处理组与对照组的热成像图。
g. 第7天氢气处理组与对照组压疮部位的最低温度(独立实验,样本量n=5)。对照组与氢气组的P值=0.0005。
h. 第7天氢气处理组与对照组的伤口面积对比(独立实验,样本量n=5)。对照组与氢气组的P值=0.0115。
i. 苏木精-伊红(H&E)染色代表性图像显示,经氢气处理后,第7天小鼠皮肤的真皮厚度增加且水肿减轻。
j. 第7天氢气处理组与对照组背部压疮部位的真皮厚度(独立实验,样本量n=5)。对照组与氢气组的P值=0.0015。
k. 第7天氢气处理组与对照组背部压疮部位的炎性病灶面积对比(独立实验,样本量n=5)。对照组与氢气组的P值=0.0018。
l. 氢气处理后压疮组织的CD4组织化学染色结果显示,免疫反应得到调控且程度温和。
m. 第7天氢气处理组与对照组的CD4阳性细胞数量(独立实验,样本量n=5)。对照组与氢气组的P值<0.0001。
n. 氢气处理后压疮组织的CD31组织化学染色结果显示,新生血管形成增强。
o. 第7天氢气处理组与对照组的血管数量(独立实验,样本量n=5)。对照组与氢气组的P值=0.0037。
数据以“平均值±标准差”表示。g、h、j、k、m、o中的P值通过双样本t检验(双侧检验)计算得出。
讨论
本研究提出了一种基于水凝胶的电化学系统,该系统整合了可控析氢反应(HER)、局部气体储存与持续释放功能,为生物医学应用中的气体储存与传输提供了一个平台。研究揭示了水凝胶聚合物组成及力学性能对电化学动力学、气体形态与气体储存的影响。在体外实验中,该电化学结构可显著减少活性氧(ROS)损伤,提高氧化应激条件下心肌细胞(CMs)与角质形成细胞的存活率;在离体实验中,该系统可减轻缺血再灌注损伤心脏的心肌梗死程度,恢复心脏的电传导与收缩功能;在体内实验中,无线便携式H-Pad系统可在压疮模型中减轻皮肤损伤,改善组织代谢活性、减轻炎症反应并促进新生血管形成。
这些研究结果凸显了水凝胶电化学系统在持续递送治疗性化学物质方面的潜力。除氢气治疗外,该策略还可适用于其他生物活性气体(如氧气治疗³⁵,³⁶),或与载药水凝胶结合——通过物理包封或化学偶联方式,载药水凝胶可负载多种治疗剂,从而实现氢气与药物的可控、持续共释放。当前可穿戴与无线生物电子学、植入式燃料电池及生物传感平台的研究进展,可与该系统整合,以提供长期电源、监测皮肤代谢及评估治疗效果³⁷-³⁹。未来研究还可利用该电化学水凝胶平台,系统探究治疗性气体对纤维化信号通路的影响,这类研究或有助于明确电化学生成的氢气能否在慢性损伤模型中调控成纤维细胞活化或细胞外基质重塑。
由于长期住院或长期护理期间,卧床不动的患者常发生压疮(褥疮),因此具备可控氢气治疗递送功能的智能床垫,或可在减轻活性氧损伤、促进伤口愈合方面发挥作用。目前的研究方向正致力于将该装置扩展为电子治疗床垫:该床垫将氢气传感器与膜电极组件-水凝胶整合,纳入比例-积分-微分(PID)控制算法以实现闭环稳定氢气供应,并确保装置的长期运行稳定性。
https://wap.sciencenet.cn/blog-41174-1499033.html
上一篇:抑郁焦虑的共同神经环路
下一篇:世界首例:中国完成猪肺人体移植