博文
氢气吸入对蛛网膜下出血脑损伤的作用机制研究 日本
||
氢气吸入和鞘内硫酸镁通过抑制大鼠蛛网膜下腔出血模型中的皮质扩散去极化改善缺血
作者单位:a 国防医科大学神经外科,3-2 Namiki, Tokorozawa, Saitama 359-8513, 日本 b 国防医科大学研究所生物信息学和治疗系统部,3-2 Namiki, Tokorozawa, Saitama 359-8513, 日本 c 社会医疗法人慈泉会健冈德川医院神经外科,4-2692-1 Higashisayamagaoka, Tokorozawa, Saitama 359-1106, 日本
摘要
本研究调查了吸入氢气和鞘内硫酸镁是否能减轻大鼠蛛网膜下腔出血模型中的皮质扩散去极化和迟发性脑缺血。成年雄性大鼠通过一氧化氮合酶抑制和高钾应用诱发蛛网膜下腔出血,以引发皮质扩散去极化。动物被分配到假手术组、对照组、$\mathrm{H}_{2}$组、Mg组或联合$\mathrm{H}_{2}$和Mg治疗组。我们测量了直流电位、脑血流量、脑含水量、体重变化和神经学结果。与对照组相比,$\mathrm{H}_{2}$组和Mg组的总去极化和低灌注时间显著减少。联合治疗产生了类似的好处。$\mathrm{H}_{2}$单独快速缩短去极化持续时间,表明它可能在Mg效应完全显现之前提供神经保护。两种治疗均未改变生理参数、脑含水量、体重或神经功能缺损。这些发现表明,$\mathrm{H}_{2}$和Mg减少了与蛛网膜下腔出血后早期脑损伤和迟发性脑缺血相关的关键病理生理过程,可能通过最小化去极化事件和相关缺血来改善结果。$\mathrm{H}_{2}$治疗可能在Mg发挥作用之前提供早期保护作用。
引言
蛛网膜下腔出血(SAH),主要由脑动脉瘤破裂引起,预后不良,死亡率在30%到40%之间。SAH后,早期脑损伤(EBI)开始,随后可能导致迟发性脑缺血(DCI),导致严重并发症或死亡[1]。EBI的病理生理学关键因素包括儿茶酚胺激增、颅内压增高、颅内低灌注、微循环衰竭、炎症反应和皮质扩散去极化(CSD)。CSD是中枢神经系统内神经元和胶质细胞的去极化波,与EBI和DCI的发展密切相关[2, 3]。大约80%的患者在SAH后15天内出现CSD[4]。此外,如果在发病后24小时内去极化总持续时间超过180分钟,迟发性梗死的可能性增加到大约80%[4]。
CSD是中枢神经系统内传播的去极化事件[5-9]。在SAH的背景下,红细胞泄漏的血红蛋白和钾引发神经元和胶质细胞内快速的离子流入和流出,导致膜电位几乎完全丧失[5-9]。因此,复极化,或膜电位的恢复,需要大量的能量[5-9]。此外,SAH中的CSD已被证明会促进皮质扩散缺血(CSI),进一步加剧脑损伤[7, 10, 11]。这一过程与CSD期间的神经血管反应密切相关,通常称为神经血管耦合(NVC)[12-15]。CSD发作时,健康和病理脑组织中的脑血管反应不同。在健康组织中,血流通常增加,而在病理条件下,如SAH,血流通常显著减少[6, 11, 16-18]。这种减少的血流被认为会加剧持续的脑缺血并延长CSD的持续时间[19-22]。延长的CSD持续时间可能会随后增加线粒体内活性氧(ROS)的产生,从而加剧组织损伤[23, 24]。
氢气以其强大的抗氧化作用和快速穿透组织的能力而闻名,使其作为生物系统中的自由基清除剂高度安全有效[25]。相比之下,镁作为一种N-甲基-D-天冬氨酸(NMDA)受体拮抗剂并具有血管扩张特性,已被报道在蛛网膜下腔出血大鼠模型中通过鞘内给药有效抑制CSD和CSI[26]。此外,研究表明,鞘内给予镁溶液与静脉内给予氢溶液相结合,可减少严重SAH后患者的DCI并改善功能结果。然而,镁需要2-3天才能在脑脊液中达到有效浓度[27]。这表明,尽管镁达到有效浓度,氢气仍然有效,因为它是一种小分子,可以迅速扩散。据报道,氢气在EBI期间(发病后几分钟到72小时内)达到治疗浓度[25],可能通过减少CSD后的ROS来抑制EBI。然而,还没有研究量化氢气对CSD和脑血流量(CBF)的影响。本研究的目的是检查氢气吸入对模拟SAH大鼠模型中CSD和CSI的影响,以及与鞘内镁给药联合使用的附加效果。
方法
研究设计
本研究中的所有实验程序均获得机构动物护理委员会的批准(批准号21057)。成年雄性Sprague-Dawley大鼠,年龄8-12周,体重300-400克(日本SLC,静冈县),饲养在有12小时光照/黑暗周期的动物房中,并提供无限量的食物和水。使用加热垫将它们的直肠温度维持在37.5±0.5°C。使用Dreier等人[28]先前描述的方法建立了大鼠SAH模拟模型。使用L-NG-硝基精氨酸甲酯(L-NAME)和高钾溶液模拟SAH后脑环境,其特征是脑池空间中一氧化氮(NO)减少和钾浓度升高,这两者都已知会诱发CSD。研究中使用的人工脑脊液(ACSF)由ARTCEREB(大冢制药,德岛县鸣门市)组成,成分包括Na+ 145 mM,K+ 2.8 mM,Mg2+ 1.1 mM,Ca2+ 1.15 mM,Cl- 129 mM,HCO3- 23.1 mM,P 1.1 mM,和葡萄糖3.39 mM。L-NAME + [K+] ACSF溶液包含ACSF、1 mM L-NAME和35 mM K+(KCl)。L-NAME + [K+]ACSF + [Mg2+]组的溶液包括L-NAME + [K+] ACSF和额外的5 mM Mg2+(MgSO4)。1.3% H2气体(氢气与21%氧气和平衡氮气混合)购自Taiyo Nippon Sanso JFP Corporation(神奈川县)。1.3% H2气体通过呼吸机控制给药。这种治疗在SAH发作当天(第0天)开始,针对氢气给药组(H2和H2+Mg组),如下所述。
最初的实验组由30只大鼠组成;然而,由于程序中的意外脑损伤排除了两只,剩下总共28只。这些被分为五组:假手术组(假手术组;六只大鼠),L-NAME+[K+]ACSF(对照组;六只大鼠),L-NAME+[K+]ACSF+[Mg2+](Mg组;五只大鼠),L-NAME+[K+]ACSF+[H2](H2组;五只大鼠),和L-NAME+[K+]ACSF+[H2]+[Mg2+](H2+Mg组;六只大鼠)(图1)。
麻醉和手术程序
大鼠用3%异氟醚在79%氮气和21%氧气的混合气体中麻醉。麻醉后,腹腔注射布比卡因(0.01 mg/kg)进行疼痛管理。连续监测动脉血压,并通过尾动脉中段插管采集血液样本。手术后和随后的CSD诱导后,测量动脉血气,包括pH值、PaCO2和PaO2。在给予维库溴铵(0.15 mg/kg)后,进行气管插管。大鼠被放置在机械通气上,麻醉维持使用1.5-2%异氟醚。对于手术
大鼠用3%异氟醚在79%氮气和21%氧气的混合气体中麻醉。麻醉后,腹腔注射布比卡因(0.01 mg/kg)进行疼痛管理。连续监测动脉血压,并通过尾动脉中段插管采集血液样本。手术后和随后的CSD诱导后,测量动脉血气,包括pH值、PaCO2和PaO2。在给予维库溴铵(0.15 mg/kg)后,进行气管插管。大鼠被放置在机械通气上,麻醉维持使用1.5-2%异氟醚。对于手术
总共 (n= 30) 因脑损伤排除 (n= 2) 创建颅窗 鞘内冲洗 (30 min) 室内空气 H2气体 acsf 假手术组 对照组 Mg组 H,组 H, +Mg组 (n=6) (n= 6) (n= 5) (n= 5) (n=6) 鞘内冲洗 (30 min) acsF L-NAME + acse L-NAME + [K\*) ac:se [mg2+】 L-NAME acse L-NAME + [K] ACSe + [Mg2+] 通过1m KCi诱导CSD 鞘内冲洗 (60min) DC电位和CBF测量 完成测量
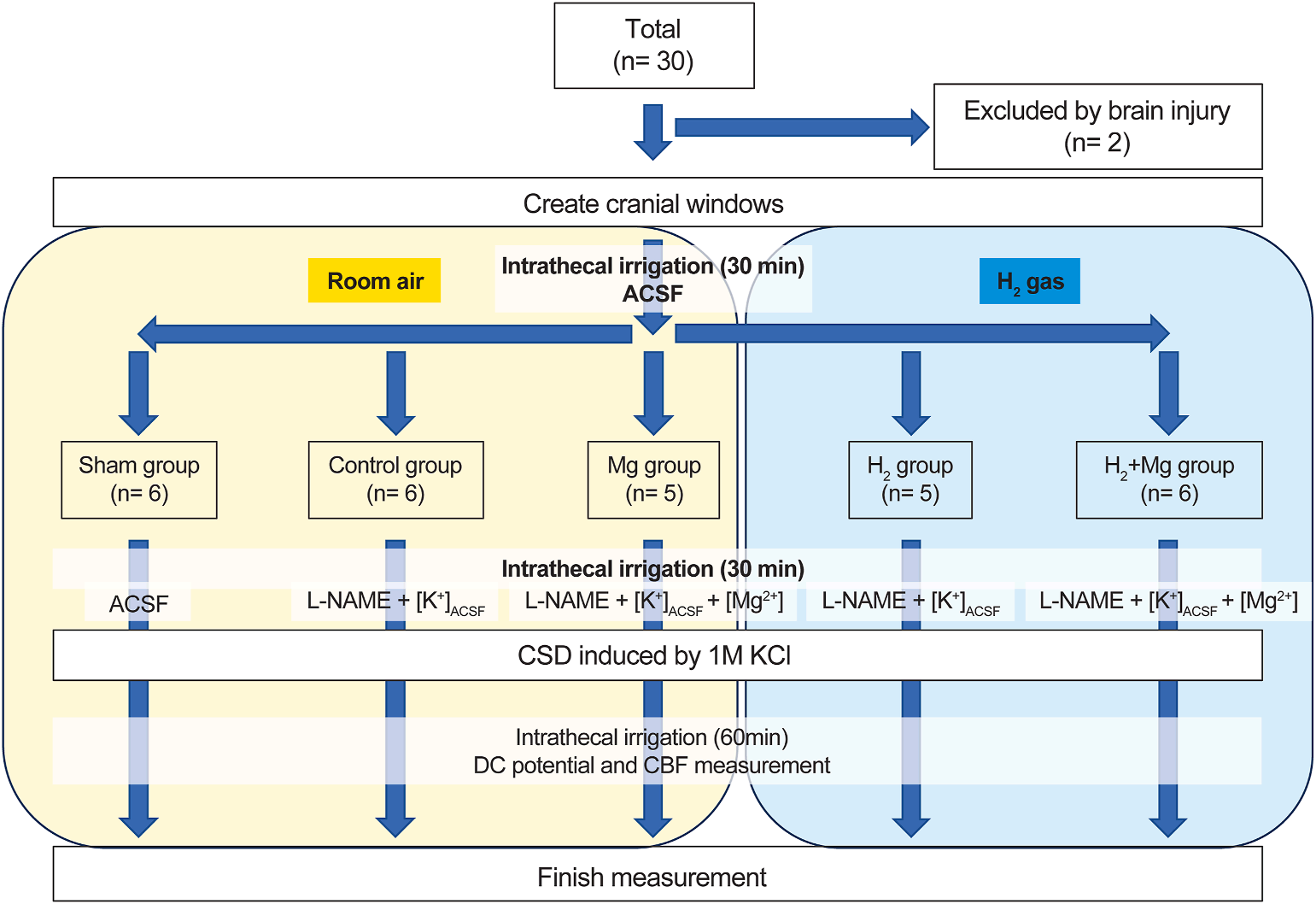
图1. 研究设计。大鼠被分为五组(假手术组、对照组、Mg组、H2组和H2+Mg组)。
手术后,大鼠的头部被固定在立体定向框架上,并在中线做一个1.5厘米的切口,露出前囟和后囟参考点。
如前所述[26],通过颅窗和在顶叶皮层上钻的两个钻孔获得大脑通路。具体来说,在前囟后1毫米处制作一个3×2毫米的椭圆形钻孔,而在后囟侧3毫米处放置一个直径为2毫米的圆形钻孔。此外,在后囟前1毫米和侧3毫米处创建一个3毫米的颅窗。椭圆形钻孔用于测量直流(DC)电位,圆形钻孔用作放置浸有KCl溶液的棉球的部位以诱导CSD,颅窗用于冲洗和测量CBF。在圆形钻孔和颅窗下方的硬脑膜被移除后,后者用盖玻片密封以创建封闭的颅窗。通过椭圆形钻孔将一个尖端直径为1.5毫米的Ag-AgCl电极放置在皮层表面以记录细胞外DC电位。封闭窗口下方的皮层表面连续用ACSF冲洗30分钟。然后进行三种不同的冲洗方案:单独的ACSF(假手术组)、L-NAME+[K+]ACSF(对照组和H2组)和L-NAME+[K+]ACSF+[Mg2+](Mg组和H2+Mg组),每种方案有30分钟的平衡期。
这之后是三种不同的冲洗方案:单独的ACSF(假手术组)、L-NAME+[K+]ACSF(对照组和H2组)和L-NAME+[K+]ACSF+[Mg2+](Mg组和H2+Mg组),每种方案有30分钟的平衡期。CBF通过激光散斑血流仪(OZ-2;Omegawave,东京,日本)在封闭颅窗的中心测量,指定为感兴趣区域。在基线测量DC电位和CBF 10分钟后,通过在软脑膜表面应用一个浸泡在1 M KCl溶液中的2毫米直径棉球来诱导CSD,每20分钟补充5μL相同的溶液,持续1小时。在整个期间连续记录DC电位,并计数CSD事件的频率。将每次负DC偏移的持续时间汇总,以计算一小时内的总去极化时间。同时,连续监测CBF,注意表明CSI(皮质扩散性缺血)的间歇性减少(图2)。在这项研究中,将持续时间超过20分钟的CSI事件定义为长时间持续的CSI,这些事件被特别监测。实验结束后,用ACSF清洁软脑膜表面,并监测DC电位、CBF和血压。手术后,缝合切口部位,并将大鼠保持在通风设备上,直到它们从麻醉中完全恢复。拔管后,大鼠被放回它们的笼子,自由获取食物和水。
与实验性啮齿动物模型和SAH的临床研究中的后续脑组织损伤强烈相关的长持续时间CSI(皮质扩散性缺血),在这项研究中被定义为持续时间超过20分钟的CSI事件,这些事件被特别监测。实验结束后,用ACSF清洁软脑膜表面,并监测DC电位、CBF和血压。手术后,缝合切口部位,并将大鼠保持在通风设备上,直到它们从麻醉中完全恢复。拔管后,大鼠被放回它们的笼子,自由获取食物和水。
数据记录
使用直流放大器(DAM50;World Precision Instruments,萨拉索塔,佛罗里达州)放大KCl诱导的事件,并通过A/D转换器(型号ML825;AD Instruments,澳大利亚贝拉维斯塔)记录。包括体温、动脉血压和脑电图在内的数据通过数据采集系统连续记录,以便离线分析(PowerLab;AD Instruments)。如前所述,通过颅窗使用激光散斑血流仪记录CBF。图像采集和分析使用提供的软件(LSI-V314和LIA-V315;Omegawave)进行。
脑含水量
通过在CSD诱导后的第二天测量脑含水量来评估脑水肿。在吸入5%异氟醚深度麻醉后,迅速取出大脑。在前囟前1毫米和后囟侧3毫米处制备4毫米厚的冠状切片,对应于测量CBF的区域。仅对左半球的脑皮质进行取样。立即称重组织(湿重)。在105°C下脱水48小时后,再次称重样品(干重)。然后使用以下公式计算脑含水量:
脑含水量 (%) = [(湿重 - 干重) / 湿重] × 100
体重和神经功能缺损
在第0天和第2天记录体重,并使用公式计算体重减轻百分比:体重减轻 (%) = [(第0天体重 - 第2天体重) / 第0天体重] × 100。在第2天由独立观察者使用改良的Garcia评分系统评估神经功能[30]。评估包括以下参数:自发活动(0-3分)、攀爬(1-3分)、身体本体感觉(1-3分)和对胡须触碰的反应(1-3分)。动物得分在3到18分之间,分数越高表示功能越好。神经功能缺损使用以下公式计算:神经功能缺损 = 18(满分)- 第2天的神经功能评分。
定量和统计分析
所有统计分析均使用EZR(埼玉县医学中心,埼玉医科大学,埼玉县)进行,EZR是R(奥地利维也纳统计计算基金会)的图形用户界面。具体来说,它是R Commander的一个修改版本,旨在纳入生物统计学中常用的统计功能。数据以均值±标准误表示。所有值均使用单因素方差分析,然后进行Tukey-Kramer多重比较程序进行分析。统计显著性设定为P<0.05。
结果
生理参数
在任何手术过程中的任何时间点,各组之间的基线体重、平均动脉血压或血气(pH值、PaCO2、PaO2)均未观察到显著差异(表1)。
DC电位和CBF的变化
局部应用KCl在所有组中均诱导了负DC偏移和CBF变化。假手术组和H2组出现CSD诱导的皮质扩散性高灌注,而对照组和Mg组出现CSI。对照组中有一半观察到了长时间的CSI,但其他组没有(表2)。
CSD事件的发病率
在1小时期间内,假手术组的平均CSD事件数为6.2 ± 1.01,对照组为5.0 ± 0.37,H2组为6.8 ± 0.97
CSD事件的发病率
在1小时期间内,假手术组的平均CSD事件数为6.2 ± 1.01,对照组为5.0 ± 0.37,H2组为6.8 ± 0.97
图3. 镁(Mg)和氢气(H2)治疗对直流电位(DC)和脑血流量(CBF)的影响。蓝线表示DC电位,橙线表示CBF,黑色虚线表示基线CBF。皮质扩散去极化(CSD)的发生由黑色箭头指示。假手术组出现CSD诱导的皮质扩散性高灌注,其他组出现皮质扩散缺血(CSI)。对照组中有一半观察到了长时间的CSI(*),但其他组没有。
表2 长时间皮质扩散缺血的发生率。
在H2+Mg组中,CSD事件的数量显著高于对照组(P<0.05)。尽管H2组和Mg组的CSD事件数量高于对照组,但差异未达到统计学意义。
在H2组和H2+Mg组中,CSI事件的数量低于对照组,但未达到统计学意义。
CSI事件在H2组和H2+Mg组中的数量低于对照组,但未达到统计学意义。
总去极化时间
假手术组的总去极化时间为666±170秒,对照组为2389±305秒,H2组为1262±162秒,Mg组为633±57秒,H2+Mg组为778±283秒(图6)。对照组的总去极化时间显著长于假手术组(P<0.05),而H2、Mg和H2+Mg组的总去极化时间显著短于对照组(P<0.05)。假手术组、H2组、Mg组和H2+Mg组之间没有显著差异。
总低灌注时间
假手术组的总低灌注时间为510±405秒,对照组为2033±239秒,H2组为1263±293秒,Mg组为182±182秒,H2+Mg组为456±211秒(图7A)。Mg组、H2+Mg组和假手术组的总低灌注时间显著短于对照组(P<0.05)。如前所述,对照组中有一半观察到了长时间的CSI,但H2、Mg或H2+Mg组中没有。最大CBF降低率在各组之间没有显著差异(图7B)。
脑含水量
假手术组的脑含水量最低,而对照组的脑含水量最高(图8A)。然而,各组之间没有显著差异(P=0.675)。
脑含水量
假手术组的脑含水量最低,而对照组的脑含水量最高(图8A)。然而,各组之间没有显著差异(P=0.675)。
体重减轻和神经功能缺损
H2+Mg组的体重减轻最少,尽管各组之间没有显著差异(图8B,P=0.906)。H2组和H2+Mg组的神经功能缺损低于其他组。然而,各组之间没有显著差异(图8C,P=0.402)。
讨论
在本研究中,Mg、H2和H2+Mg组的总去极化时间显著短于对照组(图6)。此外,Mg、H2和H2+Mg组的CBF中没有观察到长时间的CSI(图3)。这些发现表明,镁和氢气单独有效地通过减少持续去极化来抑制长时间的CSI。已经证明,SAH中的CSD通过延长去极化和升高的细胞外钾离子浓度诱导扩散性缺血,导致能量代谢失衡。这种失衡是由于氧化底物(如葡萄糖)减少和能量需求增加所致。因此,神经元中的Na-K泵受到抑制,触发了一个恶性循环,即钙流入线粒体、ROS产生增加和ATP合成减少,从而持续神经元去极化和加剧扩散性缺血[6, 23, 24]。在本研究中,氢气减少了总去极化时间,可能改变了血流对正常NVC的反应,并防止了可能对EBI和DCI有贡献的长时间CSI。氢气的主要作用是对ROS和活性氮物种(RNS)的抗氧化作用。
氢气的主要作用是对ROS和活性氮物种(RNS)的抗氧化作用。据报道,氢气还具有多效性作用,如调节小胶质细胞活性和抑制炎性细胞因子,这些作用被认为直接或间接地形成药理效应[31],并且已经发表了多篇关于氢气减少EBI的报告[32-35]。然而,还没有关于氢气对总去极化时间影响的报道。据作者所知,本研究是首次报告氢气对总去极化时间和CSI的影响,为减轻EBI提供了新的见解。
有趣的是,作为鞘内镁给药的添加剂,H2+Mg组中的CSD事件数量显著高于对照组(图4)。这一发现表明,除了上述氢气的作用外,镁的血管收缩抑制作用可能有助于阻止CSD后的恶性循环。换句话说,通过抑制持续去极化和改善能量代谢,它们的联合作用可能促进了组织从一个不应期状态——由于CSD期间或之后的代谢和离子紊乱,大脑皮层对后续刺激的反应性降低——转变为一个组织再次响应的状态,使得另一次去极化事件能够发生。在本研究中,Mg组的CSI事件数量显著低于对照组(图5),Mg和H2+Mg组的总低灌注时间显著短于对照组(图7A)。长时间CSI的发生也被抑制,这表明镁
图8. (A) 各组之间的脑含水量没有显著差异。 (B) 任何组之间的体重减轻都不显著。 (C) 任何组之间的神经功能缺损都不显著。
改善CBF,如前所述[26]。关于镁,其作为NMDA型谷氨酸受体拮抗剂和血管扩张剂的作用已在动物缺血模型中显示出减少梗死面积和改善的潜力
CSD在动物缺血模型中的潜力[36-38]。镁在大脑和小动脉中作为血管扩张剂[39],并作为具有抗血小板特性的钙通道阻滞剂发挥作用。此外,据报道,它通过抑制谷氨酸释放和阻断NMDA受体来保护神经元[39-42]。先前的研究表明,鞘内给予镁溶液可减少严重动脉瘤性SAH后患者的DCI并改善功能结果[27,43]。然而,应该考虑到,鞘内给药可能需要时间才能达到有效的治疗浓度,如后文所述。
在本研究中,各组之间的脑含水量没有显著差异,脑含水量是EBI的一个关键病理,也是脑水肿的衡量标准。然而,与对照组相比,H2和Mg治疗组的脑水肿似乎较轻。所有组的脑含水量值与之前研究中的报告一致[28,33,44]。观察到的抗水肿效应可能归因于氢气和镁的NMDA受体抑制效应的综合减少效应。在这个模型中,通过灌注程序在大脑皮层的局部区域诱导了SAH模拟环境,这可能解释了各组之间脑含水量没有统计学显著差异的原因。
本研究中使用的SAH模拟大鼠模型通过给予L-NAME和高钾溶液,模拟SAH后大脑环境,通过降低脑池中的NO浓度和增加钾浓度。其他常用的SAH模型包括向脑池内自体输血或穿刺脑动脉。然而,我们的模型具有优势,因为它再现了局限于大脑皮层的局部SAH环境,提供了更大的稳定性,受试者之间的损伤严重程度变化较小。尽管如此,重要的是要注意,这个模型并没有复制整个脑池的SAH。因此,与完整的SAH模型相比,损伤的严重程度较轻,这可能解释了体重减轻和神经功能方面没有显著差异的原因。
CSI波形与我们之前使用相同模型报告的典型模式不一致[26]。这种差异可能是由于ACSF和[K+]ACSF溶液的离子组成存在细微差异。
DC电位在与灌注部位不同的位置测量,这意味着KCl诱导的CSD和源自灌注部位的CSD都可能被记录[45]。然而,由于CBF是在灌注部位直接测量的,并且在H2和Mg给药后观察到长时间的CSI抑制,这些发现表明H2和Mg通过在灌注部位抑制持续去极化来改善NVC,从而恢复皮层兴奋性,使组织更容易发生后续的CSD事件。
基于本研究的发现,氢气疗法作为SAH的下一代治疗策略前景广阔。尽管氢气的抗氧化能力低于众所周知的抗氧化剂维生素C,但氢气选择性地中和高反应性和细胞毒性的自由基,如羟基自由基和过氧亚硝酸盐,这些是ROS/RNS中最具破坏性的。值得注意的是,氢气不与发挥生理作用的ROS/RNS(如过氧化氢和一氧化氮)相互作用[46]。此外,氢气易于给药且成本效益高,使其成为SAH急性期患者的可行治疗方法。由于其高组织扩散性,氢气不仅可以通过吸入给药,还可以通过口服富氢水或静脉给药等其他途径给药,进一步支持其临床应用[46]。目前正在对SAH患者进行氢气吸入的临床试验[47]。尽管镁疗法已被证明可以抑制DCI,但镁通常需要2-3天才能在脑脊液中达到有效浓度[27]。相比之下,氢气几乎可以立即达到治疗浓度[25],并且可能通过抑制持续
https://wap.sciencenet.cn/blog-41174-1488197.html
上一篇:分子动力学研究揭示本体氢纳米气泡在水和甲醇中的稳定性
下一篇:氢水的临床研究小结