博文
人工膨胀的脑组织展示神经元如何连接  精选
精选
|
人工膨胀的脑组织展示神经元如何连接
一种用于追踪大脑中神经元连接的荧光显微镜方法,能够让神经科学家更广泛地开展连接组学研究。
绘制密集脑组织中错综复杂的细胞连接图,也就是连接组学,长期以来一直使用电子显微镜(EM)来完成。塔瓦科利(Tavakoli)等人在《自然》杂志上发表的研究表明,一种组织膨胀方法能够利用传统光学显微镜实现类似电子显微镜分辨率的连接组重建,并且还能获得有价值的分子信息。
了解神经元如何连接并交换信息以控制行为是神经科学的核心关注点。绘制大脑中所有神经元及其连接图,也就是达到突触分辨率的连接组学,从概念上讲很简单,但在技术上却极具挑战性。连接组对于从机制上理解大脑是否必要,甚至是否足够,仍然存在争议,但对于能够获取连接组的神经科学家来说,其在提出和检验假设方面的实用性很少受到质疑。通常,争论的焦点在于需要哪些现有知识来解释或模拟线路图。无论其最终影响如何,连接组学都将成为塑造本世纪神经科学的技术之一,因为它旨在精确测量大脑中那些从根本上重要的信息。
电子显微镜依靠电子束来形成图像。由于其出色的分辨率和通量,这种技术一直是连接组学的首选方法。要从一块脑组织中恢复连接组,必须追踪直径仅为50纳米的神经元突起(如轴突和树突),长度达数毫米甚至更长,同时不能将它们与附近其他神经元的突起混淆。然而,电子显微镜有一个主要局限性:它很难揭示所成像结构的分子组成,至少使用连接组学常用的方法是做不到的。为了克服这一缺点,塔瓦科利及其同事提出了基于光学显微镜的连接组学方法(LICONN),该方法利用传统荧光显微镜实现了类似电子显微镜的分辨率,同时还能捕获蛋白质身份等信息(图1)。
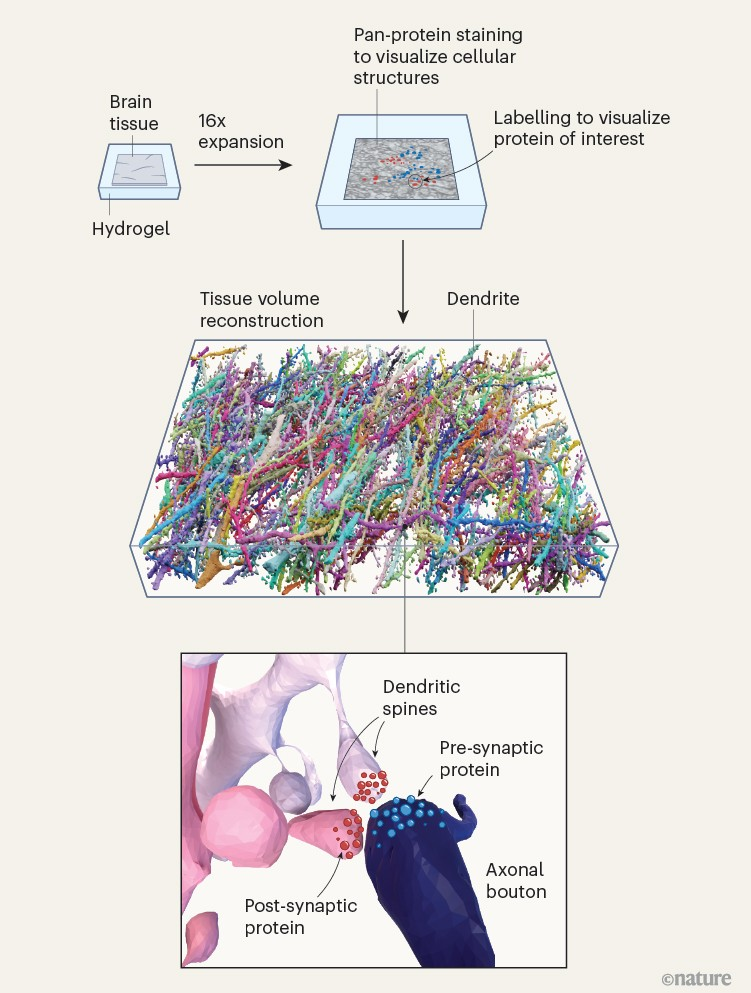
图1:基于光学显微镜的连接组学
塔瓦科利等人开发了一种追踪神经元及其连接的方法,与连接组学研究中常用的传统技术——电子显微镜相比,该方法具有优势。脑组织被嵌入一种聚合物水凝胶中,这种水凝胶在水中会膨胀,使组织增大到原来的16倍,同时保留蛋白质的相对位置。组织中的所有蛋白质都用荧光探针不加区分地进行标记,这样就可以用广泛使用的光学显微镜分辨细胞结构。与电子显微镜不同,这种方法能够同时标记感兴趣的特定蛋白质。作者利用机器学习工具,对密集的脑组织进行了三维重建,可视化了神经元突起,如树突和轴突,以及形成神经元之间通信连接(突触)的结构(树突棘和轴突终扣)。通过这种方法可以解析出有价值的分子信息,例如突触前和突触后终端存在哪些蛋白质。(改编自参考文献1的图2)
这一突破源于对 “膨胀显微镜” 的精心优化,这是2015年首次描述的一种技术。膨胀显微镜技术是通过将软生物标本中的蛋白质嵌入一种吸水膨胀的聚合物凝胶中,来物理性地扩大标本。随着水凝胶膨胀,蛋白质之间的相对位置大多得以保留。结果是细胞变得足够大,肉眼可见。
这一技巧有效地将共聚焦光学显微镜(许多神经科学实验室用于对荧光标记样本成像的标准设备)转变为具有纳米分辨率的仪器,使以前因太小而无法分辨的特征变得清晰可见。尽管膨胀显微镜的早期目标之一是用于连接组学,但在技术上,要达到足够高的图像分辨率(即每个三维像素或体素代表10至25纳米)以及组织保存质量,以便识别脑回路中的所有突触和神经元,仍然具有挑战性。在LICONN之前的重要进展包括开发创新的蛋白质标记策略,以可视化组织中的所有蛋白质,以及通过迭代水凝胶嵌入和膨胀来提高膨胀显微镜样本的放大倍数。
通过系统的化学方法和方案优化,塔瓦科利等人开发了一个两阶段膨胀过程,可将大脑和其他组织在各个方向上放大到原来的大约16倍,同时不破坏样本的形状和结构。在LICONN中,所有蛋白质都用荧光染料标记,尽管膨胀过程会导致信号大幅稀释,但仍能产生用于成像的高荧光信号强度。
高信号强度对于成像速度尤为重要,因为成像速度取决于驻留时间,即从单个像素捕获信息所需的时间。要以15纳米体素大小对整个500立方毫米的小鼠大脑进行成像,意味着需要对大约150千万亿(10¹⁵)个体素进行成像,因此为了使实验可行,成像速度必须非常快。作者表明,LICONN样本可以在标准的转盘共聚焦显微镜上以每秒1700万体素的通量进行成像。这仍然比最快的多光束扫描电子显微镜的通量(实际操作中每秒可达数亿体素)要慢,但比单光束扫描电子显微镜的速度略快。
自动重建,即追踪大脑中的神经元过程并识别突触连接,对于连接组学来说仍然是一个挑战。例如,2024年发布的果蝇(黑腹果蝇)连接组需要大量的人工校对工作。关键的是,LICONN似乎能够生成大型的脑组织三维图像,利用过去十年中为检测和分割电子显微镜图像中的结构而优化的机器学习方法,这些图像可以像电子显微镜图像一样进行自动追踪。
将结构信息和分子信息相结合的能力是LICONN的关键优势。虽然电子显微镜能提供精细的结构细节,但识别特定蛋白质通常需要复杂的关联方法来整合各种类型的数据。LICONN将分子标记无缝集成到工作流程中,使研究人员能够根据神经元表达的蛋白质(如神经递质受体)的组成来区分神经元和突触的类型。这为研究分子多样性与连接模式之间的关系开辟了新的可能性。它甚至可以让研究人员为每个神经元赋予一个独特的 “指纹” 或 “条形码”,以便更容易在细胞丛林中追踪该神经元。
然而,扩大这项技术的规模仍然面临挑战。物理膨胀过程使得分析大块组织变得困难:例如,将整个小鼠大脑放大16倍会产生一个至少以当前技术无法处理的标本。作者展示了一种可能的解决方案,即把膨胀后的样本切成小块,然后通过计算拼接在一起,但在不损失切片界面信息的情况下改进这一过程,对于大规模连接组学研究至关重要。此外,尽管自动重建算法有助于分析数据,但人工校对仍然是一个瓶颈,这也是电子显微镜连接组学面临的共同问题。
尽管存在这些局限性,LICONN仍是连接组学工具箱中的一项重要补充。它终于使光学显微镜能够进入连接组学的脑成像方法竞争领域,而在此之前该领域一直由电子显微镜方法主导。它以一种易于实现的方式结合结构和分子信息的能力,应该能够让许多实验室开展连接组学研究。技术上的改进以及计算分析的进步,可能会推动分子注释连接组的大量涌现,为理解神经回路功能提供新的见解,并推动神经科学领域的连接组学革命。
https://wap.sciencenet.cn/blog-41174-1485319.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:地球生物祖先靠氢气为生!