博文
氢气降低老年性痴呆动物毒性代谢物和氧化应激 韩国
||
氢气降低老年性痴呆动物毒性代谢物和氧化应激 韩国
摘要
阿尔茨海默病(AD)是一种神经退行性疾病,其中β-淀粉样蛋白(Aβ)斑块会引发氧化应激(OS)和神经炎症,导致记忆丧失。反应性星形胶质细胞也可能引发氧化应激和神经退行性变,通过星形胶质细胞尿素循环中有毒代谢物的积累促进阿尔茨海默病的发展。然而,分子氢(H₂)对该循环的影响尚不明确。因此,我们研究了氢气治疗是否能减轻氧化应激诱导的神经退行性变和记忆丧失。将5xFAD小鼠(n=14)和野生型小鼠(n=15)随机分为四组,分别用3%氢气(H₂)或溶媒处理60天。采用Morris水迷宫和Y迷宫实验评估小鼠的认知行为。此外,我们通过生化检测测量小鼠海马体和经AβO处理的原代小鼠星形胶质细胞中氨和过氧化氢(H₂O₂)的水平。利用免疫组织化学(IHC)和实时定量聚合酶链反应(qRT-PCR)评估Aβ、γ-氨基丁酸(GABA)以及炎症标志物的表达。我们发现,氢气处理显著改善了5xFAD小鼠的认知缺陷、氧化应激、有毒代谢物积累以及炎症标志物升高的情况。这些结果表明,氢气疗法可减轻星形胶质细胞尿素循环中的有毒代谢物,从而减少阿尔茨海默病中的神经退行性变和记忆丧失。
1. 引言
记忆障碍和神经退行性变是阿尔茨海默病(AD)的病理生理学特征,该病主要发生在65岁及以上人群中,构成了严重的公共卫生负担。在阿尔茨海默病中,β-淀粉样蛋白(Aβ)斑块(即不溶性Aβ纤维和 tau 缠结的大量沉积)在大脑中积累时,会引发氧化应激(OS)、炎症和细胞凋亡,因此它们是阿尔茨海默病发病机制的关键标志物[1,2,3]。氧化应激与神经退行性疾病(包括阿尔茨海默病、帕金森病和轻度认知障碍)的发病有关。它会破坏神经元脂质膜,导致与DNA损伤相关的细胞死亡,并通过蛋白质氧化机制进一步刺激Aβ的积累[4]。这些作用会造成神经元损伤,最终导致阿尔茨海默病相关的记忆丧失[5]和线粒体功能障碍[6,7,8],并导致细胞色素氧化酶活性缺陷和钙(Ca2⁺)信号改变[9,10,11]。同样,促凋亡标志物Bax可激活线粒体中的半胱天冬酶(如半胱天冬酶-3、-8和-9),通过凋亡促进神经退行性变[7]。氧化应激可通过核因子κB(NF-κB)和丝裂原活化蛋白激酶(MAPK)枢纽触发神经炎症,导致神经退行性变和阿尔茨海默病的发生[12]。
反应性星形胶质细胞也可能导致神经退行性变和记忆丧失[13]。随着氧化应激和亚硝化应激的增加,星形胶质细胞成为“双刃剑”,既具有神经保护作用,又会产生神经毒性[14]。这种神经毒性源于有毒代谢物的积累增加,从而增强了星形胶质细胞的反应性。氨等有毒代谢物会激活星形胶质细胞尿素循环,并触发腐胺、过氧化氢(H₂O₂)和γ-氨基丁酸(GABA)的合成[15,16]。在阿尔茨海默病中,细胞内积累的β-淀粉样蛋白(Aβ)可通过自噬-溶酶体途径清除,释放出天冬氨酸等氨基酸,这些氨基酸进入星形胶质细胞尿素循环,在精氨琥珀酸合成酶1的作用下转化为精氨琥珀酸。然后,在精氨琥珀酸裂解酶的催化作用下,精氨琥珀酸转化为精氨酸。精氨酸酶1(ARG1)将精氨酸转化为鸟氨酸,尿素作为废物释放。鸟氨酸在鸟氨酸脱羧酶1(ODC1)的作用下发生脱羧反应生成腐胺,腐胺经过一系列酶促转化,产生过氧化氢和氨作为副产物,最终生成γ-氨基丁酸。产生的氨与谷氨酸发生N-乙酰化反应,形成氨基甲酰磷酸。然后,鸟氨酸转氨甲酰酶(OTC)将氨基甲酰磷酸转化为瓜氨酸。瓜氨酸也可转化为精氨琥珀酸,从而使循环重复进行[13,17,18]。过氧化氢作为一种关键的活性氧(ROS),γ-氨基丁酸则分别促成神经退行性变和记忆障碍[18]。负责产生这些有毒代谢物的关键酶是精氨酸酶1、鸟氨酸脱羧酶1和鸟氨酸转氨甲酰酶[19]。
Ju等人阐明了反应性星形胶质细胞双重功能背后的分子机制,包括有益的尿素循环活性通路(可解毒Aβ分解代谢物)和有害的循环(会增加鸟氨酸脱羧酶1的表达,从而促进有毒的过氧化氢、氨和γ-氨基丁酸的积累)[18]。星形胶质细胞反应性增强可导致胶质纤维酸性蛋白(GFAP)水平过表达。胶质纤维酸性蛋白作为一种新兴的阿尔茨海默病诊断标志物,其过表达标志着星形胶质细胞死亡(也称为星形胶质细胞增生)[16]。
尽管对阿尔茨海默病的病理生理学进行了广泛研究,但目前尚无治愈方法[20]。胆碱酯酶抑制剂[21]、美金刚、仑卡奈单抗和多奈单抗等治疗方法只能延缓阿尔茨海默病的进展[22,23]。近年来,分子氢(H₂)在多种疾病(包括神经退行性疾病)中显示出疗效[17,24,25,26]。氢气能有效减轻氧化应激、炎症和细胞凋亡[27,28,29]。氢气分子体积小,易于穿透细胞膜并穿过血脑屏障,对中枢神经系统产生作用[17,24,25,26]。在包括阿尔茨海默病在内的神经退行性疾病中,氢气疗法已被证明可通过选择性减少活性氧以及调节炎症和凋亡信号通路来减轻氧化应激[27,30]。具体而言,富氢水与抑制NLRP3炎症小体有关,NLRP3炎症小体是先天免疫反应的重要组成部分,已被证实与阿尔茨海默病相关[31]。此外,氢气疗法已被证明可调节脑源性神经营养因子和雌激素受体β,这两种物质对突触可塑性和神经元存活至关重要[32]。此外,在化学诱导的轻度认知障碍模型中,有报道称氢气可增强空间记忆,并降低氧化应激、Aβ、Bax和切割的半胱天冬酶-7水平[29]。尽管氢气具有治疗益处,但其对星形胶质细胞尿素循环代谢通路的影响仍有待探索。
因此,本研究旨在探讨氢气治疗是否能减少星形胶质细胞尿素循环中有毒代谢物的积累,从而减缓神经退行性变和记忆丧失。我们假设,通过行为测试、生化检测、蛋白质印迹、免疫组织化学(IHC)、免疫细胞化学(ICC)和基因表达分析评估,氢气可下调5个家族性阿尔茨海默病(5xFAD)小鼠模型中尿素循环中有毒代谢物的积累,减少神经退行性变和记忆障碍。
2. 结果
2.1 吸入氢气减轻5xFAD小鼠的记忆障碍
我们采用Morris水迷宫和Y迷宫实验评估氢气治疗对5xFAD小鼠海马依赖性空间学习和记忆障碍的影响。我们分析了Morris水迷宫实验中的逃避潜伏期、路径长度和经过时间。在第2-5天(隐藏平台)的测试中,我们观察到与溶媒处理的小鼠相比,氢气处理的5xFAD小鼠的逃避潜伏期缩短了1.4倍,路径长度缩短了2.0倍(图1A、B)。在第6天的测试中,与溶媒处理的小鼠相比,氢气处理的5xFAD小鼠的逃避潜伏期缩短了6.0倍(p<0.001;图1C),路径长度缩短了3.0倍(p<0.001;图1D);此外,氢气处理的5xFAD小鼠进入目标象限(即经过时间)的次数是溶媒处理小鼠的6.0倍(p<0.01;图1E),游泳模式进一步说明了这一点(图1F)。对于Y迷宫实验,我们分析了臂进入频率(图1G)、总距离(图1H)和自发交替百分比(图1I)。与溶媒处理的小鼠相比,氢气处理的5xFAD小鼠的自发交替百分比显著增加了2.7倍(p<0.01)(图1I)。

图1. 小鼠行为测试结果。 Morris水迷宫结果,包括(A)试验期间(第2-5天)的逃避潜伏期,(B)试验期间(第2-5天)的路径长度,(C)测试试验(第6天)的逃避潜伏期,(D)测试试验(第6天)的路径长度,(E)测试试验(第6天)的经过时间,以及(F)游泳模式。Y迷宫测试结果:(G)臂进入次数,(H)总距离,以及(I)自发交替。野生型小鼠和5xFAD小鼠用3%氢气处理(每组n=7)。显著性差异设定为*p<0.05,p<0.01,*p<0.001。H₂,分子氢;5xFAD,5个家族性阿尔茨海默病;WT,野生型。
2.2 氢气减少AβO处理的星形胶质细胞中的氧化应激并减轻神经炎症
氧化应激增加和神经炎症是阿尔茨海默病的典型病理生理学特征[12]。为了评估氢气在调节这些病理标志物方面的治疗效果,我们评估了AβO诱导的星形胶质细胞中的细胞内活性氧水平、过氧化氢酶抗氧化酶活性和促炎细胞因子。氢气处理显著减弱了AβO刺激的原代小鼠星形胶质细胞中活性氧的产生,与溶媒相比减少了1.2倍(p<0.05;图2A)。此外,氢气处理后过氧化氢酶活性增加了20%,尽管这一增加并不显著(图2B)。为了进一步研究氢气在AβO刺激的原代小鼠星形胶质细胞中的抗炎潜力,我们使用qRT-PCR定量了常见神经炎症标志物肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)的表达。我们观察到与溶媒相比,肿瘤坏死因子-αmRNA水平显著降低(p<0.05;图2C),但白细胞介素-6表达的降低并不显著(图2D)。
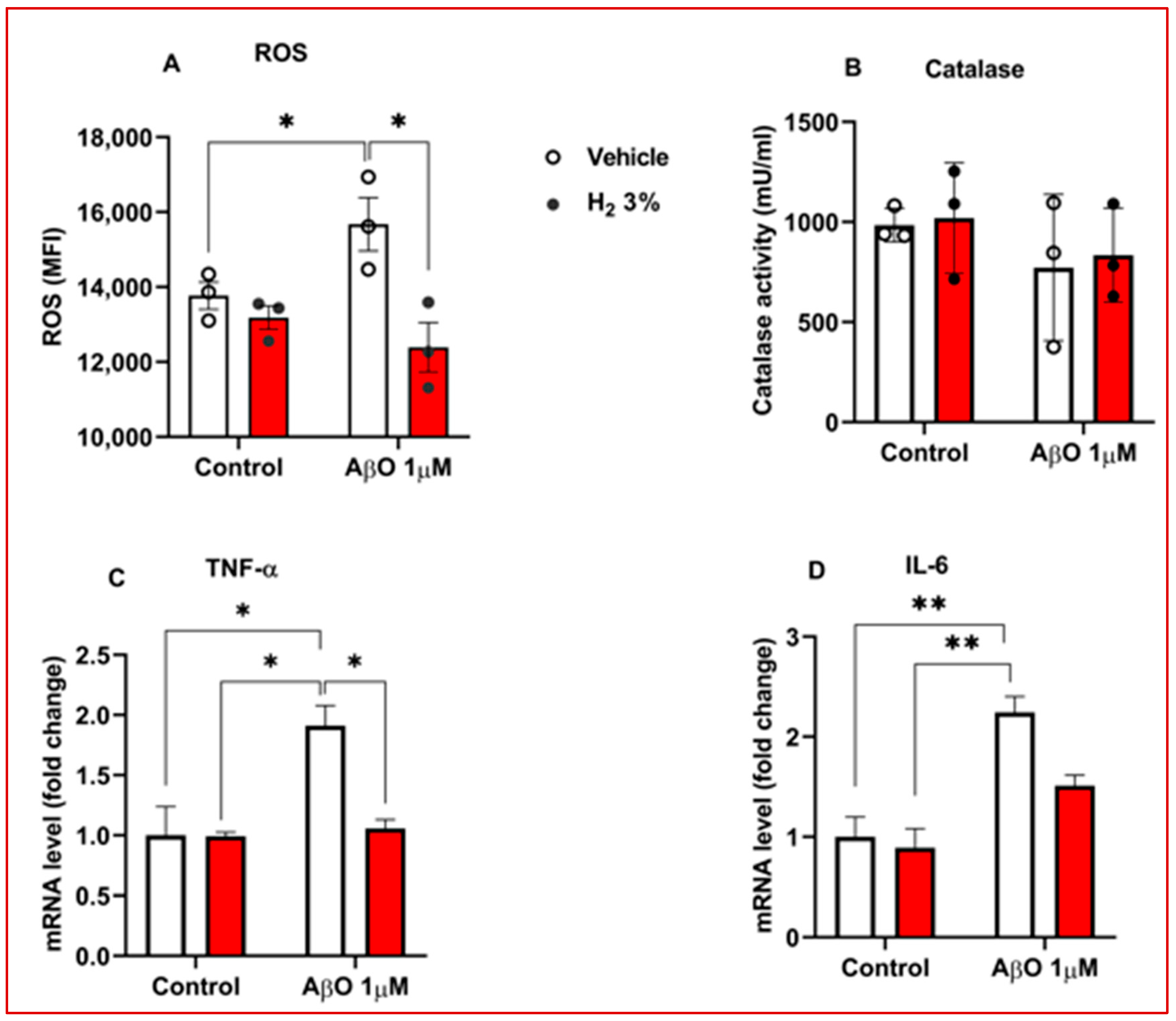
图2. 氢气处理对体外阿尔茨海默病模型中氧化应激和炎症标志物的影响。 (A-D)经氢气和溶媒处理的Aβ诱导的星形胶质细胞(2×10⁵个细胞/孔)中活性氧检测、过氧化氢酶检测、肿瘤坏死因子-αmRNA水平和白细胞介素-6的柱状图(每组n=3)。H₂,分子氢;IL-6,白细胞介素-6;OS,氧化应激;ROS,活性氧;TNF-α,肿瘤坏死因子-α。实心圆和红色柱代表氢气处理,空心圆和白色柱代表溶媒处理。统计学显著性设定为*p<0.05,p<0.01。
2.3. 氢气降低5xFAD小鼠的氧化应激和神经炎症
我们还评估了氢气处理对5xFAD小鼠海马组织中细胞内活性氧水平、过氧化氢酶抗氧化酶活性和促炎细胞因子的影响。我们发现了显著的效果,与溶媒处理组相比,活性氧水平降低1.2倍(p<0.05;图3A),过氧化氢酶活性增加1.4倍(p<0.01;图3B)。与溶媒处理组相比,氢气处理显著抑制肿瘤坏死因子-α和白细胞介素-6的mRNA表达,分别降低1.6倍(p<0.01)和1.3倍(p<0.05)(图3C、D)。
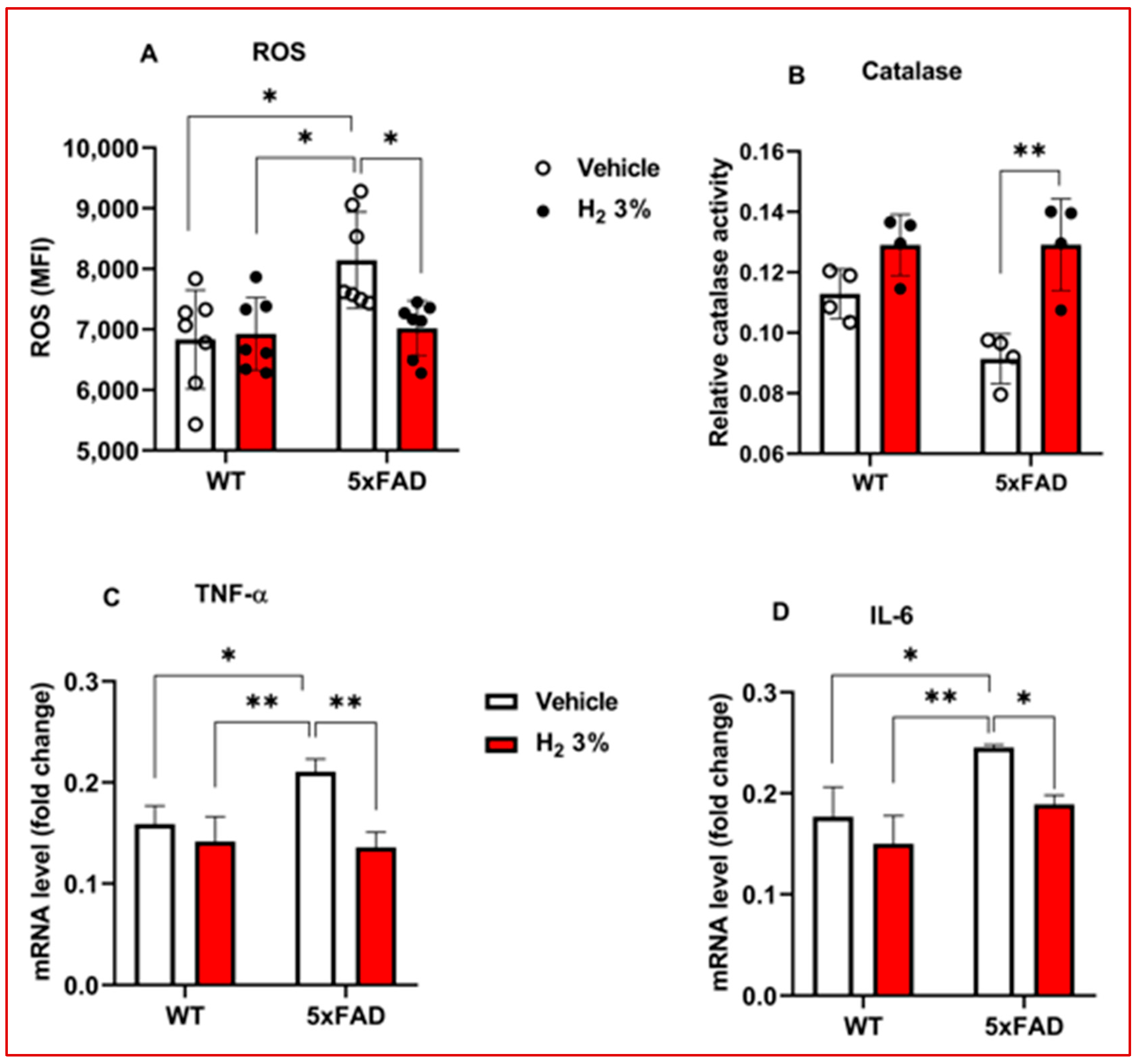
图3. 氢气处理对体内阿尔茨海默病模型中氧化应激和炎症标志物的影响。 (A-D)经氢气处理的小鼠中活性氧检测(n=7)、过氧化氢酶检测(n=4)、肿瘤坏死因子-αmRNA水平和白细胞介素-6的柱状图。野生型(n=3)和5xFAD(n=3)。5xFAD,5个家族性阿尔茨海默病;H₂,分子氢;TNF-α,肿瘤坏死因子-α;IL-6,白细胞介素-6;OS,氧化应激;ROS,活性氧。实心圆和红色柱代表氢气处理,空心圆和白色柱代表溶媒处理。统计学显著性设定为*p<0.05,p<0.01。
2.4. 氢气改善5xFAD小鼠和AβO诱导的原代星形胶质细胞的淀粉样蛋白病理并减少有毒代谢物积累
淀粉样蛋白斑块可激活星形胶质细胞尿素循环,导致有毒代谢物积累,引发星形胶质细胞再激活、神经退行性变和记忆丧失[18]。为了评估氢气处理对淀粉样蛋白病理、胶质纤维酸性蛋白表达以及有毒代谢物(过氧化氢、氨和γ-氨基丁酸)积累的影响,我们利用小鼠和星形胶质细胞的海马切片及裂解物进行了免疫组织化学、免疫细胞化学和生化检测。我们首先分析了反映过氧化氢水平的活性氧水平,发现与溶媒处理的对照组相比,经氢气处理的AβO诱导的星形胶质细胞和5xFAD小鼠中活性氧水平显著降低(图2A和图3A)。接下来,我们进行了免疫组织化学检测,观察到在皮质(CTX)中,胶质纤维酸性蛋白中Aβ斑块的积累减少2.8倍(p<0.001),在海马CA1区(CA1)减少2.4倍(p<0.05),在齿状回(DG)减少2.7倍,如图4A、B所示。同样,经氢气处理的AβO诱导的星形胶质细胞中γ-氨基丁酸水平显著低于溶媒处理的细胞(p<0.001);后续的免疫细胞化学分析证实了这一点(图4C、D)。对氨浓度的测量显示,体外氨浓度略有降低,如图4E、F所示。
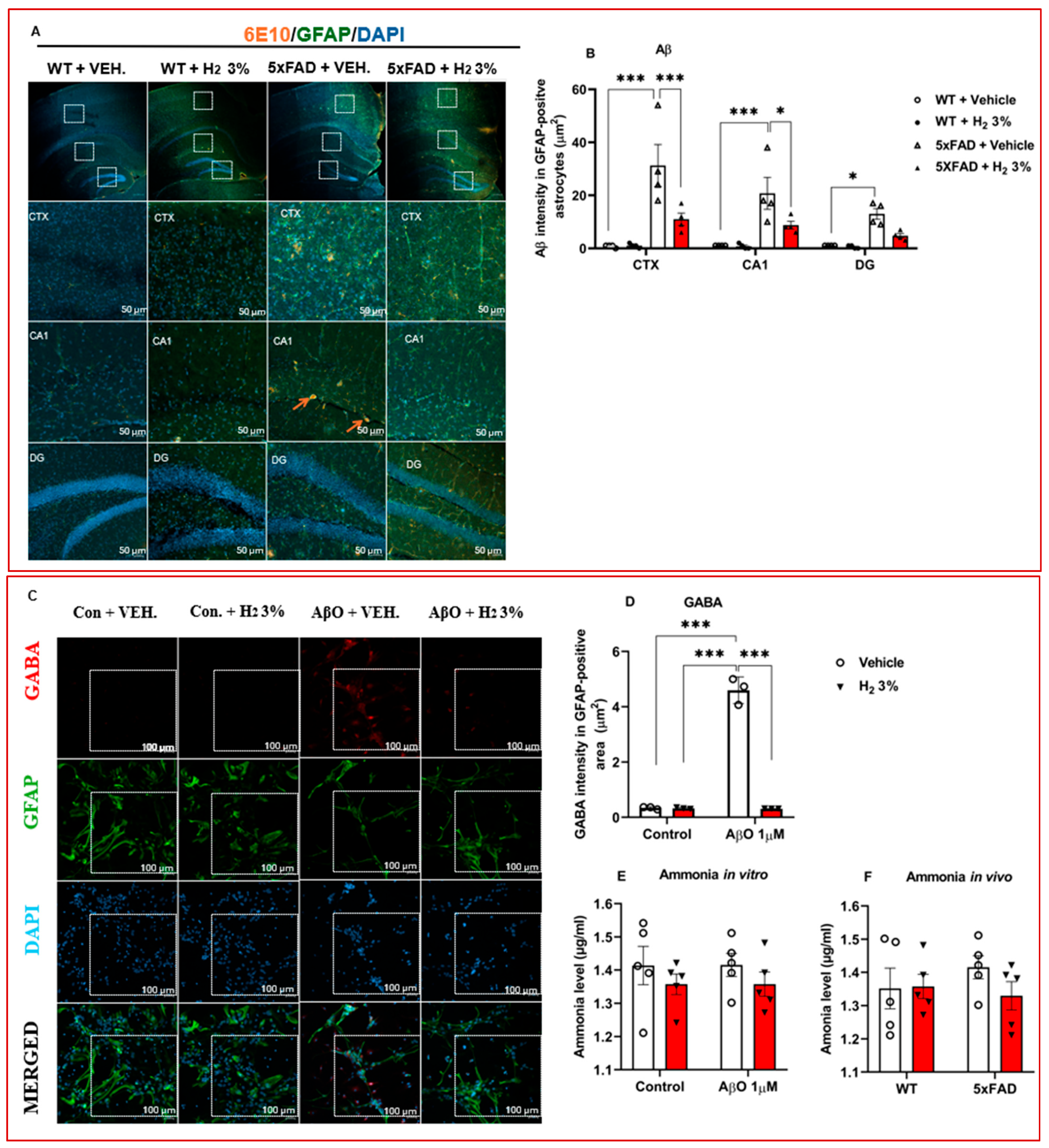
图4. 氢气处理后的有毒代谢物水平。 (A)小鼠脑切片的免疫组织化学共聚焦图像。(B)β-淀粉样蛋白信号强度图(n=4)。(C)用于检测星形胶质细胞中γ-氨基丁酸信号的免疫细胞化学图像。(D)γ-氨基丁酸强度图(n=4)。(E、F)图表显示体外和体内检测的氨浓度。统计学显著性设定为*p<0.05,*p<0.001。H₂,分子氢;CTX,皮质;CA1,海马CA1区;DG,齿状回;5xFAD,5个家族性阿尔茨海默病;GABA,γ-氨基丁酸;ICC,免疫细胞化学;IHC,免疫组织化学;VEH,溶媒;6E10阳性表示淀粉样蛋白斑块。箭头表示淀粉样蛋白斑块,白色方框表示在显微镜下检测的切片。
3. 讨论
在本研究中,我们使用5xFAD转基因小鼠和AβO诱导的原代星形胶质细胞,研究了小鼠暴露于3%氢气60天以及星形胶质细胞暴露于3%氢气3小时后,氢气处理对星形胶质细胞尿素循环代谢物和酶的影响。分析的主要发现如下:(1)我们观察到,经氢气处理的5xFAD小鼠表现出显著的记忆改善,这体现在Morris水迷宫测试中显著增加的经过时间百分比和Y迷宫测试中更高的自发交替百分比(分别见图1E、I)。这些表明,与溶媒相比,吸入3%氢气显著改善了5xFAD小鼠的空间记忆和学习能力。(2)在AβO诱导的星形胶质细胞培养物和5xFAD小鼠中,氢气处理降低了氧化应激(即活性氧和过氧化氢酶活性)和炎症标志物水平,处理组和溶媒组之间存在显著差异(图2A-D和图3A-D)。这些发现表明,氢气疗法通过其抗氧化活性降低过氧化氢水平,以及通过抗炎机制降低肿瘤坏死因子-α和白细胞介素-6基因表达,从而降低氧化应激和炎症。因此,这表明在AβO诱导的星形胶质细胞和5xFAD小鼠中,氢气通过减轻氧化应激和下调炎症细胞因子表达而产生神经保护作用。观察到的活性氧和促炎介质的减少,凸显了氢气作为一种针对阿尔茨海默病进展中氧化还原失衡和神经炎症的药物的治疗潜力。(3)处理组的有毒代谢物水平显著低于溶媒组,其中Aβ斑块(以6E10阳性信号数量为代表)和γ-氨基丁酸存在显著差异(图4A-E)。这些数据表明,氢气处理减少了有毒代谢物的积累,包括Aβ、过氧化氢和γ-氨基丁酸,与溶媒相比,氢气处理后这些物质显著减少。这表明氢气处理后,由于胶质纤维酸性蛋白水平降低(表明星形胶质细胞增生减少),星形胶质细胞功能得到增强。
抗氧化防御系统是氢气发挥功效的关键,其上游受核因子红细胞2相关因子2(Nrf2)调控[33]。在氧化应激条件下,核因子红细胞2相关因子2在Kelch样环氧氯丙烷相关蛋白1(Keap1)修饰后转移到细胞核,并与抗氧化反应元件的启动子区域结合。这种结合驱动许多抗氧化酶(包括过氧化氢酶、谷胱甘肽过氧化物酶和超氧化物歧化酶)的转录和随后的表达[34]。通过这些机制,核因子红细胞2相关因子2防止活性氧和活性氮物种对细胞的损伤,并维持氧化还原稳态[35]。近年来,关于氢气医学应用的研究有所增加,在临床前模型和临床受试者中采用了不同的氢气给药方法。这些方法包括吸入、摄入(溶解在水中)、静脉注射和皮肤涂抹凝胶[36,37]。不同研究中氢气的浓度各不相同。约1-4%的氢气被认为是安全的[36],据报道,吸入3%的氢气可改善阿尔茨海默病患者的认知和弥散张量成像评分[38]。此外,观察到吸入2%的氢气可通过下调健康成年人的生物标志物水平来降低患阿尔茨海默病的风险。这些研究加深了我们对氢气治疗效果的理解[36,39]。然而,剂量和给药途径的差异使得这些发现难以比较[36,38,39]。此外,这些研究缺乏随机性[38],迄今为止,还没有人研究过氢气在阿尔茨海默病模型中调节与星形胶质细胞尿素循环相关的有毒代谢物的机制。
最近的研究[18,40]提出鸟氨酸脱羧酶1可作为阿尔茨海默病的合适治疗靶点;然而,有研究表明,鸟氨酸脱羧酶1抑制剂二氟甲基鸟氨酸需要高剂量且具有毒性副作用[41,42]。此外,另一项研究报道,二氟甲基鸟氨酸处理组和对照组在鸟氨酸脱羧酶1抑制方面没有显著差异[43]。最近的一项研究提出,强直性γ-氨基丁酸可能靶向脑部疾病中的反应性星形胶质细胞,但需要进一步的证据来支持这一假设[44]。我们的研究显示,用3%氢气处理5xFAD小鼠后,其学习和记忆能力得到改善,这可能是由于氧化应激和炎症标志物减少所致,与早期研究的结果一致[37,38,39,45]。
过氧化氢作为一种主要的活性氧,是星形胶质细胞尿素循环中产生的有毒次级代谢物;氢气是过氧化氢的清除剂,从而减少神经退行性变。通过清除过氧化氢来降低氧化应激,可能是观察到的Aβ水平降低的原因(图4B),这与先前的研究结果一致[12,46,47]。此外,大脑中Aβ的积累可触发星形胶质细胞的氧化应激和神经炎症反应,导致神经元功能障碍和凋亡[12]。高水平的氧化应激诱导蛋白质氧化,导致Aβ形成[5]。我们的研究显示,Aβ、氧化应激(表现为活性氧减少和过氧化氢酶活性增加)以及肿瘤坏死因子-α和白细胞介素-6等炎症标志物均有所减少,这表明神经退行性变有所减轻;这增强了神经元内信号传递,并防止了阿尔茨海默病的恶化,正如小鼠记忆改善所显示的那样(图1E、I)。氧化应激的减少还意味着胶质纤维酸性蛋白区域中Aβ的共定位减少(图4A、B),这表明星形胶质细胞死亡减少,其功能得到改善。此外,γ-氨基丁酸作为一种抑制性神经递质,在星形胶质细胞尿素循环的最后一步产生,会导致阿尔茨海默病中的记忆障碍[17]。我们的结果显示,γ-氨基丁酸水平降低(图4D),这有助于经氢气处理的5xFAD小鼠的记忆改善。
然而,缺乏特定尿素循环中间产物和酶以及抗氧化防御通路上游标志物(如核因子红细胞2相关因子2)的代谢组学和蛋白质组学分析,限制了我们广泛评估氢气处理的完整代谢影响的能力。未来的研究纳入整合蛋白质组学和代谢组学分析,对于描述氢气介导的星形胶质细胞尿素循环调节的全部范围至关重要。尽管如此,我们的发现表明,氢气可抑制有毒尿素循环代谢物的积累,从而减轻阿尔茨海默病模型中的神经退行性变和记忆丧失。
4. 材料和方法
4.1. 动物和细胞培养模型
所有动物均按照延世大学原州医学院机构动物护理和使用委员会的指南进行管理,该委员会批准了本研究的伦理许可(伦理批准号:YWC-240423-2)。使用5周龄的雄性和雌性小鼠(n=29),包括过度表达淀粉样前体蛋白(APP)和早老素1(PSEN1)的转基因5xFAD小鼠(n=14)[48,49]以及C57BL/6野生型(WT)小鼠(n=15)。5xFAD转基因小鼠(RRID:MMRRC_034848-JAX)购自杰克逊实验室(美国缅因州巴尔港;库存编号:008730)。通过将转基因小鼠与F1 C57BL/6小鼠交配培育半合子品系,并使用聚合酶链反应(PCR)确认其基因型。用于基因分型的引物信息如表A2所示。小鼠被饲养在12:12小时光/暗周期的笼子里,可自由获取食物和水。处理组(野生型,n=8;5xFAD,n=7)通过氢气发生装置(GOOTZ有限公司,韩国杨州市)吸入3%氢气,持续60天。相比之下,溶媒处理组(野生型,n=7;5xFAD,n=7)接受正常通风。野生型氢气处理组有1只死亡。60天后,进行行为测试,处死小鼠,取出其大脑并保存以供进一步分析。通过匀浆20mg组织制备脑裂解物,并使用BCA测定法测定蛋白质浓度。每个样品标准化为5mg/mL蛋白质。
为了进行体外实验,我们使用1日龄C57BL/6小鼠幼崽制备原代皮质星形胶质细胞培养物。解剖大脑皮质,将其切碎并分离为单细胞。然后,我们将细胞接种在0.1mg/mL聚-D-赖氨酸包被的培养板中。细胞在含有4.5g/L葡萄糖、L-谷氨酰胺、丙酮酸钠、10%热灭活胎牛血清(SIGMA-ALDRICH,美国加利福尼亚州卡尔斯巴德)和5%青霉素-链霉素的达尔伯克改良伊格尔培养基(Gibco,英国佩斯利)中培养。培养的细胞在37°C、5%二氧化碳的湿润条件下维持。三天后,用新鲜培养基冲洗细胞,去除漂浮的细胞碎片,并更换培养基[50]。
然后,将原代星形胶质细胞培养物在单独的6孔板(2×10⁵个细胞/孔)中培养,以进行进一步的实验。AβO会加速阿尔茨海默病的进展[3];因此,为了评估氢气处理在AβO诱导的星形胶质细胞中的作用,其中一个培养板中的细胞用1μM AβO(rPeptide,美国佐治亚州沃特金斯维尔)诱导5天,并置于连接到氢气发生装置(GOOTZ有限公司,韩国杨州市)的FLUXLUK细胞处理室中,总时长为3小时,间隔30分钟,氢气浓度设定为3%。在另一个培养板中,用氢氧化铵(即溶媒)处理细胞,处理时间相同。AβO的制备方法是:将1%冰冷的氢氧化铵(NH4OH)加入分装到1.5μL微量管中的Aβ单体中,并在-80°C下储存直至需要使用。
体内和体外实验的处理持续时间不同,这是由于生物学背景和实验限制的差异。在小鼠模型中,需要延长60天的暴露时间,以模拟阿尔茨海默病样病理的慢性进展。相比之下,体外原代星形胶质细胞对环境压力更敏感,特别是在非标准培养条件下(如FLUXLUK培养箱中)。因此,为了避免诱导细胞应激或死亡,氢气暴露被限制在总计3小时的短时间间隔内,这是类似的体外抗氧化处理研究中常用的方法。这种短期暴露足以评估星形胶质细胞对AβO和氢气处理的保护或调节反应。
4.2. 行为学测试
记忆障碍是阿尔茨海默病(AD)的一个典型特征[20]。为了评估氢气(H₂)对5xFAD小鼠认知行为的影响,我们采用Morris水迷宫和Y迷宫来评估其空间学习能力和短期记忆[51,52]。所有行为学测试均采用双盲法,仅在数据分析完成后才揭盲。Morris水迷宫测试按照Bromley-Brits等人[53]发表的方法进行。简要来说,将每只小鼠小心放置在第一个象限中,让其游泳并寻找可见的平台。60秒内未能找到平台的小鼠会被轻轻引导至平台,并在平台上停留10秒。该操作对每只小鼠在所有象限中重复进行,持续五天。从第2天到第5天,平台被隐藏起来以评估空间学习能力。第6天,平台被完全移除,将小鼠分别放置在距离目标象限最远的象限中,让其探索60秒。每只小鼠的逃避潜伏期和路径长度由五次试验的平均值确定。使用摄像机(Panlab Harvard Apparatus,美国马萨诸塞州霍利斯顿,Panlab SMART视频跟踪系统Smart 3.0,Harvard Apparatus)跟踪并记录小鼠的运动,随后对数据进行分析以评估其表现。在第六天,通过分析逃避潜伏期、路径长度和经过时间来评估空间记忆和学习能力。
在Y迷宫测试中,将小鼠单独放置在迷宫中央(Jeongdo B&P有限公司,韩国首尔),迷宫有三个相同的臂(彼此成120°角),让小鼠探索8分钟。只有当小鼠的四肢都进入臂内时,才记录为一次进入。我们使用上述视频跟踪方法,并分析臂进入频率和自发交替行为[52]。
4.3. 有毒代谢物水平的评估
Ju等人[18]报道,在正常情况下,星形胶质细胞通过尿素循环清除氨、γ-氨基丁酸(GABA)和过氧化氢(H₂O₂)等有毒代谢物。然而,在阿尔茨海默病中,这些代谢物会积累,引发氧化应激(OS)、神经炎症和细胞凋亡,导致神经退行性变和记忆丧失。我们通过生化检测、免疫组织化学(IHC)和免疫细胞化学(ICC)研究了氢气对这些有毒代谢物水平的影响。
4.3.1. 活性氧和抗氧化酶检测
使用2,7-二氯荧光素二乙酸酯(DCF-DA)(EMD Millipore公司,中国北京)测量细胞内活性氧(ROS)水平,特别是过氧化氢的水平。简要来说,在体内实验中,将10μL海马裂解物(5mg/mL)和100μL 20μM DCF-DA分装到96孔板中。然后将板在暗处孵育30分钟。孵育后,使用DTX-880微孔板读数仪(Beckam Counter公司,美国加利福尼亚州富勒)在488nm激发/525nm发射波长下测量荧光。对于体外实验,原代星形胶质细胞在6孔板(2×10⁵个细胞/孔)中培养,并用1μM AβO(rPeptide公司,美国佐治亚州沃特金斯维尔)诱导5天,然后用3%氢气或1%氢氧化铵处理3小时,并用1×磷酸盐缓冲盐水(PBS)(Lonza公司,美国马里兰州沃克斯维尔)洗涤两次;按照上述方法进行荧光检测。
使用Amplex Red过氧化氢酶检测试剂盒(Invitrogen公司,美国加利福尼亚州卡尔斯巴德)定量抗氧化酶活性。过氧化氢酶分解过氧化氢,产生水和氧气,从而防止细胞损伤[54]。因此,将25μL每个样品(5mg/mL)和对照分别加入板上相应的孔中。接下来,加入25μL 40μM过氧化氢溶液,并将内容物在约25-37°C下放置30分钟。然后我们加入50μL 100μM Amplex Red试剂/0.4U/mL辣根过氧化物酶,将板在37°C下孵育30分钟。随后,使用SpectraMax ABS Plus微孔板读数仪(Molecular Devices公司,美国加利福尼亚州圣何塞)在560nm处测量吸光度。荧光变化计算为无过氧化氢酶对照的荧光减去样品的荧光。
4.3.2. 氨检测
为了定量AβO诱导的原代星形胶质细胞培养物和小鼠脑组织中的氨浓度,我们按照产品说明书使用氨检测试剂盒(Sigma-Aldrich公司,美国密苏里州圣路易斯)。使用蒸馏水和离心将细胞(2×10⁵个细胞/孔)或海马裂解物(5mg/mL)制成均匀混合物。将上清液的pH值优化至7-8,并将100μL该上清液放入比色杯中。向比色杯中加入L-谷氨酸脱氢酶溶液,充分混合,并在18-35°C下孵育5分钟。然后,如上所述,使用微孔板读数仪在340nm处测量吸光度。
4.3.3. 免疫组织化学和免疫细胞化学
为了确定3%氢气处理是否减少5xFAD小鼠海马中Aβ的积累,我们按以下方法进行免疫组织化学。将切除的小鼠大脑左半球用4%多聚甲醛在4°C下固定过夜,并在30%蔗糖中脱水2天。使用低温切片机将海马切成30μm的冠状切片。切片在4°C下储存;用磷酸盐缓冲盐水洗涤,然后浸入封闭缓冲液(由5%山羊血清、0.1M磷酸盐缓冲盐水和0.3%Triton X-100组成)中1小时。接下来,将切片在含有一抗(Dako公司,美国加利福尼亚州卡平特里亚)的封闭缓冲液中,在4°C下振荡孵育至第二天。然后用含有0.03%Triton X-100的磷酸盐缓冲盐水洗涤三次以去除未结合的抗体,并在室温下与二抗孵育1小时。重复洗涤,加入磷酸盐缓冲盐水中的4',6-二脒基-2-苯基吲哚(DAPI)(1:1500稀释);随后用荧光封片剂(Cell Signaling Technology公司,美国马萨诸塞州丹弗斯)封片,并使其干燥。使用共聚焦显微镜和Zeiss LSM880显微镜(Zeiss公司,德国耶拿)拍摄荧光图像。使用ImageJ软件(1.41版本,美国国立卫生研究院,马里兰州贝塞斯达)处理图像。一抗和二抗的信息如表A2所示。
采用免疫细胞化学分析氢气对γ-氨基丁酸积累的影响。简要来说,用3%氢气或溶媒处理的AβO诱导的星形胶质细胞用4%多聚甲醛固定15分钟,并在脑脊液中反复洗涤(三次)。使用含有0.2%Triton X-100的磷酸盐缓冲盐水渗透固定的细胞,并在室温下封闭1小时。然后将细胞与小鼠抗γ-氨基丁酸一抗(Millipore公司,澳大利亚维多利亚州贝斯沃特)在4°C下孵育1小时。接下来,将细胞与二抗和DAPI(Vectashield®,美国加利福尼亚州纽瓦克)孵育40分钟。每次孵育后,用含有0.1%Triton X-100的磷酸盐缓冲盐水洗涤三次。按照上述免疫组织化学的方法进行成像和分析。
4.4. 炎症基因的逆转录-定量聚合酶链反应分析
为了评估氢气如何影响炎症细胞因子基因的表达,我们对AβO诱导的星形胶质细胞(2×10⁵个细胞/孔)和小鼠海马裂解物(5mg/mL)进行了逆转录-定量聚合酶链反应(RT-qPCR)。首先,使用easy-BLUETM总RNA合成试剂盒(iNtRON Biotechnology公司,韩国城南市)从星形胶质细胞和海马裂解物中提取RNA。使用PrimeScriptTM第一链cDNA合成试剂盒(Takara公司,韩国首尔)将提取的RNA(标准化为1μg)逆转录为cDNA。cDNA文库制备后,按照Kwak等人[55]描述的方法进行逆转录-定量聚合酶链反应。简要来说,样品一式三份制备,最终体积为10μL,包括1μL 10pM引物、2μL cDNA、5μL SYBR Green PCR Master Mix(Applied Biosystems公司,英国沃灵顿)和2μL无RNA酶水;这些样品在QuantStudio 6 Flex实时PCR系统(Applied Biosystems®,新加坡马西岭工业区路3号)中进行分析。以GAPDH mRNA作为参照,使用2-∆∆CT法确定折叠变化。本实验中使用的引物列于表A1中。
4.5. 统计分析
我们使用GraphPad Prism软件(8版本;GraphPad Software公司,美国加利福尼亚州拉霍亚)分析数据。采用双因素方差分析和多重比较检验(Tukey事后检验)检测差异,显著性水平设定为p<0.05。实验样品的数据以平均值和标准误表示。除非图注中另有说明,否则个体小鼠或培养细胞批次以单个数据点和样本表示。
5. 结论
我们的研究结果表明,氢气处理有效减轻了AβO诱导的星形胶质细胞和5xFAD转基因阿尔茨海默病小鼠模型中有毒代谢物、氧化应激和炎症标志物的积累。此外,3%氢气给药降低了星形胶质细胞尿素循环的有毒副产物过氧化氢和γ-氨基丁酸的水平,从而起到神经保护作用。这些生化指标的改善与认知能力的增强相关,5xFAD小鼠的学习和记忆能力提高证明了这一点。据我们目前所知,这是第一项探索氢气在阿尔茨海默病模型中靶向星形胶质细胞尿素循环内有毒代谢物积累的治疗潜力的研究。这些发现表明,氢气可能通过调节阿尔茨海默病中星形胶质细胞介导的代谢功能障碍,成为一种新型且有前景的减轻神经退行性变的策略。尽管如此,仍需要详细的蛋白质组学和代谢组学分析来阐明氢气对星形胶质细胞尿素循环中间产物和酶的影响。
https://wap.sciencenet.cn/blog-41174-1496311.html
上一篇:氢(氢化镁)增强声动力疗法
下一篇:过敏原在气道细胞上打孔让我们咳嗽和喘息