博文
科研助攻 | KRAS G12D: 癌症治疗的下一个前沿热点_MedChemExpress
|
近期,2025 年美国癌症研究协会年会公开了 KRAS 靶点领域的许多重大研究进展,强调了 KRAS 在靶向治疗领域的重要地位。让小M带你了解针对 KRAS 靶向治疗的最新发展和面临的挑战吧~
在过去 40 年的药物靶向研究中,KRAS (Kirsten Rat Sarcoma Viral Oncogene Homolog) 一直被认为是 “不可成药”靶点。近年来,针对 KRAS 的直接靶向药物取得了令人惊讶的进展,尤其是 KRAS G12C 抑制剂,如Sotorasib (AMG510),Adagasib (MRTX849) 和Fulzerasib (GFH925),在临床试验中取得了令人鼓舞的结果。然而,与其他靶向治疗相比,它们的疗效有限。虽然 G12C 是非小细胞肺癌 (NSCLC) 中的主要 KRAS 突变亚型,但是,G12D 在结直肠癌 (CRC) 和胰腺导管腺癌 (PDAC) 中更为普遍存在。这些事实促使人们去开发更多靶向非 KRAS G12C 突变的抑制剂。
Section.01
KRAS 突变和癌症
KRAS 基因突变在癌症中频发,包括胰腺导管腺癌、非小细胞肺癌和结直肠癌等[1][2]。最常发生的激活突变是在密码子 12 (G12)、13 (G13)、和 61 (Q61)上的单核苷酸置换,其中绝大多数突变发生在 G12 上,G12D、G12C 和 G12V 则是最常见的突变亚型[2][3]。G12C 突变阻断 GAP 与 KRAS 的结合,从而抑制 GTP 水解并将 G12C 突变体 KRAS 锁定在其活性状态。活性 KRAS 通过 MAPK 和 PI3K 途径诱导信号转导,促进细胞增殖、生长和存活,从而促进肿瘤发生[1][4]。G12V 是第二常见的 KRAS 突变,它会导致 MAPK 通路的异常激活,并促进肿瘤的发生和转移。
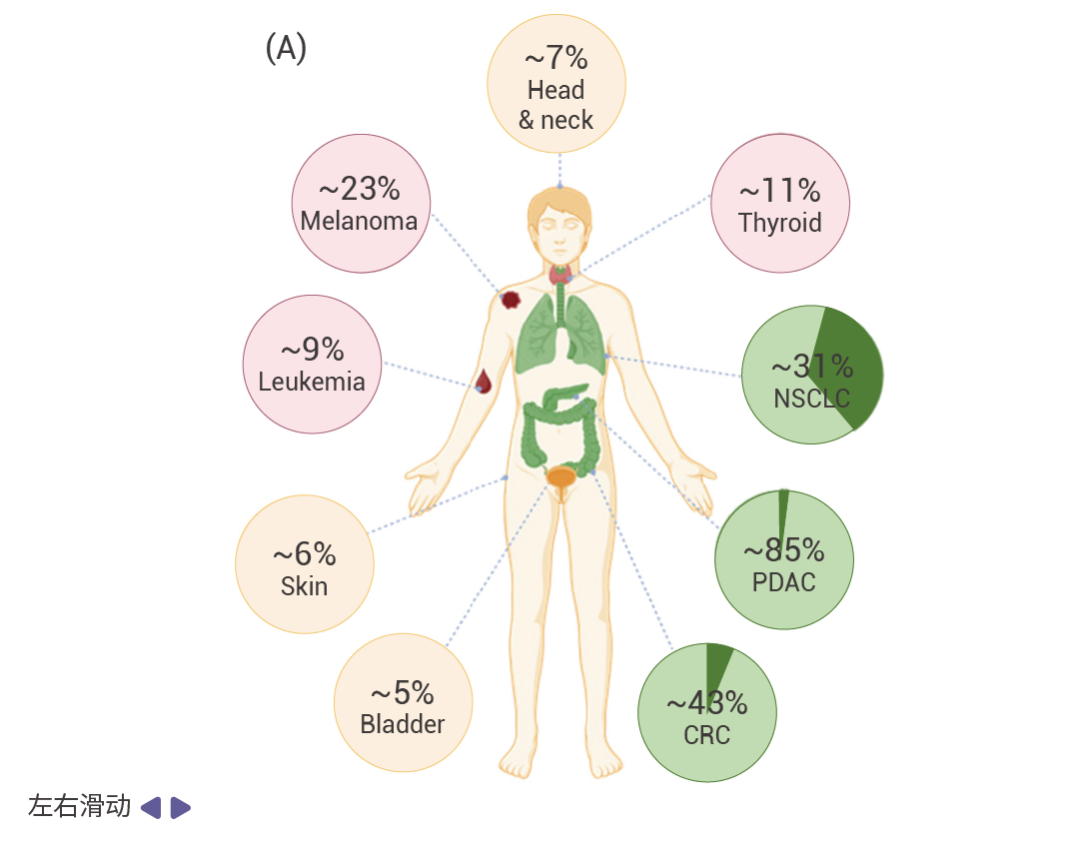
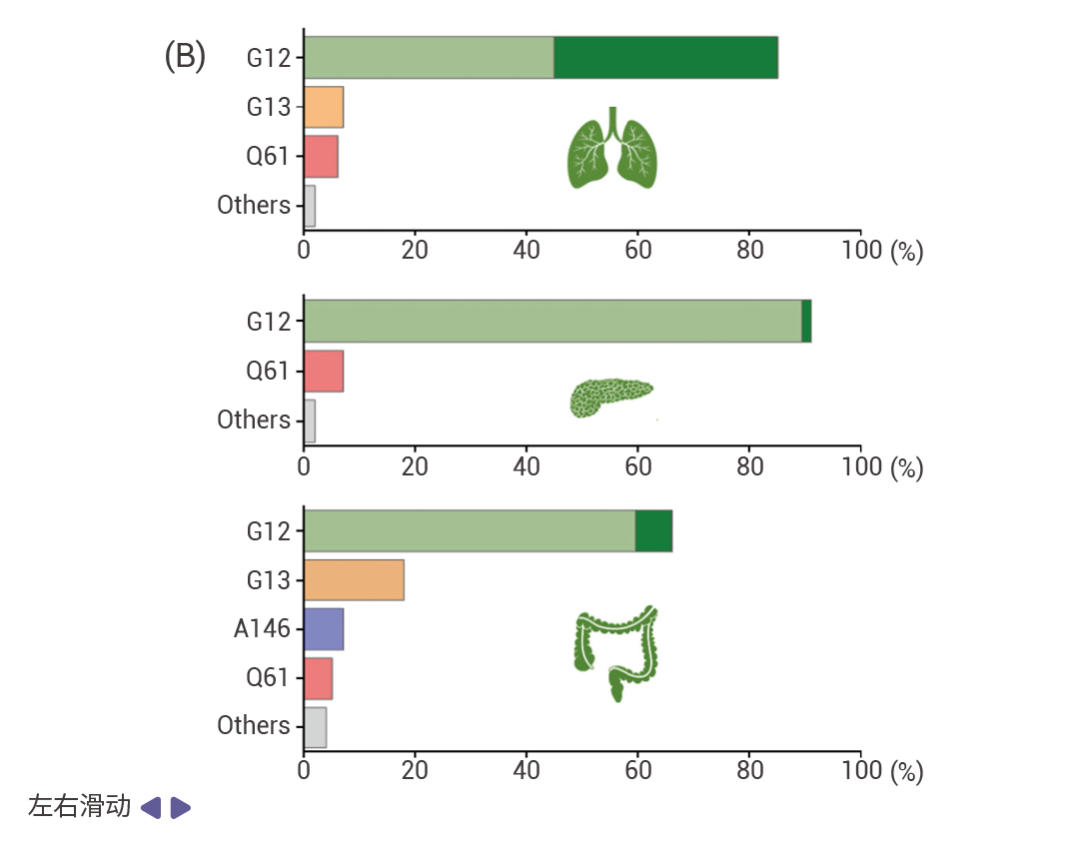
图 1. RAS 突变在各种主要癌症类型中的发生率[5]。
A.不同主要癌症类型中 KRAS (绿色), HRAS (黄色),和 NRAS (粉色) 突变频率的分布情况。 B. KRAS 突变亚型在癌症中的发生频率:上为非小细胞肺癌;中为胰腺导管腺癌;下为结直肠癌。
KRAS 属于大鼠肉瘤病毒癌基因 (Rat sarcoma viral oncogene family, RAS) 的家族成员之一,可将 GTP 水解为 GDP。在正常生理条下,在非活性 GDP 结合状态和活性 GTP 结合状态之间循环,将细胞外信号转导至细胞内部。受体酪氨酸激酶 (RTK) 激活后,鸟苷酸交换因子 (GEF) 与 KRAS 结合并促进结合的 GDP 交换为 GTP,从而将 KRAS 切换到活性状态[6]。GAPs 通过加强 GDP 和 KRAS 之间的结合来维持 KRAS 的非活性状态。
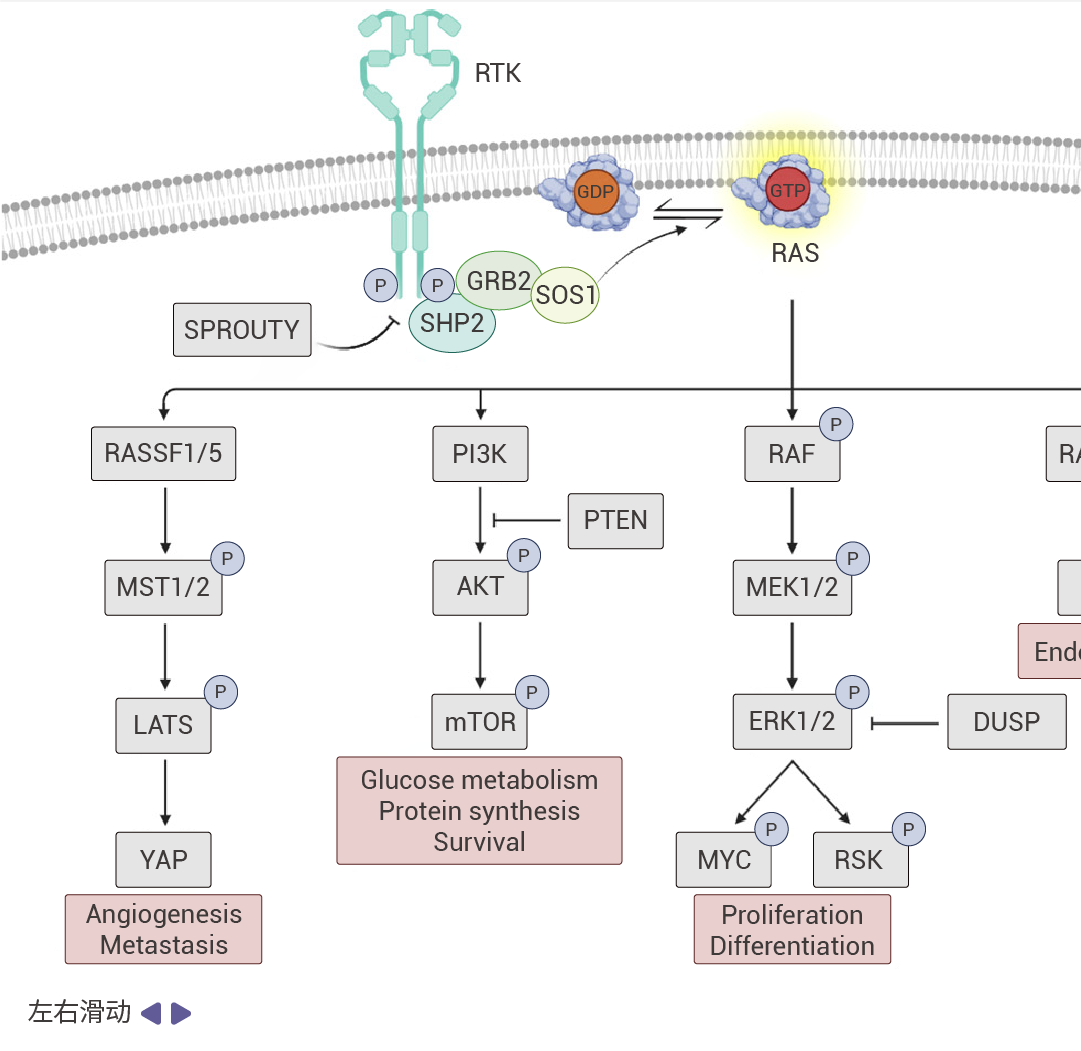
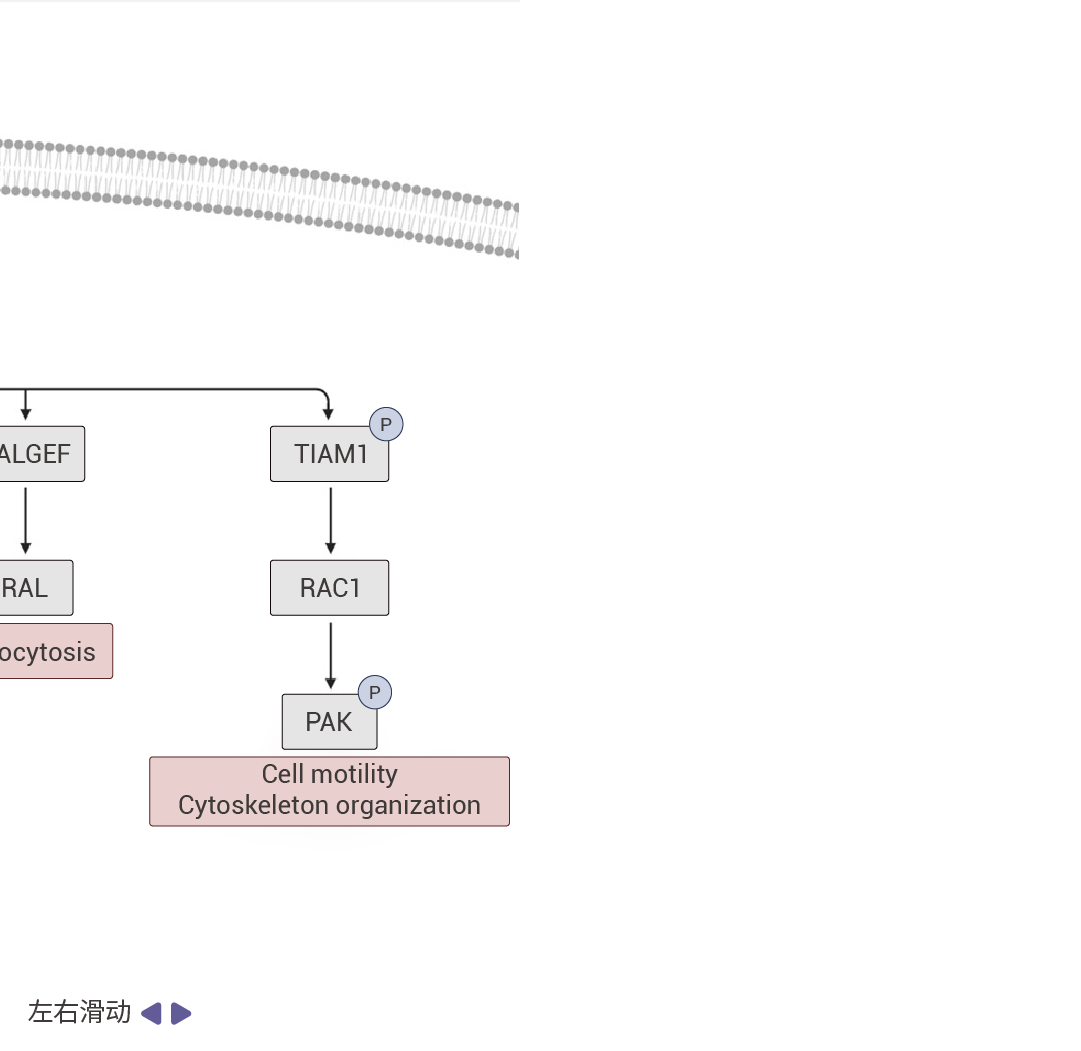
图 2. RAS 信号通路[5]。
受体酪氨酸激酶(RTKs)通过促进 GEF(如 SOS1)将 GDP 换成 GTP 的过程来促进 RAS 蛋白的激活。活跃的 RAS 会驱动众多促癌通路。
Section.02
成功靶向 KRAS G12C
KRAS 体积较小,表面光滑,导致小分子难以与 KRAS 结合。KRAS 表面除了 GTP 结合袋外,没有其他区域可以与小分子结合,但靶向 GTP 结合袋相当困难[1]。因此长久以来 KRAS 都被认为是 “不可成药” 的靶点。
switch-II 口袋的发现促进了临床应用的特异性 KRAS 抑制剂的发展,目前特异性 KRAS G12C 的抑制剂已被引入临床实践,其中 Sotorasib (AMG510) 和 Adagasib (MRTX849) 分别于 2021 年和 2022 年被 FDA 批准上市, Fulzerasib (GFH925) 在 2024 年首次获得中国批准。这 3 种药物被用于 KRAS G12C 突变的非小细胞肺癌 (NSCLC) 的治疗。
Sotorasib 和 Adagasib 的单药治疗在结直肠癌中的客观缓解率 (ORR) 均显著低于非小细胞肺癌。研究表明 EGFR 的激活是导致结直肠癌缓解率较低的原因之一,而同时使用 EGFR 抑制剂与 BRAF 抑制剂联合治疗则能够克服这一问题[7]。Sotorasib 与 Panitumumab (一种 EGFR 抑制剂) 联合使用可将无进展生存期 (PFS) 提高至 5.6 个月,而接受 trifluridine-tipiracil (三氟尿苷-替吡嘧啶) 或 Regorafenib (多靶点受体酪氨酸激酶抑制剂,抑制 VEGFR1/2/3,PDGFRβ,Kit,RET 和 Raf-1) 治疗的 KRAS G12C 突变型晚期结直肠癌患者组的 PFS 仅为 2.2 个月[8]。Adagrasib 与 Cetuximab (一种 EGFR 抑制剂) 联合使用时,客观缓解率也有所提高,达到 30.2%[9]。基于这些发现,FDA 于 2024 年批准了这种联合疗法用于 KRAS G12C 突变型结直肠癌。
此外,目前几种间接的泛 KRAS 抑制剂(通过靶向调节 KRAS 活性的蛋白来实现调控 KRAS 活性) 正在临床开发阶段。勃林格殷格翰宣布了一种 SOS1(一种鸟嘌呤核苷酸交换因子) 抑制剂 BI-1701963 正处于临床一期试验阶段,它可以破坏 SOS1 介导的 KRAS 的核苷酸交换。此外,鉴于 SHP2 在 KRAS 激活过程中发挥了不可或缺的作用,一些 SHP2 抑制剂(如 TNO155、RMC-4630 和 JNJ-3068) 正在进行早期临床试验[10]。
表 1. FDA 批准的 KRAS G12C 抑制剂临床试验
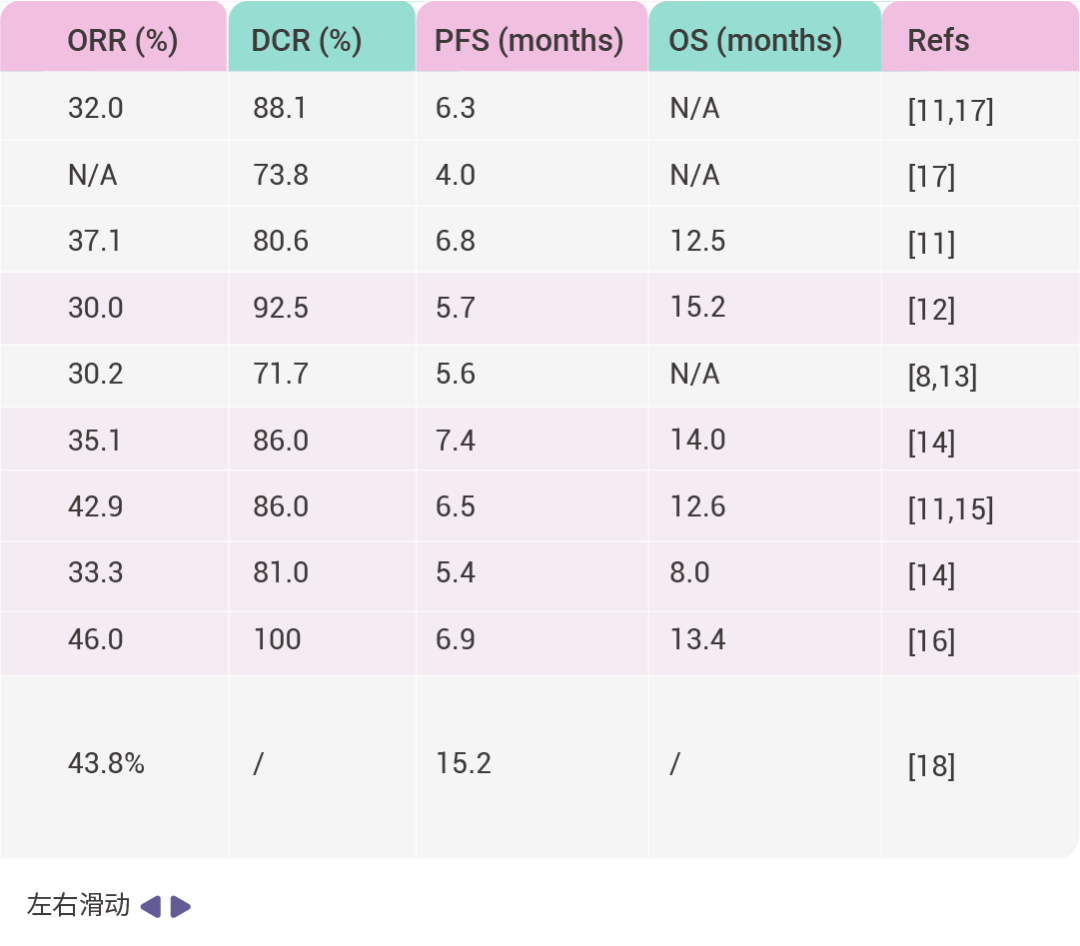
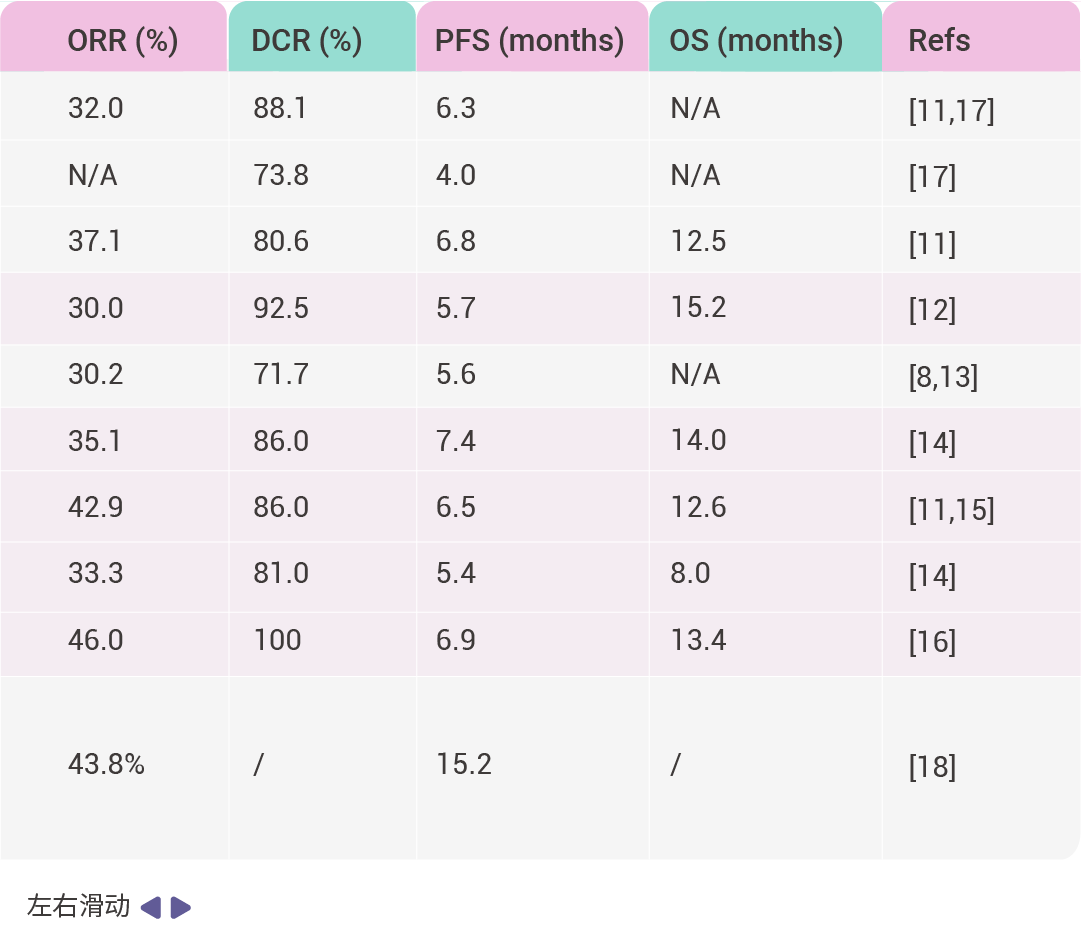
缩写词: objective response rate (ORR); progression-free survival (PFS); disease control rate (DCR); overall survival (OS).
Section.03
KRASG12D 抑制剂
由于其他 KRAS 突变的高流行率,针对其他突变选择性抑制剂以及泛 KRAS 抑制剂的开发也在进行中,一部分新型 KRAS 抑制剂正在进行临床试验。特别是 KRAS G12D 已成为开发新型抑制剂的方向,因为该突变占所有 KRAS 突变的约 28%,并且是胰腺导管腺癌和结直肠癌中最常见的突变[5]。目前,还没有获得 FDA 批准的针对 KRAS G12D 的特异性抑制剂, KRAS G12D 突变的癌症代表着一个重要的未满足的医疗需求。
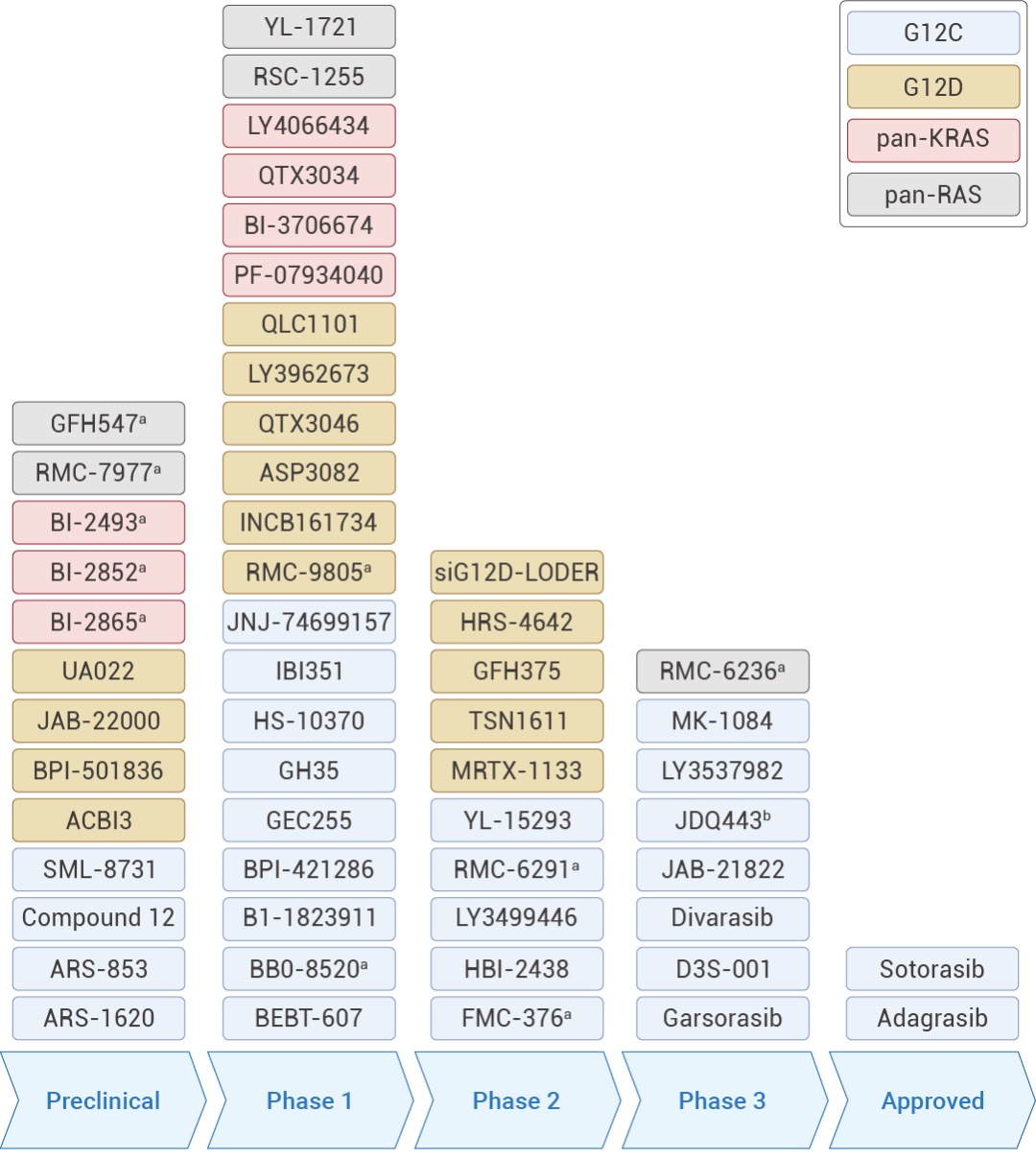
图 3. 临床在研的 RAS 抑制剂[5]。
靶向 G12C 的抑制剂共价结合到 KRAS G12C 突变体中的半胱氨酸残基,使蛋白质稳定在非活性的 GDP 结合状态。遗憾的是,这一策略不适用于 KRAS G12D,因为 KRAS G12D 突变体中的天冬氨酸残基的羧基亲核性弱于半胱氨酸的巯基[2]。这种差异导致了如 MRTX849 等化合物对 KRAS G12C 具有显著作用,但对 KRAS G12D 没有影响。
由于无法直接靶向,Mirati Therapeutics 公司基于 MRTX849 的结构将烯酰胺基团替换为哌嗪基团开发出了 MRTX1133[2][3]。MRTX1133 的哌嗪基团与 KRAS G12D 的天冬氨酸残基之间形成离子键从而实现非共价结合。MRTX1133 与 KRAS G12D 的非共价结合阻止了核苷酸交换和效应 RAF 的结合,抑制了 KRAS 下游通路激活所必需的蛋白质-蛋白质相互作用[2][3]。由于 MRTX-1133 的设计是基于 MRTX849 的结构,因此其他靶向 G12C 的药物也可以经过修饰,使其对 G12D 突变的癌症具有反应性。
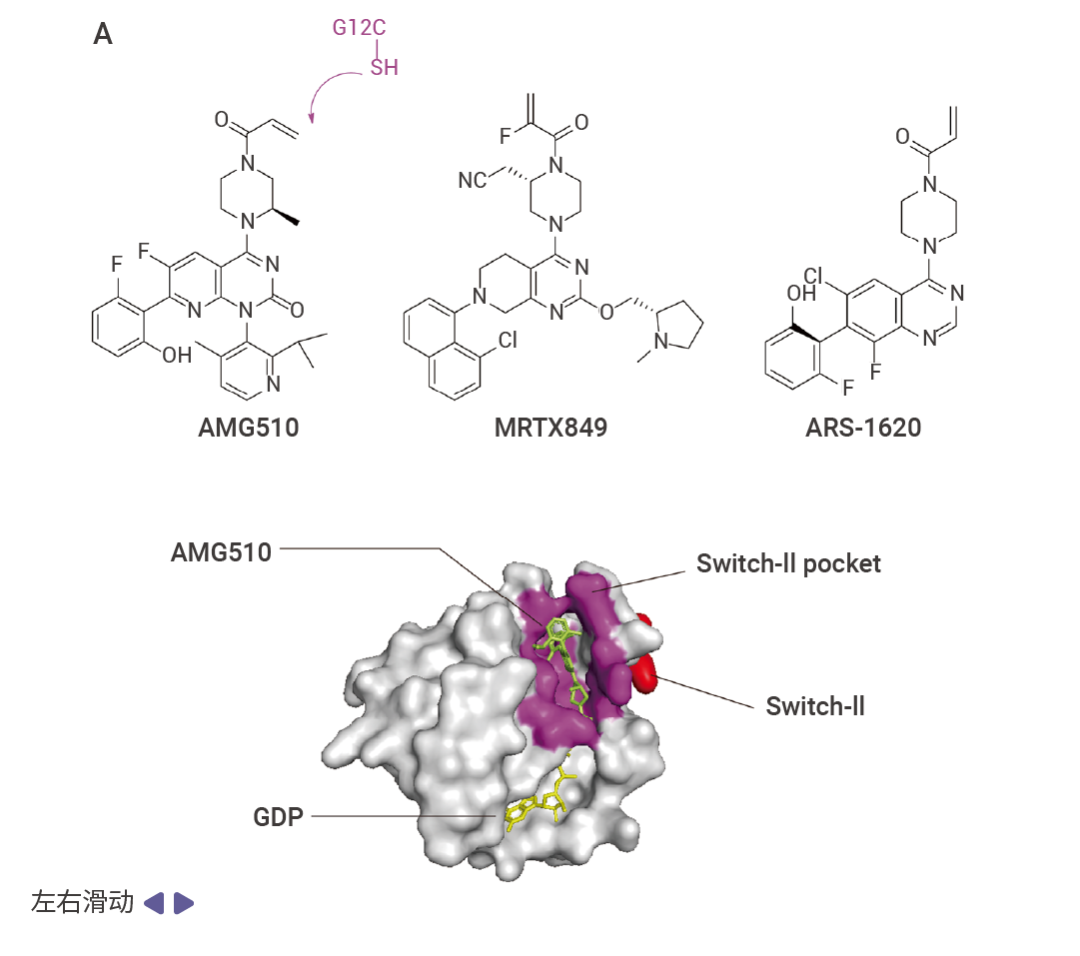
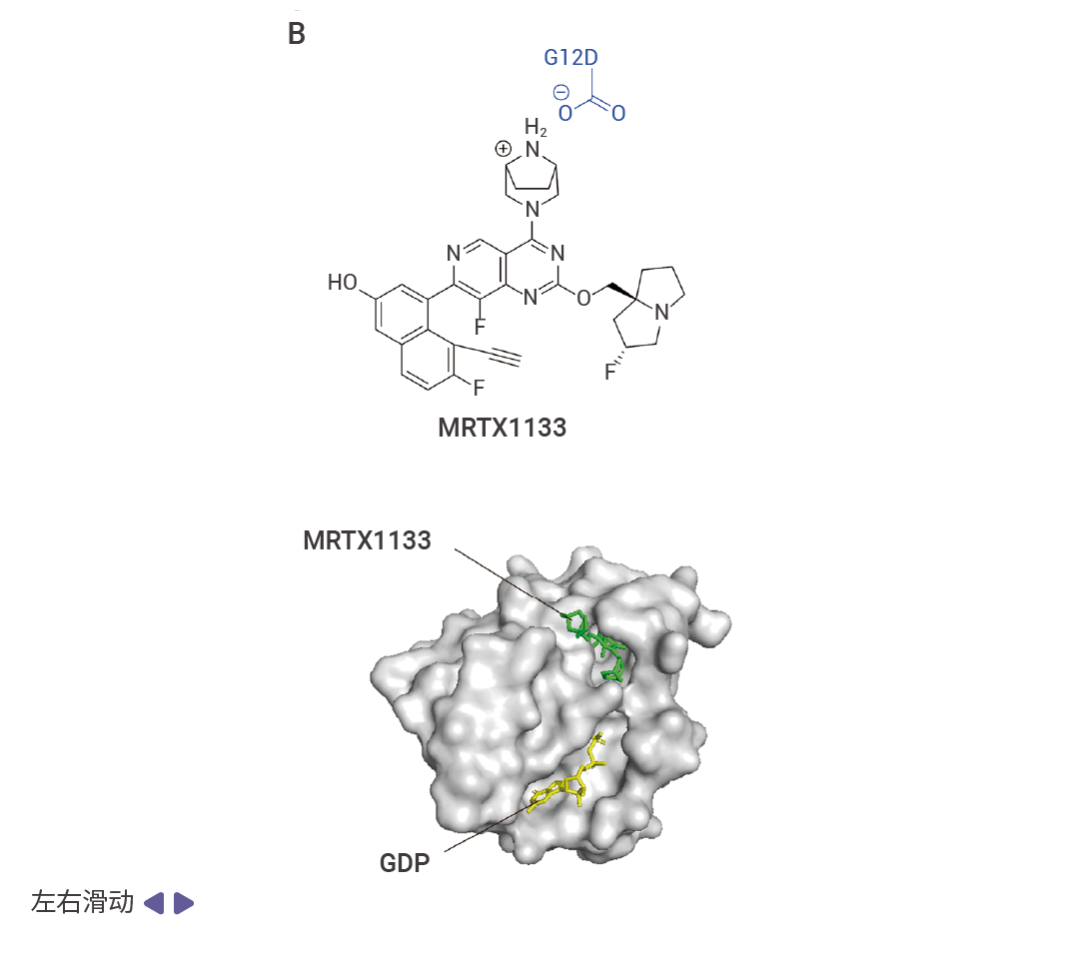
图 4. KRAS 突变抑制剂与 KRAS 结合示意图[2]。
A. AMG510 与 KRAS G12C 的 Switch-II 口袋(紫色)结合;B. MRTX1133 与 KRAS G12D 结合。
RMC-9805 的开发策略与 MRTX1133 不同。RMC-9805 首先在 KRAS G12D 与亲环素 A 之间形成非共价键,从而形成 KRAS、亲环素 A 和 RMC-9805 的三元复合物,导致 RMC-9805 与天冬氨酸缓慢地共价结合,阻断 KRAS 效应蛋白的不可逆下游结合[3]。这种相互作用通过破坏 KRAS G12D 的下游信号效应分子 (如 RAF),选择性且持续地修饰 KRAS G12D,从而诱导细胞凋亡并抑制细胞增殖。
在接受至少 14 周 RMC-9805 治疗的 KRAS G12D 突变的胰腺导管腺癌患者中,客观缓解率 (ORR) 为 30% (n=12),疾病控制率 (DCR) 为 80% (n=32)[11]。此外,RMC-9805 显示出了出色的安全性特征,并且在不同剂量下总体耐受性良好。这些结果表明,RMC-9805 具有令人鼓舞的临床表现。
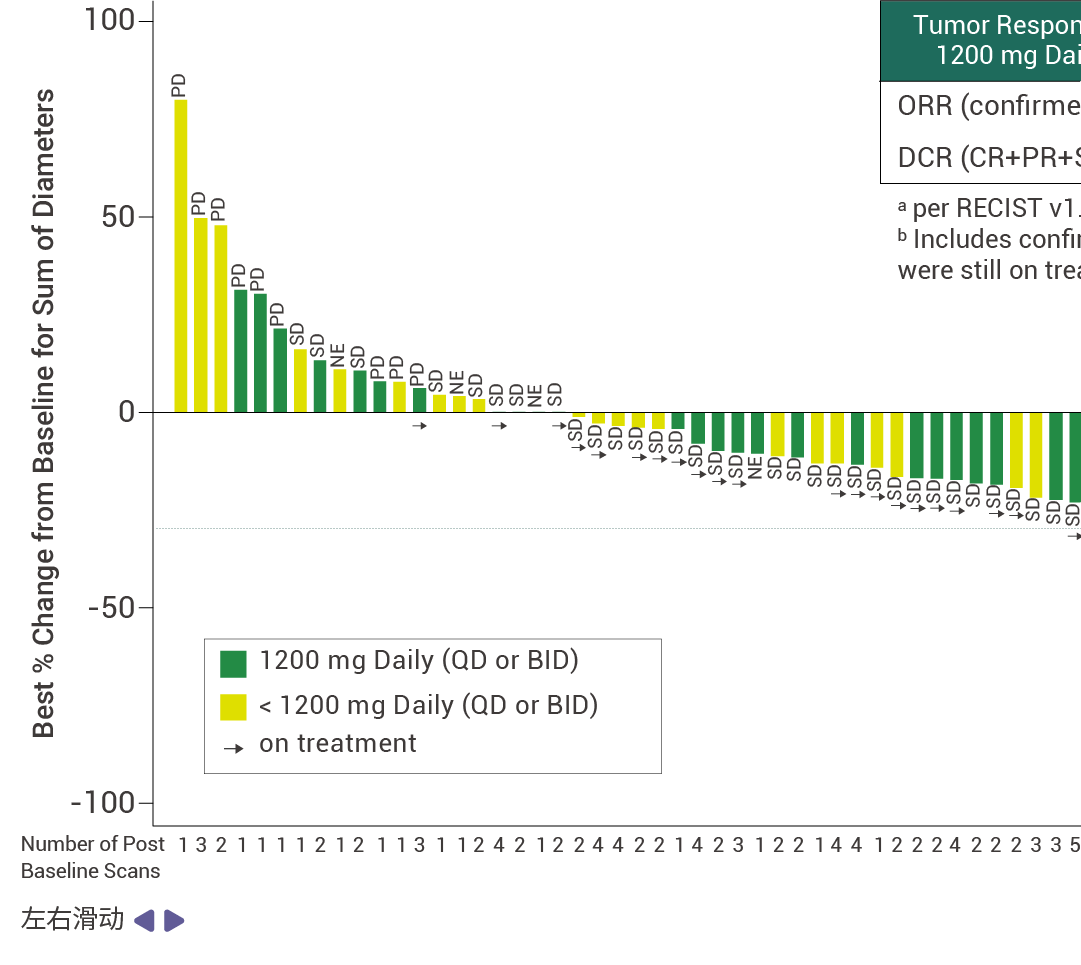
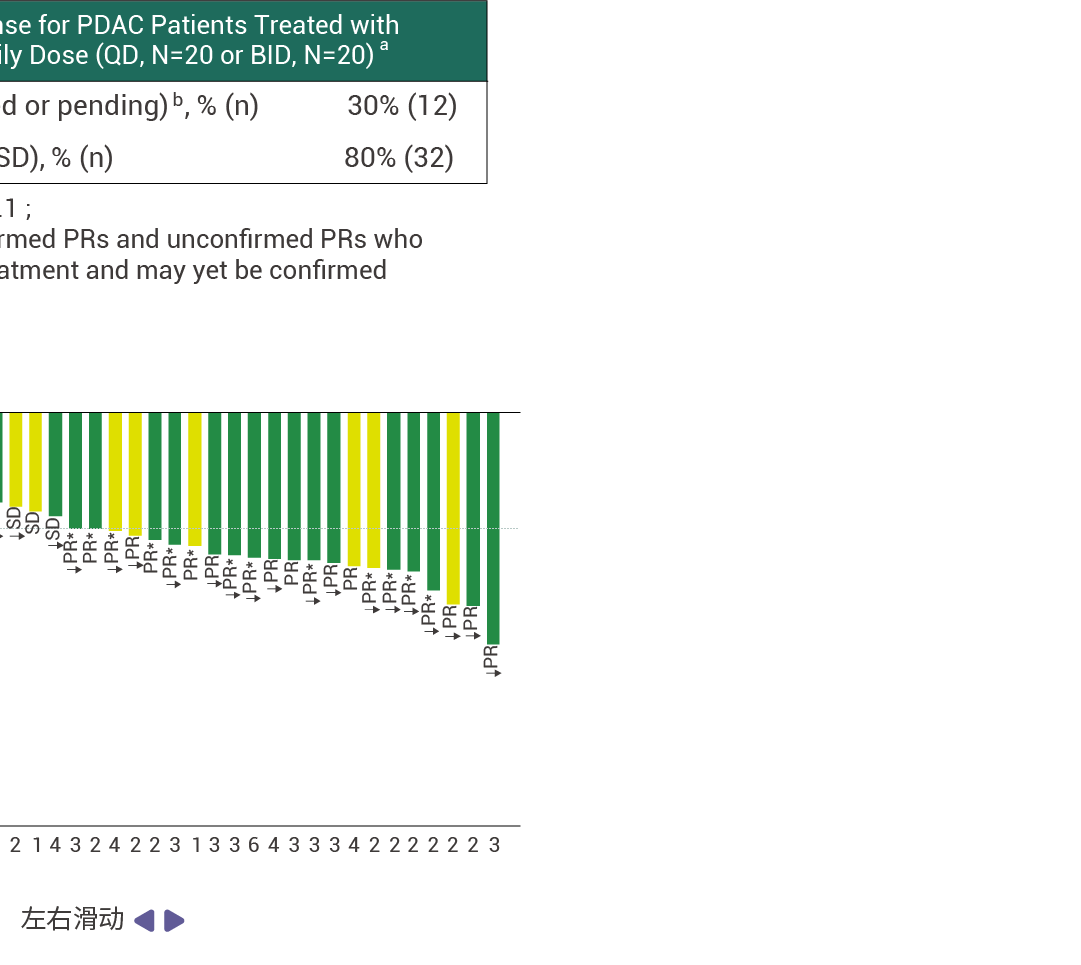
图 5. RMC-9805 对胰腺导管腺癌患者具有抗肿瘤活性[11]。
MRTX1133 和 RMC-9805 只在 KRAS G12D (ON;GTP 结合) 处于活性状态时与其结合。相比之下,VS-7375 (GFH375) 在活性状态和非活性状态 (OFF;GDP 结合) 下都能与 KRAS G12D 结合。因此,与仅在活性状态或仅在非活性状态下抑制 KRAS G12D 的化合物相比,VS-7375 更有可能更完全地抑制 KRAS G12D 信号传导和肿瘤生长。VS-7375 在体内多种 KRAS G12D 肿瘤模型中作为单药或与包括 cetuximab 在内的其他抗癌药物联合使用时都表现出良好的抗肿瘤活性[12]。这些结果支持对 VS-7375 用于治疗 KRAS G12D 突变癌症患者的临床评估。
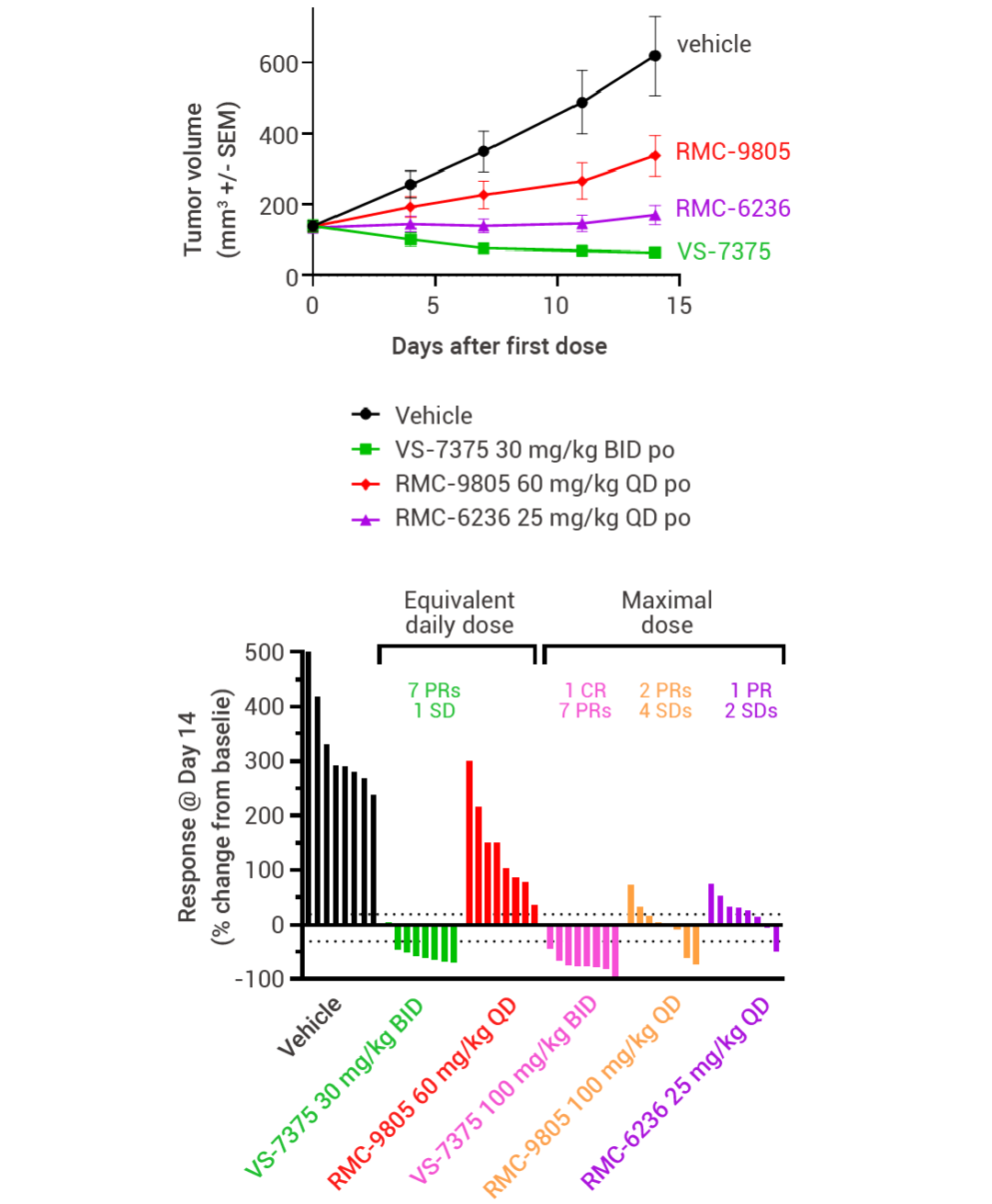
图 6. 使用 VS7375、RMC-9805 或 RMC-6263 治疗接种了 LS513 结肠癌细胞(KRAS G12D 突变)的小鼠 28 天[12]。
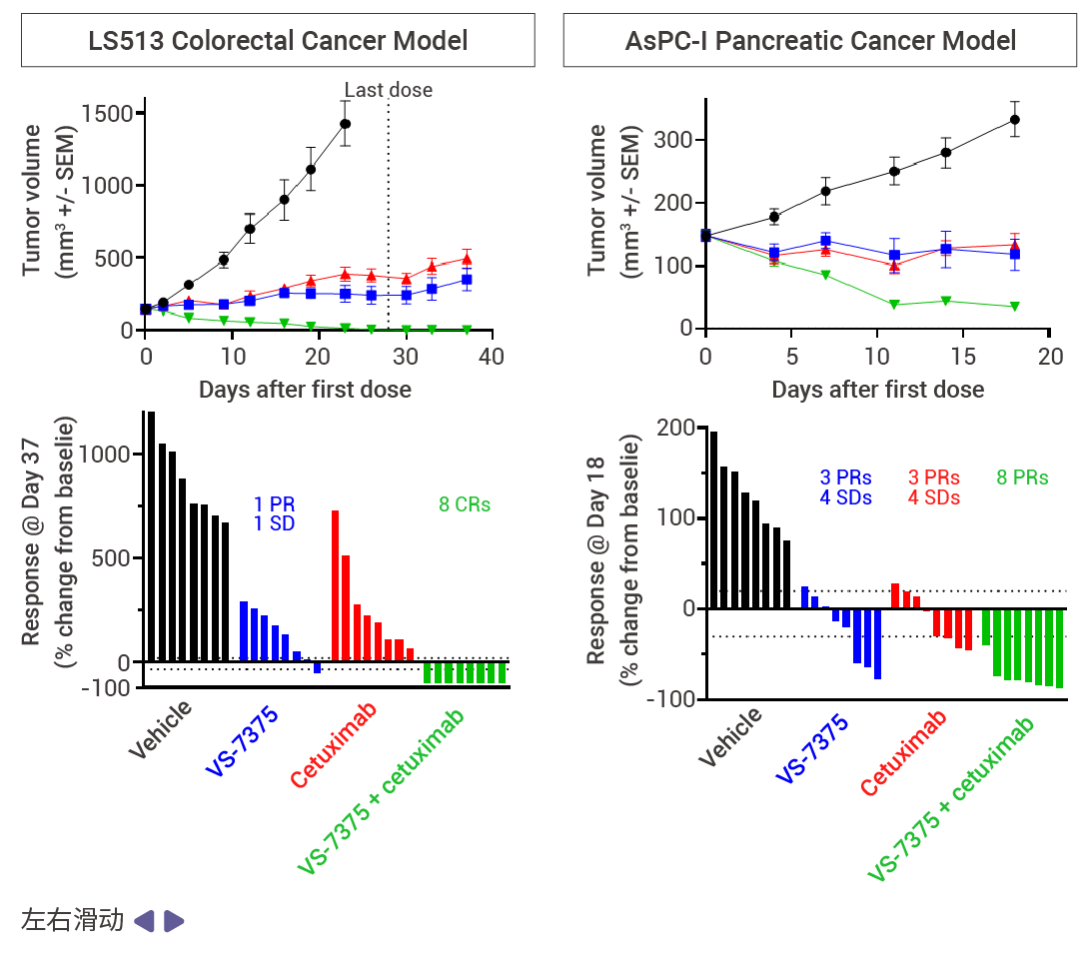
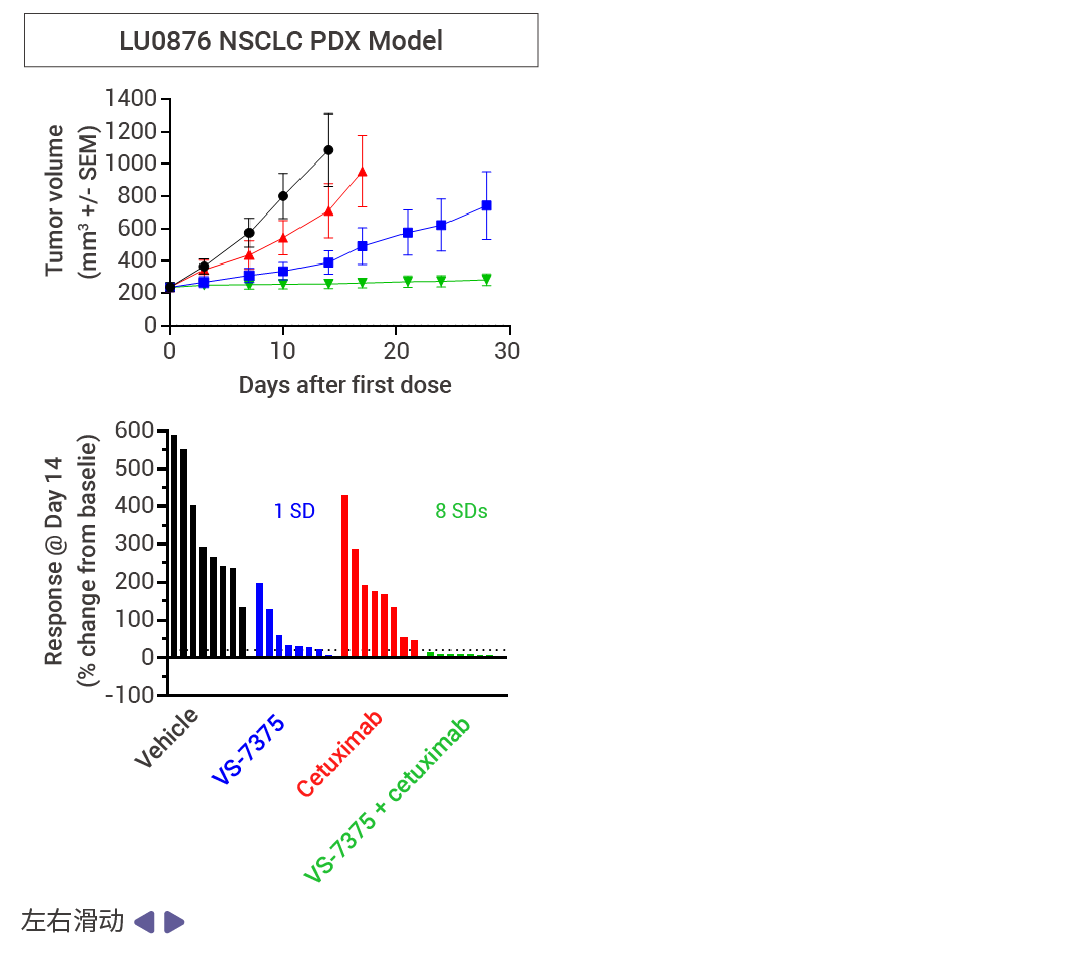
图 7. 使用 VS-7375 或 cetuximab 治疗接种了 LS513, AsPC-1 或 LU876 细胞(KRAS G12D 突变)的小鼠[12]。
其他 KRAS G12D 抑制剂包括 HRS-4642、TH-Z835、JAB-22000 和 ERAS-4 等也正在开发。还有一种 KRAS G12D 降解剂 ASP3082 通过将 KRAS G12D 与 E3 泛素连接酶结合促进蛋白降解[3]。
Section.04
小结
特异性 KRAS G12C 抑制剂改变了 KRAS 突变癌症的治疗格局,使许多 KRAS 突变癌症患者受益。不幸的是,对 KRAS 抑制剂的先天和获得性耐药阻碍了它们的发展,使这些新药的疗效降低甚至无效。作为常见的 KRAS 突变之一。KRAS G12D 驱动高度免疫抑制的肿瘤微环境,并表现出强大的致癌潜力。因此,开发 KRAS G12D 抑制剂以及其他泛 KRAS 抑制剂是 KRAS 靶向治疗的新方向。
推荐产品
Sotorasib (HY-114277)Sotorasib (AMG-510) 是一种有效的,口服生物可利用的,选择性的 KRAS G12C 共价抑制剂。Sotorasib 将 KRAS G12C 锁定在非活跃的 GDP 约束状态。Sotorasib 导致 KRAS G12C 突变的局部晚期或转移性非小细胞肺癌 (NSCLC) 的消退。Adagrasib (HY-130149)Adagrasib (MRTX849) 是一种有效,口服可用,突变选择性的 KRAS G12C 共价抑制剂,具有潜在抗肿瘤活性的。Adagrasib 在半胱氨酸 12 残基处与 KRAS G12C 共价结合,将蛋白锁定在非活性的 GDP 结合构象中,并抑制 KRAS 依赖性信号转导。Fulzerasib (HY-152848)Fulzerasib (GFH925) 是一种不可逆的 KRAS G12C 抑制剂,与西妥昔单抗 (HY-P9905) 具有协同抗癌作用。Opnurasib (HY-139612)Opnurasib (JDQ-443) (NVP-JDQ443) 是一种口服有效和选择性的共价 KRAS G12C 抑制剂。Opnurasib 具有抗肿瘤活性。D3S-001 (HY-160023)Elisrasib 是口服有效的 KRAS 抑制剂。Elisrasib 抑制 KRAS G12C 突变体 H358 和 MIA-PA-CA-2 的增殖,IC50 分别为 0.6 和 0.44 nM。Elisrasib 在多物种的肝细胞、肝微粒体、血浆和全血中表现出良好的代谢稳定性。Elisrasib 在小鼠中表现出良好的药代动力学特征和抗肿瘤活性。
[1] Huang, Lamei et al. Signal Transduct Target Ther. 2021 Nov 15;6(1):386.
[2] Zhu, Chunxiao et al. Mol Cancer. 2022 Aug 4;21(1):159.
[3] Zeissig, Mara N et al. Trends Cancer. 2023 Nov;9(11):955-967.
[4] O'Sullivan, Éabha et al. Cancers (Basel). 2023 Mar 7;15(6):1635.
[5] Isermann, Tamara et al. Trends Cancer. 2025 Feb;11(2):91-116.
[6] Toribio, María Luisa, and Sara González-García. Int J Mol Sci. 2023 Jan 10;24(2):1383.
[7] Prahallad, Anirudh et al. Nature. 2012 Jan 26;483(7387):100-3.
[8] Fakih, Marwan G et al. N Engl J Med. 2023 Dec 7;389(23):2125-2139.
[9] Yaeger, Rona et al. Cancer Discov. 2024 Jun 3;14(6):982-993.
[10] Hofmann, Marco H et al. Cancer Discov. 2022 Apr 1;12(4):924-937.
[11] Pancreatic Cancer Update. Retrieved October 25, 2024.
[12] VS-7375 (GFH375): An oral, selective KRAS G12D (ON/OFF) inhibitor with potent anti-tumor efficacy as single agent and in combination with other anticancer therapies in preclinical models.


https://wap.sciencenet.cn/blog-3536222-1494720.html
上一篇:β-Amyloid (1-42), human,107761-42-2,99.89%_MedChemExpress
下一篇:α-Bungarotoxin,11032-79-4,≥99.0%_MedChemExpress