博文
Onco CD8+ T细胞表位识别的预测的可靠性:对癌症的启示
||
源自抗原序列的合成肽在检测CD8+细胞毒性T淋巴细胞 (CTL) 方面扮演着至关重要的角色,常被应用于酶联免疫斑点试验 (ELISPOT)/ImmunoSpot®等检测手段中。本评论综合分析了病毒与癌症抗原所引发的免疫反应数据,并得出相较于仅依赖有限的精选CD8+ T细胞表位,对CD8+ T细胞实施系统且高通量的免疫监测,能更为准确地揭示宿主针对癌症的免疫反应。
CD8+ T细胞及其特异性反应
CD8+ T细胞能够识别由细胞内蛋白质合成并经由TAP分子递呈在MHC (HLA) I类分子上的肽段,这些肽段作为配体被T细胞受体所识别。为了预测CD8+ T细胞将识别的肽段,研究者们采用了两种方法:经验法和无假设法。研究者们选取人类巨细胞病毒 (HCMV) 的pp65蛋白进行系统性的无假设研究,构建了一个单氨基酸步进的九聚肽库,并实施了系统性的表位映射测试 (见图1)。
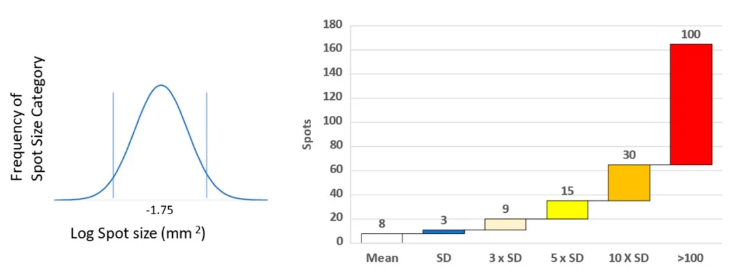
图1. 确定斑点大小及T细胞反应水平
测试结果表明,在10名HLA-A2阳性的受试者中,仅有约10%的肽具有免疫原性。其中,pp65蛋白的第495号肽在多个A2阳性供体中被识别为最著名的免疫主导表位。然而,这也揭示了一个事实:仅依赖此肽的反应强度来指示HCMV特异性记忆T细胞会导致信息的不完整甚至误导。实际上,超级主导肽分散在整个蛋白质序列中,没有明显的共同模式,这表明实际的表位识别层次结构在个体间存在差异且随机。
系统测试显示,先前定义的表位触发CD8+ T细胞的反应程度具有高度可变性,很多时候在预期为阳性的个体中却呈阴性。预测的结合强度并不反映实际引发的CD8+ T细胞反应的强度,这进一步证明了除肽-HLA结合外,还有其他因素决定了CD8+ T细胞反应的激活及其强度。
此外,系统映射结果还显示,每个受试者的CD8+ T细胞反应主要集中在少数几个超级主导表位上,且这些表位在各供体中的分布不可预测。因此,全面的CD8+ T细胞免疫监测对于评估和监控基础免疫反应至关重要。即使专注于单一抗原 (如HCMV的pp65),也不能反映身体动员的CD8+ T细胞对抗病毒的整体规模。对其他病毒 (如EBV和SARS-CoV-2) 的研究也发现了类似的结果。这些数据表明,需要放弃通过表位识别来预测个体实际参与的CD8+ T细胞库的想法,而应进行全面的免疫监测。
CD8+ T细胞反应的质量
研究者们采用四色FluroSpot技术,检测了CD8+ T细胞分泌的细胞因子 (包括IFN-γ、TNF-α、IL-2和颗粒酶B) 的表达模式,以此评估免疫反应的质量以及参与反应的CD8+ T记忆细胞的类型。具体而言,静息记忆细胞主要产生IFN-γ,多功能细胞则共表达所有检测的细胞因子,效应细胞表达IFN-γ、TNF-α和颗粒酶B,而干细胞样细胞则主要分泌IL-2。持续的抗原刺激会导致细胞功能失调,细胞因子产量下降,最终使细胞进入衰老状态并分泌免疫抑制或炎症相关的细胞因子。在健康个体中,针对黑色素瘤抗原的CD8+ T细胞展现出不同的细胞因子共表达模式,这表明四色检测能够为我们提供更深入的免疫反应见解。
结论
在所有病毒环境中,均未发现可预测的免疫主导肽段,这一发现表明,依赖少数肽段进行免疫监测是不可靠的 (如图2所示)。实际上,由于主导肽段难以预测,需要系统地覆盖所有可能的表位,而这只能通过大规模肽库的实现来完成。此外,多肽在混合前的相互干扰问题以及肽段的最佳长度仍有待进一步确定。抗病毒免疫反应已经相当复杂,而抗肿瘤CD8+ T细胞反应则因涉及多种肿瘤相关抗原、自我耐受、表位扩散及T细胞耗竭等因素而变得更加复杂。T细胞耗竭可能首先影响早期抗肿瘤反应的CD8+ T细胞,从而导致效应细胞库的转变。鉴于在病毒环境中表位识别的难以预测性,肿瘤环境中表位识别的预测可靠性更是受到了质疑。
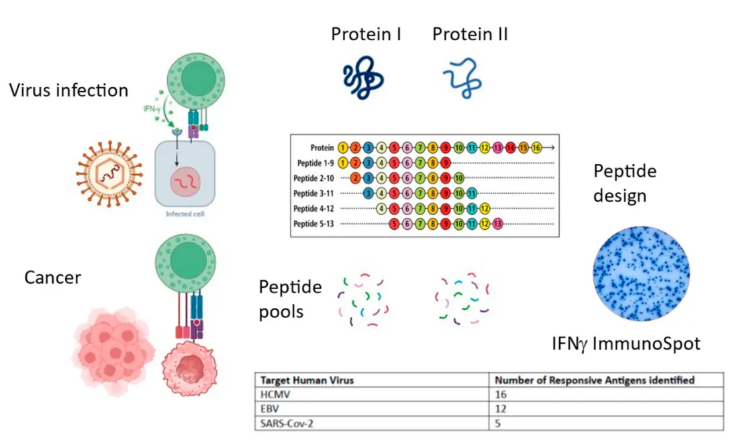
图2. 评论总结
原文出自 Onco 期刊:https://www.mdpi.com/2673-7523/4/2/6
期刊主页:https://www.mdpi.com/journal/onco
Onco 期刊介绍
主编:Constantin N. Baxevanis, Saint Savas Cancer Hospital, Greece
期刊主题涵盖肿瘤靶点和癌症治疗等肿瘤学领域。
Time to First Decision:27.8 Days
Acceptance to Publication:2.8 Days


https://wap.sciencenet.cn/blog-3516770-1472555.html
上一篇:Applied Sciences 山东大学杨磊教授等创建特刊——岩石断裂力学:从理论到实践
下一篇:Symmetry:东北大学吴易鸣博士创建特刊——控制系统和对称/不对称的进展