博文
[转载]不要让肌肉悄悄溜走——关注肌肉减少症及从菌群视角的防治
||
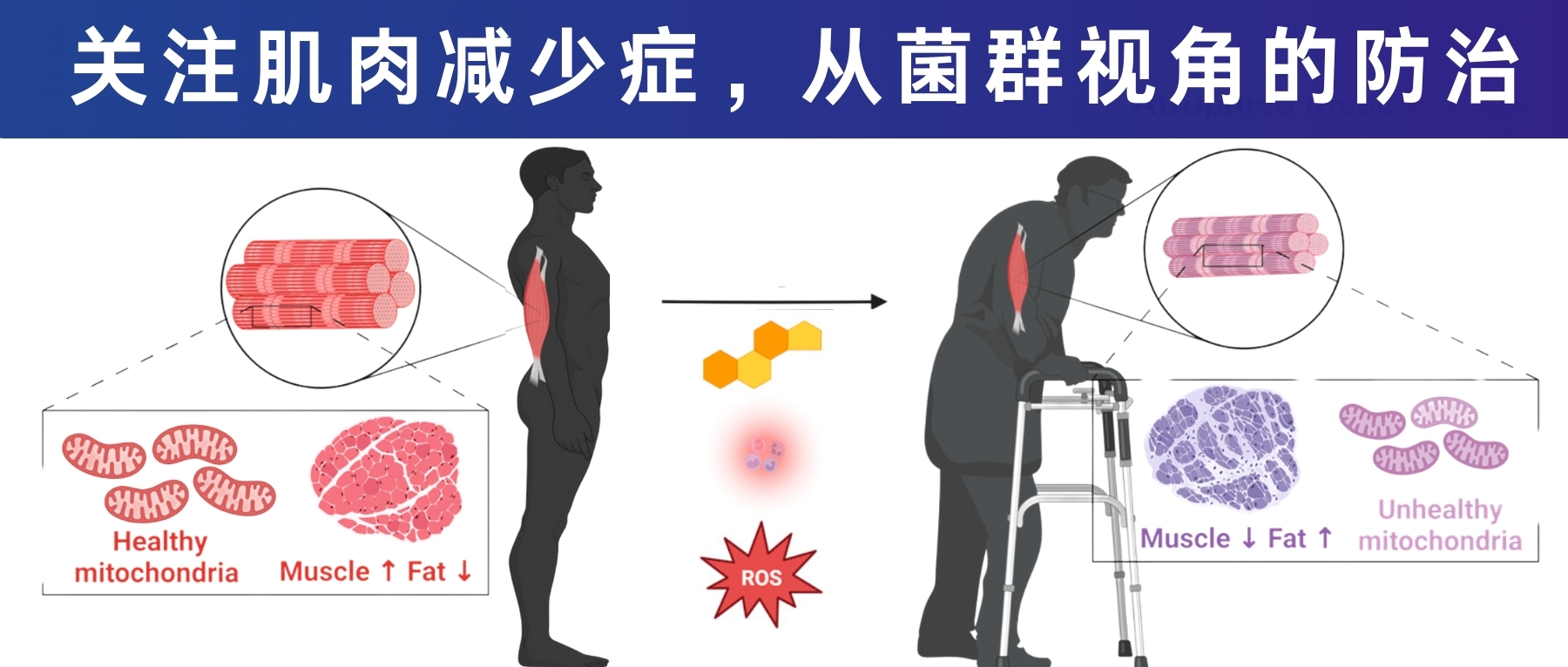
我国的老龄化问题日益突显,老年群体的生活质量是一个高度关注的焦点。许多老年人都会出现行走缓慢、起身或是爬楼梯困难、易失去平衡而摔跤、肌肉明显萎缩等症状。这很多时候都源于一种疾病——肌肉减少症。
肌肉减少症是一种与年龄相关的骨骼肌疾病,其特征是肌肉质量进行性丧失和肌肉力量下降。大约从30岁以后,肌肉质量会因为老化开始逐渐流失;到了40岁后,肌肉会开始以每10年约8%左右的速度流失,如果没有营养和运动干预,70岁时,人体肌肉质量下降约40%,到了80岁,肌肉大约会流失掉50%。据估计,60-70岁人群肌肉减少症的发病率为5-13%,80岁及以上人群更是高达11-50%。
肌肉作为生命的"隐形盔甲",——它保护关节、储存营养、影响代谢等,许多人把肌肉流失当作“自然衰老”,直至跌倒骨折才认识其严重性。肌肉减少症对健康老龄化构成威胁,因为它不仅影响日常活动能力,还会损害代谢与免疫功能,增加肥胖、心血管等疾病病风险,甚至导致死亡率的升高。并且肌肉减少症不仅影响老年人,也威胁中、青年健康。肌肉减少会降低代谢率,易导致肥胖和三高,并与糖尿病、心梗和脑中风密切相关。
如今肌肉减少症已不仅限于老年人,部分年轻人也受其影响。长期"葛优躺"、"咸鱼瘫"、"办公坐"。无论是白天上班,还是晚上回家,很多人动都不愿多动一下,只想瘫着。长此以往后发现,不仅爬个楼梯就膝盖痛,甚至有时连拿个东西都觉得无力。肌肉减少症的主要原因是自然衰老,但缺乏运动、不良的饮食、慢性炎症、肥胖等一些疾病也都会促进肌肉减少症的发生,而这些正是当代年轻人普遍的生活特征。
如何提前预防、减缓或治疗改善肌肉减少症?除了常规的抗阻运动和充足且均衡的营养摄入外。不少研究发现肠道微生物群在肌肉减少症中发挥了不可忽视的作用,并提出了“肠道-肌肉轴”。紊乱的微生物组成可能导致肌肉老化和肌肉减少症的发展。肌肉减少症患者肠道菌群多样性和丰富度都较低,表现为放线菌门和梭杆菌门比例下降,普雷沃氏菌(Prevotella)与拟杆菌(Bacteroidetes)比率(P/B)降低,以及粪球菌属(Coprococcus)和毛螺菌科(Lachnospiraceae)的等产生短链脂肪酸的细菌丰度降低。
肠道微生物群似乎通过多种途径影响肌肉系统:包括调节饮食效果与营养传导,改变肠道通透性和炎症状态,影响肌肉合成代谢/分解代谢平衡,调节线粒体功能与激素分泌,以及影响骨骼肌纤维组成和神经肌肉传递等。
肠道微生物群分析有望帮助我们提前评估营养状况和预测肌肉减少症风险。谷禾肠道微生物检测报告不仅分析菌群状况,还提供营养评估和相关健康指标,有助于早期风险预警。同时有研究证实补充益生菌可以改善肌肉减少症,因此通过调节肠道微生物群可能成为治疗该症的新靶点。
01 认识肌肉减少症及其危害肌肉减少症的定义
肌肉减少症(Sarcopenia),临床上也将其称为“肌少症”。医学定义是肌肉质量、力量和功能逐渐丧失而引起的综合症。
下面是肌肉减少症的一些最常见症状:
•肌无力
•活动时失去耐力或持久力
•行走缓慢
•难以进行日常活动
•爬楼梯困难
•易失去平衡
•肌肉明显萎缩
患病情况
▸ 主要发生在老年人,随年龄增长发病率增高
肌肉减少症通常发生在60岁及以上的老年人群,发病率随年龄的增长明显上升。60-70岁人群发病率为5-13%,80岁及以上人群高达11-50%。
依据2019年亚洲肌少症工作组制订的诊断标准,一项基于我国社区人群的流行病学调查研究结果显示,60岁以上人群的肌少症患病率为14.7%,其中男性肌少症患病率为17.3%,女性为12.5%。
▸ 不良生活习惯导致年轻人群患病增加
然而,近年来有统计发现,我国30岁以下的年轻人,竟有超过两成患“肌少症”。随着生活节奏加快,很多年轻人久坐少动、饮食不规律。
此外,再加上"白幼瘦"等审美观念影响,种种因素相加,增加了年轻人的肌肉流失,使这种原本的老年病,也变得越来越年轻化。肌少症已成一种全球性健康威胁。
肌少症的危害
肌肉和身体健康之间紧密相关,肌肉作为人体最重要的器官之一,意味着力量和生命力。有研究显示,肌肉减少对人体的影响和危害巨大:
肌肉减少10%左右,就可能出现机体免疫功能下降,感染风险增加;
肌肉减少20%左右,就可能出现肌肉无力,日常生活能力下降,跌倒风险增加,伤口愈合延迟;
肌肉减少30%左右,就可能出现日常生活能力下降甚至失能,还易发生压疮;
肌肉减少40%以上,则死亡风险明显增加。
肌肉减少症是一个严重的问题。一旦你失去了大量的肌肉和力量,你可能很难做一些事情,比如从椅子上站起来、打开罐子或搬运物品。也可能变得虚弱,跌倒、骨折、残疾和死亡的风险更高。我们总结肌肉减少症的危害主要有以下几方面:
▸ 身体功能下降与日常生活能力丧失
•跌倒风险增加;
•骨折风险增加;
•行动受限,步行变慢,难以上下楼梯;
•逐渐丧失独立生活能力,无法自理基本日常活动。
▸ 代谢与免疫功能受损
•影响糖代谢,胰岛素敏感性降低;
•炎症水平升高,导致"炎症老化"状态;
•免疫功能下降,增加感染风险;
•肌肉脂肪浸润增加,导致肌肉质量和功能持续下降。
▸ 共病风险增加
•肥胖和三高:中年后很容易出现肥胖等代谢问题。以前大家都把它归咎于吃太多,运动不足,但肌肉减少,基础代谢率降低也是关键所在;
•心血管疾病风险增加:肌少型肥胖者的高血压风险,会高出正常者两倍之多;
•呼吸功能下降:影响呼吸肌功能和肺活量;
•认知功能下降:肌肉减少症与认知障碍有关联;
•术后并发症增加:手术恢复更慢,术后风险更高;
•全因死亡率增加:研究显示肌肉减少症与死亡率有一定的关联。
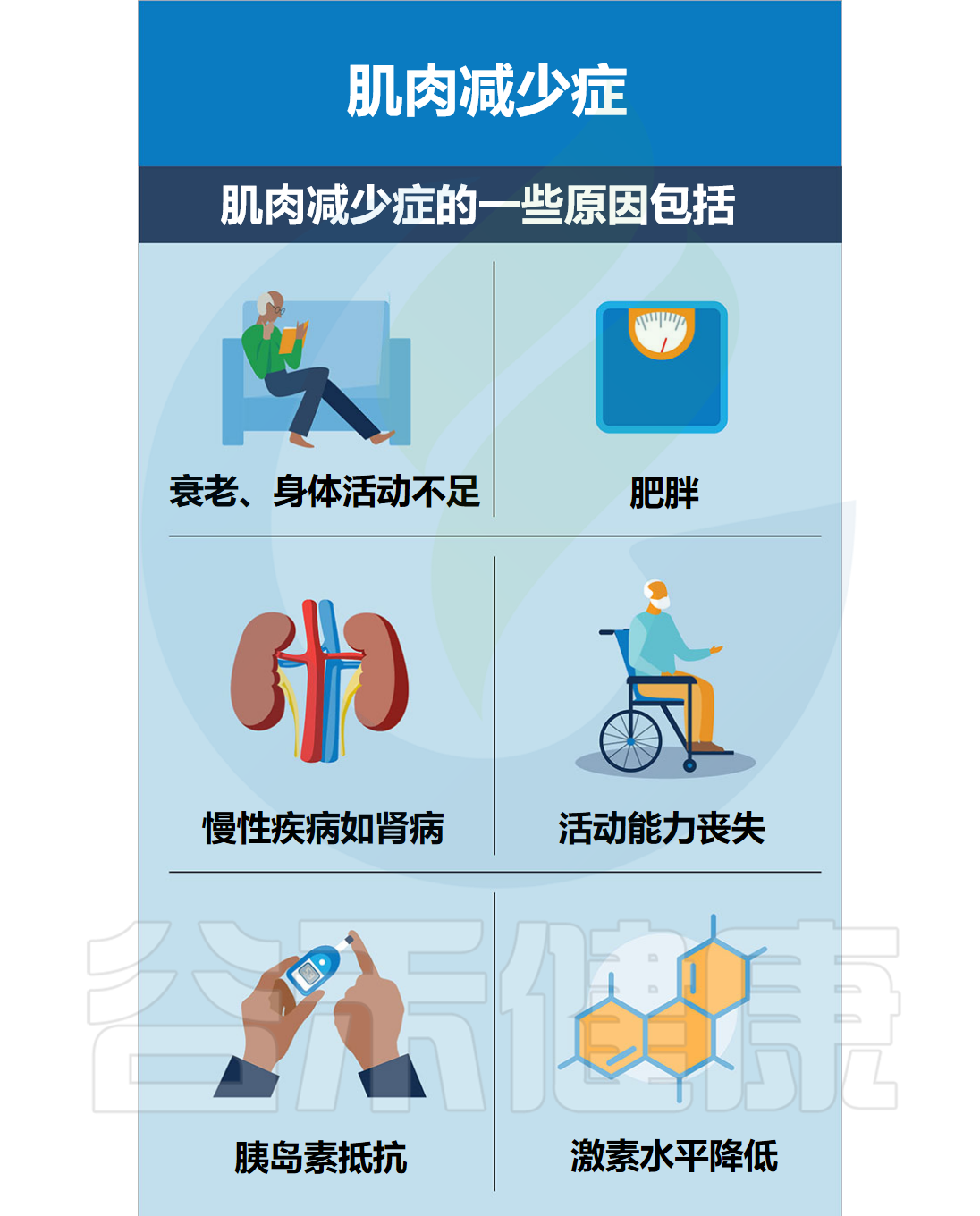
导致肌肉减少症的原因
▸ 自然衰老
肌肉减少症最常见的原因是自然衰老。尽管并非所有长寿者都患此症,但大约从35岁以后,肌肉质量就会因老化开始逐渐流失。到了40岁后,肌肉会开始以每10年约8%左右的速度流失,如果没有营养和运动干预,70岁时,人体肌肉质量下降约40%,到了80岁,肌肉大约会流失掉50%。
随着年龄的增长,我们身体中会发生一些可能导致肌肉减少症的事情:
•负责从大脑向肌肉发送信号以开始运动的神经细胞减少;
•某些激素的浓度较低,包括生长激素、睾酮和胰岛素样生长因子;
•将蛋白质消化利用的能力下降;
•炎症增加,部分原因是疾病。
除了生理性衰老外,还有其他风险因素,例如缺乏运动、不良饮食和慢性疾病,这些因素都会导致肌肉和力量的丧失。
▸ 缺乏运动
研究表明,保持活跃可显著降低肌肉减少症风险。久坐卧床时间越长,肌肉质量和力量流失越多。即使在固定时间锻炼,长时间不活动仍会导致肌肉和力量损失。
▸ 不良饮食
劣质饮食可能导致肌肉减少症,蛋白质摄入不足被认为是主要原因,因为老年人体内蛋白质转化能力下降。部分研究显示蛋白质摄入不足与肌肉减少症相关。水果蔬菜摄入不足也可能是影响因素。富含超加工食品(高糖、高盐、多添加剂和不健康脂肪)的饮食同样与低肌肉质量有关。
一般来说,营养不良的老年人,无论是摄入量不足还是营养质量不佳,都面临更高的肌肉减少症风险,且病情恶化速度更快。
▸ 肥胖
肥胖似乎会加重肌肉减少症。高水平的体脂会增加炎症并改变胰岛素反应,这两者都可以加速肌肉流失。肥胖还会降低活动能力,形成肌肉流失和脂肪堆积的恶性循环。
▸ 慢性疾病
患有慢性阻塞性肺病(COPD)、肾病、糖尿病、癌症或艾滋病等慢性疾病会增加患肌肉减少症的风险。
人们有时会将肌肉减少症与其他疾病混淆,以下是两种症状相似且易混淆的疾病。
▸ 肌肉减少症与恶病质的区别
病因不同:恶病质主要由癌症、感染、肾病等慢性消耗性疾病引起;肌肉减少症主要由自然老化、激素水平和蛋白质合成减少相关。
表现差异:恶病质除肌肉流失外,还伴有明显的非自愿性体重减轻和脂肪组织丢失,是全身性消耗,并且进展迅速,常在数周或数月内显著恶化;而肌肉减少症进展缓慢,通常在数年间发展,且主要影响肌肉组织。
危害:肌肉减少症主要是增加跌倒和骨折风险、降低日常生活自理能力;而恶病质严重影响治疗效果,是晚期疾病的不良预后标志,显著增加死亡风险。
▸ 肌肉减少症与身体虚弱的区别
病因不同:身体虚弱源于多系统生理储备减退,涉及肌肉、神经、内分泌和免疫系统等,且心理社会因素在发病过程中具有重要影响。
表现差异:表现为虚弱表型五项特征(非自愿体重减轻、自我报告的疲劳感、肌力下降、步行速度减慢、体力活动水平降低),虽与肌肉减少症高度重叠但不等同,范围更广,涵盖全身各系统功能衰退。
危害:身体虚弱会导致全方位健康状况恶化的风险更高,面对应激时缺乏稳态解决能力,对各种医疗干预的耐受性下降。
02肠道菌群改变:可能是肌肉减少症的重要特征我们知道,肠道微生物群在免疫、内分泌、能量代谢稳态和整体健康等方面都起着至关重要的作用。肠道菌群失调和肌肉减少症又都常见于老年人,那么两者之间是否存在一定的联系呢?
近年来许多研究聚焦于肌肉减少症与肠道菌群组成之间关系,发现菌群失调与骨骼肌量和功能降低相关。并有研究发现,肠道微生物群及其代谢物可以作用于肌肉,还提出了“肠-肌肉轴”理论 。
参与“肠肌肉轴”发病机制的关键驱动因素
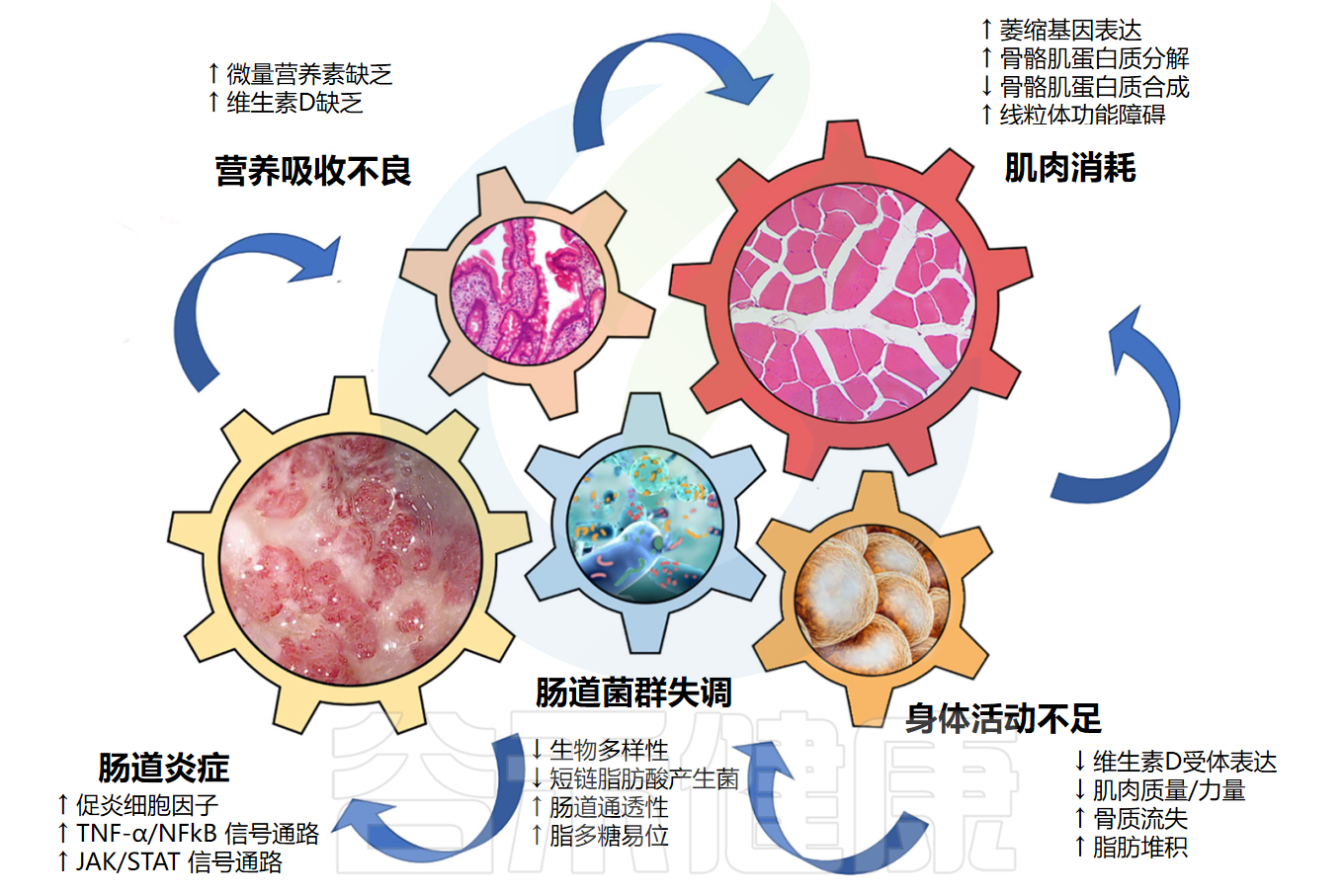
Nardone OM,et al.Front Immunol.2021
2024年一项涉及4307名43至87岁参与者的17项随机对照研究荟萃分析,基于16S rRNA基因测序揭示了肌肉减少症患者肠道菌群特征变化。

肌肉减少症患者的肠道菌群变化
▸ 肠道菌群的多样性和丰富度低于正常人
研究发现,肌肉减少症患者肠道菌群的多样性和丰富度低于健康对照组。在门水平上,放线菌门和梭杆菌门的比例下降(梭杆菌门减少20%至28%,放线菌门减少7%至10%),而其他门没有显著变化。
在属水平上,Akkermansia、Dialister、Dorea、Lachnospiraceae、Ruminococcaceae、Coprococcus、Faecalibacterium、Megamonas、Phascolarctobacterium、Prevotella、Lachnoclostridium、Paraprevotella、Ruminococcus_2、Streptococcus和Subdoligranulum的比例下降,瘤胃球菌科、粪杆菌属、普雷沃氏菌属、 Lachnoclostridium 显著减少(下调3%),而其他细菌略有减少(下降1%)。
Alistipes、Bacteroidota、Escherichia、Eubacterium_rectale_group、Flavonifractor、g-Bacteroides、 g-Lactobacillus、o-Clostridiales、g-Parabacteroides和Shigella的比例增加,其中拟杆菌属的增加幅度最大(上调12%),副拟杆菌属和志贺氏菌的比例增加2%,其他细菌增加1%。
▸ 菌群的变化可能是肌少症的早期迹象或标志物
具体来说,普雷沃氏菌(Prevotella)与拟杆菌(Bacteroidetes)比率(P/B)的降低,以及粪球菌属(Coprococcus)和毛螺菌科(Lachnospiraceae)的丰度降低,是重要的指标。
普雷沃氏菌(Prevotella)和拟杆菌(Bacteroidetes)参与膳食纤维的发酵和短链脂肪酸(SCFA)的产生,这对维持肌肉质量和功能至关重要。较低的P/B比率表明SCFA的产生能力降低,这可能会对肌肉健康产生负面影响。同样,粪球菌属(Coprococcus)和毛螺菌科(Lachnospiraceae)也是产生SCFA的细菌,它们的减少与SCFA水平降低有关,导致肌肉萎缩和无力。因此,监测这些特定的细菌标志物可以提供肌肉减少症的早期迹象,从而允许及时干预。
肠道菌群和肌肉力量
肠道菌群和肌肉功能参数也显示出了一定的关联,肌肉力量下降是肌肉减少症的一个重要特征。通过使用手持测力计测量优势侧握力评估肌肉力量。
注:该参数在生理上会随着年龄的增长而下降,但在满足肌肉减少标准的患者中,其降低通常更为明显。
▸ 肌肉力量下降的人群体内促炎微生物更丰富
在最近的一项观察性研究中发现,过度饮酒的人们的握力较低,变形菌门、萨特氏菌属、梭状芽胞杆菌属和霍尔德曼氏菌属的相对丰度较高,而粪杆菌属的相对丰度较低。
粪便微生物群的这些变化伴随短链脂肪酸水平降低,表明存在促炎微环境。这些结果表明微生物群可能对肌肉力量产生一些影响。
▸ 调整肠道微生物群有助于改善握力等肌肉功能
一项对60名疗养院老人的随机对照试验显示,菊粉和低聚果糖益生元干预13周后,握力显著提升。虽未直接评估肠道菌群,但菊粉和低聚果糖对肠道微生物群组成有已知有益的影响。补充菊粉可以提高人体中双歧杆菌、嗜胆菌的相对丰度,而低聚果糖具有选择性增加双歧杆菌丰度的能力。益生元还刺激微生物合成SCFAs,从而改善钙吸收和骨矿化。
正如最近的一项系统评价所表明的那样,骨骼健康和钙稳态与肌肉减少症发作密切相关。因此,握力改善可能由肠道菌群变化调节炎症和代谢平衡所致。
综上,人类肠道菌群与肌肉力量可能相关,双歧杆菌和粪杆菌被认为是主要参与者。这两个属之间存在相互作用,粪杆菌合成丁酸盐的能力是由双歧杆菌的丰度介导的,在可能的肌肉力量-微生物群关联中也应考虑。
肠道菌群和步行速度
步行速度是衡量老年肌肉减少症的一项参数,能预测行动不便和死亡率,且与多种慢性疾病进展相关。慢步态(≤0.8m/s)与事故残疾显著相关,尽管临界值因环境和人群而异。
注:步行速度通常在4米直线路径上以患者平常行走速度测量,推荐使用电子设备以提高精度和可重复性。
▸ 肠道菌群可以影响运动功能
肠道菌群与步行速度关系的研究较少。一项动物实验显示,无菌状态或抗生素使用导致运动过度活跃,比肠道菌群正常的移动更快。向无菌果蝇添加特定乳酸菌后恢复正常运动行为,表明肠道菌群可通过调节糖代谢和章鱼胺能系统(相当于人类去甲肾上腺素系统)影响运动功能。
一项对32名65岁以上久坐女性的非随机比较试验显示,躯干肌肉训练与有氧运动后肠道菌群组成发生特异性变化,拟杆菌属丰度与6分钟步行测试中步态速度增加呈正相关。另一项绝经前健康女性研究表明,拟杆菌属丰度与心肺健康相关,但未直接评估步态速度。
最后,在一项随机对照试验中,在36名肝硬化患者中测试了多菌株益生菌与安慰剂的效果发现,益生菌给药诱导的肠道微生物群有益修饰与步态速度的改善有关。
这些研究表明肠道菌群组成可能与步行速度相关,但均未针对肌肉减少症老年人开展,研究未能确立菌群与步态速度变化间的因果关系。
此外,步行速度作为功能参数不仅依赖肌肉力量和功能,还取决于中枢神经系统功能。衰老过程中,微生物群通过多种机制影响大脑生理学,这些机制可能影响老年人步行速度和功能依赖性。肠道细菌产生神经递质(γ-氨基丁酸、去甲肾上腺素和多巴胺)的能力及调节宿主产生血清素的能力,似乎与菌群组成和步行速度的关联有关。因此,这些关联可能不仅取决于肠道-肌肉轴,还与微生物对大脑的影响有关。
改善微生物群对肌肉的影响
▸ 肠道菌群失调可能导致炎症引发神经肌肉功能受损
评估肠道菌群改善对肌肉质量和功能影响的研究较少,多集中于动物模型。一项研究证明,向小鼠癌症模型给予含罗伊氏乳杆菌(一种FoxN1调节剂)的益生菌可抑制恶病质发展并维持肌肉质量。
部分益生菌具有明显抗炎作用,可能通过促进合成代谢有益肌肉健康。例如,含普拉梭菌(主要SCFA生产者之一)的益生菌制剂能改善小鼠肝脏合成代谢并减少全身炎症。同样,螺旋藻(一种食品添加剂或补充剂)治疗可改善老年小鼠炎症和氧化应激生物标志物。
此外,动物研究还评估了抗生素引起的肠道菌群失调的全身影响。肠道菌群失调与骨骼强度和机械性能受损相关,可能因成骨减少导致合成代谢刺激不足。抗生素诱导的菌群失调会干扰小鼠神经肌肉传递,可能促进肌肉蛋白质分解代谢。
03肠道微生物群及其代谢物如何影响肌肉减少症?越来越多证据显示肠道菌群可能参与肌肉减少症的病理生理学。但肠道微生物群及其代谢物究竟是如何影响肌肉减少症的?
我们通过查阅文献并汇总,认为肠道菌群可能通过以下方式影响肌肉减少症:
微生物群作为营养信号的传感器
▸ 肠道微生物群会影响饮食的效果、营养的传导
肠道微生物群会影响宿主代谢平衡。例如无菌小鼠即使在喂食高脂肪饮食时也表现出持续的瘦表型。即使在均衡饮食的情况下,将营养不良人类的粪便微生物群移植到无菌小鼠也会导致生长缺陷。
将猪肠道菌群移植到瘦无菌小鼠中,导致肌肉纤维结构发生显著变化,类似于猪的典型变化。因此,微生物群可以作为向宿主发送营养信号的基本转导,而饮食则塑造微生物群组成和功能。
肠道菌群与营养和肌肉功能

doi: 10.3390/nu9121303.
饮食会影响微生物群的组成;反过来,微生物群将一些营养物质(包括纤维和蛋白质)代谢成介质,例如短链脂肪酸,进入体循环。
这些介质通过调节炎症和促进胰岛素敏感性产生的多种信号通路,对肌细胞,即对它们的线粒体产生已知影响。图下半部分显示体育锻炼能直接调节肠道菌群组成,并标明了相关参与因子。
▸ 肠道微生物群对氨基酸吸收和肌肉合成很重要
蛋白质摄入对骨骼肌具有公认的促合成代谢作用,有利于肌肉质量的沉积与体育锻炼协同作用。这种影响可能是由肠道微生物群介导的。例如在肉鸡中,在类似的饮食方案下,肌肉质量的增长速度深受特定肠道微生物群代谢型的影响,这表明肠道微生物群在氨基酸吸收和促进肌肉合成代谢方面发挥着重要作用。
一项对38名超重人群的随机对照试验显示,与麦芽糖糊精对照组相比,接受酪蛋白和大豆蛋白3周补充后,细菌代谢明显转向氨基酸降解和发酵。这表明肠道菌群可通过增加氨基酸生物利用度并刺激骨骼肌中胰岛素分泌和反应来促进蛋白质合成代谢。动物研究表明,微生物产生的支链氨基酸(BCAA)增加与胰岛素敏感性和蛋白质合成改善相关。
▸ 但过度高蛋白饮食并不一定对肌肉有利
需要注意的是,高蛋白饮食对微生物群的影响可能并不总是对肌肉有利。高蛋白饮食小鼠的肠道菌群表现为厚壁菌门/拟杆菌门比率降低、病原体(如肠杆菌科)增加,同时产生代谢调节剂(如SCFA)的菌群减少,导致体重减轻并可能对肌肉代谢产生负面影响,包括炎症调节减少和胰岛素抵抗增加。一项人体随机对照试验也发现,耐力运动员长期服用牛肉蛋白补充剂导致健康相关菌群(包括双歧杆菌、Roseburia和Blautia)减少。
因此,蛋白质摄入与微生物群组成的关系及其对宿主代谢的影响复杂且尚未完全明确。蛋白质摄入对肠道菌群组成及肌肉质量沉积的影响可能取决于蛋白质质量和微生物群代谢型,微生物群介导的蛋白质摄入促合成代谢反应可能因个体差异而不同。
肠道菌群影响肌肉质量
肠道微生物群参与氨基酸的代谢、吸收和活力。膳食蛋白质被宿主和细菌的蛋白酶/肽酶水解成肽和氨基酸,这些产物能够调节全身能量状态,支持肠道菌群生长和生存。
▸ 肠道菌群可以影响肌肉合成对蛋白质的需求
有证据表明,肠道微生物群组成的改变可以决定肌肉合成对蛋白质的更高需求,那些老年肌细胞的特征现象(即所谓的“合成代谢抵抗”)。合成代谢抵抗是导致肌肉蛋白质合成减少和随之而来的肌肉生理改变的原因,促进肌肉减少症发生。
合成代谢抵抗现象与参与肌肉合成的蛋白质基因表达改变有关,受损的氨基酸转运到肌肉中,使流向骨骼肌的营养血流失调,减弱蛋白质消化和吸收,肌肉蛋白分解增加和骨骼肌干细胞的损失。
▸ 短链脂肪酸等菌群代谢物会调节肌肉合成代谢
证据支持肠道-肌肉轴的存在,其中肠道微生物群组成可以通过产生介质来影响肌肉质量合成代谢和宿主的功能。一般来说,随年龄增长,肠道菌群中短链脂肪酸(SCFA)生产者减少。SCFA能够调节蛋白质调节途径,增加ATP的产生,通过调节全身合成代谢/分解代谢平衡来影响骨骼肌蛋白质沉积刺激骨骼肌葡萄糖摄取,并影响胰岛素敏感性和炎症等功能。
肠道菌群影响氨基酸进入门静脉循环供全身使用。菌群失调会降低膳食蛋白质和促进肌肉蛋白合成的特定氨基酸(如色氨酸)的生物利用度。
肠道菌群代谢物可能参与骨骼肌功能
 doi: 10.3390/nu9121303.
doi: 10.3390/nu9121303.
▸ 肠道微生物群本身也可以合成一些氨基酸
肠道微生物群本身可以合成氨基酸,这是肌肉蛋白质合成代谢的关键底物,衰老会损害微生物群合成赖氨酸、异亮氨酸、亮氨酸和缬氨酸的能力,从而增加其蛋白水解功能。肠道微生物群还参与维生素的合成,包括叶酸、维生素B12和核黄素,介导这些营养素对骨骼肌细胞的促合成代谢作用。
▸ 肠道菌群变化会改变骨骼肌纤维组成并影响肌肉力量
此外,肠道菌群的年龄相关变化能诱导肌内脂肪浸润。动物模型显示,特定菌群会改变骨骼肌纤维组成。值得注意的是,随年龄增长,肌肉力量下降幅度大于肌肉质量,主要由于肌肉纤维分布改变(I型纤维比例增高、II型纤维萎缩)以及肌纤维间脂肪积累。
肠道与肌肉的交流可能是双向的。研究表明,运动训练与有益的菌群谱(生物多样性和代谢活性物质产生)相关。
炎症性衰老导致肌肉减少
老年人肠道菌群特征是由促炎与抗炎途径失衡引起的慢性低度炎症("炎症性衰老")所促成。炎症性衰老部分源于免疫衰老现象,表现为免疫功能失调、CD-28共刺激分子丧失和端粒缩短。
▸ 肠道菌群及其代谢物影响炎症性衰老
肠道菌群及其代谢物在炎症性衰老中扮演重要角色。衰老的肠道菌群抵抗有害微生物、清除代谢物的能力下降,循环内毒素水平升高。因此,调整肠道菌群的饮食改变可能影响促炎/抗炎介质释放,维持表型变化。
免疫系统受菌群与肠道细胞间互动调节。健康肠道菌群调控免疫系统发育和稳态,维持炎症平衡并抑制慢性炎症。短链脂肪酸通过减少促炎细胞因子和趋化因子分泌及巨噬细胞浸润发挥抗炎作用。特别是,丁酸盐诱导IL-10、视黄酸和TGF-β分泌,并刺激抗炎调节性T细胞产生。
▸ 炎症反应会通过影响合成代谢导致肌肉减少
肠道菌群通过维持肠屏障功能调控脂多糖和促炎细菌内毒素的吸收,参与炎症调节。动物研究表明,年龄相关的肠道菌群变化与肠道通透性增加相关,这主要由上皮紧密连接损伤引起。屏障功能的这种改变促进宿主全身炎症。肠道菌群失调会刺激肠上皮细胞分泌粘蛋白,增加病原体进入肠粘膜的几率。丁酸盐则通过增强紧密连接组装减轻炎症,阻止内毒素易位。
这些机制导致炎症反应改变,可能通过在骨骼肌促进分解代谢并抑制合成代谢来加速肌肉流失。
菌群失调导致线粒体功能障碍
肠道菌群能影响肠道屏障稳态,实验表明,在肠道菌群存在时,肠道上皮能产生生理水平的氧化应激。氧化应激与肠道菌群组成、功能及肠壁通透性相互作用,从而调节外源分子进入体循环的可能性。
▸ 不健康的菌群会使线粒体损伤进而改变肌肉稳态
不健康的肠道菌群抗氧化能力下降,可能导致年龄相关的肌细胞线粒体质量降低。线粒体损伤释放的分子激活线粒体DNA诱导的炎症途径,促使炎症细胞释放细胞因子、趋化因子、活性氧和一氧化氮,造成慢性炎症持续并形成恶性循环,从而改变肌肉稳态。
线粒体功能障碍影响肌肉减少症
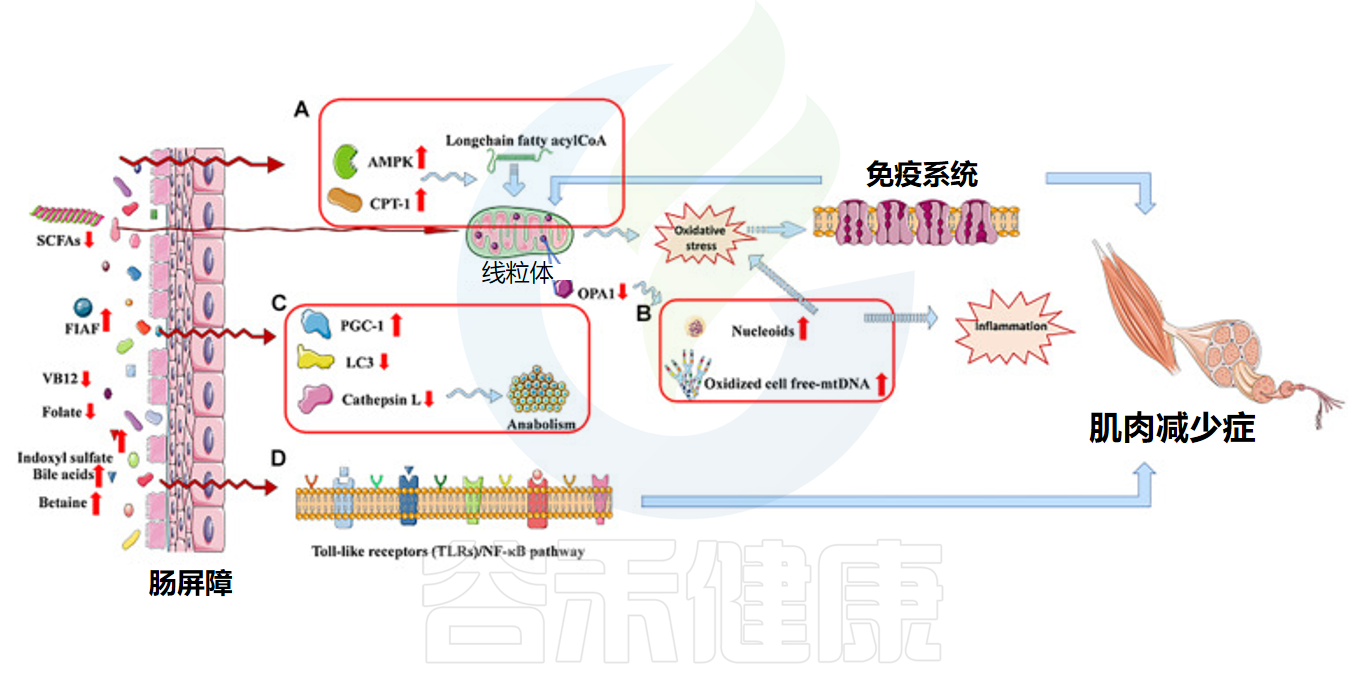
doi: 10.3389/fbioe.2020.590869.
研究表明,肌细胞质量控制过程的变化可能参与肌肉减少症的发生。老年肌细胞中线粒体功能障碍和自噬信号分子表达降低是衰老现象的组成部分。这些变化可能导致受损线粒体清除效率低下和功能失调细胞器积累,引起肌肉萎缩。肠道菌群产生的短链脂肪酸等代谢物可能积极参与骨骼肌中的线粒体生物发生。
肠道微生物群和骨骼肌的分子信号通路

doi: 10.1002/jcsm.12784.
有害细菌代谢物(硫酸吲哚酯和脂多糖)和肠道菌群缺失诱导肌肉萎缩。这些物质通过激活PI3K/AKT、NF-κB和MAPKs信号通路,上调E3泛素连接酶基因(Atrogin-1/MAFbx和MuRF1)及炎症因子,导致肌肉萎缩和炎症。
细菌耗竭条件下,AMPK-FoxO3-Atrogin-1/MuRF1级联反应和BCAAs分解代谢被激活,同时IGF1、肌生成素和MyoD表达降低,肌肉生长抑制素升高,神经肌肉接头和线粒体功能受损。
胰岛素抵抗加速肌肉损失
健康肠道菌群可降低胰岛素抵抗。肠道菌群失调和肠屏障改变导致短链脂肪酸和次级胆汁酸减少,同时脂多糖和支链氨基酸的吸收与循环水平增加,这些变化共同导致胰岛素抵抗。
短链脂肪酸增强胰岛素敏感性,在调节葡萄糖摄取和代谢中发挥关键作用。它们提高能量消耗,改善葡萄糖耐量。次级胆汁酸则通过激活胰高血糖素样肽-1分泌防止胰岛素抵抗,影响葡萄糖稳态。脂多糖结合并激活toll样受体4信号通路,诱导胰岛素抵抗、亚临床炎症和肥胖。循环支链氨基酸水平升高与2型糖尿病发病率增加5倍相关。
▸ 胰岛素抵抗会加速肌肉质量和力量的流失
胰岛素抵抗和糖尿病与肌肉质量和力量的加速损失有关。胰岛素在刺激肌细胞中线粒体蛋白合成和抑制蛋白水解中起关键作用。由于信号系统的改变,响应胰岛素的蛋白质合成正常增加受损,促进了肌细胞中与年龄相关的合成代谢抵抗。
众所周知,肌肉减少症(即肌肉生长和再生的损害)的特征是生长激素(GH)和胰岛素样生长因子1(IGF-1)浓度下降。有证据表明,短链脂肪酸促进全身性 IGF-1 释放,这表明由于细菌失调而改变这些微生物群介质可能会影响肌肉健康。
04如何通过肠道菌群更好地防治肌肉减少症?肠道微生物群与肌肉健康密切相关,构成"肠道-肌肉轴"。这一关系使肠道菌群可能成为肌肉减少症早期诊断、预防和辅助治疗的重要指标和潜在干预靶点。
谷禾的肠道微生物群检测可为肌肉减少症的早期诊断和预防提供哪些关键信息?让我们接着往下看。
作为肌肉减少症的生物标志物
许多研究表明,肌肉减少症患者肠道菌群的多样性和丰富度低于健康对照组,这种变化先于临床症状出现。
▸ 关键菌属丰度变化
•放线菌门和梭杆菌门的比例下降;
•普雷沃氏菌(Prevotella)和粪球菌(Coprococcus)等有益菌群减少;
•普雷沃氏菌(Prevotella)与拟杆菌(Bacteroidetes)比率(P/B)的降低;
•变形菌门尤其大肠杆菌等机会病原菌增加;
•产丁酸盐菌群(如Lachnospiraceae和Ruminococcaceae科细菌)减少。
▸ 菌群代谢物作为生物标志物
短链脂肪酸:尤其是丁酸盐,在肌肉健康中起关键作用。检测报告中显示的短链脂肪酸水平可作为评估风险的生物标志物。
次级胆汁酸:次级胆汁酸水平改变与胰岛素敏感性和肌肉质量相关。
色氨酸代谢物:肠道菌群参与色氨酸代谢,其代谢产物(如血清素等)与系统性炎症和肌肉功能相关。
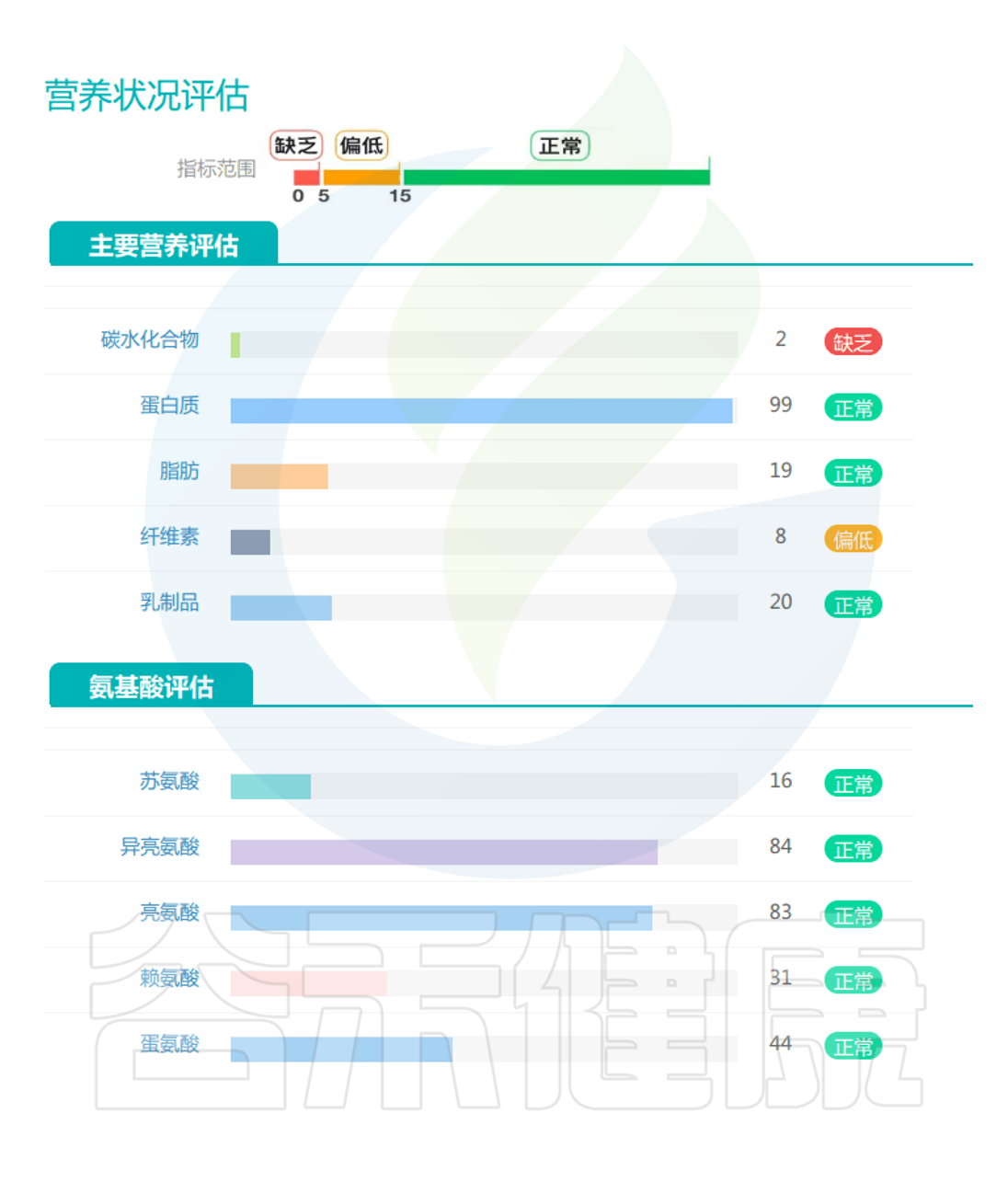
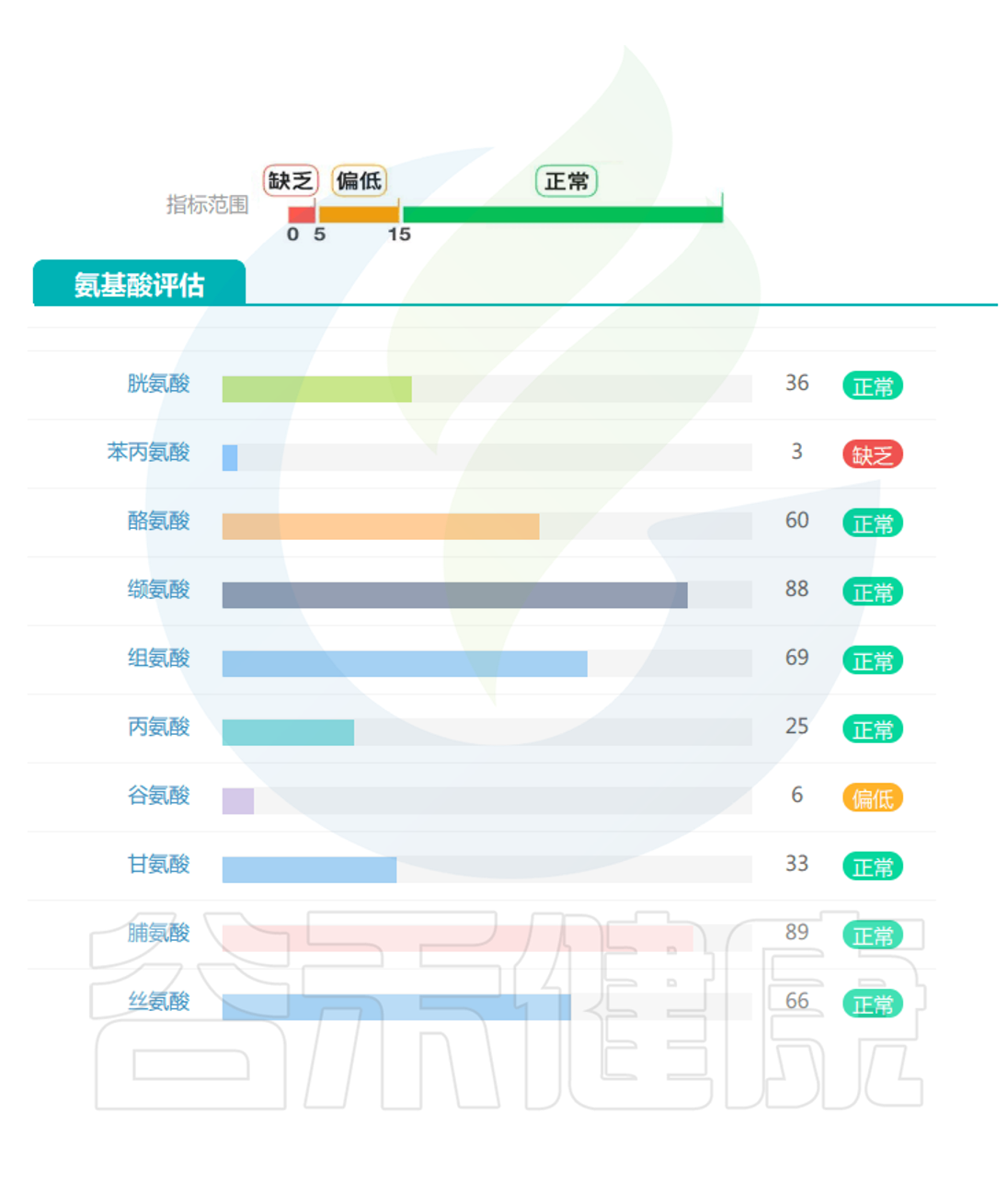
评估营养状况
营养不足是肌肉减少症的主要原因之一,谷禾肠道微生物检测报告中有专门的营养评估内容,以及一些与营养相关的健康指标,这些有助于提前预测肌肉减少症风险。
<来源:谷禾健康肠道菌群检测数据库>
▸ 根据营养指标评估是否营养不良
蛋白质和氨基酸:这是与肌肉减少症最直接相关的重要指标。作为构成肌肉组织的基本单位,蛋白质及其组成成分氨基酸的代谢状况直接影响肌肉的合成与分解平衡,因此在预测和诊断肌肉减少症风险中具有核心意义。
短链脂肪酸(SCFAs):作为膳食纤维发酵的主要产物,肠道SCFAs水平直接反映了膳食纤维摄入状况。丁酸盐、丙酸盐和乙酸盐的比例和浓度在肌肉健康中起关键作用。
氨基酸代谢物:支链氨基酸(BCAAs)代谢异常与肌肉减少症相关。
次级胆汁酸:胆汁酸代谢反映肠道对脂质消化吸收的能力,次级胆汁酸水平的变化与胰岛素敏感性和肌肉质量维持相关。
注:谷禾健康与临床机构合作成立的临床营养检测评估技术中心,致力于使营养检测更具体、更直观,扩展肠道菌群检测应用,克服传统营养评估方法局限,为临床提供更有价值的数据支持。
▸ 宏基因组反映消化吸收能力
肠道微生物的功能基因组学分析也可提供营养代谢能力的证据:
KEGG通路富集分析:与蛋白质消化、氨基酸代谢和能量转换相关的功能通路在肌肉减少症患者中表现异常。
碳水化合物活性酶谱:反映消化复杂碳水化合物的能力。
蛋白酶和肽酶活性:与蛋白质消化吸收效率相关。
除了在预防和提前诊断中发挥作用外,肠道菌群还能够在改善或治疗肌肉减少症患者中起到一定辅助作用。
补充益生菌改善肌肉减少症
已经有不少研究证实使用益生菌可以改善肌肉质量和力量。2021年一项随机双盲临床试验证实,口服植物乳杆菌(Lactobacillus plantarum TWK10)六周可有效提升虚弱老年人的肌肉质量和功能,预防肌肉减少症。
同年另一项研究表明,植物乳杆菌TWK10通过提高肌肉组织糖原浓度和调节肠道菌群,预防小鼠因衰老导致的肌肉无力、骨质流失和认知障碍。
此外研究发现,补充干酪乳杆菌(L.casei Shirota)(LcS)可通过肠道肌肉轴减轻衰老小鼠的肌肉减少症。LcS通过改变肠道菌群组成、改善线粒体功能、降低炎症和活性氧水平及维持短链脂肪酸水平,减缓与衰老相关的肌肉质量损失。
从一位举重金牌运动员肠道分离出的长双歧杆菌(Bifidobacterium longum OLP-01),连续补充4周可剂量依赖性地提高小鼠握力和耐力。
肌肉减少症的发展可以受肠道微生物群调节
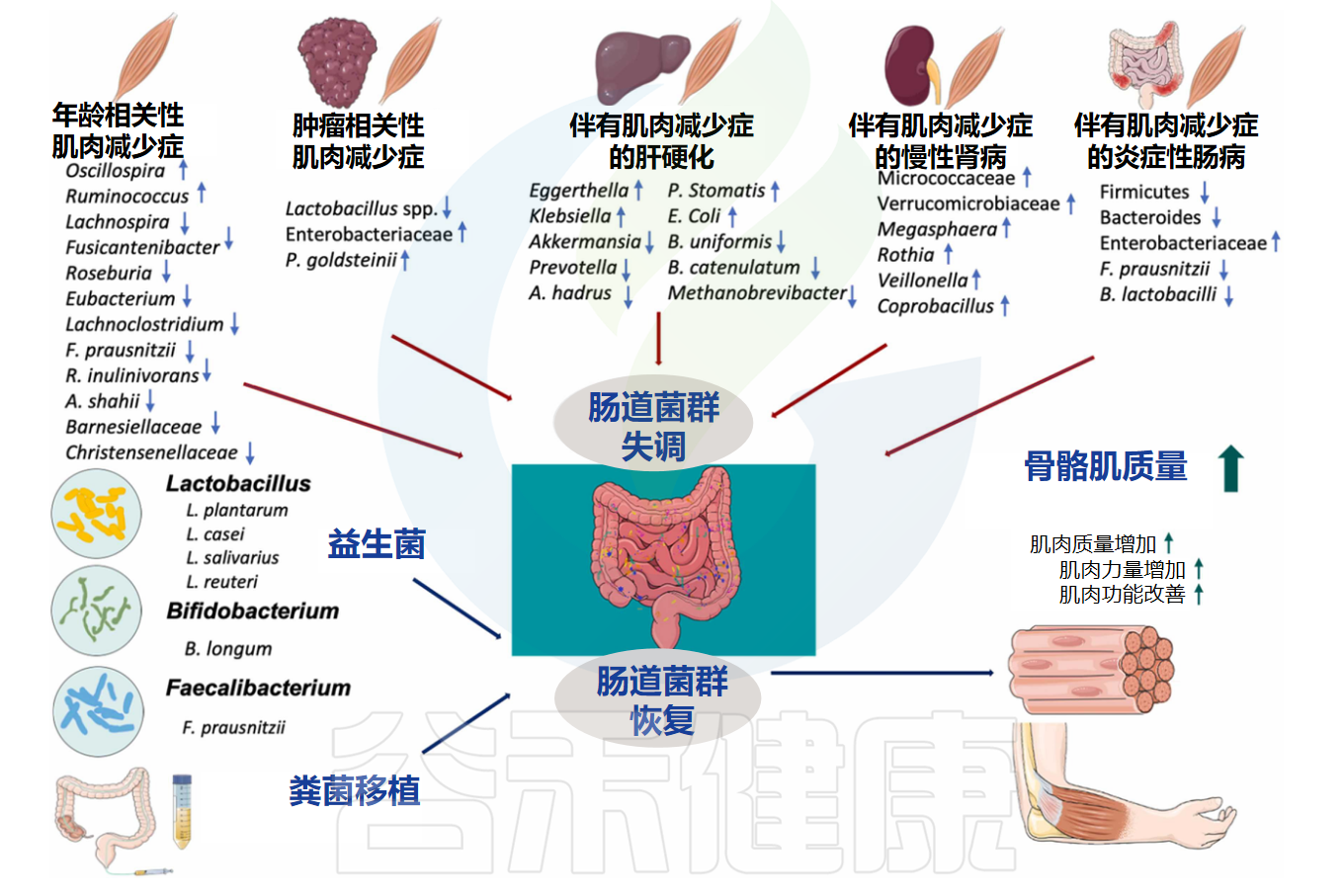
Zhang T,et al.Ageing Res Rev. 2022
益生菌改善肌肉减少症的作用机制可能通过以下几点:
1.提高蛋白质分解吸收效率
肌肉减少症的一个关键问题是营养吸收不足,特别是蛋白质摄入和利用效率下降。研究表明,益生菌能够显著提高蛋白质的消化吸收率,尤其是对植物性蛋白质。
2020一项安慰剂对照、随机、双盲、多中心交叉研究中证实,益生菌补充能显著增加植物蛋白中氨基酸的吸收率。这对素食者或依赖植物蛋白为主要蛋白质来源的老年人尤为重要。
2.增强肠道屏障功能
肠漏被认为与肌肉减少症有关,由于肠道屏障的破坏,其通透性增加,调节有害物质转移的能力降低,从而触发免疫系统和炎症反应。低度慢性炎症是被认为导致合成代谢抵抗和肌肉减少症发展的因素之一 。
而特定益生菌能够增强肠道上皮细胞间的紧密连接,减少肠道通透性。
3.作为肌肉营养传感器
肠道核心菌属普拉梭菌(Faecalibacterium prausnitzii)干预显著增加高脂肪饮食小鼠的肌肉质量,可能与增强线粒体呼吸、ATP合成酶水平提高、肠道菌群改变及肠道完整性改善有关。
肠道微生物群可能还是肌肉营养的调节传感器,肠道菌群的产物,尤其是短链脂肪酸(SCFA)被发现可以改善肌肉质量。喂养SCFA的年轻无菌小鼠的新证据表明,与未治疗的对照相比,骨骼肌质量和力量增加。
粪菌移植
与补充益生菌相比,粪菌移植(FMT)是一种更激进的治疗选择。
▸ 来自健康供体的粪菌移植后改善了原本的肌肉质量
许多研究表明,粪菌移植可能是一种改善骨骼肌质量和功能的方法。与肠道菌群正常的无病原体小鼠相比,缺乏肠道菌群的无菌小鼠表现出骨骼肌萎缩增加,以及与骨骼肌生长和线粒体功能相关的基因表达降低。
在将无病原体小鼠的肠道微生物群移植到无菌小鼠体内后,观察到肌肉质量增加,肌肉萎缩改善,肌肉氧化代谢能力增强,神经肌肉连接相关基因Rapsyn 和 Lrp4 表达增加。
注:Rapsyn 和 Lrp4是肌肉发育和功能中极其重要的两个基因,尤其是在突触后膜乙酰胆碱受体(AChR)聚集和信号转导方面。
上述结果表明肠道菌群在调节骨骼肌质量和功能中的重要作用。当肠道稳态受损时,通过益生菌或粪菌移植(FMT)干预可增强肌肉功能并缓解疾病症状,从而为宿主带来益处。
常规的防治措施
除了通过肠道微生物群干预外,肌肉减少症的常规防治方法我们也应掌握。
▸ 营养充足且均衡的饮食
营养不良和肌肉减少症在老年患者中经常重叠,老年人的营养和能量摄入通常会随着年龄的增长而下降,因此预防和治疗肌肉减少症的主要方法之一是促进营养充足。
蛋白质、维生素D、抗氧化营养素和长链多不饱和脂肪酸的充足摄入量受到特别重视,因为这些营养素能够抵消合成代谢抵抗,促进蛋白质合成并调节炎症,从而防止其对肌肉细胞的有害后果。
营养不良或肌肉减少症老年人的推荐蛋白质摄入量(1.2-1.5 g/kg/天)需高于健康活跃老年人(1.0-1.2 g/kg/天),以满足更高能量需求并防止肌肉损失。
▸ 运动锻炼
目前没有专门用于治疗肌肉减少症的药物,其治疗方法还有肌肉强化和步态训练的物理疗法。
长期研究证实,运动训练(尤其是阻力训练)是改善老年人肌肉质量和力量的最有效方法,几乎所有临床试验均证实了运动对预防肌肉减少症的积极作用。
此外,运动对肠道微生物组有显著影响,研究表明运动能增加肠道菌群多样性并促进有益代谢功能菌群的增长。
05结语随着人口老龄化加剧和不健康生活方式,肌肉减少症已从传统的老年疾病逐渐年轻化,成为威胁全民健康的重要问题。本文深入探讨了肌肉减少症的定义、症状、危害及其与肠道菌群的密切关系,揭示了这一隐形健康杀手的多重面貌。
本文主要从"肠道-肌肉轴"的新视角重新审视肌肉减少症的发生机制及防治。研究表明,肠道菌群通过多种途径影响肌肉系统:调节饮食效果与营养传导,影响肌肉合成代谢/分解代谢平衡,改变肠道通透性和炎症状态,调节线粒体功能与激素分泌,以及影响骨骼肌纤维组成和神经肌肉传递。
并且肌肉减少症患者普遍存在肠道菌群多样性和丰富度降低,表现为特定菌群比例失调,尤其是产生短链脂肪酸细菌的减少。
在日益重视健康老龄化的时代背景下,深入理解肠道菌群与肌肉健康的关联至关重要。肠道微生物群分析有望成为肌肉减少症的早期预警手段,益生菌等菌群调节手段可能成为创新治疗靶点。未来研究需聚焦个体化肠道菌群干预策略,为各类人群提供精准肌肉和营养健康管理方案,使"肌"不可失的健康意识深入人心。
主要参考文献:
Song Q, Zhu Y, Liu X, Liu H, Zhao X, Xue L, Yang S, Wang Y, Liu X. Changes in the gut microbiota of patients with sarcopenia based on 16S rRNA gene sequencing: a systematic review and meta-analysis. Front Nutr. 2024 Jun 28;11:1429242.
Zhang T, Cheng JK, Hu YM. Gut microbiota as a promising therapeutic target for age-related sarcopenia. Ageing Res Rev. 2022 Nov;81:101739.
Liao X, Wu M, Hao Y, Deng H. Exploring the Preventive Effect and Mechanism of Senile Sarcopenia Based on "Gut-Muscle Axis". Front Bioeng Biotechnol. 2020 Nov 5;8:590869.
de Marco Castro E, Murphy CH, Roche HM. Targeting the Gut Microbiota to Improve Dietary Protein Efficacy to Mitigate Sarcopenia. Front Nutr. 2021 Jun 21;8:656730.
Prokopidis K, Cervo MM, Gandham A, Scott D. Impact of Protein Intake in Older Adults with Sarcopenia and Obesity: A Gut Microbiota Perspective. Nutrients. 2020 Jul 30;12(8):2285.
Zhao J, Huang Y, Yu X. A Narrative Review of Gut-Muscle Axis and Sarcopenia: The Potential Role of Gut Microbiota. Int J Gen Med. 2021 Apr 13;14:1263-1273.
Ticinesi A, Nouvenne A, Cerundolo N, Catania P, Prati B, Tana C, Meschi T. Gut Microbiota, Muscle Mass and Function in Aging: A Focus on Physical Frailty and Sarcopenia. Nutrients. 2019 Jul 17;11(7):1633.
Sarcopenia Cruz-Jentoft, Alfonso J et al.The Lancet, Volume 393, Issue 10191, 2636 - 2646.
Casati M, Ferri E, Azzolino D, Cesari M, Arosio B. Gut microbiota and physical frailty through the mediation of sarcopenia. Exp Gerontol. 2019 Sep;124:110639.
Ticinesi A, Lauretani F, Milani C, Nouvenne A, Tana C, Del Rio D, Maggio M, Ventura M, Meschi T. Aging Gut Microbiota at the Cross-Road between Nutrition, Physical Frailty, and Sarcopenia: Is There a Gut-Muscle Axis? Nutrients. 2017 Nov 30;9(12):1303.
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1482921.html
上一篇:[转载]青春双歧杆菌(Bifidobacterium adolescentis)——功能性食品和微生物疗法中的明星菌种
下一篇:[转载]微生物的生长和营养