博文
[转载]改善慢性代谢炎症和调节肠道稳态:茶作为一种潜在的疗法
||

由于生活方式改变,不健康饮食引起的糖尿病、肥胖、高血压和心血管疾病等慢性疾病已成为全球公共卫生危机,带来沉重医疗负担并造成现代社会生产力损失。在中国,慢性病患病率持续上升,成年人超重和肥胖率超过50%且无减缓趋势。高血压、糖尿病、慢性阻塞性肺病和癌症患病率也在增加,慢性病死亡占总死亡人数的88.5%(中国居民营养和慢性病状况报告,2020)。
慢性代谢性炎症和相关疾病
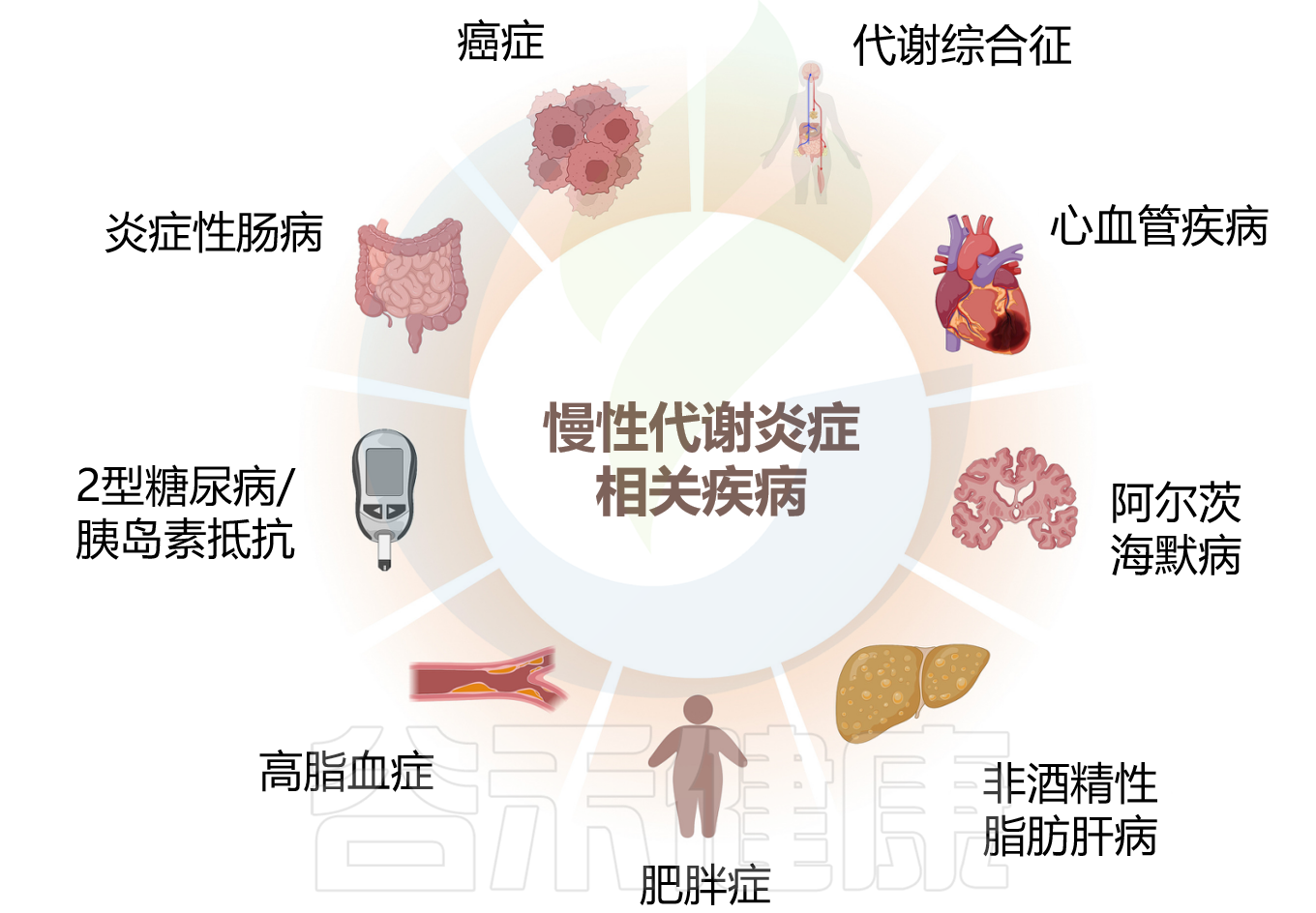
Yu S,et al.Pharmacol Ther.2025
慢性代谢炎症是肥胖、糖尿病和心血管疾病等代谢紊乱的共同发病机制,通常与肠道稳态改变相关。其病理过程包括肠道微生物失调、内毒素受体激活、代谢重编程、线粒体功能障碍等。最新研究揭示了一种涉及多个成分和靶标时序性相互作用的新机制。
而健康的饮食有助于降低患慢性病的风险,减缓疾病进展并预防心血管事件。抗炎饮食是健康饮食的主要类型之一,与降低代谢疾病(如心血管疾病和糖尿病)的风险密切相关。地中海饮食作为一种健康饮食模式,以其显著的抗炎特性而闻名。与此同时,还存在着其他一些同样具有健康促进作用的饮食模式,这些不同的健康饮食方式各自具有其特定的营养优势和健康效益。
茶作为中国广泛普及的饮料,已有数千年历史。明代李时珍《本草纲目》记载茶具有祛火、解毒、促进消化的作用,表明其可能具有抗炎相关的肠道调节功能。茶叶含有茶多酚、茶色素、茶多糖等生物活性物质,表现出包括抗氧化、抗炎、抗肿瘤和抗菌特性在内的广泛生物活性。
从体外研究到人群研究的一系列证据表明:表没食子儿茶素没食子酸酯(EGCG)被认为是发挥抗氧化和抗炎作用的最重要成分之一,它在绿茶中最为丰富。在乌龙茶和红茶中,一部分儿茶素在加工过程中通过内源性多酚氧化酶转化为茶黄素和茶红素。而后发酵黑茶特点是茶多糖和茶褐素富集,简单儿茶素减少。这些活性化合物与特定靶标相互作用并表现出独特的剂量-效应关系,产生多种效果。
随着高通量测序和生物信息学技术进步,肠道菌群对人类健康的重要性日益显现。大量研究表明,喝茶可通过调节肠道稳态增强葡萄糖和脂质代谢,肠道微生物群改善有助于预防肥胖、非酒精性脂肪肝、高血糖、高脂血症等代谢紊乱。此外,茶与炎症标志物改善之间已建立联系。
喝茶对代谢的积极影响可能归因于其减少慢性代谢炎症和调节肠道稳态的能力。研究表明,喝茶与肠道微生物群丰度相关,厚壁菌门/拟杆菌门比例发生变化,乳杆菌、双歧杆菌和嗜粘蛋白阿克曼菌丰度显著增加。而Turicibacter或Rombustsia等有害菌则减少。
茶对肠道稳态的直接影响主要针对脂多糖相关途径,包括减少肠道脂多糖合成、抑制其易位以及阻止与TLR4受体结合,从而阻断下游炎症途径。TLR4/MyD88/NF-κB p65通路对抗炎反应至关重要。茶的抗氧化特性通过清除自由基、抑制NLRP3炎性小体和调节Nrf2/ARE活性,增强线粒体功能并减轻相关炎症。茶还通过促进短链脂肪酸合成、激活肠道芳烃受体和法尼醇X受体以及改善肠炎等机制保护肠道屏障。
本文主要探讨了茶、肠道稳态和代谢健康关系,特别关注慢性代谢炎症,炎症指标改善和肠道菌群调节,并研究了这些影响的潜在机制和生物学基础。通过研究茶叶改善慢性代谢炎症的机制,关注其与食物或药物的相互作用,探索安全有效的用量,并调查个体差异对茶干预效果的影响。喝茶最终可能成为调节肠道稳态、抗慢性代谢炎症和促进代谢健康的一种便民通用疗法。
新陈代谢 · 炎症免疫反应与代谢调节是高度相关的,相互依存以维持机体稳态。这种平衡一旦被破坏,就可能导致肥胖、2型糖尿病和心血管疾病等代谢紊乱。
代谢疾病患者体内促炎细胞因子升高
炎症是机体对病原体入侵或细胞损伤等内源性刺激的保护性反应。代谢疾病患者体内促炎细胞因子水平升高,表明炎症过程是代谢疾病发展的重要生物标志物。这些疾病的共同特征是代谢紊乱以及游离脂肪酸和内毒素等代谢物的积累,这些代谢物可激活巨噬细胞并引发炎症反应。
脂肪摄入过多也会导致促炎细胞因子升高
脂肪组织在代谢炎症中发挥关键作用。过量卡路里摄入导致脂肪细胞增大并分泌TNF-α、IL-6和MCP-1等促炎因子,吸引免疫细胞聚集并维持持续的低水平炎症。
肝脏、肌肉等其他器官也参与代谢炎症过程。在非酒精性脂肪肝病中,肝脏脂肪积累引起局部和全身炎症反应;在动脉粥样硬化中,血管壁脂质沉积触发局部炎症,促进斑块形成和发展。
代谢炎症是一种慢性持续状态
急性炎症是机体对损伤或感染的正常生理反应,表现为红肿疼痛,而炎症因子的持续存在和组织损伤则导致慢性炎症。代谢性炎症特指发生在脂肪等代谢组织中的炎症,常由肠道微生物失衡引发,通常呈慢性状态。
已经提出了一个概念,将这种类型的炎症定义为代谢炎症(metaflammation)。Metaflammation的特征是慢性、低度全身炎症,与传统的急性和短暂炎症反应相反。这种情况不仅限于单个代谢组织;相反,它涉及全身的多个代谢器官,并与各种代谢紊乱有关。
茶具有抗炎作用
慢性代谢性炎症的管理需要药物干预和生活方式改善相结合。二甲双胍和噻唑烷二酮类药物已证实能提高胰岛素敏感性并降低炎症水平。健康的生活方式选择同样有助于减轻炎症反应。
膳食炎症指数通过定量建模评估饮食对C反应蛋白、白细胞介素和肿瘤坏死因子等炎症生物标志物的影响。
茶被发现具有抗炎作用,其主要成分槲皮素、花青素和表儿茶素均具有抗炎特性。抗氧化活性是茶发挥药理作用的关键。研究发现,膳食抗氧化质量评分和综合膳食抗氧化指数与IL-1β、TNF-α等炎症因子水平呈显著负相关,提示食物抗氧化活性与抗炎生物途径间存在相互作用。
因此,慢性代谢性炎症的治疗策略应超越单一疾病管理,重点关注整体抗炎和代谢健康的改善。
肠道稳态 · 慢性代谢炎症肠道稳态依赖于肠道微生物群、肠上皮和宿主免疫系统之间的复杂相互作用,其失衡与疾病发生密切相关。(图2)
◮ 肠道微生物失调和慢性炎症会相互加剧
不均衡饮食或抗生素滥用可破坏肠道微生物群,导致脂多糖等病原体相关分子模式释放。这些分子激活宿主免疫细胞受体,引发炎症并启动可能导致慢性炎症的级联反应。炎症过程损害肠道屏障完整性,增加其通透性,促进细菌和代谢物进入血液循环。这种易位进一步刺激免疫系统,使炎症反应持续存在。同时,炎症微环境抑制有益菌生长,促进有害菌增殖,加剧生态失调并维持慢性炎症。
肠道屏障的损伤促进慢性代谢炎症
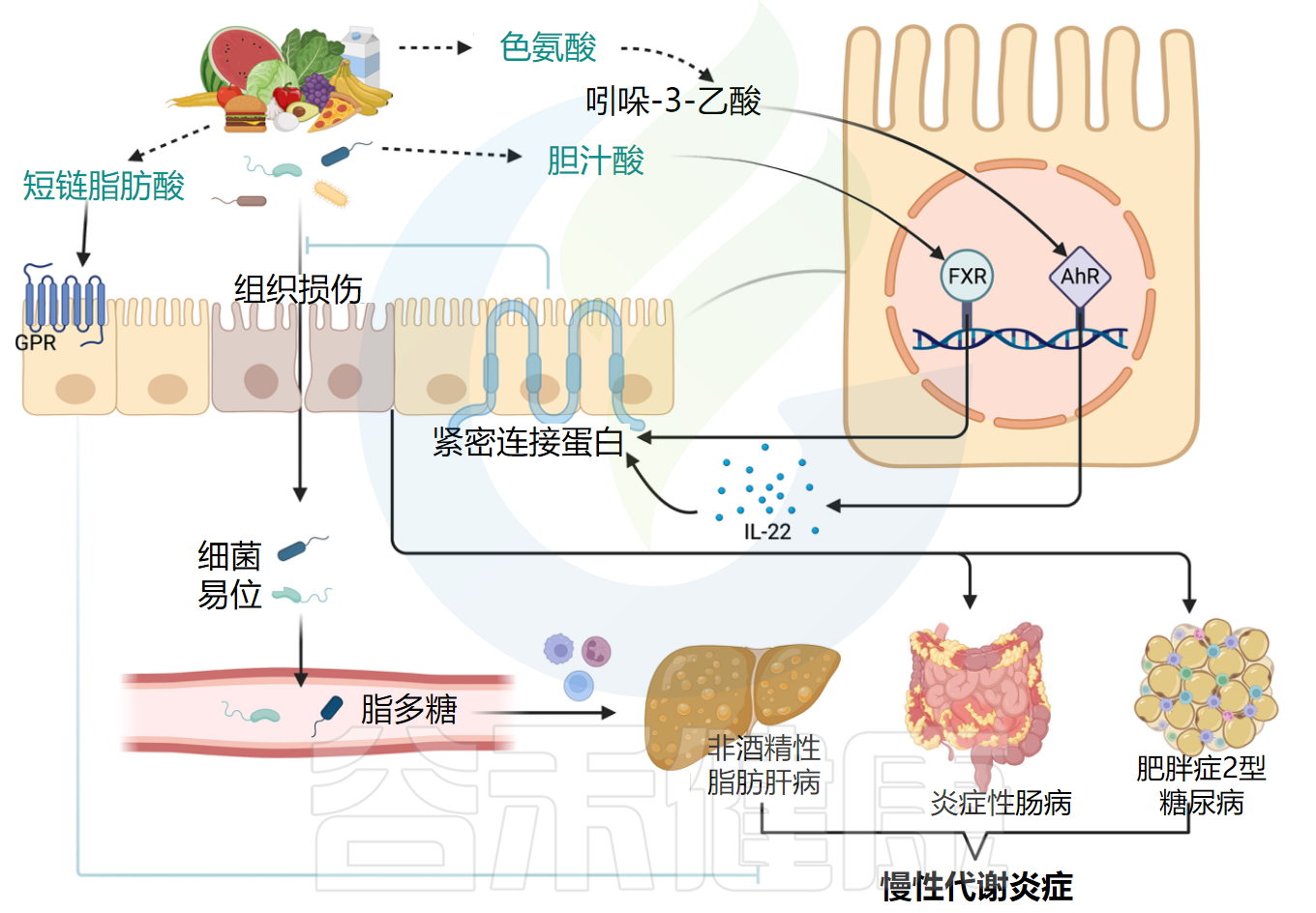
Yu S,et al.Pharmacol Ther.2025
代谢性疾病,如2型糖尿病、肥胖和脂肪肝,通常与肠道菌群失调一起出现。肠道炎症环境促使有害细菌和代谢物从受损屏障释放入循环系统,引发慢性全身炎症并推动疾病进展。炎症性肠病作为免疫介导的肠道炎症,其患病率与代谢综合征同步增加,可能具有共同的环境致病因素。两者的潜在致病机制均涉及肠道微生物群改变和宿主对细菌衍生代谢物的异常处理。
而膳食纤维、类黄酮等饮食成分有助于维持肠道稳态并改善代谢健康。其作用机制包括:调节肠道菌群以减少内毒素产生;调控巨噬细胞等免疫细胞以控制炎症;增强紧密连接蛋白以保护屏障功能,防止内毒素转移;确保适当的营养利用和能量平衡。
▸ 肠道屏障对肠道稳态的影响
肠道屏障是由紧密连接蛋白连接的肠上皮细胞构成的机械屏障,结合粘液、胃酸、胆汁等化学屏障,肠道淋巴组织中免疫细胞形成的免疫屏障,以及肠道微生物群提供的生物屏障,共同构成维持肠道内稳态的复杂防御系统。
在病理状态下,肠道稳态被破坏,肠道屏障受损,促使脂多糖等细菌内毒素转移入血。异常的屏障功能还会促进有害细菌增殖,干扰肠道相关免疫细胞的稳态和正常功能,引发慢性代谢炎症。
◮ 肠道屏障受损会导致肠道稳态被破坏
在肠炎的情况下,肠道稳态被破坏,并激活全身和肝脏炎症,促进肝纤维化。紧密连接蛋白在粘膜愈合中发挥关键作用,其异常表达是炎症性肠病(IBD)发病进展的重要因素。
短链脂肪酸(SCFA)对肠上皮细胞的生长和修复至关重要。SCFA可结合并抑制组蛋白脱乙酰酶,抑制促炎基因表达,并通过促进调节性T细胞分化和增殖来增强其免疫抑制功能。研究还发现,SCFA能抑制脂多糖诱导的NF-κB信号通路,减少IL-1β、IL-6和NO等炎症介质产生,并抑制诱导型一氧化氮合酶(iNOS)活性。
◮ 色氨酸代谢产生的吲哚丙酸增强上皮屏障
NF-κB和缺氧诱导因子1-α(HIF-1α)作为脂多糖或活性氧下游的核受体,与炎症密切相关。G蛋白偶联受体、法尼醇X受体(FXR)、芳香烃受体(AhR)和过氧化物酶体增殖物激活受体(PPAR)通过抑制NF-κB通路或促进抗炎因子表达来保护肠道屏障。
AhR可被多环芳烃和色氨酸代谢物激活,对免疫细胞正常功能至关重要。它通过支持调节性T细胞生长和产生抗炎白细胞介素-22来减少炎症,并通过加强紧密连接屏障维护上皮细胞健康。肠道色氨酸代谢产生的吲哚丙酸通过AhR或孕烷X受体激活免疫系统,可减少肠道炎症,增强上皮屏障,抑制脂质积累并缓解非酒精性脂肪肝症状。体循环中吲哚丙酸水平可能还有助于预测非酒精性脂肪性肝病(NAFLD)、2型糖尿病(T2DM)和心血管疾病(CVD)风险。
▸ 脂多糖促炎途径对肠道稳态的影响
◮ 肠道屏障受损时脂多糖会诱导全身炎症反应
内毒素是革兰氏阴性菌细胞壁的主要成分,由脂多糖(LPS)构成。高糖高脂饮食会增加肠道革兰氏阴性细菌比例并促进LPS产生,LPS可通过受损的肠道屏障易位进入循环,转运至脂肪和神经系统等组织,诱导全身炎症反应。
LPS信号传导与神经退行性、代谢性和心血管等慢性炎症性疾病的病理生理学密切相关。LPS依次转移至CD14分子和TLR4-跨膜蛋白2复合物,随后募集MyD88和白细胞介素-1受体相关激酶,最终激活NF-κB或MAPK通路。LPS信号通路激活诱导COX-2、TNF-α、IL-1β、IL-6、iNOS等炎症基因表达。注:MAPK通路与NF-κB通路相互作用协同调节这些炎症基因的表达。
脂多糖与TLR4受体结合激活炎性小体
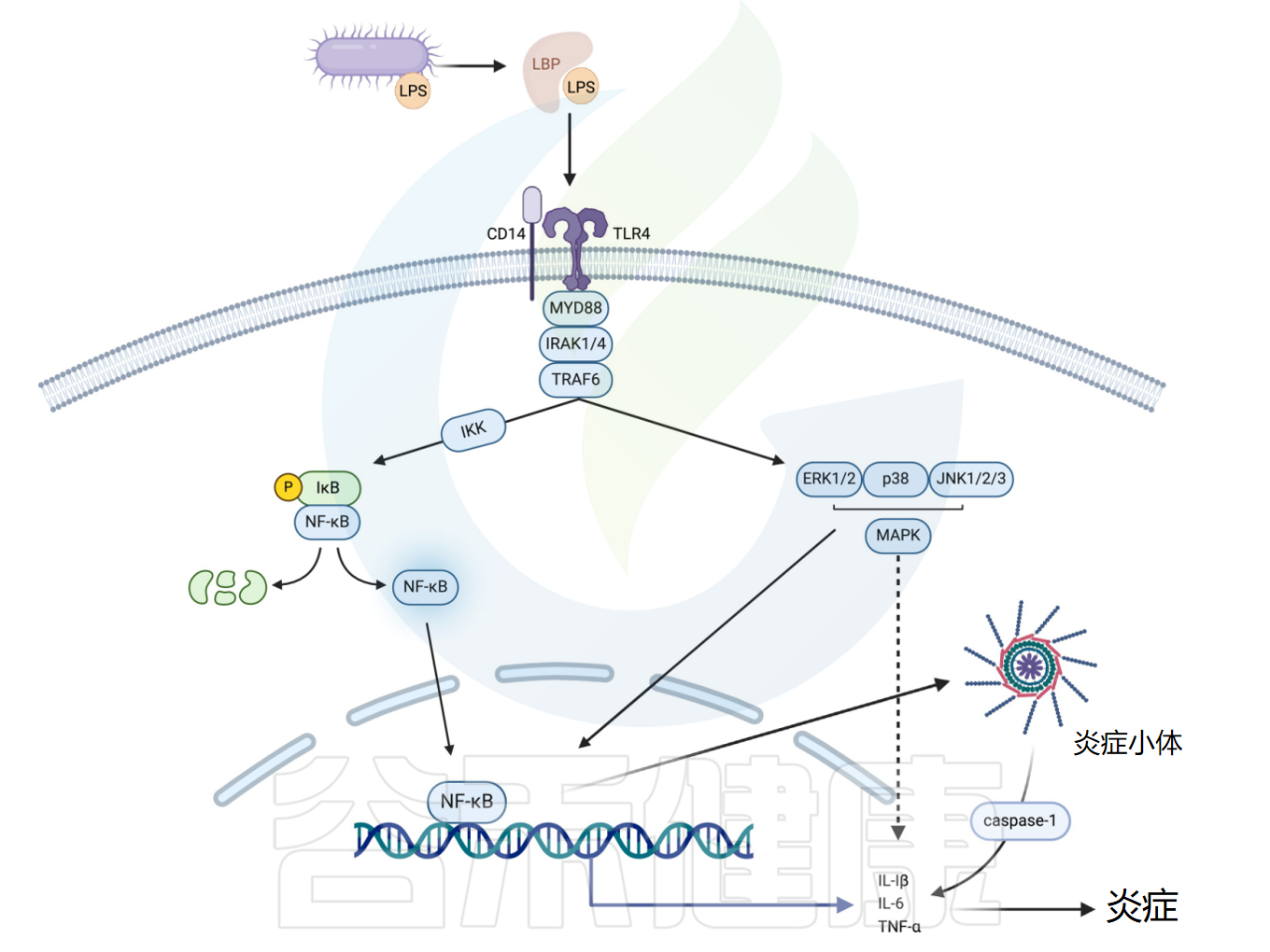
Yu S,et al.Pharmacol Ther.2025
◮ 肠道感染时巨噬细胞也会破坏肠道屏障
经典理论认为肠道巨噬细胞不表达LPS辅助受体CD14或免疫球蛋白受体(CD89、CD16、32、64)。但在肠道感染等病理状态下,血液单核细胞被募集至肠道,LPS通过TLR4受体依赖性或非依赖性途径诱导肠道通透性增加,导致巨噬细胞代谢重编程为炎症表型,进一步破坏肠道屏障并引发外周炎症。
▸ 线粒体功能异常与肠道稳态
线粒体作为细胞能量发生器,通过氧化磷酸化产生ATP。线粒体受损时ATP产生受影响,破坏细胞内能量代谢并引发炎症反应。
当细胞氧化应激或平衡中断时,异常线粒体通透性发生变化,导致功能障碍和线粒体损伤相关分子模式的释放。炎症通过两种途径触发:mtDNA激活的cGAS-STING信号传导,或mtDNA和ROS诱导的炎性小体信号传导。当mtDNA因氧化应激受损时,可逃避自噬并导致强烈炎症反应。
◮ 线粒体功能异常会导致肠道炎症和屏障受损
线粒体在维持肠道稳态中起关键作用,其功能异常会引发炎症甚至肿瘤。IBD患者线粒体表现出电子传递链复合物活性降低、线粒体ROS和mtDNA积累。这些异常与肠道炎症和屏障功能障碍相关,导致上皮屏障完整性丧失并促进细菌入侵。肠道屏障受损时,LPS转移影响肠道外围和周围组织的线粒体,这可能是导致炎症和疾病的重要机制。
肠道糖酵解细菌通过厌氧呼吸代谢碳水化合物,产生琥珀酸等副产品。人体肠道中,拟杆菌属、副拟杆菌属、韦荣氏球菌属、普雷沃氏菌属、双歧杆菌属、乳酸杆菌属和脱硫杆菌属是主要产琥珀酸盐的菌属,而瘤胃球菌属、梭状芽胞杆菌属和考拉杆菌属(Phascolarctobacterium)是主要利用琥珀酸盐的菌属。
注:琥珀酸盐在三羧酸循环中充当代谢中间体,连接线粒体电子传递链。过量琥珀酸盐触发HIF-1α/IL-1β炎症途径激活,将免疫细胞能量代谢与炎症变化联系起来。脂多糖显著提高三羧酸循环中琥珀酸水平,可能增强巨噬细胞对琥珀酸的摄取。相反,降低琥珀酸水平或琥珀酸脱氢酶活性会抑制HIF-1α募集,阻断IL-1β表达并减少活性氧产生。
线粒体释放与损伤相关的分子模式
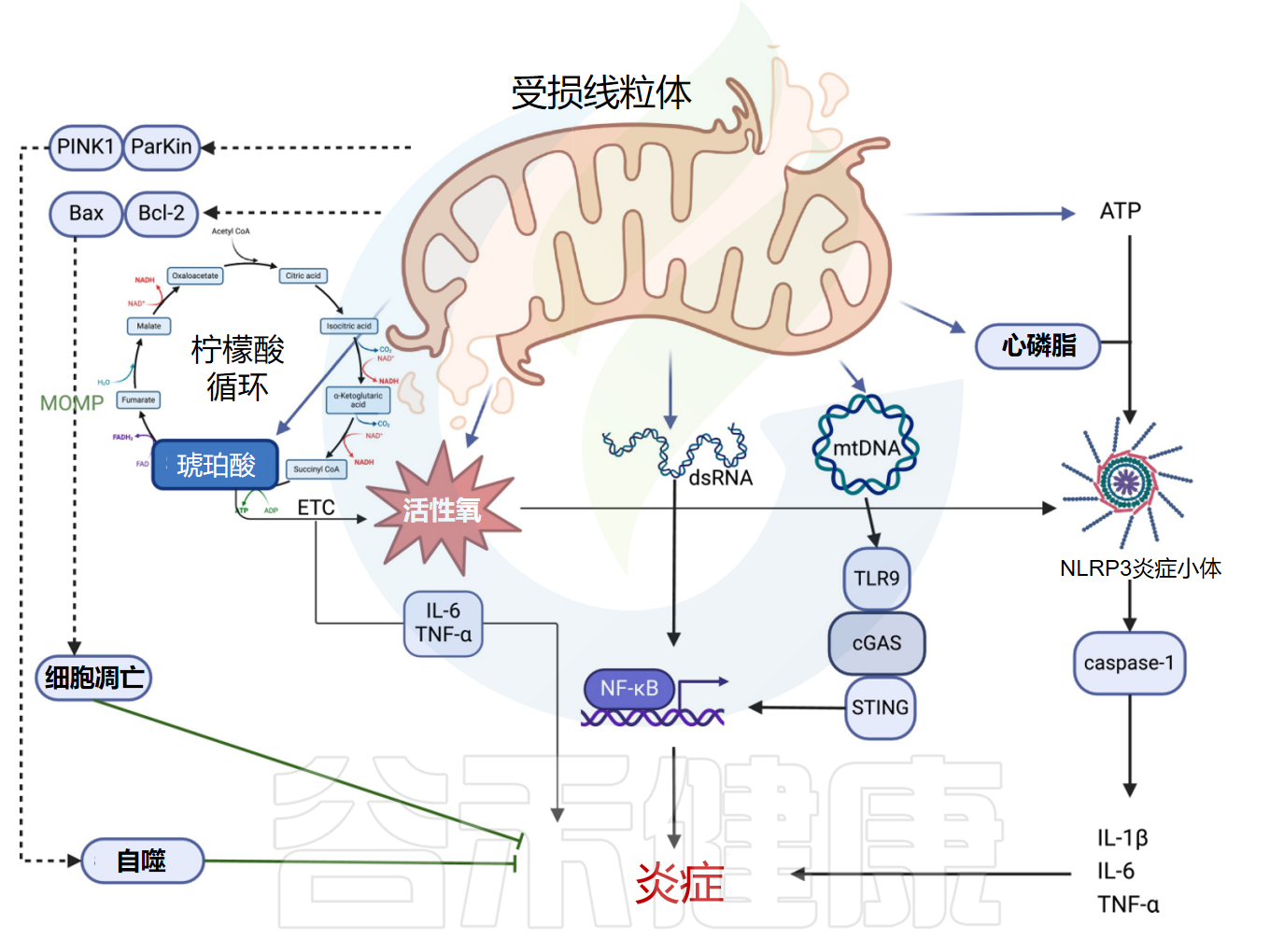
Yu S,et al.Pharmacol Ther.2025
琥珀酸盐相关炎症反应存在于胃肠道和其他身体组织中。炎症性肠病(IBD)患者血液和肠道组织中检测到琥珀酸水平升高和琥珀酸受体的存在。
茶 · 改善代谢健康近年来,越来越多的研究证据发现了茶对肠道稳态和代谢健康的积极影响。茶饮与肠道微生物群之间的关系被认为在改善糖尿病、血脂异常、肥胖和心血管疾病等方面起着至关重要的作用。
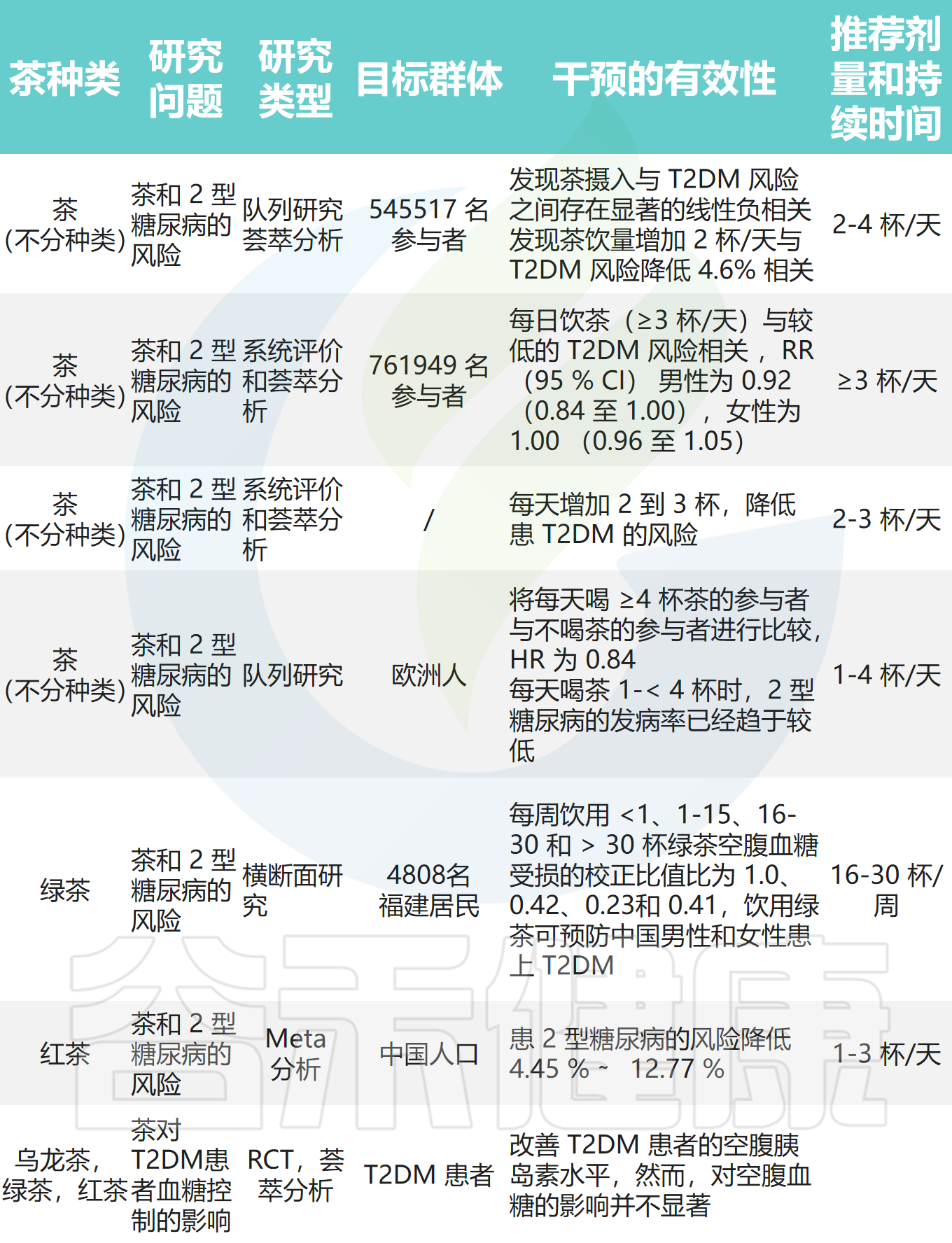
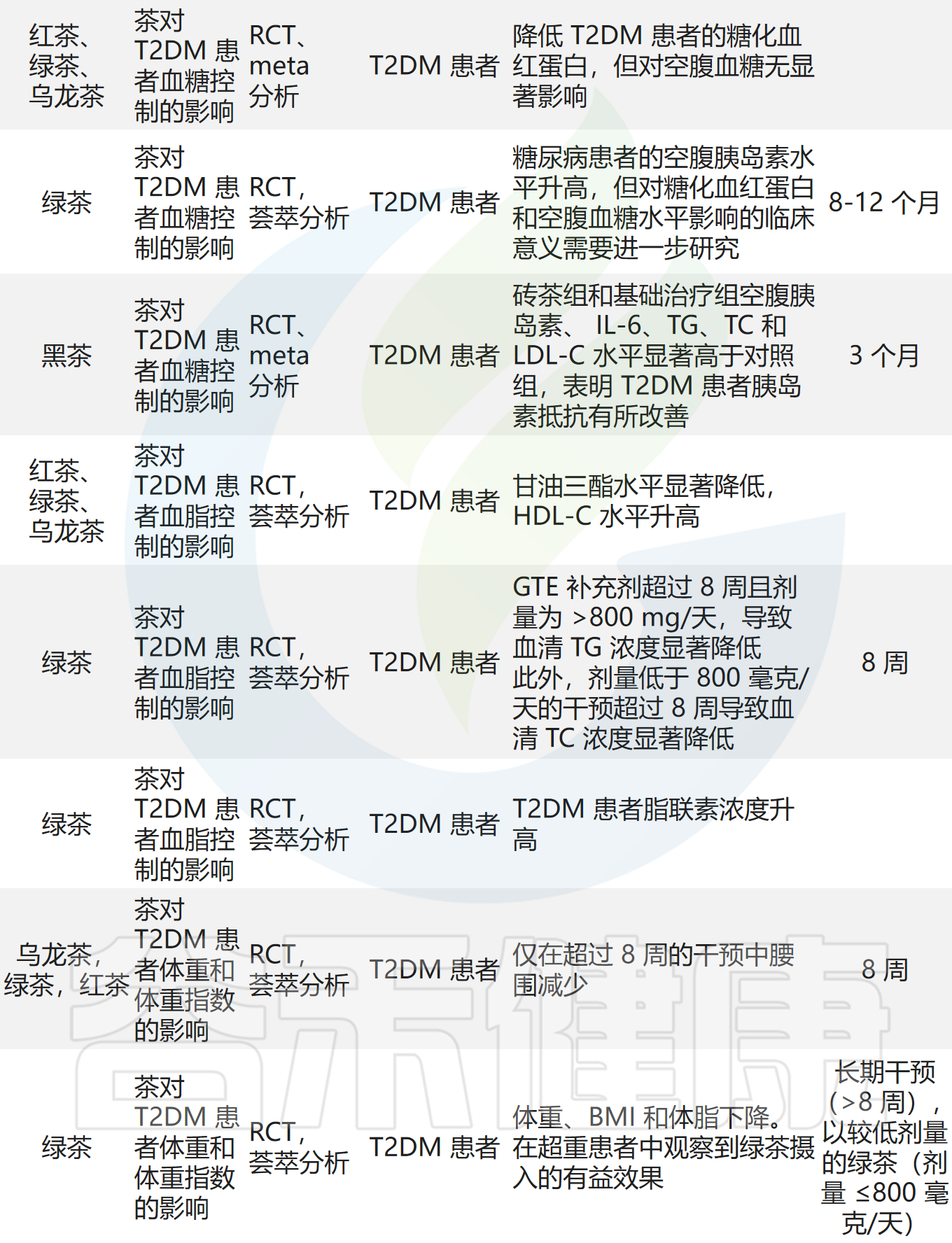
适当喝茶有助于减轻2型糖尿病、肥胖
下表中总结了目前关于茶的人群和临床研究。四项元分析、两项队列研究和横断面研究均表明,饮茶与降低2型糖尿病(T2DM)风险相关,建议摄入量为每日1-4杯。
五项荟萃分析显示,饮茶与空腹血糖、糖化血红蛋白、胰岛素抵抗指数和胰岛素水平的改善相关。三项随机对照试验和荟萃分析表明,茶对T2DM患者血脂控制的影响主要体现在甘油三酯、HDL-C、TG和血清脂质载蛋白浓度的改善。两项随机对照试验和荟萃分析显示,饮茶与体重、腰围、BMI和体脂的显著降低相关。一项荟萃分析表明,饮用绿茶显著降低循环C反应蛋白水平。
五项荟萃分析和一项系统评价证实了茶和茶提取物的调脂作用,汇总结果显示总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)显著改善,说明茶作为肥胖干预和预防措施是可行的。
茶的减肥效果在较高剂量下更明显,如每日3-4杯绿茶、5000mg/天乌龙茶、1000mg/天普洱茶等。长期饮用效果更佳,如绿茶超过两个月、乌龙茶超过六周、普洱茶超过三个月。
还有四项剂量反应分析和荟萃分析及一项队列研究表明,饮茶与降低冠心病和中风等心血管疾病风险相关。
茶对人代谢健康影响的研究






Yu S,et al.Pharmacol Ther.2025
茶调节肠道微生物群并维持肠道稳态
九项随机对照试验证明茶具有调节肠道微生物群、减轻肥胖或高脂饮食引起的肠道微生态障碍的能力。这主要通过增加肠道微生物群丰度和改变菌群群落结构实现,如F/B比值变化,乳酸菌、双歧杆菌和嗜粘蛋白阿克曼菌(A.muciniphila)等有益菌属显著增加。
茶的健康促进作用源于其与肠道微生物群的相互作用,后者在维持肠道稳态中起关键作用。现有人群研究既检查了急性炎症的传统方面,也涉及慢性炎症相关内容。茶对增强慢性代谢性疾病肠道稳态的影响可能在慢性代谢炎症治疗中发挥重要作用。
茶 · 通过调节肠道稳态改善慢性代谢炎症在肥胖和非酒精性脂肪性肝病等代谢性疾病中,肠道微生物群的组成和功能发生改变。病原菌增加导致肠道屏障受损,随后通过肠道代谢轴引发炎症。此外,肠道微生物产生的特定代谢物与宿主酶相互作用,调节代谢器官或组织中的炎症和基因表达。
▸ 茶通过调节肠道菌群改善代谢和炎症
研究证据表明,不同的茶表现出与保护肠道屏障相关的抗炎作用。喝茶有助于改善肠炎对肠道上皮屏障的损害,在非炎症情况下保护上皮屏障,并可能影响AhR、FXR和PPAR等核受体相关通路。
◮ 喝茶增加了AKK菌等有益菌并展现抗炎作用
绿茶和乌龙茶已被证明对改善肠炎有积极作用。在绿茶粪便移植结肠炎小鼠中,嗜粘蛋白阿克曼菌或乳球菌等有益菌增加,Turicibacter或Rombustsia等有害菌减少。
结肠炎小鼠实验显示,绿茶和黑茶增加嗜粘蛋白阿克曼菌、乳杆菌和双歧杆菌比例,减少拟杆菌属。此外,紧密连接蛋白水平显著增加,增强肠道屏障并改善炎症。陈年乌龙茶通过调节氧化应激和炎症因子,上调肠道紧密连接蛋白表达(Occludin、Claudin-1、ZO-1和Mucin 2)来改善溃疡性结肠炎。它通过刺激与氨基酸、脂肪酸和胆汁酸代谢物相关的代谢途径发挥抗炎作用。
此外,Sutterella、Clostridium、Mucispirillum、Oscillospira和Ruminococcus已被确定为影响炎症发展和缓解的关键细菌。铁观音茶已被发现通过减少促炎细胞因子(如白细胞介素-4、干扰素-γ、白细胞介素-17 和转化生长因子)同时增加抗炎细胞因子 IL-10 对炎症产生积极影响。铁观音还抑制大肠埃氏菌属-志贺氏菌属(Escherichia-Shigella)等有害细菌,并增加Lachnospiraceae_NK4A136_group等有益细菌的存在,这有助于缓解结肠炎。
◮ 茶促进短链脂肪酸的产生并降低脂多糖
喝茶可以纠正肥胖或癌症等各种慢性疾病中出现的肠道微生物失调。它还影响参与代谢过程的细菌生长,例如影响脂多糖的水平或调节炎症因子的产生。
黄叶绿茶干预高脂饮食小鼠粪便菌群移植实验导致 unclassified_Muribaculaceae的增加和Colidextribacter的减少,以及抗肥胖作用。绿茶、乌龙茶和红茶中的儿茶素均显著改善高脂饮食小鼠的肥胖、减轻低度炎症并预防肝脂肪变性,同时上调 mRNA 和 PPARα 蛋白表达。肠道菌群的变化还包括降低F/B比值和变形菌门丰度。此外,代谢物的调节包括促进短链脂肪酸的产生和降低血液中高水平的脂多糖。
◮ 茶中的儿茶素成分能减轻炎症并改善代谢
使用宏基因组学对粪便样本的分析表明,所有三种类型的儿茶素都通过影响其结构、组成和蛋白质功能对微生物群产生相似的影响。
具体来说,表没食子儿茶素没食子酸酯(EGCG)增加了乳酸菌等有益肠道细菌的存在,同时降低了肠球菌和肠杆菌科的水平。黑茶(后发酵茶)包括普洱茶、福茶、六宝茶、青砖茶和康砖茶,含茶多糖(TPS)和茶褐素(TB)水平较高,儿茶素含量较低。黑茶提取物通过增加嗜粘蛋白阿克曼菌、普雷沃氏菌、拟杆菌属和拟普雷沃菌属等有益菌,改善肠道环境,降低糖尿病和肥胖风险。
青砖茶有效干预高脂饮食诱导的NAFLD,提高乳酸菌属、Alloprevotella和Ruminalococcaceae水平,降低分枝杆菌属(Mycobacterium)水平,平衡初级胆汁酸与次级胆汁酸比例,改善脂质代谢并减少炎症。
福茶中的茶多酚和茶褐素(TB)通过靶向AhR途径相关肠道菌群(如乳酸菌)缓解溃疡性结肠炎(UC),促进色氨酸向I3A的微生物转化激活AhR。福茶多糖缓解UC机制相似。TB激活肠道FXR抑制小肠胆盐水解酶活性,该酶会将初级胆汁酸转化为脱氧胆酸和石胆酸等炎性次级胆汁酸。而TB减少次级胆汁酸产生,促进糖脱氧胆酸等抗炎胆汁酸生成,调节肠道屏障功能,防止有害物质进入肠壁并降低全身炎症风险。
▸ 茶的肠道代谢物及其抗炎特性
由于茶已显示出不同程度的抗炎作用,其代谢物也可能表现出抗炎生理活性,因此茶叶微生物代谢物研究具有重要意义。
◮ 茶代谢产生的酚酸和儿茶素等物质具有抗炎活性
茶黄素在肠道中的主要代谢产物是酚酸,通过微生物酶作用产生没食子酸等代谢物,没食子酸在体外和体内均具有抗炎活性。儿茶素化合物属于黄烷-3-醇基,大多数可到达结肠被肠道菌群代谢,经历环裂解、还原、脱羧、β氧化和二羟基化反应。羟基苯基-γ-戊内酯(DHPV)可进一步转化为更小的酚酸,在IEC-6细胞模型中抑制脂多糖诱导的IκBα磷酸化和降解,显示抗炎潜力。
注:茶黄素是茶叶中重要的活性成分,主要存在于发酵茶(如红茶)中,由儿茶素氧化聚合形成。
4-羟基苯乙酸是小鼠粪便和血浆中最丰富的茶多酚代谢物。表儿茶素和主要结肠酚酸可防止高葡萄糖和脂多糖诱导的近端肾小管细胞炎症,表儿茶素和2,3-二羟基苯甲酸抑制促炎细胞因子(TNF-α、IL-6和MCP-1)升高。口服或腹膜内给予表没食子儿茶素没食子酸酯(EGCG)形成的半胱氨酰代谢物在LPS刺激的RAW264.7细胞中将异常花生四烯酸和NO恢复至正常水平,表现出抗炎活性。
茶及其成分的抗炎特性及影响的肠道菌群
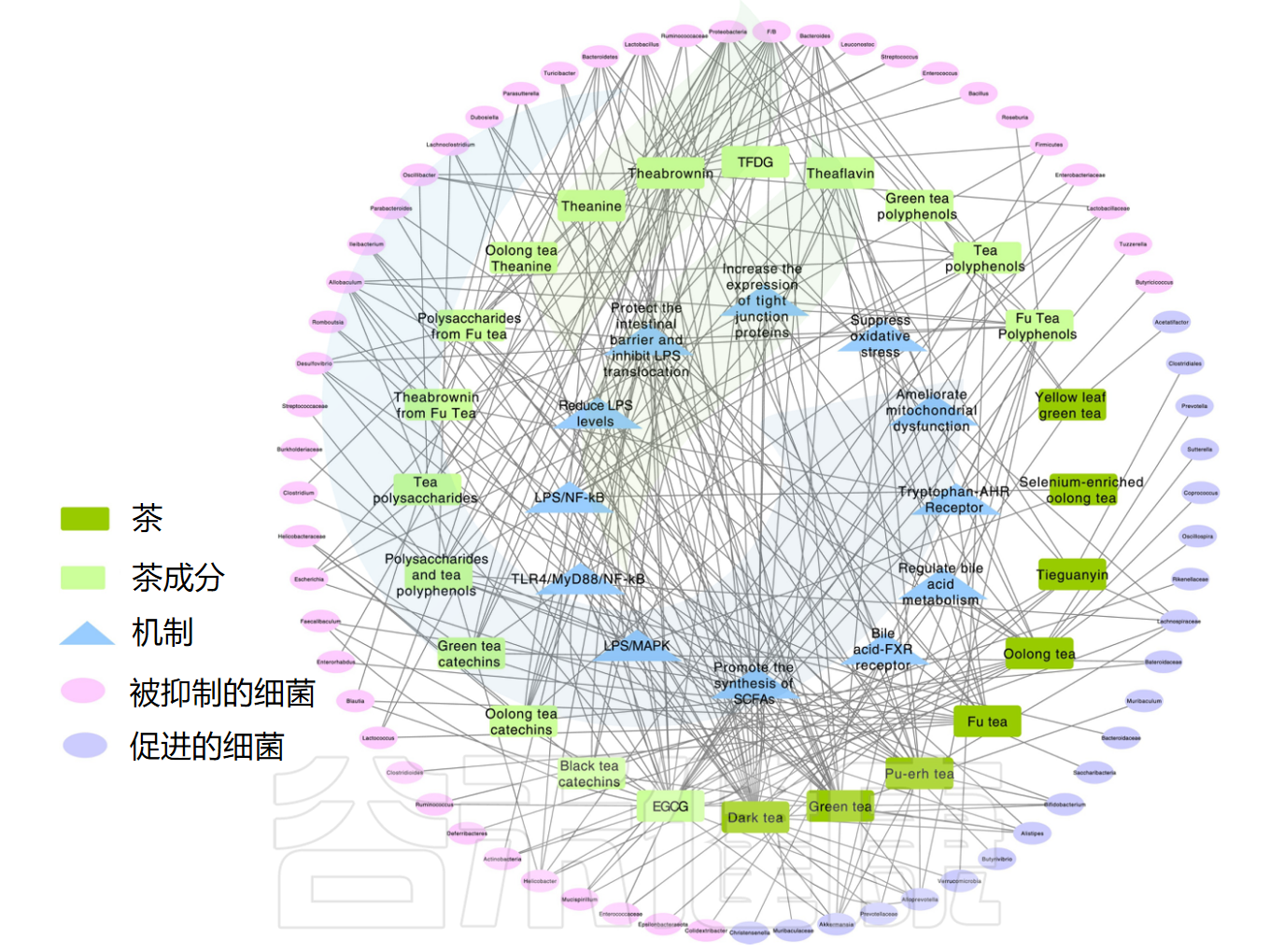
Yu S,et al.Pharmacol Ther.2025
◮ 茶中的咖啡因、茶碱等生物碱也具有抗炎作用
茶中主要生物碱咖啡因、可可碱和茶碱具有抗炎作用。咖啡因通过控制NF-κB激活和MAPK磷酸化减少RAW264.7细胞炎症反应。茶碱将抗炎细胞因子IL-10自发产生提高2.8倍,抑制人肺上皮细胞中NF-κB活化和IL-6产生。可可碱抑制IL-1β诱导的软骨细胞NF-κB活性,改善ROS、COX-2和iNOS表达,抑制TNF-α和MCP-1产生。
茶多糖(TPS)具有复杂化学结构,对胃和小肠消化具有抵抗力,但可被大肠肠道菌群利用。虽然TPS代谢物研究有限,但已证明可调节肠道微生物群组成和丰度,增加短链脂肪酸产生,增强免疫反应,维持肠道功能。不同人群肠道环境和体内平衡差异导致茶叶成分代谢能力不同,可能影响抗炎能力。
下表概述了茶可以减轻炎症的几种方式。在目前的研究中,重点是探索黑茶、绿茶和乌龙茶等各种茶的抗炎特性。
茶可改善肠道稳态和慢性代谢炎症





Yu S,et al.Pharmacol Ther.2025
▸ 抑制脂多糖炎症通路
茶饮通过多组分多靶点方式抑制肠道脂多糖(LPS)通路,调节肠道微生物群,抑制LPS与TLR4受体结合或阻断LPS激活的下游炎症途径。主要功能成分包括茶多酚、茶黄素(TF)、茶褐素(TB)、咖啡因和茶氨酸。
◮ 茶抑制脂多糖下游通路,降低炎症水平
福茶、绿茶和乌龙茶通过调节肠道菌群、抑制脂多糖合成,改善小鼠血脂异常、肝脂肪变性和炎症反应,缓解高脂肪饮食和酒精诱导的肝损伤。绿茶提取物降低肝脏TLR4表达预防酒精相关肝炎,TLR4被确定为潜在核心靶点。
慢性炎症损害PI3K/AKT胰岛素信号通路,引起胰岛素抵抗。福茶干预8周有效控制高脂肪饮食引起的体重增加、葡萄糖代谢问题和器官脂肪堆积,减少氧化应激。免疫组织化学分析显示,下调NF-κB表达,抑制肝脏TNF-α、IL-1β和IL-6表达,使肝组织中IκB-α、JNK、AKT和PI3K水平正常化。
绿茶和红茶对结肠炎小鼠研究中,抑制脂多糖下游TLR4/MyD88/NF-κB信号通路,降低血清IL-1β、IL-6和TNF-α水平,增强抗炎因子IL-10表达。10mg/kg成熟普洱茶(相当于人体7g/60kg/天)产生优异结果,可作为结肠炎辅助治疗。富硒乌龙茶抑制NF-κB通路和MAPK促炎通路中p38、ERK和JNK磷酸化。
◮ 靶向抑制TLR4通路,降低TNF-α、IL-6等炎症因子
药理学分析确定TLR4为表儿茶素、咖啡因、EGCG等茶活性成分作用的中心靶标。EGCG通过抑制TLR4/MyD88/NF-κB炎症通路提高艰难梭菌感染小鼠存活率,与低剂量组相比,高剂量组在肠道和血清水平上的抗炎作用更为明显。
在肝损伤小鼠中,发现EGCG抑制 TLR4/MyD88/NF-κB 通路的激活。它还降低了TNF-α、IL-6和IL-1β等炎症标志物的水平,同时促进肝脏代谢组等变化。这导致结肠中的炎症以及全身和肝脏炎症显著减少。
茶黄素(TF)、茶褐素(TB)和茶氨酸(TA)主要通过阻断下游信号传导抑制脂多糖通路。TF和茶黄素-3,3′-没食子酸酯(TFDG)抑制NF-κB,下调COX-2、TNF-α、iNOS、ICAM-1、NO等促炎介质表达。TB通过抑制NF-κB和MAPK通路减轻肝损伤和炎症。
生普洱茶在调节血糖、减少炎症方面更有效,成熟普洱茶在抑制脂肪分解相关基因和调节肠道菌群方面更佳。乌龙茶茶氨酸通过抑制MEK-ERK磷酸化减少炎症。
◮ 茶多糖被肠道微生物利用促进短链脂肪酸产生并抑制脂多糖易位
茶多糖(TPS)主要作为肠道微生物的一种营养物质,在调节肠道微生态方面发挥重要作用。它们通过改变肠道细菌的组成和丰度来促进产生短链脂肪酸的细菌的生长。这种改变增强了SCFA的产生并降低了炎症因子的水平,而SCFA可以进一步减少脂多糖(LPS)的产生。TPS通过促进SCFA的肠道合成和激活保护肠道屏障的信号通路来抑制LPS易位。
然而,TPS与脂蛋白合成途径减弱间存在U形定量关系,约7克/天剂量显著抑制LPS相关通路,高剂量TPS则增强毒素-蛋白质途径,降低对肝脏脂肪堆积的保护作用。在RAW264.7巨噬细胞中,高剂量TPS显著增加IL-1β等炎症因子表达。由于TPS增加肠道双歧杆菌增殖并可能促进琥珀酸盐合成,过量摄入TPS可能导致琥珀酸盐水平升高,触发琥珀酸盐介导的炎症途径。
▸ 增强肠道和代谢部位的线粒体功能
最近的研究还表明,茶提取物或某些成分有可能改善细胞和动物模型中与炎症相关的线粒体功能障碍。这可以通过调节能量代谢和减少氧化应激来增强线粒体功能,最终导致炎症反应的减少。
◮ 茶多酚减少氧化应激和炎症状况
非酒精性脂肪性肝病(NAFLD)发展中,活性氧过多引起的氧化应激起催化作用,改善氧化应激和平衡氧化还原水平是治疗策略。绿茶含EGCG,通过减少氧化应激及相关代谢问题、炎症、纤维化和肿瘤形成预防和减缓NAFLD发展。与茶多糖和茶褐素相比,茶多酚对活性氧抑制作用更强,通过阻断Cytc/Cleaved-caspase-3信号通路显示最强抗凋亡作用和线粒体保护功能。
NLRP3炎症小体异常激活与多种炎症状况相关。表没食子儿茶素没食子酸酯(EGCG)通过阻止肺部NLRP3炎性小体激活防止急性胰腺炎肺损伤,消除线粒体活性氧及其氧化产物。茶黄素抑制NLRP3炎性小体组装和焦亡,通过改善线粒体功能和减少线粒体活性氧产生实现。口服茶黄素有效减少尿酸钠晶体诱导的小鼠腹膜炎,提高脓毒症小鼠存活率,显著减少IL-1β等炎性细胞因子。
◮ 增加线粒体解偶联蛋白1表达,降低炎症因子
茶色素和茶多糖通过影响肠道-线粒体通路促进脂肪褐变和产热。富含茶黄素、茶褐素、茶红霉素的红茶提取物促进棕色脂肪组织产热和白色脂肪组织褐变,增加线粒体解偶联蛋白1(UCP1)表达,防止体重增加,改善脂肪分布和葡萄糖代谢。
茶多糖显示抗肥胖作用,与肠道微生物丰度变化相关,通过增加产热基因表达引起脂肪褐变和产热活性。TF-2抑制COX-2基因表达,降低TNF-α、iNOS、ICAM-1和NF-κB水平,在炎症模型中显示抗炎作用。
虽然研究表明茶与线粒体在抗炎方面存在潜在联系,但需要更多研究了解具体分子机制和信号通路,特别是免疫细胞中脂多糖相关途径与线粒体能量代谢途径的相互作用。
小编的话
茶多糖(TPS)、多酚、茶氨酸(TA)、茶褐素(TB)、茶黄素(TF)及表没食子儿茶素没食子酸酯(EGCG)这些成分通过改善肠道屏障、抑制脂多糖易位发挥关键作用,增强抗炎效果,表现为短链脂肪酸和紧密连接蛋白含量增加。
茶成分除抑制NF-κB或MAPK等经典促炎途径外,还改善线粒体功能,抑制过度氧化,正向调节AhR和FXR核受体,产生协同抗炎作用。茶成分还调节肠道菌群,促进嗜粘蛋白阿克曼菌、Alloprevotella、Alistipes、双歧杆菌和毛螺菌科增殖,抑制拟杆菌门、变形菌门和Allobaculum,降低F/B比。
结语本文探讨了茶对慢性代谢炎症和肠道稳态的调节作用。研究表明,慢性代谢炎症已成为糖尿病、肥胖、心血管疾病等代谢性疾病的共同发病机制,而肠道稳态失衡是其重要诱因。茶作为一种传统饮品,通过其丰富的生物活性成分,包括茶多酚、茶黄素、茶褐素、茶多糖等,能够有效调节肠道微生物群组成,改善肠道屏障功能,抑制脂多糖介导的炎症通路,从而发挥抗慢性代谢炎症的作用。
研究证据显示,喝茶能够显著增加有益菌群如乳酸菌、双歧杆菌和嗜粘蛋白阿克曼菌的丰度,减少有害菌群,优化厚壁菌门/拟杆菌门比例,促进短链脂肪酸产生,增强肠道屏障完整性。这些变化直接转化为代谢健康的改善,包括血糖控制、脂质代谢优化、体重管理和炎症标志物的降低。
未来健康管理将越来越重视肠道微生物群的核心地位。肠道微生物群不仅是消化系统的重要组成部分,更是连接饮食、代谢、免疫和神经系统的关键枢纽。随着高通量测序技术和生物信息学的快速发展,我们对肠道微生物群功能的理解将更加深入,这将为精准健康干预提供科学基础。
肠道微生物群在未来健康改善中将发挥以下重要作用:
个性化营养指导:基于个体肠道菌群特征制定个性化饮食方案。
疾病预防:通过调节菌群组成预防代谢性疾病的发生。
治疗辅助:作为传统治疗方法的重要补充手段。
而茶作为一种安全、便捷且具有悠久历史的天然产品,在未来肠道微生物群调节方面具有巨大潜力:不同类型的茶(绿茶、红茶、乌龙茶、黑茶)具有不同的功能成分组合,未来可根据个体肠道菌群特征和健康状况,精准选择最适合的茶类和用量。将茶饮与益生菌、膳食纤维等其他肠道调节手段结合,构建多元化的肠道健康管理方案。
主要参考文献
Yu S, Zhu X, Zhao X, Li Y, Niu X, Chen Y, Ying J. Improvement of chronic metabolic inflammation and regulation of gut homeostasis: Tea as a potential therapy. Pharmacol Ther. 2025 May;269:108828.
Agirman G, Yu KB, Hsiao EY. Signaling inflammation across the gut-brain axis. Science. 2021 Nov 26;374(6571):1087-1092.
Al Bander Z, Nitert MD, Mousa A, Naderpoor N. The Gut Microbiota and Inflammation: An Overview. Int J Environ Res Public Health. 2020 Oct 19;17(20):7618.
Asbaghi O, Fouladvand F, Ashtary-Larky D, Bagheri R, Choghakhori R, Wong A, Baker JS, Abbasnezhad A. Effects of green tea supplementation on serum concentrations of adiponectin in patients with type 2 diabetes mellitus: a systematic review and meta-analysis. Arch Physiol Biochem. 2023 Apr;129(2):536-543.
Asbaghi O, Fouladvand F, Gonzalez MJ, Aghamohammadi V, Choghakhori R, Abbasnezhad A. The effect of green tea on C-reactive protein and biomarkers of oxidative stress in patients with type 2 diabetes mellitus: A systematic review and meta-analysis. Complement Ther Med. 2019 Oct;46:210-216.
Blander JM, Longman RS, Iliev ID, Sonnenberg GF, Artis D. Regulation of inflammation by microbiota interactions with the host. Nat Immunol. 2017 Jul 19;18(8):851-860.
Cao SY, Zhao CN, Gan RY, Xu XY, Wei XL, Corke H, Atanasov AG, Li HB. Effects and Mechanisms of Tea and Its Bioactive Compounds for the Prevention and Treatment of Cardiovascular Diseases: An Updated Review. Antioxidants (Basel). 2019 Jun 6;8(6):166.
Chen SY, Li YP, You YP, Zhang HR, Shi ZJ, Liang QQ, Yuan T, Xu R, Xu LH, Zha QB, Ou-Yang DY, He XH. Theaflavin mitigates acute gouty peritonitis and septic organ injury in mice by suppressing NLRP3 inflammasome assembly. Acta Pharmacol Sin. 2023 Oct;44(10):2019-2036.
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1494408.html
上一篇:[转载]慢性肾病:微生物群调节协同营养治疗
下一篇:[转载]幽门螺杆菌毒力靶向:消化致病菌识别和精准干预