博文
[转载]弓形菌属(Arcobacter)——一种新兴的食源性肠道病原菌
||

随着夏季天气变得炎热,高温环境为病原微生物的繁殖创造了有利条件,同时也加速了食品的腐败变质过程,从而导致食源性感染的数量呈现出明显的增加趋势。
重要的食源性细菌病原体包括大肠杆菌、沙门氏菌、弯曲杆菌、小肠结肠炎耶尔森菌、葡萄球菌、肉毒杆菌等。近年来,弓形菌属(Arcobacter)已被确定为一种新兴的食源性人畜共患病原体。
弓形菌属(Arcobacter)是一类革兰氏阴性、螺旋形、不产芽孢的杆菌。其与弯曲杆菌属非常相似,但具有更强的耐氧性和低温耐受性。该属已包含三十多个物种,广泛分布于土壤、淡水、海水以及人类和各种动植物中,大约7%的人群粪便中能够检出。
与人类疾病相关的主要是四个菌种:A.butzleri、A.cryaerophilus、A.skirrowii和A.cibarius,其中A.butzleri最常见,是腹泻患者粪便中第四大弯曲杆菌样生物。该菌可引起胃肠炎、严重腹泻、菌血症、败血症、心内膜炎、腹膜炎等疾病,还存在于肝硬化和坏疽性阑尾炎患者的血液样本中。
Arcobacters对常用抗菌剂的耐药性也有所增加,研究显示,所有测试的Arcobacter菌株都对氨苄青霉素敏感,对氨基糖苷类和四环素类也表现出敏感性。但A.butzleri对氨苄西林耐药率为56%,其次是头孢噻肟(33%)和环丙沙星(33%),对恩诺沙星和庆大霉素敏感,这些是治疗Arcobacter感染的首选药物。所有A.skirrowii和大多数A.cryaerophilus分离株对阿莫西林/克拉维酸敏感,对青霉素、万古霉素、夫西地酸、氯唑西林和头孢唑啉耐药,对阿米卡星、恩诺沙星、氧氟沙星、土霉素、氯霉素、呋喃妥因、红霉素、氨苄西林舒巴坦和阿莫西林中度敏感。
本文全面介绍了这一重要食源性病原体的各个方面,包括不同Arcobacter物种的分布及临床相关性、毒力因子、感染症状和危害、药物敏感性以及与人体和其他菌群的相互作用。并提出使用草药活性成分、精油、噬菌体、益生菌、禽蛋抗体、RNAi技术等新治疗方法有助于防止抗生素耐药性发展和Arcobacter传播。基于肠道菌群检测等技术将进一步深化对Arcobacter感染的理解。
弓形菌属(Arcobacter)的基本属性弓形菌属(Arcobacter)名称源自拉丁语"arcus"(弓形)和"bacter"(细菌),意为"弓形细菌",反映了其弯曲的形态特征。其属于弯曲杆菌科(Campylobacteraceae)。这是一类革兰氏阴性、螺旋形、不产芽孢的杆菌。硝化弧菌(Arcobacter nitrofigilis)为其模式菌种。
弓形菌属(Arcobacter)于1977年首次从流产牛胎儿中分离获得。1991年,该属被归类为非典型弯曲杆菌属中的一组耐氧细菌,随后增加了两个新种。基于核糖体RNA遗传相似性95%的截断标准,该属被确立为独立属。
注:弓形菌属(Arcobacter)与弯曲杆菌属(Campylobacter)密切相关,两者都是Campylobacteriaceae家族的成员。它们的主要区别在于更高的耐氧性和在较低温度下生长的能力。
1
形态特征
弓形菌属(Arcobacter)的主要形态特征包括:
基本形态:革兰氏阴性、通常呈螺旋状、弯曲状或"S"形杆菌。
细胞大小:宽度0.2-0.9微米,长度0.5-3微米。
运动特性:具有单一的无鞘极性鞭毛,表现出独特的穿梭式螺旋运动。
特殊能力:能够通过0.45μm和0.65μm的膜过滤器,这一特性常用于分离培养。
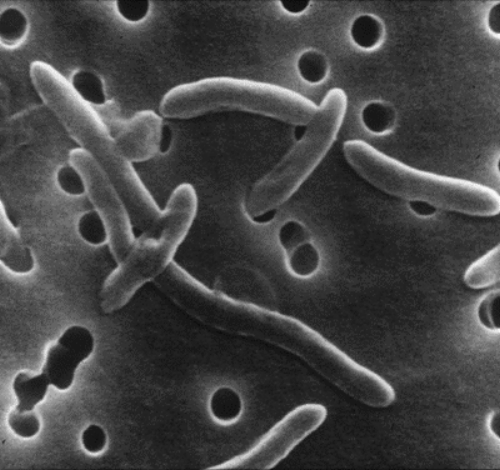
doi.org/10.1111/j.1472-765X.2005.01841.x
2
生长环境
温度:弓形菌属(Arcobacter)的生长温度范围为15-37°C,最适温度30°C。该菌具有良好的低温耐受性,可在-20°C存活6个月,在-70°C存活24个月,但在55°C及以上温度下会迅速失活。
注:A.butzlerii能够在10°C下生长,这是这种微生物的最低可检测生长温度,并且在40°C时没有生长。
氧气:Arcobacter能够耐受氧气,这一点可区分于严格微需氧的弯曲杆菌属(Campylobacter)。
pH和渗透压耐受性:该菌pH耐受范围为5.5-9.5,最适pH为6.8-8.0,并能耐受高盐浓度和低水分。
3
代谢能力
代谢类型:呼吸型代谢,Arcobacter能够耐受氧气环境,主要进行有氧呼吸代谢。
碳源利用:可利用有机酸和氨基酸作为碳源,不发酵或氧化碳水化合物,但有新发现某些菌株能够代谢果糖。
酶活性:氧化酶、过氧化氢酶、吲哚乙酸水解酶和硝酸盐还原酶等均呈阳性。
4
主要菌种及分布
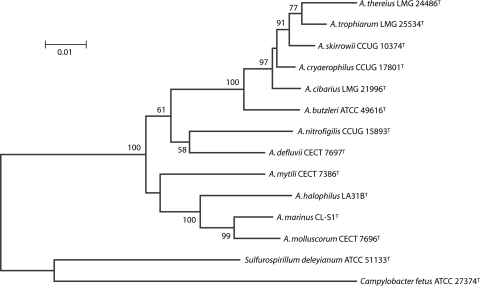
弓形菌属(Arcobacter)已包含三十多个物种,广泛分布于土壤、淡水、海水以及人类和各种动植物中。该属可在全球范围内从肉类、乳制品、蔬菜和海鲜中分离出来,被认为是新兴的人畜共患病原体。其致病菌种可引起人类急性持续性腹泻、恶心、呕吐和肠道功能紊乱,也可导致无腹泻的菌血症。
Arcobacter物种基于16S rRNA 基因的关系
doi: 10.1128/CMR.00034-10.
• 与人类疾病密切相关的主要有四种:
A.butzleri(最常见,与人类疾病关联最强)
A.cryaerophilus(第二常见菌种)
A.skirrowii(水环境污染中检出率13%)
A.cibarius
• 人群中的检出率:
健康人群:大约7%的人群粪便中能够检出Arcobacter。
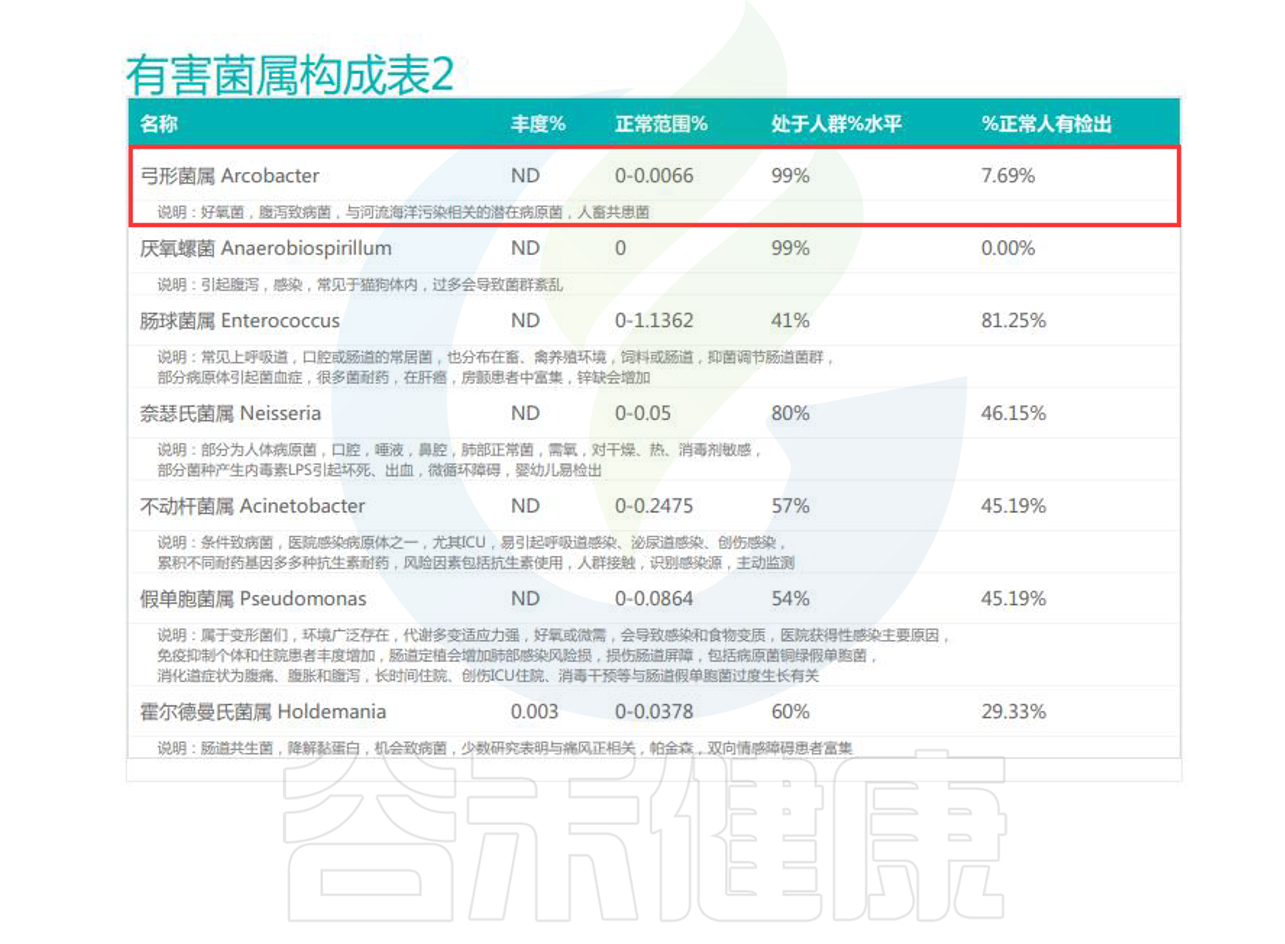
腹泻患者:在一些研究中,A.butzleri是第三或第四常见的弯曲菌样病原体。
分布特点:遍布全球各大洲、发展中国家检出率相对较高、与环境卫生条件相关。
• A.butzleri—与人类疾病关联最强的
在所有Arcobacters中,A.butzleri是最常见的物种,与人类疾病有关,可引起肠炎、严重腹泻、菌血症和败血症等疾病,是腹泻患者粪便中第四大弯曲杆菌样生物。
A.butzleri感染的主要临床表现包括:
胃肠道症状:
-持续性水样腹泻(与空肠弯曲杆菌的血性腹泻不同);
-急性腹泻持续3-15天;
-腹痛和恶心;
-血性粪便(部分病例);
-恶心和呕吐;
全身症状:
-发热和寒战
-虚弱和乏力
-厌食和体重减轻
在下面的章节中我们也会主要以A.butzleri为例阐述该致病菌对人体的危害。
• A.cryaerophilus—新出现的食源性病原体
A.cryaerophilus是一种新兴的食源性病原体,与人类疾病也相关。A.cryaerophilus是人类粪便样本中第二常见的Arcobacter菌种,仅次于A.butzleri,并且在肠炎症状患者粪便样本中占43%,仅次于A.butzleri(55%)。
A.cryaerophilus主要引起人类传染性胃肠道疾病,症状包括急性或长期水样腹泻、腹痛、恶心、持续性腹泻,严重者可发生菌血症。
5
毒力因子
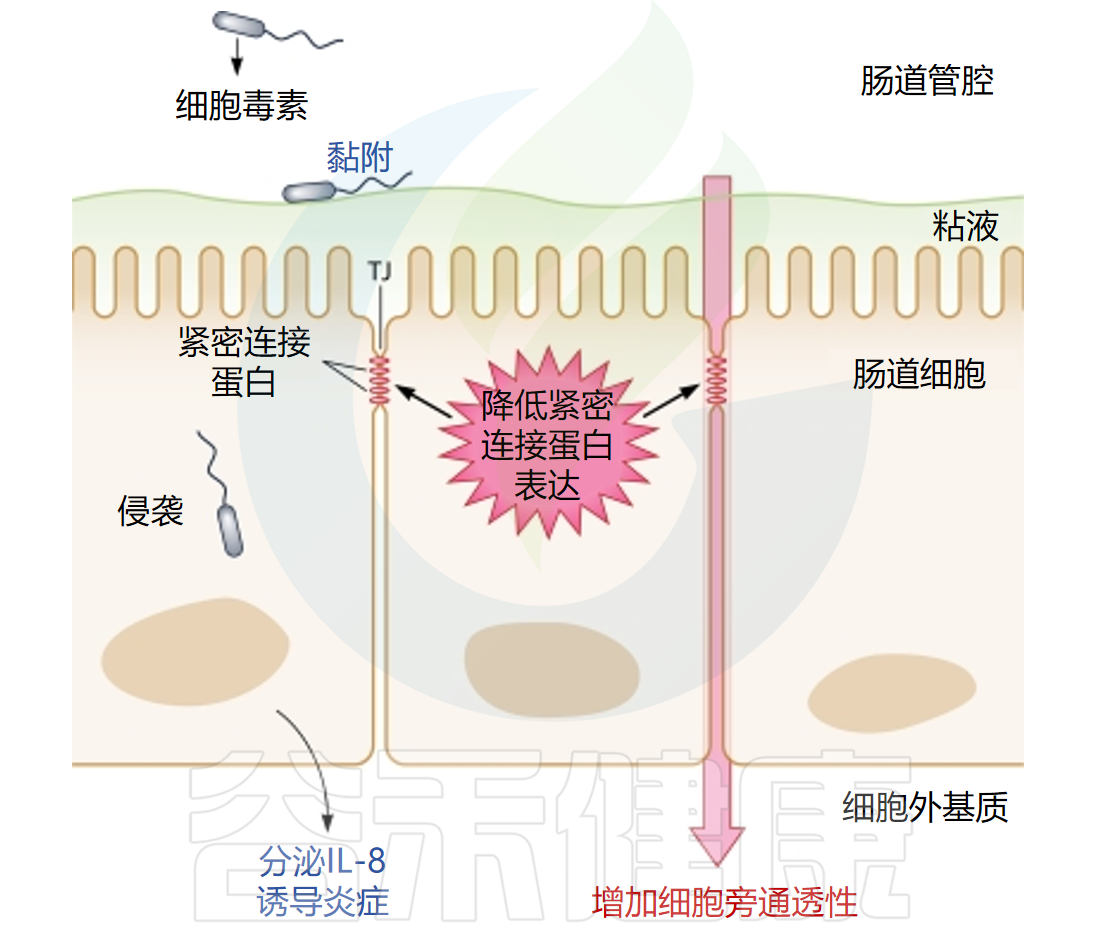
目前关于Arcobacter毒力基因/因子的研究信息有限。现有研究表明,粘附、病原体入侵、毒素分泌和促炎细胞因子(IL-8)在建立宿主感染中发挥主要作用。A.cryaerophilus和A.butzleri是迄今为止在粘附性和侵袭性方面研究最多的两个主要Arcobacter物种。
• 损害结肠上皮功能
A.butzleri感染会损害人HT-29/B6结肠上皮单层的上皮功能。Claudin蛋白家族对屏障功能至关重要,其中claudin-1、5和8具有屏障密封特性。A.butzleri感染期间,紧密连接蛋白claudin-1、-5和-8表达异常,导致上皮屏障功能障碍。类似的claudin-1功能障碍也在肠致病性大肠杆菌感染的人肠道T84单层中观察到。
据报道,血凝素特性也与A.butzleri有关,它与红细胞相互作用,因此有助于细菌的粘附。
与弯曲杆菌和幽门螺杆菌一样,Arcobacter感染中IL-8的释放可能在引起腹泻中发挥作用。促炎细胞因子的释放是幽门螺杆菌和弯曲杆菌的主要毒力因子,同样,Arcobacter也能导致促炎细胞因子的释放。
Arcobacter的毒力机制
doi: 10.1128/CMR.00034-10.
• 可以产生肠毒素和液泡毒素
当在Vero细胞中培养时,Arcobacter分离物会产生细胞伸长,这表明它们具有产生肠毒素的能力,部分分离株还能在细胞中产生液泡,显示其具有液泡毒素产生能力。
• 各种毒力基因参与不同的致病过程
目前已在A.butzleri ATCC 49616基因组中发现10个推定毒力基因:cadF、ciaB、cj1349、hecA、iroE、hecB、irgA、mviN、pldA和tlyA。这些基因分别编码外膜蛋白、侵袭蛋白、溶血素、磷脂酶A等,参与粘附、侵袭、溶血、铁获取等过程。
注:不同基因的功能包括: cadF基因和cj1349基因编码外膜蛋白,通过粘附纤连蛋白促进肠上皮细胞间接触;ciaB基因参与宿主细胞的侵袭,pldA基因编码水解酰酯键的外膜磷脂酶 A,tlyA基因是溶血素基因,irgA基因编码肠杆菌素的外膜受体,hecA基因是丝状血凝素家族的成员,hecB基因编码溶血素激活蛋白。
一项研究揭示了Arcobacter spp中的6个毒力基因 (cadF、ciaB、cj1349、mviN、pldA 和 tlyA)存在于所有A.butzleri分离株中,而在A.cryaerophilus和A.skirrowii中的分布存在差异。各种毒力基因负责不同的致病过程:CadF、HecA和Cj1349参与粘附,CiaB参与侵袭,HecB、TlyA和PldA参与红细胞裂解,IrgA和IroE参与铁获取,MviN参与肽聚糖生物合成。
6
药物敏感性
关于Arcobacter的抗菌药物敏感性数据有限,A.butzleri是研究最多的物种。现有报告表明,这种新兴病原体的抗菌素耐药性增加,导致常用抗菌剂治疗失败。并且A.butzleri比A.cryophilus和A.skirrowi表现出更强的耐药性。
Arcobacter的抗生素耐药性或检测到的基因组性状
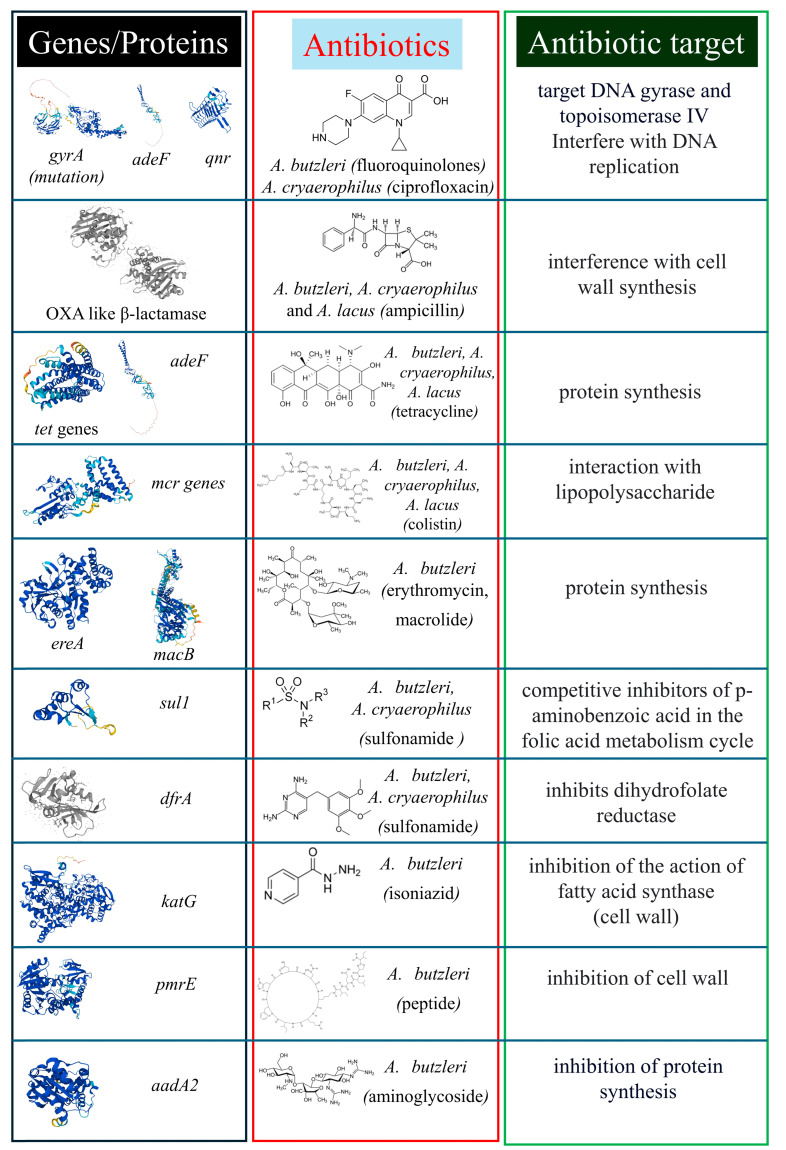
Buzzanca D,et al.Antibiotics (Basel).2024
• 对氨苄青霉素敏感
研究显示,所有测试的Arcobacter菌株都对氨苄青霉素敏感,对氨基糖苷类和四环素类也表现出敏感性。A.butzleri对氨苄西林耐药率为56%,其次是头孢噻肟(33%)和环丙沙星(33%),对恩诺沙星和庆大霉素敏感,这些是治疗Arcobacter感染的首选药物。
在一项研究中,所有A.skirrowii和大多数A.cryaerophilus分离株对阿莫西林/克拉维酸敏感,对青霉素、万古霉素、夫西地酸、氯唑西林和头孢唑啉耐药,对阿米卡星、恩诺沙星、氧氟沙星、土霉素、氯霉素、呋喃妥因、红霉素、氨苄西林舒巴坦和阿莫西林中度敏感。
• 对头孢菌素和万古霉素具有耐药性
研究发现,Arcobacter对头孢菌素、新生霉素和万古霉素耐药,但对阿奇霉素、萘啶酸和庆大霉素敏感。71种Arcobacter分离株的抗菌素敏感性测试显示,所有分离株对一种或多种抗菌剂具有耐药性,对头孢菌素和万古霉素的耐药性最常见(96%),其次是甲氧西林、阿奇霉素和氨苄西林。所有分离株都对庆大霉素、链霉素、四环素和卡那霉素敏感。
比利时患者分离的A.butzleri和A.cryaerophilus菌株研究显示,大多数菌株对庆大霉素(99%)和四环素(89%)敏感,红霉素(78%)、环丙沙星(72%)和多西环素(76%)显示中等活性,仅9%的菌株对氨苄西林敏感。大多数A.butzleri菌株对环丙沙星敏感(87%),而一半的A.cryaerophilus分离株(51%)表现出高水平耐药性。
研究结果表明,大环内酯类药物不是Arcobacter感染的首选经验性抗生素,四环素类药物可用于治疗Arcobacter诱导的胃肠道感染。所有Arcobacter分离株均对万古霉素、利福平、甲氧苄啶、头孢曲松和头孢菌素耐药,而对土霉素、四环素、环丙沙星、红霉素、卡那霉素、阿米卡星、恩诺沙星和庆大霉素高度敏感。四环素类和氨基糖苷类药物可用于治疗人类Arcobacter感染。
7
与人体和其他菌群的相互作用
• 细胞粘附与侵袭
粘附因子:cadF、cj1349、hecA等基因编码外膜蛋白;
侵袭机制:通过ciaB基因介导的细胞侵袭;
紧密连接破坏:影响claudin-1、claudin-5、claudin-8等紧密连接蛋白。
• 免疫相互作用
促炎反应:诱导IL-8、TNF-α、IFN-γ、IL-6等细胞因子释放;
TLR激活:激活Toll样受体4(TLR-4)依赖的免疫反应;
氧化应激:诱导活性氧产生,损伤细胞。
• 与肠道菌群的关系
生态竞争:Arcobacter会与有益菌竞争营养和定植位点;
菌群失调:Arcobacter感染可导致肠道菌群结构改变,并造成菌群失调;
代谢产物影响:影响短链脂肪酸等有益代谢产物产生。
• 菌群相互作用
增强:
Bacteroidales
Bacteroides
Odoribacter
Peptococcaceae
抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Porphyromonas
Prevotella
Clostridium
Clostridiales incertae sedis
Clostridiales Family XIII. Incertae Sedis
Blautia
Coprococcus
Dorea
Lachnospiraceae
Ruminococcaceae
Ruminococcus
Dialister
Campylobacteraceae
Erysipelotrichaceae
被抑制:
Bifidobacterium
Coriobacteriales
Adlercreutzia
Collinsella
Bacteroidales
Bacteroides
Porphyromonadaceae
Odoribacter
Parabacteroides
Porphyromonas
Prevotella
Rikenellaceae
Alistipes
Turicibacter
Streptococcus
Clostridiales
Catabacteriaceae
Clostridium
Clostridiales incertae sedis
Peptoniphilus
Clostridiales Family XIII. Incertae Sedis
Lachnospiraceae
Blautia
Lachnospiraceae
Coprococcus
Dorea
Eubacterium
Lachnobacterium
Lachnospira
Roseburia
Lachnospiraceae
Peptococcaceae
Ruminococcaceae
Ruminiclostridium
Acetivibrio
Eubacterium
Faecalibacterium
Oscillospira
Ruminococcus
Acidaminococcus
Dialister
Phascolarctobacterium
Veillonella
Rubrivivax
Alcaligenaceae
Oxalobacter
Bilophila
Desulfovibrio
Campylobacteraceae
Enterobacteriaceae
Escherichia
Erysipelotrichaceae
Holdemania
Akkermansia
弓形菌属(Arcobacter)的临床重要性1
感染的危害
多项研究表明,Arcobacter在世界不同国家的人类中普遍存在,已从人类粪便和血液样本中分离出来。而其中的致病菌种A.butzleri和A.cryaerophilus已被多次证明与胃肠道疾病相关。持续性水样腹泻是A.butzleri的主要症状,与空肠弯曲杆菌病例中的血性腹泻形成对比,其余微生物学或临床特征非常相似。
注:Arcobacter spp.也被认为是旅行者腹泻的一种细菌因子,与大肠杆菌、志贺氏菌、沙门氏菌和弯曲杆菌并列。
• A.butzleri是第三普遍的弯曲杆菌病原体
一项通过分子方法的研究发现,在322份粪便标本中,A.butzleri是第三普遍的弯曲杆菌(6.2%),仅次于幽门螺杆菌(50.6%)和空肠弯曲杆菌(10.2%)。比利时和法国的两项独立研究显示,A.butzleri是从腹泻患者粪便中发现的第四种最常见的弯曲杆菌样生物。最近,该物种还被发现是美国和欧洲旅行者前往墨西哥、危地马拉和印度后发生旅行者腹泻的病因,患病率为8%,这是首次证明Arcobacter与此类感染关联的研究。
• 可引起肠炎,导致腹泻等症状
在所有研究中,A.butzleri的患病率往往最高,其次是A.cryaerophilus和A.skirrowii,直接分子检测报告的值分别为6.2%、2.9%和1.9%。A.skirrowii仅在少数情况下与胃肠炎相关。
A.butzleri近年来已被定位为一种新兴的人畜共患病原体,它被描述为急性细菌性胃肠炎的原因,伴有血便、大量腹泻、腹胀,在某些情况下是菌血症的原因。此外,A.butzleri和A.cryaerophilus引起的病例也偶有报道。
Arcobacter中的致病菌种丰度过高会导致以下危害:
急性胃肠炎
症状:水样腹泻(持续3-15天,严重可达2个月)
伴随症状:腹痛、恶心、呕吐、发热、寒战
病程特点:通常自限性,但可发展为慢性感染
严重系统性感染
菌血症:可发生原发性或继发性菌血症
心内膜炎:罕见但严重的并发症
腹膜炎:腹腔感染的重要病原体
败血症:在免疫功能低下患者中易发生
肝硬化和阑尾炎患者中也存在
在患有肝硬化和阑尾炎等临床疾病的患者的血液样本中也检测到弓形菌属(Arcobacter)。
• 诱导促炎细胞因子释放
A.butzleri感染会诱导小肠和大肠分泌更多促炎细胞因子,包括TNF、IFN-γ、IL-6和MCP-1。A.butzleri还以菌株依赖性方式诱导比共生大肠杆菌更明显的局部和全身免疫反应,表明A.butzleri不仅仅是人体中的共生体。
研究还发现miRNA在感染A.butzleri的巨噬细胞免疫信号中发挥作用。细菌感染期间有几种miRNA表达,其中miR-155、miR-212和miR-125等新型miRNA表达上调,它们在Toll样受体信号转导中起关键作用,参与免疫反应的产生。揭示了人类先天免疫细胞与Arcobacter在感染过程中的相互作用。
2
疾病相关的发病机制
• 肠道屏障功能破坏
物理屏障:破坏肠道上皮细胞紧密连接;
化学屏障:影响胃酸和胆汁酸的保护作用;
生物屏障:干扰正常肠道菌群的保护功能;
免疫屏障:调节肠道免疫系统反应。
• 与炎症性肠病的关联
炎症介质:激活NF-κB信号通路,促进炎症因子释放;
氧化应激:诱导活性氧产生,加重肠道损伤;
自身免疫:可能触发自身免疫反应;
菌群失调:加重肠道菌群紊乱。
• 毒力因子与致病机制
粘附侵袭:cadF、cj1349、ciaB、hecA;
毒素产生:hecB、tlyA、pldA(溶血素和磷脂酶);
铁获取:irgA、iroE(铁离子转运);
细胞壁合成:mviN(维持细胞完整性)。
3
感染途径
人类中的Arcobacter主要引起肠道问题,通过粪口传播、动物直接传播以及受污染的食物(蔬菜、鸡肉和猪肉)和水源等多种方式在宿主细胞中定植。
• 食源性传播
已从鸡肉、猪肉、牛肉和海鲜等各种肉类样本中分离出Arcobacter。据报道,鸡肉的Arcobacter患病率最高,其次是猪肉和牛肉。
注:据报道,鸡肉的A.butzleri发病率最高,为83%,其次是牛肉(20%)和猪肉(15%)。从哥斯达黎加销售的家禽内脏样本中分离出17%的Arcobacter,其中大多数分离株对氯霉素和氨苄青霉素具有耐药性。
四种弓形菌属(A.butzleri、A.cryaerophilus、A.skirrowii和A.cibarius)已从肉类中大量分离,尤其是从鸡尸体中。从牡蛎、鱼类、贝类和蛤蜊等海鲜中也可分离出Arcobacter。
来自世界不同地区的报告显示从牛奶样本中分离出Arcobacter,表明牛奶在其传播中可能起作用。其中A.butzleri是最主要的物种(60%),其次是A.cryaerophilus(40%)。并且研究表明A.butzleri和A.cryaerophilus在4°C和10°C储存的牛奶中存活了6天,因此牛奶可以作为人类Arcobacter感染的来源。
与Arcobacter相关的人类胃肠炎的几次爆发与食用受污染的新鲜蔬菜有关,因此可能成为重要的感染源。最近,在生菜和胡萝卜加工厂上报告了一些Arcobacter物种。在预切即食蔬菜上出现Arcobacter的比率为28%,其中91%(40/44)分离株为A.butzleri,9.1%(4/44)分离株为A.cryaerophilus。这些结果表明,直接食用生蔬菜可能存在健康风险。
• 经受污染的水源传播
受污染的水被认为是人类Arcobacter感染的重要来源。据估计,63%的A.butzleri感染是通过食用或接触受污染的水在人类中获得的。已从河流、湖泊、地下水、海水以及浮游生物中检测到了Arcobacter。
在土耳其伊兹密尔,来自不同来源(66个污水、25个河流、16个泉水和8个饮用水)的水样本中,有36%(41/115)的Arcobacter呈阳性。其中,34%的样本(39/115;24个污水、13条河流和2个泉水)报告了A.butzleri。这些结果表明,环境水样是Arcobacter的常见来源。
4
易感因素
虽然宿主特征(如年龄和免疫状态)在Arcobacter感染中的作用尚未明确确定,但很可能发挥重要作用。研究显示,以下人群可能更易受到感染:
• 免疫功能低下者
-慢性淋巴细胞白血病患者
-HIV感染者
-器官移植受者
-化疗患者
• 年龄相关易感性
-新生儿:可发生垂直传播
-老年人:易发生严重感染和并发症
-儿童:症状通常较轻但持续时间长
• 一些疾病患者中弓形菌属丰度也较高
弓形菌属(Arcobacter)还常见于患有其他潜在疾病的患者中,包括1型和2型糖尿病、肝硬化、坏疽性阑尾炎、癌症、慢性肾功能衰竭、内部假体植入、高尿酸血症和酗酒等。
一项研究通过多重PCR检测发现,患有2型糖尿病但无胃肠道症状的老年受试者中,粪便携带弓杆菌的患病率高达79%(30/38)。
弓形菌属(Arcobacter)的预防和控制针对新兴食源性病原体Arcobacter,需要采取一些控制措施来降低其感染风险或减轻疾病负担。
1
食品加工控制措施
肉类、奶类、海鲜等烹饪不当和受污染的动物源性食品可能是人类弓形菌属(Arcobacter)感染的重要来源。因此,彻底和良好的烹饪方法是预防感染的关键。
• 物理处理方法
高温处理:A.butzleri对热敏感,50°C热处理后会产生致命的协同效应;
辐射处理:A.butzleri对辐射的抗性比空肠弯曲杆菌更强;
低温储存:低温可抑制Arcobacter生长,但不能完全杀死。
• 化学处理方法
柠檬酸:1.0%浓度可抑制A.butzleri生长;
乳酸:2.0%浓度有效抑制生长;
乳酸钠:2%浓度有效抑制;
苯甲酸、苹果酸和山梨酸:具有较强抑制活性。
链球菌素50 IU/ml可将A.butzleri存活率降低约500%。磷酸三钠和EDTA在纯培养中能有效减少A.butzleri存活。
2
益生菌防控策略
• 益生菌菌株的抑制作用
植物乳杆菌(L.plantarum CFS)在12.5%浓度下完全抑制A. butzleri生长;
嗜酸乳杆菌(L.acidophilus)和罗伊氏乳杆菌(L.reuteri CFS)在25%浓度下完全抑制生长;
在TSB+MRS培养基中,所有乳酸杆菌在24-48小时内均能有效抑制A.butzleri。
• 益生菌抑制机制
酸化环境:益生菌产生的乳酸创造酸性环境(pH<3.0时A. butzleri在20分钟内无法生长);
代谢产物抑制:细胞无培养上清液(CFS)中的抗菌物质;
细菌素产生:如罗伊氏乳杆菌产生的罗伊氏菌素(Reuterin);
竞争性排斥:通过置换和排斥机制减少A. butzleri的肠道粘附。
3
植物提取物
• 精油类抗菌剂
百里香精油:对A.butzleri具有显著抗菌活性,抑制浓度为32-1024 μg/mL;
丁香精油:抑制浓度为512-1024 μg/mL;
其他精油:17种精油(迷迭香、大蒜、鼠尾草、熊果、多香果、黑胡椒、孜然、肉桂、香菜、百里香、丁香、茴香、甘草、圣约翰草、生姜、洋甘菊和薄荷等)均显示出抑制效果。
• 植物提取物
柠檬、甜橙和佛手柑油:可预防Arcobacter感染;
白藜芦醇植物提取物:通过抑制细菌代谢活动、影响DNA并阻断细胞分裂发挥杀菌作用;
草药提取物:洋甘菊、鼠尾草、肉桂、迷迭香、熊果提取物等。
4
环境控制和卫生措施
• 屠宰场和食品加工厂卫生
严格消毒:使用适当消毒剂,因为A.butzleri在常规消毒后仍可能存活;
HACCP体系:实施严格的胴体微生物监测、验证系统和良好生产规范;
表面处理:A.butzleri可在铜、不锈钢和塑料管道表面定植,需要加强清洁。
• 个人卫生
食品处理:彻底烹饪肉类、奶类、海鲜等动物源性食品;
交叉污染防控:避免生熟食品交叉污染。
• 水处理
氯化处理:尽管A.butzleri对氯敏感,但常规饮用水处理效果仍需加强;
水源保护:受污染的水是重要感染源,需要有效处理水资源。
5
新型治疗方案
面对抗生素耐药性上升,急需探索替代疗法,包括噬菌体疗法、益生菌、禽蛋黄抗体、细胞因子、RNAi技术、群体感应抑制剂、草药和精油等。噬菌体疗法已成功用于预防沙门氏菌、李斯特菌等,在屠宰场控制Arcobacter进入食物链方面具有良好前景。
主要参考文献
Ramees TP, Dhama K, Karthik K, Rathore RS, Kumar A, Saminathan M, Tiwari R, Malik YS, Singh RK. Arcobacter: an emerging food-borne zoonotic pathogen, its public health concerns and advances in diagnosis and control - a comprehensive review. Vet Q. 2017 Dec;37(1):136-161.
Collado L, Figueras MJ. Taxonomy, epidemiology, and clinical relevance of the genus Arcobacter. Clin Microbiol Rev. 2011 Jan;24(1):174-92.
García-Salguero C, González-Corralejo C, Marroyo Laso J, Delgado-Iribarren García-Campero A. Acute gastroenteritis due to Arcobacter butzleri: an emerging pathogen. Gut Pathog. 2025 Apr 11;17(1):22.
Buzzanca D, Chiarini E, Alessandria V. Arcobacteraceae: An Exploration of Antibiotic Resistance Featuring the Latest Research Updates. Antibiotics (Basel). 2024 Jul 18;13(7):669.
Ferreira S, Queiroz JA, Oleastro M, Domingues FC. Insights in the pathogenesis and resistance of Arcobacter: A review. Crit Rev Microbiol. 2016 May;42(3):364-83.
Chieffi D, Fanelli F, Fusco V. Arcobacter butzleri: Up-to-date taxonomy, ecology, and pathogenicity of an emerging pathogen. Compr Rev Food Sci Food Saf. 2020 Jul;19(4):2071-2109.
Prouzet-Mauléon V, Labadi L, Bouges N, Ménard A, Mégraud F. Arcobacter butzleri: underestimated enteropathogen. Emerg Infect Dis. 2006 Feb;12(2):307-9.
Vieira A, Mateus C, Fonseca IM, Domingues F, Oleastro M, Ferreira S. The dual action of probiotic lactobacilli in suppressing virulence and survival of Arcobacter butzleri. Microb Pathog. 2025 Jul;204:107589.
Bachus A, Beyer S, Bücker R, Sharbati S, Alter T, Gölz G. Pathogenicity of Arcobacter cryaerophilus in two human intestinal cell lines. Gut Pathog. 2025 Jun 22;17(1):48.
Jiménez-Guerra G, Casanovas MorenoTorres I, Moldovan TD, Navarro-Marí JM, Gutiérrez-Fernández J. Arcobacter butzleri and intestinal colonization. Rev Esp Quimioter. 2020 Feb;33(1):73-75.
Gölz G, Karadas G, Alutis ME, Fischer A, Kühl AA, Breithaupt A, Göbel UB, Alter T, Bereswill S, Heimesaat MM. Arcobacter butzleri Induce Colonic, Extra-Intestinal and Systemic Inflammatory Responses in Gnotobiotic IL-10 Deficient Mice in a Strain-Dependent Manner. PLoS One. 2015 Sep 25;10(9):e0139402.
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1494412.html
上一篇:[转载]幽门螺杆菌毒力靶向:消化致病菌识别和精准干预
下一篇:[转载]解码宠物猫狗的肠道微生物组:守护毛孩健康新前沿