博文
金属镁微球增效肝癌介入栓塞治疗【Sci.Adv.】
||
苏州大学刘庄教授、程亮教授研究团队联合丽水市中心医院纪建松教授及苏大附一院倪才方教授在Science Advances上发表题为Magnesium Microspheres for Enhanced Transarterial Chemo-Embolization Therapy of Hepatocellular Carcinoma: from Animal Models to a Pilot Clinical Study的研究。该研究创新性地利用金属镁微球作为一款新型的栓塞制剂,旨在解决临床介入栓塞治疗的问题并提升其治疗效果。
本博主特别认真阅读学习了该研究论文,文章思路清晰,研究系统全面,非常钦佩研究团队的工作,可以说是用了一种非常简单的方法,解决了一个非常重要的临床问题,如果效果确定,如获得更多RCT研究证据,该研究和策略非常有希望迅速进入临床应用,且不仅仅局限于肝癌,甚至非肿瘤疾病。
对该研究有三个小问题,一是氢气一般都认为是减少细胞凋亡,当然也有认为是增加细胞凋亡,主要是在肿瘤效应方面,本研究认为是后者,没有对这个问题进行阐述和讨论。二是研究中发现能提高碘油阻塞作用,这非常有可能,加入镁材料产生氢气气泡,这有可能会促进血液凝固,因为气泡本身能促进血液凝固,如果这个效应明确,那么对肿瘤的治疗效果可能来自于提高了血流中断的作用,其他的治疗效应有可能是次要的,当然细胞免疫增加似乎不符合这一推测。三是组织内氢气测定结果使用了微摩尔,不够明确。氢气扩散性非常高,这种测定可能只是局限在组织内的氢气,且不清楚是多少组织的这种氢气量。总之,这里需要更详细的描述。

经动脉化疗栓塞术(TACE)已在临床上广泛用于治疗不可切除的肝细胞癌(HCC)。本研究中,镁微球(Mg MSs)被用作栓塞装置,以增强碘油介导的TACE疗效。将镁微球分散在碘油中并注入肿瘤后,会持续产生氢气和氢氧化镁,从而中和酸性肿瘤微环境、恢复耗竭的CD8⁺T细胞、逆转免疫抑制,并触发特异性T细胞介导的抗肿瘤反应,协同抑制肿瘤生长。
在兔原位肝癌模型中,动脉输注镁微球分散的碘油相较于基于碘油或聚合物微球的TACE,治疗效果显著增强。在一项初步临床研究中,15例符合条件的肝癌患者中,11例达到完全缓解,3例达到部分缓解,在1至3个月的随访期间未出现意外的治疗相关不良事件。在这项小规模试验中,镁增强TACE的客观缓解率约为93.3%,远高于当前的TACE疗法。
引言
肝细胞癌(HCC)是全球第六大常见癌症,也是第三大癌症死亡原因(1-3)。大多数肝癌患者在确诊时已处于中晚期,因此失去了接受手术切除和肝移植等根治性治疗的机会(4,5)。对于不适合手术或已失去手术机会的患者[多结节肿瘤(>3个)伴或不伴血管侵犯/肝外转移、残余肝体积不足(肝硬化患者<40%)],经动脉栓塞/化疗栓塞术(TAE/TACE)通过阻断肿瘤血供并在局部引入化疗药物(针对TACE),目前被认为是肝癌最常见的非手术治疗方法(6,7)。在这些手术中,栓塞剂如碘油或聚合物微球分别用于传统TACE(cTACE)或药物洗脱微球TACE(D-TACE)。然而,有报道称接受cTACE和D-TACE的患者在无进展生存期(PFS)方面无显著差异(8,9)。在最近报道的针对中国晚期肝癌患者的CHANCE001回顾性队列研究中,TACE单药治疗的客观缓解率(ORR)仅为32%,而TACE联合PD-(L)1抑制剂和分子靶向治疗时,客观缓解率可提高至60.1%(5)。因此,TACE疗法的疗效仍有很大提升空间。众所周知,具有酸性pH、缺氧和高氧化应激特征的肿瘤微环境(TME)会导致免疫抑制,并使肿瘤对不同类型的治疗产生耐药性(10,11)。特别是在TACE治疗中,动脉栓塞后肿瘤微环境的恶劣理化特征会进一步恶化,导致pH进一步降低、缺氧加剧,增加肿瘤转移和耐药风险(12,13)。为解决这些问题,在先前的一项临床试验中,Chao等人(14)在cTACE前向肿瘤局部输注碳酸氢钠以中和酸性肿瘤pH,发现这些患者的生存期优于单纯接受cTACE的患者。然而,由于碳酸氢钠在动脉输注后会迅速流失,这种策略无法实现对肿瘤微环境的长期调节。近年来,各类纳米药物和生物材料工具被用于实现肿瘤微环境的持续调节和肿瘤免疫抑制的逆转,旨在提高肿瘤对不同治疗的响应(15-18)。针对TAE/TACE疗法,已有多种可中和酸性pH的纳米或微米级材料被提出,并在动物研究中显示出良好结果(19,20)。除pH中和外,在我们最近的临床前研究中,我们发现经TAE注入肿瘤后,分散在碘油中的氢化钙(CaH₂)纳米颗粒会与水反应生成氢气(H₂),同时中和肿瘤pH,改变免疫抑制性肿瘤微环境,从而显著增强治疗效果(21)。在该系统中,氢气能够与肿瘤内的活性氧(ROS)反应,逆转免疫抑制并促进抗肿瘤免疫(22,23)。此外,高浓度氢气本身可通过引起线粒体功能障碍、激活P53介导的凋亡信号通路和诱导免疫原性细胞死亡(ICD)导致肿瘤细胞凋亡(24-26)。然而,氢化钙纳米颗粒与水反应剧烈,在肿瘤中会迅速分解,更不用说其临床应用的安全性问题。因此,开发长效栓塞装置以实现肿瘤内持续的pH中和和氢气生成,并在临床研究中测试该策略增强TACE的可能性具有重要意义。镁(Mg)及其合金材料具有高生物相容性和生物可降解性,已在临床上用作植入材料和血管支架(27,28)。镁能与水(H₂O)缓慢反应生成氢气和氢氧化镁[Mg(OH)₂],其反应性可通过镁球的尺寸调节,纳米和微米级镁的反应速度远快于块状镁。本研究中,我们选择尺寸约70μm的镁微球(Mg MSs)作为栓塞装置,通过调节肿瘤微环境来增强碘油介导的肝癌TACE疗效。研究发现,将镁微球分散在碘油中(Lip-Mg)注入小鼠皮下肿瘤后,会释放氢气并生成氢氧化镁,分别清除肿瘤内过量的活性氧和中和酸性pH。随后,我们观察到T细胞介导的抗肿瘤反应增强,耗竭的CD8⁺T细胞得以恢复,从而显著抑制肿瘤生长。同时,与单纯碘油相比,Lip-Mg显示出更强的TAE能力。在兔肝肿瘤动脉输注治疗中,使用Lip-Mg的镁基TACE(M-TACE)相较于基于碘油的cTACE和临床使用的药物洗脱微球TACE(D-TACE),治疗效果更优。最后,在一项初步临床研究中探讨了镁微球增强TACE的能力。15例有效肝癌患者经M-TACE治疗后,11例达到完全缓解(CR),客观缓解率高达93.3%,远高于cTACE单药治疗。这些患者在M-TACE后未观察到意外的额外不良事件。本研究提出了一种基于镁微球的栓塞微装置用于M-TACE治疗,有望显著提高TACE在肝癌治疗中的疗效。
结果
镁微球的制备与表征
采用气体雾化粉碎法制备镁微球(29)。在氩气保护下,将镁锭在气体雾化设备中加热至700°C,使其处于熔融状态(图1A)。随后,熔融镁从狭窄通道流出,立即被超高速气流雾化。冷却至室温后,通过气流筛分机筛选得到的镁粉,收集镁微球。从倒置光学显微镜图像可见,获得了一系列直径从纳米级到微米级(约700nm、25μm、70μm、150μm、250μm和350μm)的镁微球(图1B)。由于纳米级和小微米级镁微球(约700nm和25μm样本)的反应性较高,在有水存在时会迅速反应,在短时间内产生大量水凝胶气泡(图S1)。另一方面,由于镁微球需分散在碘油中进行注射,我们研究了这些微球在碘油中的悬浮时间,发现尺寸过大的镁微球(约150和250μm)在碘油中的分散时间较短(图S2)。此外,考虑到这些微球在体内动脉内输注的应用,尺寸过小的微球可能通过毛细血管导致异位栓塞(约25μm),而尺寸过大的微球(约150和250μm)难以沉积在小动脉末端(图S3)。因此,综合考虑异位栓塞风险、导管注射可行性、动脉末端沉积情况以及相对较低的反应性,本研究选择约70μm的镁微球进行进一步研究。
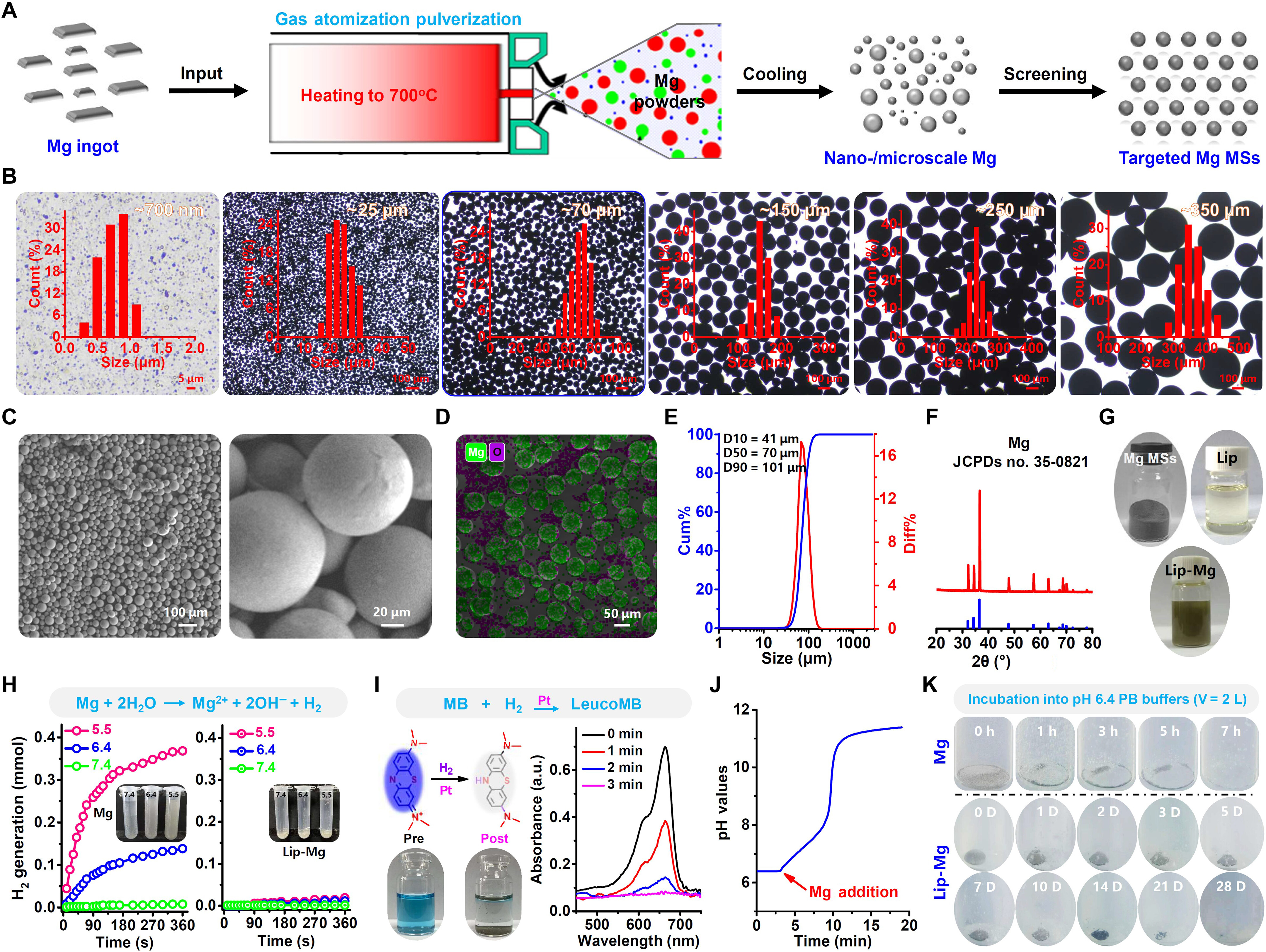
图1. 镁微球的制备与表征
(A)通过气体雾化粉碎法从镁锭制备不同尺寸镁微球的示意图。(B)筛选出的不同尺寸镁微球的显微照片。插图为基于这些显微照片的镁微球粒径分布。(C)所选镁微球(约70μm)在不同放大倍数下的扫描电子显微镜图像。(D)所选镁微球的元素分布图。(E)通过激光粒度分布仪测定的所选镁微球的累积分布和差分分布。(F)所选镁微球的X射线衍射(XRD)图谱。(G)所选镁微球粉末、碘油及Lip-Mg分散液的照片。(H)通过气相色谱(GC)比较裸镁和Lip-Mg在不同pH缓冲液中氢气的生成情况。(I)通过亚甲基蓝-铂(MB-Pt)探针检测生成的氢气。(J)通过pH传感器监测添加镁后缓冲液从酸性到中性的pH值变化。(K)不同时间点镁微球和Lip-Mg分散液在pH 6.4缓冲液中的照片。[小时(h);天(D)]。a.u.:吸光度单位。随后,我们对所选尺寸(约70μm)的镁微球进行了详细表征。扫描电子显微镜图像显示,所选镁微球呈灰白色,表面形态均匀光滑(图1C)。元素 mapping 显示,所得镁微球表面仅有轻微氧化(图1D),通过乙二胺四乙酸(EDTA)滴定法测定其纯度>99%。激光粒度分布仪测得这些镁微球的平均直径为68.7μm(图1E)。X射线衍射图谱中,32.2°、34.4°、36.6°、47.8°和57.6°处的特征峰对应金属镁的(1 0 0)、(0 0 2)、(1 0 1)、(1 0 2)和(1 1 0)晶面(JCPDS编号35-0821)(图1F)。镁能与水缓慢反应生成氢气和氢氧化镁。因此,我们评估了所选镁微球在不同pH值(5.5、6.4和7.4)的生理溶液中的反应性。显然,添加纯镁微球后,这些缓冲液释放出大量氢气气泡,且pH值越低,气泡数量急剧增加(图1H,左)。通过气相色谱测量对氢气生成进行定量分析。当pH值从7.4降至5.5时,反应6分钟后氢气生成量从约0.008 mmol显著增加至约0.368 mmol。亚甲基蓝-铂探针进一步证实,将镁微球加入pH 6.4的缓冲液后可有效产生氢气(图1I)(30)。除释放氢气外,镁与水的反应还生成氢氧化镁,可中和酸性pH。pH计显示,pH 6.4的酸性缓冲液在与镁微球孵育后pH值迅速升高(图1J),表明镁微球具有酸中和能力。接下来,我们使用传统TACE中常用的淡黄色油性液体碘油来分散镁微球。所得镁微球/碘油(Lip-Mg)分散液在酸性pH条件下更稳定,这是因为碘油可阻止Lip-Mg样本中镁微球与水的直接接触(图1G)。随后评估了Lip-Mg分散液的氢气释放情况。与纯镁微球在酸性缓冲液中快速生成氢气不同,Lip-Mg的氢气释放速率显著降低。气相色谱测量显示,在pH 5.5条件下,反应6分钟后氢气生成量约为0.02 mmol,远低于纯镁微球(约0.368 mmol)(图1H,右)。在酸性缓冲液(pH 6.4)中,纯镁微球急剧减少,反应7小时后消失,而Lip-Mg样本可长期释放氢气气泡直至28天,表明油性碘油能有效减缓镁微球与水的反应(图1K及图S4、S5)。
镁微球通过调节肿瘤微环境有效抑制肿瘤生长
接下来,我们探究镁微球是否可通过氢气疗法用于癌症治疗。使用Lip-Mg分散液作为注射剂,研究其对H22小鼠肝癌模型的治疗效果。将这些小鼠随机分为四组(每组n=8~10):(i)对照组;(ii)碘油组[瘤内注射,每只小鼠25μl];(iii)Lip-Mg(OH)₂组[氢氧化镁粉末分散于碘油中,193 mg/ml,瘤内注射,每只小鼠25μl];(iv)Lip-Mg组(镁微球分散于碘油中,80 mg/ml,瘤内注射,每只小鼠25μl)。肿瘤注射中镁和氢氧化镁的摩尔浓度相同(图2A)。治疗后,每2天测量一次肿瘤大小。与对照组和纯碘油注射组相比,Lip-Mg(OH)₂注射组肿瘤生长部分延迟,而Lip-Mg治疗组显著抑制肿瘤生长(图2B及图S6、S7)。Lip-Mg组小鼠的存活时间显著延长,约为对照组、碘油组和氢氧化镁组的2倍(图2C),进一步证实了镁微球的高效抗肿瘤作用。苏木精-伊红(H&E)染色显示,与对照组和碘油组不同,Lip-Mg(OH)₂组和Lip-Mg组的肿瘤细胞出现严重损伤(图2D)。Ki67免疫荧光染色显示,与其他治疗组相比,Lip-Mg治疗后的肿瘤增殖活性最低(图2E及图S8),进一步验证了镁微球强大的杀瘤功效。除H22肿瘤模型外,Lip-Mg分散液在治疗4T1和CT26皮下肿瘤模型中也显示出良好的治疗效果(图S9、S10)。同时,治疗后小鼠体重和主要器官中的镁含量均无明显变化,表明可注射Lip-Mg分散液具有良好的生物安全性(图S11、S12)。
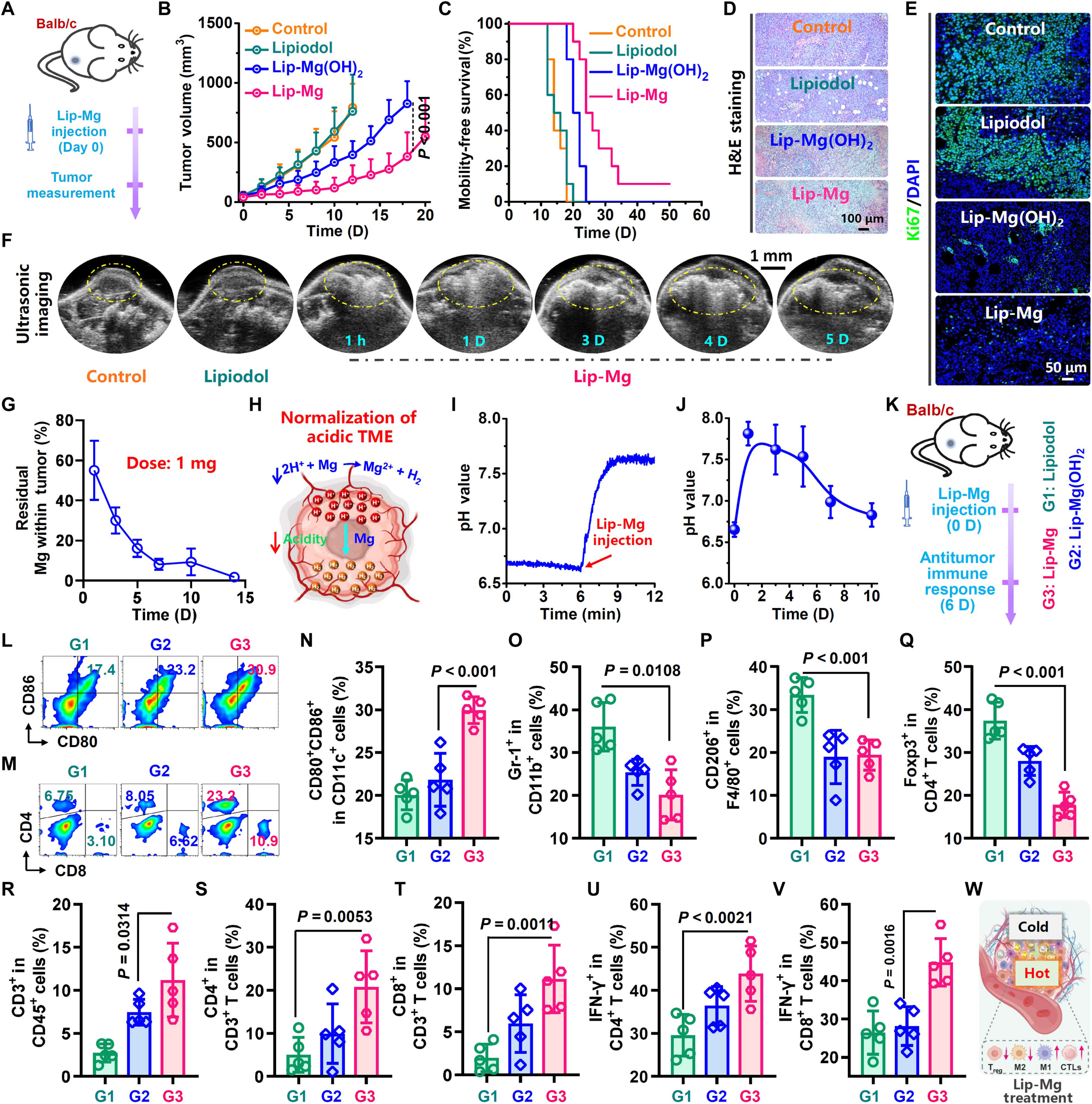
图2. 体内镁微球通过调节肿瘤微环境有效抑制肿瘤生长
(A)通过瘤内注射Lip-Mg对Balb/c小鼠进行治疗的流程示意图。(B)H22荷瘤Balb/c小鼠治疗后的平均肿瘤生长曲线。(C)这些小鼠治疗后的生存曲线。(D、E)不同组肿瘤切片的苏木精-伊红(H&E)染色和Ki67染色显微镜图像。(F)瘤内注射Lip-Mg后H22肿瘤的超声成像。(G)通过电感耦合等离子体发射光谱(ICP-OES)测定肿瘤中残留的镁含量。(H)Lip-Mg中和瘤内酸性pH值的示意图。(I、J)Lip-Mg注射后肿瘤内pH值的变化。(K)对H22荷瘤Balb/c小鼠进行体内免疫评估的流程示意图。G1:碘油组;G2:Lip-Mg(OH)₂组;G3:Lip-Mg组。(L)淋巴结内树突状细胞(DC)成熟(CD11c⁺CD80⁺CD86⁺)的流式细胞术分析结果。(M)肿瘤内CD4⁺T细胞(CD3⁺CD4⁺)和CD8⁺T细胞(CD3⁺CD8⁺)的流式细胞术分析结果。(N-V)淋巴结内DC成熟(N)以及肿瘤内髓系来源抑制细胞(MDSCs,CD45⁺CD11b⁺Gr-1⁺,O)、M2型巨噬细胞(CD11b⁺F4/80⁺CD206⁺,P)、调节性T细胞(Treg,CD3⁺CD4⁺Foxp3⁺,Q)、总T细胞(CD45⁺CD3⁺,R)、CD4⁺辅助性T细胞(CD3⁺CD4⁺,S)、CD8⁺T细胞(CD3⁺CD8⁺,T)、干扰素-γ(IFN-γ)⁺T细胞(CD3⁺CD4⁺IFN-γ⁺,U;CD3⁺CD8⁺IFN-γ⁺,V)的定量结果。(W)示意图显示Lip-Mg诱导免疫沉默的“冷肿瘤”向免疫炎症的“热肿瘤”转化。
我们推测,Lip-Mg的抗肿瘤治疗效果源于其释放氢气以清除过量的瘤内活性氧(ROS),以及产生的氢氧化镁中和酸性pH,两者共同作用将免疫抑制性肿瘤微环境有效调节为免疫支持性状态。为验证肿瘤内氢气的生成,通过超声成像监测瘤内气泡。在注射Lip-Mg的肿瘤中,观察到持续5天以上的强超声信号(片状高回声信号伴彗星尾征),证实镁微球注射的肿瘤可持续生成氢气(图2F)。通过气相色谱测量,瘤内氢气生成量约为17μmol(图S13)。随后研究了镁微球对ROS的清除作用。与对照组和氢氧化镁组相比,注射镁的小鼠瘤内ROS水平更低,表明在治疗过程中镁微球会释放氢气以清除过量ROS(图S14)。接着研究了注射后肿瘤内镁微球的分解速率。瘤内镁含量随时间持续下降,大部分在2周内清除(图2G)。在镁微球分解过程中,副产物氢氧化镁作为碱性物质可中和瘤内酸性(图2H),pH微电极测量显示,注射Lip-Mg后瘤内pH从约6.69持续升高至约7.59(ΔpH:约0.9)(图2I)。同时,瘤内pH的中性水平可维持长达7天(图2J)。我们的结果证实,注射到肿瘤内的Lip-Mg可持续释放氢气并中和其pH,有利于逆转免疫抑制性肿瘤微环境。随后,在H22荷瘤Balb/c小鼠上详细研究了Lip-Mg触发的免疫反应(图2K)。与对照组和氢氧化镁处理组相比,瘤内注射Lip-Mg显著促进树突状细胞成熟(图2L、N),有利于抗原呈递。由于镁和氢氧化镁具有中和酸性免疫抑制性肿瘤微环境的能力,Lip-Mg组和Lip-Mg(OH)₂组的肿瘤中,髓系来源抑制细胞(MDSCs,图2O及图S15A)、M2型巨噬细胞(图2P及图S15B)、调节性T细胞(Treg,图2Q及图S15C)等免疫抑制细胞群均显著减少。另一方面,Lip-Mg组中总T淋巴细胞(图2R及图S15D)、辅助性T细胞(图2M、S)、杀伤性T细胞(图2M、T及图S16)、M1型巨噬细胞(图S15E、I)和单核细胞(图S15F、J)的浸润显著增加,而Lip-Mg(OH)₂组中这些免疫支持性细胞仅轻度增加。此外,T细胞中干扰素-γ(IFN-γ)的高表达(图2U、V及图S15G、H)以及肿瘤内肿瘤坏死因子-α(TNF-α)和IFN-γ的高水平,进一步证实镁微球可有效诱导T细胞介导的细胞免疫(图S17)。综上,Lip-Mg分散液治疗可将免疫沉默的“冷肿瘤”转化为免疫炎症的“热肿瘤”(图2W),从而增强抗肿瘤免疫反应。此外,我们在Sprague-Dawley大鼠原位N1S1肝癌模型中也观察到Lip-Mg诱导的这些强烈抗肿瘤免疫反应(图S18)。上述结果表明,Lip-Mg能有效逆转免疫抑制性肿瘤微环境,且其效果较氢氧化镁更为显著。尽管镁和氢氧化镁均能中和酸性pH,但Lip-Mg在肿瘤内具有生成氢气的独特能力。因此,镁微球释放的氢气可能在抗肿瘤治疗中发挥关键作用。JC-1(5,5,6,6-四氯-1,1,3,3-四乙基苯并咪唑碳菁碘化物,一种线粒体膜电位指示剂)染色显示,高浓度氢气分子可诱导线粒体功能障碍以杀死癌细胞(图S19)。此外,氢气分子还能诱导癌细胞发生强烈的免疫原性细胞死亡(ICD),有利于触发抗肿瘤免疫反应(图S20)。所有这些结果证实,我们的镁微球不仅能逆转免疫抑制性肿瘤微环境,还能诱导癌细胞的免疫原性细胞死亡,进一步激发抗肿瘤免疫,从而增强抗肿瘤治疗效果。
瘤内注射镁微球触发抗肿瘤T细胞反应
为进一步研究免疫反应,我们对对照组和Lip-Mg处理组的小鼠肿瘤组织(每组n=3只小鼠)在治疗后进行了转录组测序[RNA测序(RNA-seq)]分析。差异表达基因(DEGs)的火山图显示,130个基因上调,2个基因下调(图3A及图S21)。基因本体论富集分析表明,Lip-Mg处理的肿瘤中这些上调基因主要与T细胞介导的免疫治疗过程相关,如T细胞介导的细胞毒性(如Gzmb和Prf1)、T细胞增殖的正向调节(如Il2ra、Itgal、Cd3e和Card11)、T细胞活化的正向调节(如Tnfsf11、Cd3e和Card11)、T细胞共刺激(如Cd3e和Card11)以及IFN-γ产生的正向调节(如Slamf6、Ptpn22、Cd2、Klrk1、Cd3e、Isg15和Irf8)(图3B、D及图S22)。此外,京都基因与基因组百科全书(KEGG)通路分析显示,与未处理的肿瘤相比,镁处理的肿瘤中关键免疫通路被激活,如T细胞受体信号通路、抗原加工与呈递通路、趋化因子信号通路、Toll样受体信号通路以及细胞因子-细胞因子受体相互作用通路(图3C),这些均有利于T细胞介导的抗肿瘤免疫反应。值得注意的是,这些上调基因与T细胞受体信号通路(如Nfkbie、Cd8b1、Trbc1、Cd3e、Pik3r5和Card11)和肿瘤细胞凋亡(如Gzmf、Gzme、Gzmc、Bcl2a1a、Gzmg、Casp12、Prf1、Bcl2a1d、Pik3r5、Gzmb和Bcl2a1b)相关(图3E、F),进一步证实了镁微球诱导的强烈免疫反应和抗肿瘤效果。综上,我们的RNA-seq结果为镁处理后T细胞反应的正向调节和适应性免疫反应的激活提供了进一步证据。

图3. Lip-Mg触发抗肿瘤T细胞反应的潜在机制
(A-F)碘油和Lip-Mg注射肿瘤的转录组高通量测序(n=3,P<0.05,折叠变化>2)。(A)两组中已鉴定差异表达基因(DEGs)的火山图。(B)显示免疫相关术语的基因本体论富集分析的富集散点图。(C)显示免疫相关术语的京都基因与基因组百科全书通路分析的富集散点图。(D)热图显示T细胞介导的免疫治疗中上调的基因。(E)热图显示T细胞受体信号通路中上调的基因。(F)热图显示细胞凋亡中上调的基因。(G)示意图显示氢气分子恢复耗竭T细胞的过程。(H)耗竭T细胞(PD-1⁺CD8⁺)的定量结果。(I、J)终末耗竭T细胞(Tim3⁺PD-1⁺CD8⁺,I)和前体耗竭T细胞(TCF7⁺PD-1⁺CD8⁺,J)的定量。(K-M)这些耗竭T细胞的增殖活性(Ki67⁺PD-1⁺CD8⁺,K)、干扰素-γ分泌(IFN-γ⁺PD-1⁺CD8⁺,L)和CXCR3分泌(CXCR3⁺PD-1⁺CD8⁺,M)的定量。(N)示意图显示通过瘤内注射Lip-Mg并阻断CD4和CD8 T细胞对Balb/c小鼠的治疗过程。(O)H22荷瘤Balb/c小鼠的平均肿瘤生长曲线。(P)示意图显示通过瘤内注射Lip-Mg对Rag1基因敲除小鼠的治疗过程。(Q)H22荷瘤Rag1基因敲除小鼠的平均肿瘤生长曲线。(R)示意图显示通过瘤内注射Lip-Mg并阻断干扰素-γ对Balb/c小鼠的治疗过程。(S)H22荷瘤Balb/c小鼠的平均肿瘤生长曲线。(T)示意图显示通过静脉注射肿瘤浸润T细胞对H22荷瘤NSG小鼠的治疗过程。(U)这些NSG小鼠的平均肿瘤生长曲线。(V)示意图显示通过向原发肿瘤瘤内注射Lip-Mg并静脉注射抗CTLA-4对Balb/c小鼠的治疗过程。(W、X)原发肿瘤(W)和远处肿瘤(X)的平均肿瘤生长曲线。据报道,T细胞持续暴露于肿瘤抗原可能导致其功能逐渐下降,进而发生耗竭(31)。这种耗竭通常以程序性死亡蛋白1(PD-1)表达上调为特征。有研究称,氢气可减少终末耗竭PD-1⁺CD8⁺T细胞的数量,增加活性终末PD-1⁻CD8⁺T细胞的数量(32),这表明终末PD-1⁺和PD-1⁻CD8⁺T细胞之间的平衡对癌症预后至关重要(图3G)。由于氢气的有效供应,镁微球可用于恢复肿瘤内耗竭的CD8⁺T细胞。研究发现,与对照组和氢氧化镁组相比,镁微球处理后肿瘤内PD-1⁺CD8⁺T细胞的比例显著降低(图3H及图S23A)。耗竭的CD8⁺T细胞通常表现出表型和功能的异质性。具体而言,一部分耗竭T细胞是前体耗竭T细胞,高表达转录因子T细胞因子7(TCF7),具有杀伤作用,可恢复为正常CD8⁺T细胞(33);另一部分是终末耗竭T细胞,无任何杀伤活性,可通过含黏蛋白分子3(Tim3)识别(34)。镁微球处理有效降低了终末耗竭Tim3⁺T细胞的数量(图3I及图S23B),并显著增加了前体耗竭TCF7⁺T细胞的比例(图3J及图S23C),表明镁可介导耗竭CD8⁺T细胞的恢复。在镁微球处理的肿瘤中,这些耗竭T细胞高表达Ki67⁺和分泌IFN-γ⁺,分别表明其具有高增殖活性和杀伤活性(图3K、L及图S23D、E)。RNA-seq分析显示,镁处理的肿瘤中CXCL10表达升高(图3D),CXCL10是一种趋化因子,可通过与活化CD8⁺T细胞的受体CXCR3结合来招募这些细胞。值得注意的是,这些耗竭T细胞也高表达CXCR3(图3M及图S23F),使其能够被招募到肿瘤内。综上,作为氢气供体,镁微球可有效恢复耗竭的CD8⁺T细胞,有利于抗肿瘤免疫反应。为进一步证实T细胞在Lip-Mg触发的抗肿瘤免疫反应中的重要作用,使用抗CD8和抗CD4抗体耗竭T细胞(图3N)。向H22荷瘤Balb/c小鼠静脉注射耗竭抗体,并进行瘤内注射Lip-Mg治疗。小鼠同型单克隆免疫球蛋白G对Lip-Mg诱导的显著肿瘤生长抑制无影响,而单独耗竭CD8⁺T细胞或CD4⁺T细胞会部分削弱Lip-Mg的肿瘤抑制效果(图3O及图S24A)。值得注意的是,同时耗竭这两种T细胞群会完全消除Lip-Mg的肿瘤抑制作用,这表明CD4⁺T细胞和CD8⁺T细胞在Lip-Mg触发的肿瘤生长抑制过程中均至关重要。此外,使用缺乏T淋巴细胞的Rag1基因敲除(k/o)小鼠评估Lip-Mg处理的肿瘤抑制效果(图3P)。与野生型(WT)小鼠相比,Lip-Mg对荷瘤Rag1基因敲除小鼠的肿瘤抑制作用消失(图3Q),进一步证实T细胞在Lip-Mg触发的抗肿瘤免疫治疗中不可或缺。主要由CD8⁺T细胞分泌的IFN-γ在肿瘤细胞的清除中起着关键作用(35)。因此,使用抗IFN-γ抗体耗竭IFN-γ,以证实CD8⁺T细胞的关键功能(图3R)。静脉注射抗IFN-γ后,Lip-Mg诱导的肿瘤抑制被完全消除,这表明IFN-γ在Lip-Mg触发的CD8⁺T细胞诱导的细胞免疫过程中至关重要(图3S及图S24B)。为进一步揭示镁微球对T细胞的激活作用,将镁处理的Balb/c小鼠的肿瘤浸润T细胞过继转移至H22荷瘤NOD.Cg-Prkdcscidll2rgtm1Wjl/SzJ(NSG)小鼠(图3T)。向H22荷瘤Balb/c小鼠注射Lip-Mg。6天后,收集这些肿瘤,通过磁珠分选获得肿瘤浸润T细胞,随后将其静脉注射到H22荷瘤NSG小鼠中(每只小鼠约230万个T细胞)。作为对照,将从注射碘油的Balb/c小鼠H22肿瘤中收集的T细胞也静脉注射到H22荷瘤NSG小鼠中。值得注意的是,尽管两种T细胞都能抑制NSG小鼠上H22肿瘤的生长,但来自镁微球处理小鼠的肿瘤浸润T细胞表现出更强的肿瘤抑制能力(图3U),进一步证实镁微球处理后T细胞被有效激活。传统TACE疗法作为一种局部治疗方法,难以抑制癌症转移,而转移是癌症死亡的主要原因。考虑到镁微球具有触发T细胞介导的免疫反应的能力,我们进而探究向肿瘤中施用镁微球是否会产生远隔效应以抑制远处肿瘤。双侧H22肿瘤模型实验显示,局部注射Lip-Mg不仅能抑制局部肿瘤生长,还能延缓未注射Lip-Mg的远处肿瘤生长(图3V)。使用抗细胞毒性T淋巴细胞相关抗原4(CTLA-4)、PD-1或其配体(PD-L1)抗体的免疫检查点阻断疗法是广泛使用的免疫治疗策略(36)。局部注射Lip-Mg联合静脉注射抗CTLA-4在治疗原发肿瘤和远处肿瘤方面均显示出进一步增强的治疗效果(图3W、X及图S25)。对免疫反应的进一步评估显示,向原发肿瘤注射Lip-Mg后,这些肿瘤中总T细胞的百分比以及辅助性/杀伤性T细胞的浸润显著增加,而引入抗CTLA-4治疗后,抗肿瘤免疫反应进一步增强(图S26)。我们的结果表明,镁微球触发的抗肿瘤免疫可用于抑制远处肿瘤,尤其是与免疫检查点阻断疗法联合使用时。
体内介入栓塞治疗
在将镁微球用于TAE治疗之前,首先在兔耳动脉模型上评估镁微球的栓塞性能。为进行耳动脉栓塞,将分散在生理盐水(NS)或碘油(40 mg/ml)中的镁微球缓慢注射到兔耳动脉中(白色箭头,图4A)。注射纯碘油后,耳动脉及其分支的血流在最初5分钟消失,随后恢复正常水平,表明碘油对耳动脉闭塞的栓塞效果较弱(图4B、C)。相比之下,镁微球和Lip-Mg分散液对兔耳动脉显示出显著的血管闭塞作用。由于碘油的良好流动性和镁微球的适宜尺寸,Lip-Mg分散液栓塞了整个兔耳的所有动脉及其分支。整个兔耳的温度降低和明显的组织梗死进一步证实了Lip-Mg分散液的高效动脉栓塞作用(图4D)。
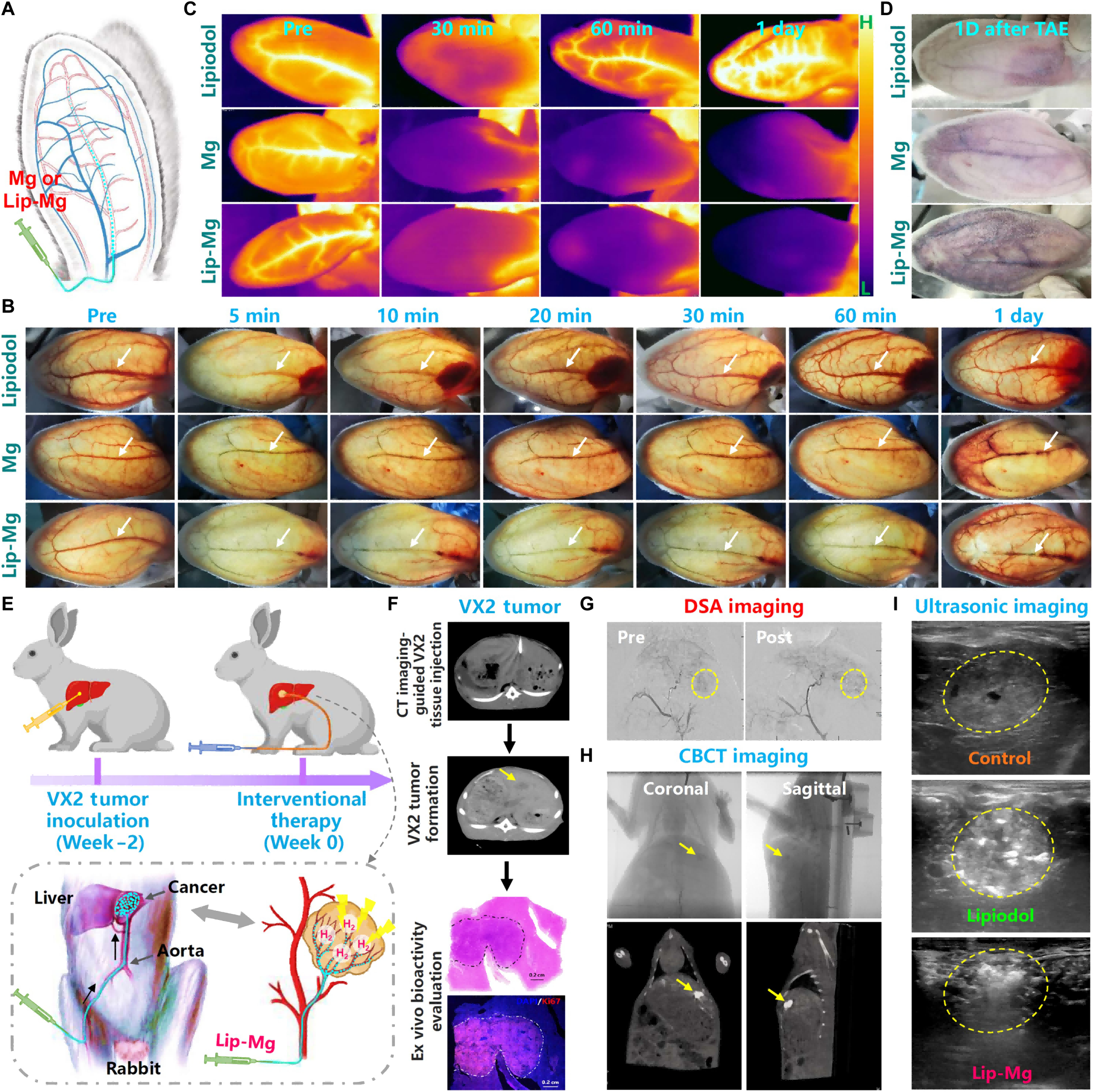
图4. 纯镁微球或Lip-Mg分散液的体内动脉栓塞
(A)示意图显示纯镁微球或Lip-Mg分散液对兔耳动脉的栓塞过程。(B)注射碘油、纯镁微球或Lip-Mg(镁在生理盐水或碘油中的浓度为40 mg/ml,0.3 ml)后兔耳动脉的光学照片。(C)兔耳的红外热成像图显示镁微球对耳动脉的闭塞作用。(D)动脉栓塞1天后兔耳的照片。(E)示意图显示介入性TAE治疗兔原位肝肿瘤的过程。(F)CT成像引导下兔肝内VX2肿瘤接种过程。(G)经动脉递送Lip-Mg前后VX2肝肿瘤的DSA成像。(H)Lip-Mg行TAE后VX2肝肿瘤的CBCT成像,显示肿瘤内明显的碘油沉积。(I)Lip-Mg行TAE后VX2肝肿瘤的超声成像,因氢气生成可见肿瘤内明显的造影增强。接下来,进一步研究了使用Lip-Mg分散液对兔原位肝肿瘤的TAE治疗(图4E)。为构建原位肝肿瘤,在穿刺针和计算机断层扫描(CT)的辅助下,将分散在生理盐水中的VX2肿瘤组织悬液缓慢注射到肝叶中(图4F)。生长2周后,这些VX2肿瘤直径可达约1.2 cm。苏木精-伊红(H&E)和Ki67染色均显示新形成的VX2肿瘤具有高增殖活性。通过微导管,首先向肿瘤附近的肝动脉注射0.1 ml纯碘油(以避免兔实验中常见的微球异位栓塞,因为兔的动脉过细,难以进行超选择性经导管肿瘤动脉栓塞),随后注射0.3 ml Lip-Mg分散液(含12 mg镁微球)(图4G)。经动脉输注后,数字减影血管造影(DSA)成像监测到肿瘤血管消失,锥形束CT(CBCT)成像显示VX2肿瘤密度较高,证实肿瘤内有明显的碘油沉积(图4H)。由于气泡造影增强效应,进一步通过超声成像评估VX2肿瘤内镁微球生成的氢气气泡。经动脉输注碘油后,检测到VX2肿瘤内散在分布的点状高回声信号,表明碘油沉积。相比之下,对于Lip-Mg栓塞的肿瘤,观察到片状高回声信号伴彗星尾征,与超声成像中微气泡的表现一致,证实肿瘤内生成了氢气气泡(图4I)。通过检测肿瘤中的镁含量,观察到由于镁微球的分解,瘤内镁含量随时间持续下降(图S27)。随后,将这些模型兔随机分为6组(图5A):(i)对照组;(ii)单纯碘油TAE治疗组(0.4 ml);(iii)Lip-Mg分散液TAE治疗组(0.1 ml纯碘油+0.3 ml Lip-Mg分散液);(iv)载表柔比星(EPI)的药物洗脱微球(尺寸70 μm;10 mg CalliSpheres)D-TACE治疗组;(v)cTACE治疗组(0.1 ml碘油@EPI混悬液+0.3 ml纯碘油);(vi)M-TACE治疗组(0.1 ml碘油@EPI混悬液+0.3 ml Lip-Mg分散液)。相应组中,表柔比星剂量为每只兔1 mg,镁微球剂量为每只兔12 mg。然后,通过增强CT成像及相应的三维(3D)重建监测TAE两组和TACE三组的肿瘤生长情况(图5B)。未接受任何治疗的VX2肿瘤生长迅速,3周内体积从初始约1.9 cm3增至约39 cm3,2周内出现部分转移灶。与未治疗兔的肿瘤相比,单纯碘油TAE治疗后兔的VX2肿瘤生长部分延迟(最终体积约12.8 cm3)。然而,单纯碘油TAE治疗后部分兔仍出现转移灶。Lip-Mg介导的VX2肿瘤TAE治疗显著抑制肿瘤生长,疗效远优于单纯碘油治疗组。

图5. 兔原位肝肿瘤的体内镁基TAE/TACE治疗
(A)示意图显示经动脉输注碘油、Lip-Mg、Lip-EPI、Lip-Mg-EPI或药物洗脱微球后,VX2荷瘤兔的治疗过程。Lip-Mg:0.1ml纯碘油+0.3ml Lip-Mg分散液(含12mg镁微球);D-TACE:10mg载1mg表柔比星(EPI)的CalliSpheres微球注射;cTACE:0.1ml碘油@EPI混悬液(含1mg EPI)+0.3ml纯碘油;Mg-TACE:0.1ml碘油@EPI混悬液(含1mg EPI)+0.3ml Lip-Mg分散液(含12mg镁微球)。(B)动脉栓塞治疗后VX2肝肿瘤的增强CT图像及相应三维重建。蓝色和绿色分别代表原发肿瘤和转移灶。[周(w)]。(C)不同处理后VX2肝肿瘤的个体生长曲线。(D)不同处理后VX2肝肿瘤的平均体积。(E)不同组全肝肿瘤切片的苏木精-伊红(H&E)染色显微镜图像。黑线为肿瘤组织与正常肝组织的边界。放大的H&E图像对应全肿瘤组织切片中圆圈标记的肝肿瘤位置。(F)不同组全肝肿瘤切片的Ki67染色共聚焦图像。白线为肿瘤边界。红色区域表示具有高增殖能力的组织。(G)免疫荧光染色图像显示肝肿瘤内总T细胞(CD3⁺)和总淋巴细胞(CD45⁺)的浸润。引入化疗药物后,与无EPI组(碘油组和Lip-Mg组)相比,TACE治疗组(D-TACE、cTACE和M-TACE组)的VX2肿瘤生长受到显著抑制,表明EPI的化疗作用。特别是,M-TACE完全抑制肿瘤生长,且抑制效果优于D-TACE和cTACE组,进一步证实镁微球增强cTACE治疗的强大能力。肿瘤生长曲线进一步证实,镁介导的TAE/TACE治疗对肿瘤生长的抑制作用显著强于传统的碘油或碘油@EPI混悬液TAE/TACE治疗(图5C、D)。另一方面,由于镁微球的栓塞功能,观察到Lip-Mg输注的肿瘤内碘油滞留明显优于单纯碘油组,表明Lip-Mg分散液的长期动脉栓塞有利于长效TAE治疗(图S28)。全肝增强CT成像显示,由于不可降解的CalliSpheres微球,异位栓塞会导致严重的肝组织损伤(图5B、D,TACE组)。值得注意的是,D-TACE组的6只兔中,有3只在治疗后1~2天死亡。相比之下,在Mg-TACE组中未观察到明显的肝组织损伤(图5B、M,TACE组),表明可降解镁微球不会引起严重的异位栓塞。最后,检测了TACE治疗后与肝功能相关的指标,包括血清天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)(图S29)。与未治疗组相比,D-TACE组兔的AST和ALT水平明显升高,而Mg-TACE组则保持在相对正常水平,进一步表明镁微球用于TACE治疗的良好安全性。接下来,通过H&E和Ki67染色评估细胞损伤和增殖状态。在TAE组中,与对照组或单纯碘油TAE组相比,Lip-Mg介导的TAE治疗导致最高的凋亡率和最低的增殖活性(图5E、F)。在TACE组中,与D-TACE或cTACE组相比,M-TACE治疗也表现出相对更好的治疗效果(图S30)。此外,使用抗兔CD45和CD3标记物进行免疫荧光染色,评估免疫细胞和T淋巴细胞的浸润情况。镁处理组肿瘤内总免疫细胞和T淋巴细胞的浸润明显增加(图5G及图S31),表明肿瘤内的镁微球可引发强烈的抗肿瘤免疫反应。此外,对VX2肿瘤切片进行血管内皮生长因子(VEGF)和缺氧诱导因子-1α(HIF-1α)的免疫荧光染色,以研究缺氧和血管生成水平(图S32)。与对照组相比,经碘油或聚合物微球阻断血供的肿瘤中,HIF-1α和VEGF水平明显升高。然而,引入镁微球可部分缓解这些恶化情况。总体而言,这一观察结果可能是由于镁微球能够通过中和pH和生成氢气来逆转免疫抑制性肿瘤微环境,而氢气可清除肿瘤内过量的活性氧(ROS)并触发肿瘤细胞凋亡。最后,在健康Sprague-Dawley大鼠上研究了肌内注射或肝动脉输注镁微球后的潜在副作用(图S33、S34)。这些Sprague-Dawley大鼠接受Lip-Mg肌内注射(四个剂量组:0.25、0.5、1和2g/kg),出现轻微不良反应(气体引起的皮肤肿胀),随后消失(图S33A)。在如此高剂量的镁微球注射后,这些大鼠的体重逐渐增加(图S33B)。此外,Lip-Mg分散液与红细胞孵育后未出现溶血反应,表明镁微球具有良好的生物相容性(图S34B、C)。然后,对健康Sprague-Dawley大鼠进行肝动脉输注碘油或Lip-Mg分散液处理。肝动脉输注后,大鼠体重略有下降,随后恢复至初始水平(图S34E-G)。Lip-Mg动脉输注后,全血中的镁含量变化可忽略不计(正常水平约60μg/g),表明未出现高镁血症(图S34H)。大鼠器官的组织学检查显示,仅部分肝脏因碘油动脉栓塞出现肝硬化和坏死,且碘油组和Lip-Mg组之间无显著差异(图S34I、S35)。这些组的肝功能和肾功能相关指标(包括ALT、碱性磷酸酶、AST和血尿素氮)也保持在正常水平(图S34K-N、S36),进一步证实动脉输注分散在碘油中的镁微球用于TAE治疗是安全的。
肝癌的临床镁基TACE治疗
受镁介导的TAE/TACE令人印象深刻的临床前结果以及镁材料优异的生物相容性的启发,我们启动了一项单中心、单臂、开放标签试验,评估Lip-Mg分散液在肝癌患者TACE(改良TACE,M-TACE)中的安全性和有效性。该研究已在ClinicalTrials.gov注册(编号:ChiCTR2200064999),并经丽水市中心医院伦理委员会批准。入组时间为2022年9月至2024年7月,主要终点为镁微球在TACE治疗中的安全性和耐受性,次要终点为肿瘤反应。本研究的入选标准包括:年龄18~80岁;经组织学或临床确诊为原发性肝癌;Child-Pugh分级A或B;东部肿瘤协作组(ECOG)体能状态评分0~2;且选择TACE作为治疗方式。纳入本研究的患者包括巴塞罗那临床肝癌(BCLC)分期B或C期的不可切除肝癌患者(TACE推荐作为一线治疗),以及不适合切除或拒绝切除的BCLC A期肝癌患者。M-TACE手术由熟练的介入放射科医生监督,采用超选择性方法靶向局部肿瘤的亚段或段栓塞(图6A)。化疗栓塞过程包括注射EPI与碘油的混合物,随后靶向注射分散在碘油中的镁微球。镁微球的剂量根据肝癌病灶的血供特征调整,约为30~200mg。当靶动脉血流停滞时,栓塞过程结束。在整个随访过程中,使用多相增强磁共振成像(MRI)进行监测。必要时,每3~4周重复一次M-TACE。

图6. 镁联合TACE(M-TACE)治疗肝癌患者
(A)示意图显示M-TACE对患者的治疗策略。(B)本试验入组患者的基线特征,包括中国肝癌分期(CNLC)、巴塞罗那临床肝癌分期(BCLC)、基线肿瘤负荷(最大肿瘤病灶直径与肿瘤数量之和)以及甲胎蛋白(AFP)。(C)本试验中的治疗相关不良事件(TRAEs)。(D)通过肿瘤大小变化百分比评估M-TACE治疗后患者的治疗反应。排除3例伴VP3/4门静脉侵犯的患者。(E)巴塞罗那临床肝癌分期A、B、C期以及初治肝癌或有TACE失败史的肝癌患者经M-TACE治疗后获得不同的治疗反应(完全缓解、部分缓解、疾病稳定)。(F)具有不同肿瘤包膜特征的患者经M-TACE治疗后获得显著的治疗反应。(G)具有不同包膜特征的代表性肝癌病灶患者的磁共振成像(MRI)图像,所有患者均对M-TACE治疗达到完全缓解。白线显示肝癌靶病灶。本试验共入组18例患者,其特征详见图6B和表S1。患者平均年龄为61.5岁,大多数有乙型肝炎病毒(HBV)感染史。根据中国肝癌分期(CNLC)和巴塞罗那临床肝癌分期系统对患者进行分类。在这18例患者中,4例有传统TACE治疗失败史,其余14例为初治肝癌患者。本研究中,对这些入组患者共进行了27次M-TACE手术。在1至3个月的随访期间,记录了112起治疗相关不良事件(表S2),并根据《美国国家癌症研究所不良事件通用术语标准》5.0版进行分类。其中大多数为轻至中度事件(1级和2级),共101起,严重事件(3级及以上)共11起,如图6C所示。最常见的治疗相关不良事件(影响39%的患者)为血小板减少、淋巴细胞减少、低白蛋白血症和发热。严重的治疗相关不良事件虽较少见,但17%的患者出现血小板减少,11%的患者出现淋巴细胞减少,17%的患者出现天冬氨酸转氨酶和丙氨酸转氨酶升高。这些事件通常与化疗和栓塞手术相关,被归类为栓塞后综合征(37)。所有治疗相关不良事件均可控,未观察到意外毒性,凸显了镁微球在TACE治疗中的生物安全性和耐受性。考虑到镁微球的生物可降解性,镁离子(Mg2⁺)释放的安全性是一个关键方面。值得注意的是,临床观察显示患者的血清镁水平仅略有波动,始终维持在正常范围内(图S37)。这些发现证实了镁微球的安全性,进一步表明其用于M-TACE的潜力,且不会引起血清镁水平的明显波动。随后,评估了肿瘤对治疗的反应。在18例患者中,3例表现出VP3/4门静脉侵犯,被认定不适合通过TACE治疗完全栓塞靶病灶,因此被排除在分析之外(38)。对其余患者在M-TACE后的肿瘤反应进行了详细评估。该评估采用增强磁共振成像进行。根据改良实体瘤疗效评价标准(mRECIST),根据肿瘤对治疗的反应程度将患者的反应分为不同类别,包括完全缓解(CR,所有靶肿瘤强化完全消失)、部分缓解(PR,存活肿瘤病灶最大直径之和至少减少30%)、疾病进展(PD,存活肿瘤病灶最大直径之和至少增加20%,或出现新的肝内病灶)和疾病稳定(SD,既未达到部分缓解也未达到疾病进展)。M-TACE的总体疗效令人印象深刻,本研究的反应率已证明这一点(图6D)。在整个患者队列中,11例达到完全缓解,3例达到部分缓解,1例出现疾病稳定。按巴塞罗那临床肝癌分期细分结果如下:巴塞罗那临床肝癌A/B期患者的客观缓解率为100%,初治患者的完全缓解率也为100%(图6E,左)。这表明M-TACE不仅有效,而且对初诊早期肝癌患者特别有益。M-TACE显示出显著的疗效,不仅在初治肝癌患者中达到91%的完全缓解率(11例中的10例),还为先前对TACE无反应的患者提供了治疗机会(图6E,右)。在另外4例先前TACE治疗失败的患者中,3例在接受M-TACE后达到部分缓解,1例达到完全缓解。与他们之前的治疗结果相比,这是一个显著的改善。此外,我们还注意到,即使对于肿瘤包膜不完整的患者,M-TACE在实现完全缓解方面也显示出强大的疗效,如图6F所示的病例。通常,对于无肿瘤包膜或包膜不完整的肝癌,与有完整包膜的肿瘤相比,TACE的效果会大打折扣(39)。然而,M-TACE在这些病例中的成功表明,它有潜力克服包膜不完整或缺失带来的限制(图6G),为更广泛的肝癌患者提供了一种有前景的治疗选择。为了说明我们的M-TACE治疗的有效性,有必要将我们的研究结果与现有关于传统TACE(cTACE)的文献进行比较。历史上,cTACE报告的反应率约为30%至60%,明显低于M-TACE观察到的结果。一项涵盖10,108例患者的随机对照试验的综合系统评价和荟萃分析显示,cTACE治疗后的客观缓解率为52.5%(40)。此外,日本的一项单中心回顾性队列研究报告,55例接受cTACE治疗的肝癌患者的客观缓解率为62%,完全缓解率为18%(41)。在欧洲进行的一项多中心、国际、前瞻性、随机、单盲2期研究中,108例接受cTACE治疗的患者的客观缓解率为44%,完全缓解率为22%(42)。在最近报道的CHANCE001回顾性队列研究中,450例中国晚期肝癌患者接受TACE单药治疗的客观缓解率仅为32%(5)。此外,中国最近的两项单中心回顾性队列研究分别报告,110例和172例患者接受cTACE治疗后的客观缓解率为51.8%和43.6%(9,43)。中国患者与欧美及日本患者的治疗反应差异主要归因于,中国大多数肝癌患者有乙型肝炎病毒感染、肝硬化、中位肿瘤直径为6.5至6.7 cm、肿瘤负荷高且分期相对较晚(44)。相比之下,我们的初步临床研究显示,M-TACE治疗的客观缓解率和完全缓解率更高,分别为93.3%和73.3%。这比cTACE报告的比率有所提高。值得注意的是,在初治肝癌患者中,我们实现了91%的完全缓解率,这凸显了M-TACE增强cTACE治疗效果的潜力。我们的研究结果进一步强调了M-TACE的潜在疗效,特别是在特定患者群体中。例如,巴塞罗那临床肝癌A/B期患者的客观缓解率达到100%,初治患者的完全缓解率也为100%。这些结果优于相关中国研究中巴塞罗那临床肝癌A期和B期患者的客观缓解率,后者分别仅为63.4%和51.5%(45)。总体而言,我们的研究标志着M-TACE在肝癌治疗中迈出了重要的一步,展示了高反应率和良好的安全性。M-TACE的这种增强治疗效果可能源于镁微球的独特特性,它可以中和肿瘤pH、生成氢气并调节免疫抑制性肿瘤微环境,从而增强TACE的治疗效果。然而,由于入组患者大多为巴塞罗那临床肝癌A期,我们的研究结果有待在更广泛的患者群体中验证,特别是B期和C期患者。样本量小也需要更大规模的多中心试验来证实M-TACE的治疗益处并评估长期结局。尽管存在这些局限性,但即使在复杂病例中也能观察到显著的反应,这表明我们的M-TACE有潜力改变肝癌治疗。未来的研究将扩大我们的理解,为改善患者护理和可能创新肝癌治疗标准铺平道路。
讨论
总之,我们引入了具有最佳尺寸(约70 μm)的金属镁微球作为栓塞微装置,以增强碘油介导的肝癌TACE(图7)。临床前研究表明,当这些镁微球分散在碘油中并注入小鼠皮下肿瘤时,能够有效中和酸性肿瘤微环境、触发氢气治疗并逆转免疫抑制性肿瘤微环境,从而显著抑制肿瘤生长。在兔原位肝肿瘤模型中进行的兔动脉栓塞实验进一步表明,这种基于Lip-Mg的M-TACE与临床使用的D-TACE或cTACE疗法相比,治疗效果显著增强。我们的M-TACE在一项初步临床研究中得到了进一步测试。在15例无法进行根治性切除的有效肝癌患者中,11例在M-TACE后达到完全缓解,客观缓解率高达93.3%(15例中的14例)。值得注意的是,91%的初治肝癌患者达到完全缓解,所有先前TACE治疗失败的患者对M-TACE均有积极反应。M-TACE的安全性良好,所有不良事件均得到妥善处理,且无因不良事件导致的治疗中断。
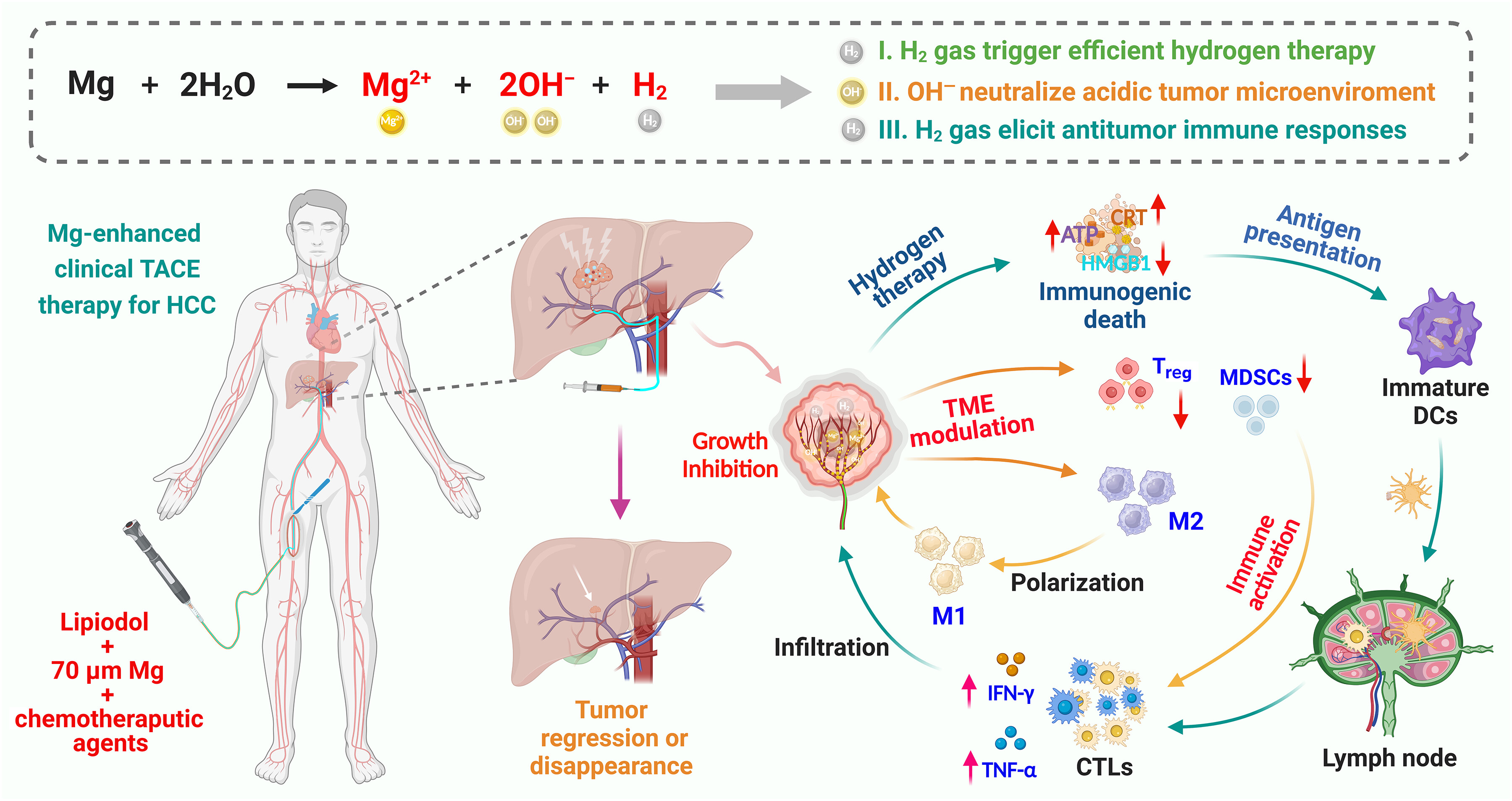
图7. 镁微球增强基于碘油的肝癌TAE/TACE治疗
经动脉输注镁微球后,会持续产生氢气、氢氧根离子、镁离子和氢氧化镁,从而中和酸性肿瘤微环境、恢复耗竭的CD8⁺T细胞、逆转免疫抑制,并触发特异性T细胞介导的抗肿瘤反应,协同抑制肿瘤生长。本研究表明,肿瘤微环境调节对TACE治疗尤为重要,因为动脉栓塞会进一步降低肿瘤pH、加剧缺氧并导致活性氧积累,从而增强肿瘤免疫抑制。M-TACE后递送至肝癌中的镁微球可持续产生氢氧化镁和氢气,通过持续方式中和酸性pH并清除肿瘤内过量的活性氧。因此,免疫抑制性肿瘤微环境会逆转为免疫支持性状态,恢复耗竭的CD8⁺T细胞并触发T细胞介导的抗肿瘤反应,从而增强治疗效果。尽管其他类型的纳米或微米级生物材料也能实现pH中和,但在肿瘤内温和且持续地生成氢气是我们镁微球的独特特征,这得益于最适宜的金属选择和最适宜的微米尺寸。氢气疗法已在多项临床试验中用于增强癌症治疗(46,47)。然而,将氢气有效递送至肿瘤内以及在肿瘤内持续生成足量氢气仍面临挑战。值得注意的是,通过M-TACE递送的镁微球可在肿瘤内持续生成氢气,这对恢复耗竭的CD8⁺T细胞特别有帮助。另一方面,关于血管栓塞性能,我们用于M-TACE治疗的镁微球也具有许多独特优势。对于大肝癌或多结节肝癌,由于碘油沉积不理想,传统TACE常导致血管栓塞不完全且预后较差(9)。动物数据表明,我们的M-TACE疗法使用分散在碘油中的镁微球,有望实现更强的血管栓塞和更长的肿瘤内碘油滞留。此外,与传统不可降解微球相比,使用可降解镁微球进行栓塞具有明显优势。与不可降解微球不同,可降解镁微球设计为可被代谢清除,对肝功能的影响相对较小,从而避免对正常肝组织的长期负面影响。这一特征在肝癌治疗中尤为有益,因为保护肝功能至关重要。此外,可降解镁微球允许通过同一动脉重复进行血管栓塞,而对于使用不可降解微球的传统D-TACE,同一肿瘤的第二次TACE手术通常必须通过另一条动脉进行。总体而言,我们的研究提出了一种有前景的镁微球TACE治疗方法,可通过调节肿瘤微环境和改善血管栓塞,显著提高肝癌患者的治疗效益。考虑到镁金属及其合金作为植入装置在临床上已广泛应用且具有优异的生物相容性,以及与其他水反应性氢气供体相比,镁与水的反应温和,镁是我们应用的最适宜材料。未来的步骤包括开展大规模、多臂、多中心临床试验,比较M-TACE与传统TACE或D-TACE治疗肝癌患者的疗效和安全性。此外,鉴于镁微球能够调节免疫抑制性肿瘤微环境并激活T细胞的临床前证据,我们期望M-TACE与全身治疗(特别是免疫检查点阻断疗法)的联合应用,可能为对抗晚期肝癌提供更多机会,以延长那些在当前标准治疗下通常预后较差患者的无进展生存期和总生存期。
【提醒,以下供相对专业读者阅读,更专业读者请阅读原文,避免因为翻译不达意引起误解。】
材料与方法
材料
镁锭购自苏州荣乾稀有金属制品有限公司。超液化碘油购自苏州恒瑞医疗器械有限公司。BCECF[2,7-双(2-羧乙基)-5(6)-羧基荧光素]探针购自Invitrogen。所有化学试剂均为分析纯,未经进一步纯化直接使用。
镁微球的制备
采用气体雾化粉碎法从镁锭制备镁微球。在气体雾化设备中,将镁锭加热至700°C获得熔融镁,然后用氩气雾化。通过适当的参数,获得平均尺寸约70μm的镁微球。制备Lip-Mg分散液时,将镁微球以适当浓度分散在碘油溶剂中。
表征
通过倒置显微镜(Leica)进行显微镜成像。粉末X射线衍射测量由配备CuKα辐射(λ=0.15406nm)的PANalyticalX射线衍射仪进行。紫外-可见-近红外(UV-vis-NIR)吸收光谱由PerkinElmer Lambda750紫外-可见-近红外分光光度计记录。共聚焦图像由Zeiss共聚焦显微镜采集。在超声成像系统上进行超声成像。使用西门子3.0特斯拉磁共振系统进行磁共振成像。在飞利浦CT扫描仪上进行CT成像。在西门子DSA系统上进行数字减影血管造影成像。
氢气释放测量
实验中,使用亚甲基蓝(MB)染料作为探针,在铂催化剂的催化下,其蓝色在与氢气反应后迅速消失。亚甲基蓝在664nm处的特征吸光度下降与氢气生成量相关。为检测氢气,将镁微球(20mg)加入亚甲基蓝-铂探针溶液中不同时间,然后通过紫外-可见-近红外分光光度计实时监测664nm处的吸光度。除亚甲基蓝-铂探针外,还使用气相色谱法对氢气生成量进行定量。将镁微球(20mg)加入各种磷酸盐缓冲液(pH7.4、6.4和5.5)中反应,然后从上述反应系统中收集0.5ml气体,通过气相色谱分析测定氢气浓度。
pH变化测量
为监测缓冲液pH值,将侵入式pH微电极(PM-HP5,PreSens)插入添加镁微球后的缓冲溶液中。除pH微电极外,还使用pH敏感荧光探针(BCECF)进行pH成像。添加镁微球后的缓冲液在5、10和15分钟时收集,然后与BCECF探针(10μM)孵育10分钟。接下来,用MaestroEX体内光学成像系统(Cambridge Research and Instrumentation Inc.)对缓冲液进行成像。
镁释放测量
为测量缓冲液中镁离子的释放,使用电感耦合等离子体发射光谱法(ICP-OES)测定镁含量。具体而言,将镁微球或Lip-Mg分散液(镁,50mg)加入2升不同pH(pH7.4、6.4和5.5)的磷酸盐缓冲液中。然后在不同时间点从上述系统中收集0.5ml缓冲液,通过电感耦合等离子体发射光谱法分析测定镁离子含量。
细胞实验
小鼠H22肝癌细胞、4T1乳腺癌细胞、CT26结肠癌细胞和大鼠N1S1肝癌细胞在标准细胞培养基中于37°C、5%二氧化碳条件下培养。
线粒体损伤
将H22细胞接种在24孔板中,用镁微球处理48小时,然后用JC-1染料染色30分钟,以检测线粒体膜电位的变化。所有这些细胞均通过流式细胞术分析。此外,根据ATP含量检测试剂盒(Solarbio)检测细胞内三磷酸腺苷(ATP)水平。
镁诱导的免疫原性细胞死亡
在本节中,检测细胞表面钙网蛋白(CRT)的表达和高迁移率族蛋白B1(HMGB1)的胞外释放,以确定镁诱导的癌细胞免疫原性细胞死亡。将H22细胞接种在24孔板中,用镁微球处理48小时。然后,这些细胞用磷酸盐缓冲液(PBS)洗涤,用多聚甲醛固定,并用CRT或HMGB1一抗以及相应的Alexa Fluor488偶联二抗染色。最后,通过流式细胞术分析和共聚焦成像确定CRT的表达和HMGB1的释放。
肿瘤模型
Balb/c小鼠(18~20g)、Rag1基因敲除小鼠、NSG小鼠和Sprague-Dawley大鼠购自常州卡文斯实验动物有限公司。新西兰白兔(2.5~3.5kg)购自苏州震湖实验动物有限公司。所有动物实验均在苏州大学实验动物中心许可下进行(编号:ECSU-202102A0108)。对于小鼠皮下肿瘤接种,将2×10⁶个肿瘤细胞(H22、CT26或4T1)分散在50μl磷酸盐缓冲液中,皮下注射到每只小鼠的背部以建立肿瘤模型。为构建大鼠原位肝癌模型,开腹后将10⁷个N1S1细胞悬液直接注射到大鼠肝叶中。为构建兔原位肝癌模型,在CT成像引导下将VX2肿瘤组织直接植入肝左叶。
体内Lip-Mg诱导的癌症治疗
将携带H22肿瘤(约60mm3)的Balb/c小鼠分为四组(每组n=10):(i)对照组;(ii)碘油组(25μl,瘤内注射,每只小鼠);(iii)Lip-Mg(OH)₂组(193mg/ml,25μl,瘤内注射,每只小鼠);(iv)Lip-Mg组(80mg/ml,瘤内注射,每只小鼠25μl)。碘油用作分散剂,本实验中氢氧化镁和镁的摩尔浓度相同。每2天监测一次肿瘤大小和小鼠体重。肿瘤体积按以下公式计算:体积=长度×宽度2/2。对于H&E和Ki67染色,收集第二天不同处理的肿瘤进行染色。所有图像均在Leica荧光显微镜下获取。
瘤内氢气释放监测
由于气泡对超声波的强衰减作用,通过超声成像监测小鼠瘤内注射Lip-Mg后肿瘤内氢气气泡的生成。在声学界面上出现的强回声信号表明氢气气泡的生成。同时,采用气相色谱法对Lip-Mg注射后瘤内氢气生成量进行定量。
瘤内pH变化测量
瘤内注射Lip-Mg分散液(80mg/ml,每只小鼠25μl)后,将侵入式pH微电极插入肿瘤中以监测pH变化。此外,BCECF荧光探针也用于pH成像。向上述镁处理的肿瘤瘤内注射BCECF(0.5mM),然后在注射后30分钟收集。立即用MaestroEX体内光学成像系统对这些肿瘤进行成像。
体内Lip-Mg触发的免疫反应
在第6天,对瘤内注射Lip-Mg(80mg/ml,每只小鼠25μl)的携带H22肿瘤的Balb/c小鼠实施安乐死,并收集所有肿瘤。然后,将肿瘤组织在荧光激活细胞分选(FACS)缓冲液中匀浆,用消化酶消化,并通过尼龙 gauze过滤以获得单细胞悬液。接下来,按照制造商的说明,用荧光标记的抗体[髓系来源抑制细胞:CD45-异硫氰酸荧光素(FITC)、CD11b-藻红蛋白(PE)和Gr-1-别藻蓝蛋白(APC);调节性T细胞:CD3-FITC、CD4-APC和Foxp3-PE;T细胞:CD3-FITC、CD4-APC和CD8-PE;肿瘤相关巨噬细胞:CD11b-PE、F4/80-FITC、CD80-APC和CD206-APC;单核细胞:CD11b-FITC和CD14-PE;干扰素-γ分泌:CD3-FITC、CD4-percp、CD8-APC和IFN-γ-PE]对这些细胞进行染色。所有抗体均稀释200倍。通过流式细胞术分析(BD Biosciences AccuriC6)测量染色细胞,并通过FlowJo软件(10.0.7版本,TreeStar)进行分析。
体内T细胞耗竭
对瘤内注射Lip-Mg(80 mg/ml,每只小鼠25 μl)的携带H22肿瘤的Balb/c小鼠,在第1、3、7天静脉注射耗竭抗体(抗CD8和抗CD4,每只小鼠每次20 μg),共注射3次。治疗后,每2天监测肿瘤大小,以评估T细胞耗竭后的肿瘤抑制情况。
对Rag1基因敲除小鼠的体内肿瘤抑制作用
将携带H22肿瘤(约60 mm3)的Rag1基因敲除小鼠分为两组(n=6):(i)碘油组(瘤内注射,每只小鼠25 μl);(ii)Lip-Mg组(80 mg/ml,瘤内注射,每只小鼠25 μl)。治疗后,每2天监测肿瘤大小,以评估镁在Rag1基因敲除小鼠中诱导的肿瘤抑制作用。
体内RNA测序分析
在第6天,对瘤内注射Lip-Mg(80 mg/ml,每只小鼠25 μl)的携带H22肿瘤的Balb/c小鼠实施安乐死,并收集所有肿瘤。随后,对碘油处理组和Lip-Mg处理组的肿瘤(每组n=3个肿瘤)进行RNA测序分析,以鉴定两组之间的差异表达基因。
体内干扰素-γ细胞因子耗竭
对瘤内注射Lip-Mg(80 mg/ml,每只小鼠25 μl)的携带H22肿瘤的Balb/c小鼠,在第1、3、7天静脉注射耗竭抗体(抗IFN-γ,每只小鼠每次20 μg),共注射3次。治疗后,每2天监测肿瘤大小,以评估干扰素-γ细胞因子耗竭后的肿瘤抑制情况。
体内耗竭T细胞的恢复
在第6天,对瘤内注射Lip-Mg(80 mg/ml,每只小鼠25 μl)的携带H22肿瘤的Balb/c小鼠实施安乐死,并收集所有肿瘤。然后,将肿瘤组织在荧光激活细胞分选缓冲液中匀浆,用消化酶消化,并通过尼龙纱布过滤以获得单细胞悬液。接下来,用荧光标记的抗体(耗竭T细胞:CD3-FITC、CD8-Percp和PD-1-PE;前体耗竭T细胞:CD3-FITC、CD8-Percp、PD-1-PE和Tim3-APC;终末耗竭T细胞:CD3-FITC、CD8-Percp、PD-1-PE和TCF7-APC;耗竭T细胞增殖:CD3-FITC、CD8-PE、PD-1-APC和Ki67-Percp;干扰素-γ分泌:CD3-FITC、CD8-Percp、PD-1-PE和IFN-γ-APC;CXCR3分泌:CD3-FITC、CD8-Percp、PD-1-APC和CXCR3-PE)对这些细胞进行染色,以评估镁微球处理后耗竭T细胞的恢复情况。通过流式细胞术分析(BD Biosciences AccuriC6)测量染色细胞,并通过FlowJo软件(10.0.7版本,TreeStar)进行分析。
肿瘤浸润T细胞的体内过继转移
为进一步揭示T细胞的激活情况,将Lip-Mg处理的Balb/c小鼠的肿瘤浸润T细胞过继转移至携带H22肿瘤的NSG小鼠。向携带H22肿瘤的Balb/c小鼠注射Lip-Mg,7天后收集这些肿瘤,通过磁珠分选获得肿瘤浸润T细胞。随后,将肿瘤浸润T细胞静脉注射到携带H22肿瘤的NSG小鼠中(每只小鼠约230万个T细胞)。这些NSG小鼠分为三组:(i)空白组(n=3,不注射T细胞);(ii)碘油处理T细胞组(n=5,来自注射碘油小鼠的肿瘤浸润T细胞);(iii)Lip-Mg处理T细胞组(n=5,来自注射Lip-Mg小鼠的肿瘤浸润T细胞)。治疗后,每2天监测肿瘤大小,以评估NSG小鼠的肿瘤生长情况。
镁在Sprague-Dawley大鼠中触发的体内免疫反应
为评估原位肝肿瘤的免疫反应,我们构建了大鼠N1S1原位肝癌模型。通过开腹后将N1S1细胞悬液直接注射到大鼠肝叶中构建原位肝肿瘤模型。10天后,形成直径约5 mm的N1S1肿瘤。然后,在第7天,对经动脉输注Lip-Mg(碘油:100 μl,镁:每只大鼠2 mg)的Sprague-Dawley大鼠实施安乐死,并收集所有肿瘤。然后,将肿瘤组织在荧光激活细胞分选缓冲液中匀浆,用消化酶消化,并通过尼龙纱布过滤以获得单细胞悬液。接下来,按照制造商的说明,用荧光标记的抗体(调节性T细胞:CD3-FITC、CD4-Percp和Foxp3-PE;T细胞:CD3-FITC、CD4-Percp和CD8-PE;M1型巨噬细胞:CD11b-APC、CD68-FITC和CD80-PE)对这些细胞进行染色。通过流式细胞术分析(BD Biosciences AccuriC6)测量染色细胞,并通过FlowJo软件(10.0.7版本,TreeStar)进行分析。
人类患者体内介入栓塞治疗
碘油是临床上广泛使用的栓塞剂。由于碘油对镁微球的分散和保护作用,我们将Lip-Mg应用于兔原位肝癌(VX2肿瘤)的体内介入TAE治疗,并评估镁增强碘油诱导的TAE治疗效果。为构建原位肝肿瘤模型,使用新西兰白兔,在CT成像引导下将VX2肿瘤组织直接植入肝左叶。2周后,注射碘佛醇进行增强CT成像,确认形成大小为1.0~1.5 cm的肿瘤。然后,将携带VX2肿瘤的兔随机分为6组(n=5~8):(i)未治疗组;(ii)经动脉栓塞碘油组(每只兔0.4 ml);(iii)经动脉栓塞Lip-Mg分散剂组(镁:40 mg/ml;每只兔0.1 ml碘油+0.3 ml Lip-Mg分散液);(iv)经动脉栓塞药物洗脱微球组(D-TACE,微球大小:70 μm;每只兔10 mg载1 mg表柔比星的CalliSpheres微球);(v)经动脉栓塞碘油@表柔比星混悬液组[cTACE,每只兔0.1 ml碘油@表柔比星混悬液(含1 mg表柔比星)+0.3 ml纯碘油];(vi)经动脉栓塞碘油@表柔比星混悬液和Lip-Mg分散液组[M-TACE,每只兔0.1 ml碘油@表柔比星混悬液(含1 mg表柔比星)+0.3 ml Lip-Mg分散液(含12 mg镁微球)]。使用18号套管针穿刺兔股动脉。然后通过套管插入2.7-F微导管和同轴微导丝,在透视引导下将其导航至肝左动脉和肝癌部位。进行动脉造影以定位肝肿瘤的血管丰富区域。通过微导管缓慢注射碘油、药物洗脱微球、碘油@表柔比星混悬液或Lip-Mg分散液至肝左动脉,以避免反流;详细描述如上。注射后,进行数字减影血管造影和锥形束CT成像,以确认肿瘤区域的碘油沉积。治疗后,在第1、2和3周注射碘佛醇进行增强CT扫描,以测量VX2肿瘤体积。同时,基于多相增强CT图像对VX2肝肿瘤进行三维重建,以评估和测量肿瘤体积,比较治疗效果。为进行组织形态学或免疫荧光染色,在治疗后1周对携带VX2肿瘤的兔实施安乐死,收集肿瘤组织及瘤周正常组织,固定在4.0%磷酸盐缓冲液多聚甲醛中,用于后续组织病理学评估(HIF-1α、VEGF、H&E和Ki67染色)和淋巴细胞浸润评估(CD45⁺免疫细胞和CD3⁺T淋巴细胞)。对于镁-TAE组,通过电感耦合等离子体发射光谱法测量镁元素,确定VX2肿瘤内镁的滞留情况。经肝动脉注射Lip-Mg分散液后,在第1、3和7天收集肿瘤组织并在磷酸盐缓冲液中匀浆。随后,将肿瘤组织悬液浸泡在盐酸中以溶解镁微球。最后,通过电感耦合等离子体发射光谱法测定镁离子,以评估VX2肿瘤内的镁滞留情况。
统计分析
本研究中所有结果均以平均值±标准差表示。通过GraphPad Prism 9软件进行统计分析。两组比较采用双尾Student's t检验,多组比较采用单因素方差分析(ANOVA)并进行Tukey事后检验。采用双尾Student's t检验计算统计差异,*P<0.05,**P<0.01,***P<0.001。
肝癌患者的临床M-TACE治疗
患者入选标准
开展了一项单中心、单臂、开放标签试验,旨在研究Lip-Mg用于TACE治疗(简称M-TACE)在中国肝癌患者中的疗效和安全性,并改善预后和患者满意度。该研究已在ClinicalTrials.gov注册,编号:ChiCTR2200064999。本试验经丽水市中心医院伦理委员会批准(编号:2022-326)。对肝癌患者进行筛查。本研究的纳入标准如下:(i)年龄≥18且≤80岁,预期生存期超过12个月,并提供书面知情同意书;(ii)经组织学或临床确诊为原发性肝癌;(iii)Child-Pugh分级A/B,无难以控制的腹水或肝性脑病;(iv)东部肿瘤协作组体能状态评分0~2,骨髓、肾脏和心脏功能良好;(v)选择TACE作为首选治疗方式。接受TACE治疗的患者不符合手术切除指征,或患者及其代理人不愿接受手术。有肝癌相关治疗史(如手术、消融、TACE或放疗)的患者也纳入本研究。本研究中所有患者均签署了书面知情同意书。患者入组时间为2022年9月至2024年7月。选择性TACE手术
TACE手术由数字减影血管造影室的医生按照技术建议进行。简要来说,在局部麻醉下通过Seldinger技术进入右股动脉,随后插入动脉导入鞘,引入5-F Yashiro导管进行肝动脉造影。之后,推进2.7-F同轴微导管,将导管尖端超选择性置于亚段肿瘤供血血管进行超选择性插管。首先注射表柔比星(30 mg/m2)-碘油水包油乳剂进行传统TACE,然后在透视引导下输注镁微球-碘油分散液(简称M-TACE)。镁微球的使用剂量主要取决于肝癌病灶的血供(范围:约30至200 mg)。当靶动脉血流停滞时停止栓塞。化疗药物和碘油的剂量由肿瘤大小和血管分布情况决定。当后续图像显示明显强化病灶时,根据需要每4周重复一次M-TACE治疗。栓塞治疗的最大次数为3次。
治疗方案
首次M-TACE治疗后,评估患者的治疗相关不良事件和肿瘤反应。之后,治疗医生在每个疗程后通过影像评估,并根据肿瘤反应程度和生活质量,为每位患者确定是否重复M-TACE手术。对于出现轻度不良反应、靶肿瘤反应明显但仍存在部分明显强化病灶的患者,医生会决定继续进行M-TACE。
安全性和有效性评估
在每个M-TACE治疗疗程前后进行体格检查和血液检查。根据《不良事件通用术语标准》评估毒性。M-TACE治疗后进行增强磁共振成像,根据改良实体瘤疗效评价标准评估肿瘤反应。对于改良实体瘤疗效评价标准,在基线(BL)和随访(UP)时测量靶增强肿瘤的最大直径之和(D),避免内部坏死的主要区域。直径变化百分比计算如下:DC=[D(UP)−D(BL)]/D(BL)*100%。患者分为完全缓解[所有靶病灶(最多两个可测量肝病灶)的任何瘤内动脉强化消失]、部分缓解[以基线靶病灶直径之和为参照,存活(动脉期强化)靶病灶的一维直径之和至少减少30%]、疾病进展[以治疗开始后记录的存活(强化)靶病灶的最小直径之和为参照,存活(强化)靶病灶的直径之和至少增加20%,或出现新的肝内病灶]和疾病稳定(既不符合部分缓解也不符合疾病进展的任何情况)。客观缓解率定义为达到完全缓解和部分缓解的患者百分比。随访评估计划持续至最终M-TACE手术后1个月。截至2024年7月8日数据锁定日期,平均随访时间为1.5个月,范围为1至3个月。该信息使我们对随访持续时间有了更清晰的了解,并能更准确地评估不良事件和反应。
https://wap.sciencenet.cn/blog-41174-1492512.html
上一篇:结合微藻与氢氧化细菌的新型光-化能自养系统用于从二氧化碳生产微生物蛋白
下一篇:氢气对新生猪缺血缺氧后心脏功能的改善作用