博文
[转载]项目文章:从ac4C修饰到胃癌致病机制,NAT10的潜力与突破
||

[导读]
胃癌一直是全球范围内致死率极高的恶性肿瘤之一,尽管近年来治疗手段不断进步,但对于中晚期胃癌患者来说,整体预后仍不理想。在上篇推文中,我们聊到ac4C修饰在绝经后骨质疏松(PMOP)中的研究进展。今天,我们一起来看一看ac4C在癌症领域,尤其是胃癌中的研究是怎样展开的。
近日,福建医科大学的研究团队联合纽科生物,探索了ac4C NAT10酶在胃癌中的作用机制(纽科生物提供ac4C-seq测序服务)。通过精准的实验设计和数据分析,研究揭示了NAT10通过其RNA乙酰转移酶的作用,催化TNC上的ac4C修饰,增强了TNC的稳定性和翻译效率。这一过程促使TNC的过度表达,并通过激活TNC/Akt/TGF-β1正反馈通路,推动胃癌的恶性进展。
在整个实验设计中,研究团队采用了“由表及里”的层层推进策略,通过acRIP-seq、mRNA稳定性检测、翻译效率分析及体内外功能实验,构建了“修饰酶NAT10→靶mRNA TNC→信号通路Akt/TGF-β1”这一完整的机制路径,深入解析了ac4C修饰在调控癌细胞迁移与侵袭过程中的关键作用。这种将临床观察与机制研究结合的思路,不仅有助于揭示关键调控路径,也为后续靶点干预打下了实验基础。
本期推文中,我们将从数据分析、实验验证到核心机制挖掘,带您系统解析这项RNA修饰研究在实体瘤机制研究中的典型实践,探索ac4C修饰如何成为肿瘤研究中的“新变量”。
英文标题:NAT10 promotes gastric cancer progression by enhancing the N4-acetylcytidine modifcation of TNC mRNA
中文标题:NAT10通过增强TNC mRNA的N4-乙酰胞苷修饰促进胃癌进展
发表期刊:Infectious Agents and Cancer
研究思路: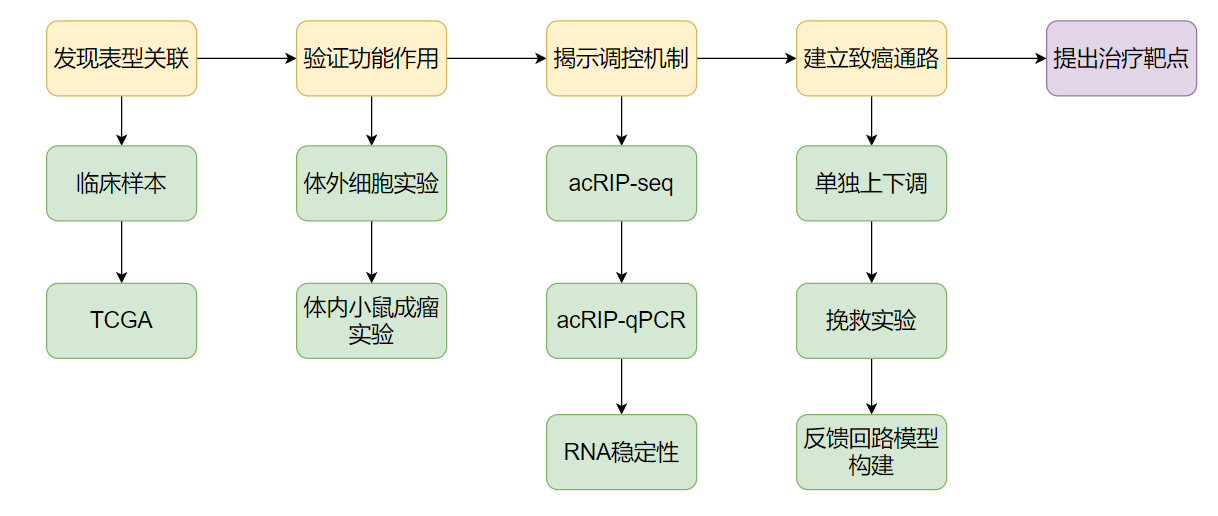
[NAT10在胃癌中的表达特征]
首先,研究通过分析临床样本和TCGA中的数据,发现NAT10在胃癌组织(GC)中明显上调,并且高表达的NAT10与较差的患者预后相关。为了进一步验证NAT10的功能,研究团队进行了一系列体外实验,发现NAT10的过表达显著促进了GC细胞的增殖、迁移和侵袭能力。此外,又通过小鼠体内肿瘤模型实验,确认了NAT10过表达能够加速肿瘤生长。这些实验结果初步证明了NAT10可能是潜在的促癌因子。
分析方法:
1)临床样本验证NAT10与TNC共同上调,预后较差;
2)生物信息学分析TCGA数据,发现NAT10在GC中上调;
3)体外细胞实验(转染、CCK-8、克隆形成、Transwell等)验证其促癌功能;
4)体内小鼠成瘤实验,证实其促增殖功能。

图1. NAT10 在 GC 组织中表达上调,且与 TNC 表达呈正相关
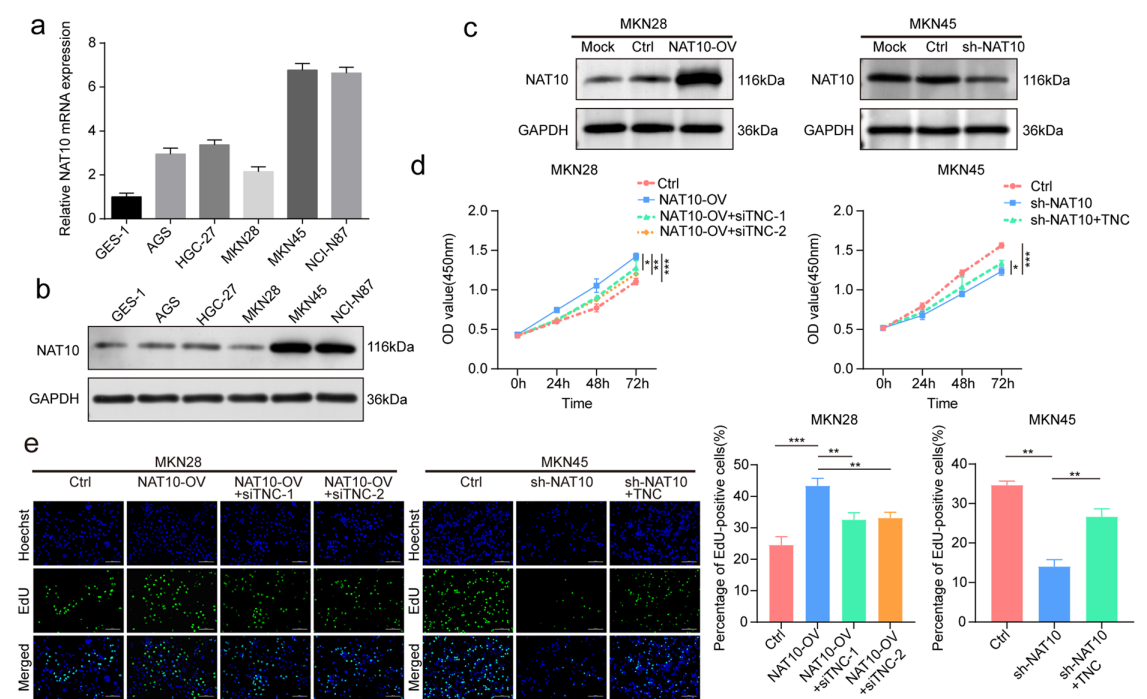
图2. NAT10对体外GC细胞恶性表型的影响
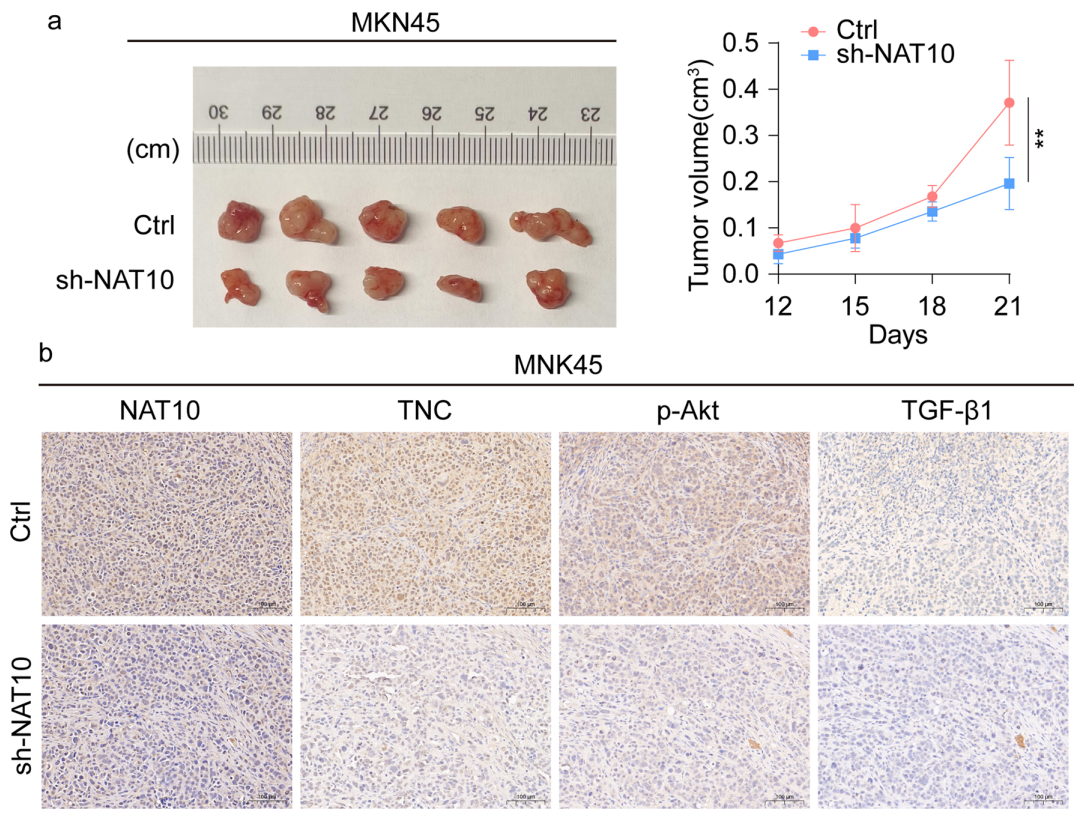
图3. NAT10敲低抑制了裸鼠胃癌细胞的致瘤性
[NAT10通过ac4C修饰调控TNC]
为了进一步探究NAT10如何调控TNC的表达,研究人员选择了3对GC组织及其配对癌旁组织进行acRIP-seq分析,用以识别ac4C修饰在mRNA中的位置及其分布模式。结果显示,1)GC组织中ac4C修饰水平显著高于癌旁组织,修饰的主要集中区域为mRNA的编码区(CDS);2)在修饰的序列上,发现“CXXCXXCXX”这一基序在GC组织和癌旁组织中均有富集,但不同基因的修饰水平有所不同。
通过与mRNA联合分析得到,3)在GC组织中,ac4C修饰水平差异的基因涉及多个与肿瘤相关的信号通路,如PI3K-Akt、MAPK和TGF-β等;4)11个基因的ac4C修饰在GC组织中上调,其中TNC作为一个致癌基因被特别关注。TNC的ac4C修饰水平较高,且与NAT10的表达水平呈正相关,Western blot结果进一步证明TNC可能是NAT10在胃癌中引发恶性行为的重要下游靶点。
此外,acRIP-qPCR实验和RNA稳定性实验进一步证实了这种修饰机制的存在。
分析方法:
1)acRIP-seq分析找出TNC为NAT10潜在靶点;
2)acRIP-qPCR实验和RNA稳定性实验验证ac4C修饰增强TNC mRNA稳定性与翻译效率。
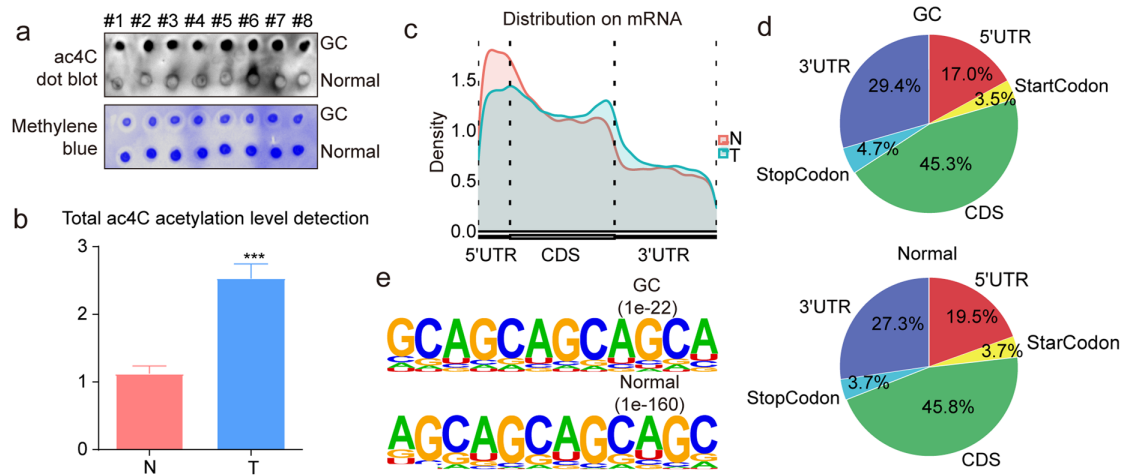
图4. acRIP-seq揭示了NAT10在催化GC中TNC的ac4C修饰中的作用
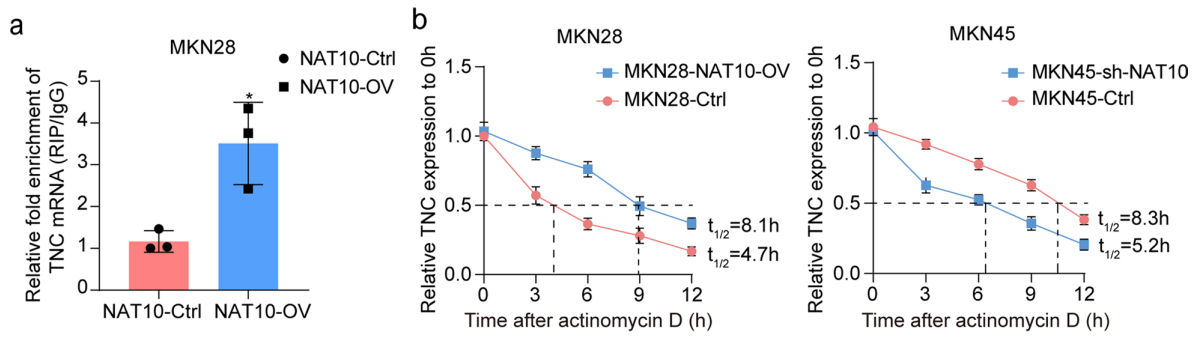
图5. NAT10通过催化ac4C修饰提高TNC的mRNA稳定性和翻译效率
[TNC的促癌作用及其正反馈机制]
接下来,研究团队深入探讨了TNC在胃癌中的促癌作用及其与NAT10的相互关系。研究显示,TNC的过表达显著促进了GC细胞的增殖、迁移和侵袭,而通过siRNA技术下调TNC表达能够部分逆转NAT10过表达引起的恶性表型。这表明,TNC是NAT10介导的胃癌恶性进展的重要效应分子。此外,研究进一步发现,TNC通过激活Akt和TGF-β1信号通路,形成了一个正反馈回路,加剧了胃癌细胞的恶性行为。
分析方法:
1)构建TNC过表达质粒(单独上调)发现TNC表达促进GC细胞增殖;
2)构建TNC特异性敲除siRNA(单独下调)发现TNC表达抑制GC细胞增殖;
3)挽救实验:CCK-8、EdU、流式细胞术、Transwell侵袭和迁移实验,部分逆转NAT10诱导的恶性表型;
4)检测Akt和TGF-β1信号通路的激活状态,构建反馈回路模型。
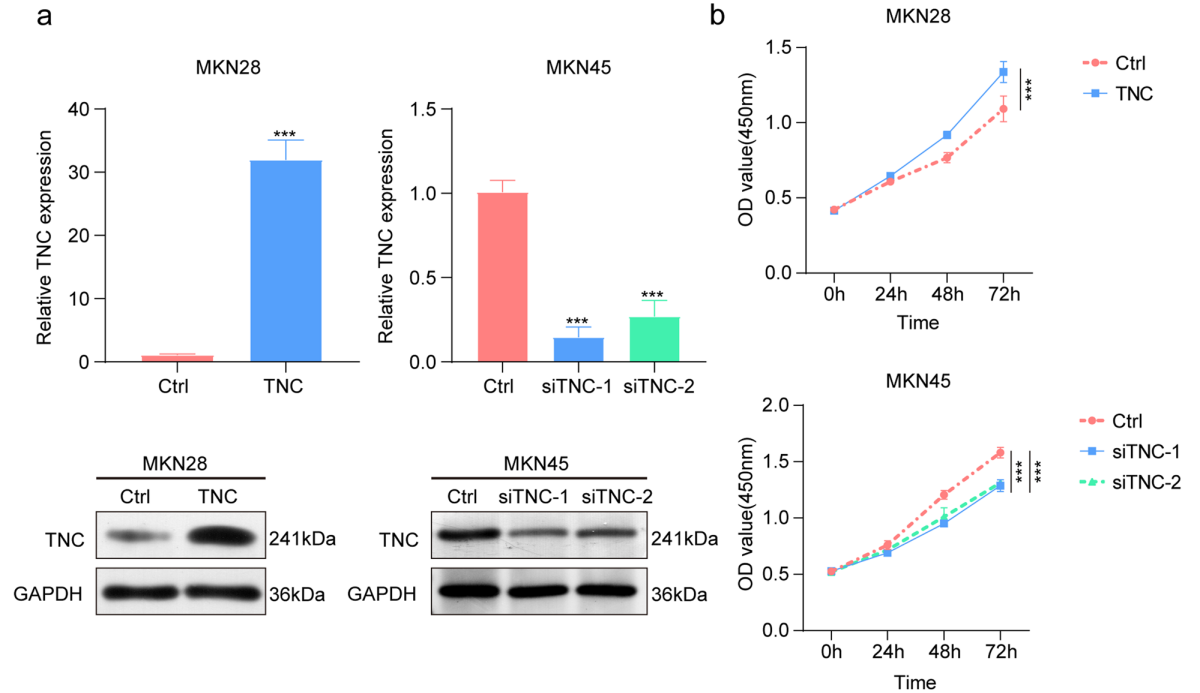
图6. TNC促进GC细胞增殖、迁移和侵袭
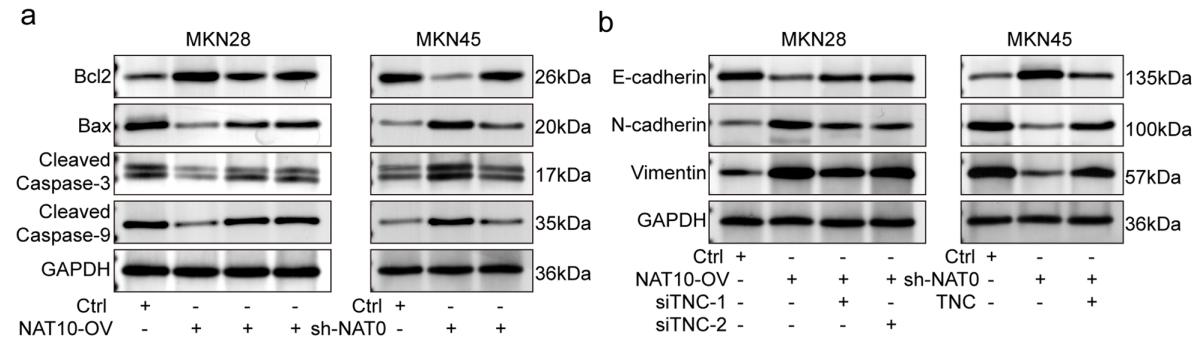
图7. NAT10激活TNC/Akt/TGF-β1正反馈回路,驱动GC细胞恶性表型
[总结]
这篇研究围绕NAT10在胃癌中的作用机制展开,采用了从“现象观察”到“机制解析”再到“通路整合”的经典生物医学研究路线,由表及里层层递进,逐步深入探索NAT10在胃癌中的致癌机制。以下是小编整理的主要思路,供大家参考。如果有进一步需要,也可以直接联系纽科公司的生信分析团队,我们将为您提供精准、高效的科研支持,助力项目顺利开展,实现研究目标:
1)发现表型关联:发现NAT10在GC中高表达,与差预后相关;
2)验证功能作用:体内外实验验证NAT10确实促进癌细胞恶性行为;
3)揭示调控机制:通过ac4C修饰调控TNC表达,发现NAT10的功能依赖其乙酰化酶活性;
4)建立致癌通路:发现NAT10通过调控TNC,进而激活TNC/Akt/TGF-β1正反馈通路,促进GC的进展;
5)提出治疗靶点:NAT10及其介导的ac4C修饰、TNC可能成为潜在干预靶点。
微生信助力高分文章,用户300000+,谷歌学术6400+
https://wap.sciencenet.cn/blog-707141-1489520.html
上一篇:[转载]【客户高分文章:IF40.8】外泌体传递促焦亡miRNA--驱动心脏损伤的肇事因子
下一篇:[转载]【项目文章】多组学短快平发文——测序技术助力发现角膜瘢痕重要因子