博文
氢水局部注射缓解疼痛动物实验
||
氢水局部注射缓解疼痛实验
题目:Nrf2/HO-1-硫氧还蛋白还原酶1通路介导超声引导下早期局部注射纳米气泡溶氢水对慢性压迫性损伤致神经病理性疼痛大鼠模型的保护作用

神经病理性疼痛(NP)是一种常见且难治的慢性疼痛。富氢水通过鞘内注射、饮水及腹腔注射等方式,已被证实对神经病理性疼痛具有保护作用。纳米气泡溶氢水(NHW)是一种同时含有氢气气泡和溶解态氢气的溶液。基于此,本研究旨在观察超声引导下局部注射纳米气泡溶氢水对神经病理性疼痛模型大鼠的作用,并探究其潜在作用机制。
方法
本研究采用结扎大鼠坐骨神经的方法,构建慢性压迫性损伤(CCI)致神经病理性疼痛模型。将造模成功的大鼠分为不同组别,分别给予低浓度或高浓度纳米气泡溶氢水干预,注射次数为1次或3次(每组6只大鼠)。实验期间,检测大鼠的缩足阈值(PWT)和缩足潜伏期(PWL)。慢性压迫性损伤造模后第14天,检测大鼠坐骨神经组织结构、炎症反应及氧化应激损伤情况,并通过蛋白质印迹法(Western blotting)和逆转录聚合酶链式反应(RT-PCR)检测核因子E2相关因子2/血红素氧合酶1(Nrf2/HO-1)及硫氧还蛋白还原酶1(sulfiredoxin-1)的表达水平。
结果
与低浓度组相比,高浓度纳米气泡溶氢水组大鼠在慢性压迫性损伤造模后第1、3、5、7、14天的缩足阈值和缩足潜伏期均显著提高(*p*<0.05)。造模后第14天,高浓度组大鼠的神经损伤、炎症反应及氧化应激损伤程度均显著轻于低浓度组;且高浓度多次给药(3次)组的改善效果更优(*p*<0.05),同时该组大鼠体内Nrf2/HO-1及硫氧还蛋白还原酶1的蛋白与mRNA表达水平也显著升高。
结论
超声引导下早期局部注射纳米气泡溶氢水,可通过激活Nrf2/HO-1-硫氧还蛋白还原酶1通路,减轻慢性压迫性损伤模型大鼠的坐骨神经损伤,缓解机械性痛觉超敏和热痛觉过敏症状,并抑制炎症反应与氧化应激损伤。
1 引言
2008年,神经病理性疼痛被定义为“由外周或中枢神经系统损伤或疾病所引发的疼痛”,其典型特征为感觉异常,包括感觉迟钝、痛觉过敏和痛觉超敏(Colloca 等,2017;Bouhassira 等,2008)。神经病理性疼痛是一种常见的难治性慢性疼痛,对患者的生活质量造成严重负面影响,不仅损害身体健康,还会影响心理健康,给社会和家庭带来沉重负担(Petzke 等,2022;Bader 等,2022)。神经病理性疼痛的患病率为5%~10%,每年有数百万新发患者(Martínez-Serrat 等,2022)。因此,临床上迫切需要研发针对神经病理性疼痛的有效治疗方案。
目前,临床治疗神经病理性疼痛的手段多样,包括药物治疗、运动疗法、心理治疗和介入治疗等,但仅有30%的患者能获得满意的镇痛效果(Sumizono 等,2022;Zhang 等,2022)。药物治疗虽是神经病理性疼痛的基础治疗方式,但相关副作用常导致许多患者中断治疗(Finnerup 等,2015)。因此,亟需探索治疗神经病理性疼痛的替代方案。
氢气(H₂)是一种无色无味的小分子气体,过去被认为是一种生物学惰性气体(Li 等,2018)。2007年,有研究证实氢气对脑缺血再灌注损伤具有抗氧化作用,这一发现引起了科研人员的广泛关注(Ohsawa 等,2007)。随后的研究表明,氢气具有抗炎、抗凋亡、抗氧化损伤等保护作用,已在肺部疾病、皮肤病、心脏病、脑部疾病等多种疾病模型中得到验证(Ishibashi,2019)。在我国,氢气疗法甚至被纳入新型冠状病毒肺炎的治疗方案(Luo 等,2022)。氢气的应用形式主要有三种:气态氢气、富氢水和含氢纳米材料。
既往多项研究已将氢气应用于神经病理性疼痛的治疗探索。早期研究发现,鞘内注射富氢水可降低神经病理性疼痛模型大鼠的氧化应激水平(Chen 等,2013);后续研究证实,饮用富氢水也能缓解小鼠的神经病理性疼痛症状(Kawaguchi 等,2014;Lian 等,2021)。而在近期研究中,腹腔注射富氢水成为治疗神经病理性疼痛的常用方式(Wang 等,2018;Coral-Pérez 等,2022;Chen 等,2019)。但这种给药方式存在一定缺陷,例如氢气易挥发、储存条件严苛,且该给药途径在临床中较难被神经病理性疼痛患者接受。因此,本研究提出神经周围局部注射的给药方式,该方式更贴近临床常规治疗方案。
相较于富氢水,纳米气泡溶氢水具有多重优势。纳米气泡溶氢水是一种含有直径小于1微米氢气气泡的溶液(Kato 等,2015)。溶液中氢气的纳米气泡状态与溶解状态,可大幅提升氢气浓度(Tanaka 等,2022),同时纳米气泡溶氢水的稳定性也显著增强(Tanaka 等,2022)。基于此,本研究旨在探讨超声引导下坐骨神经局部注射纳米气泡溶氢水对慢性压迫性损伤致神经病理性疼痛模型大鼠的治疗效果,并阐明其潜在作用机制。
2 材料与方法
2.1 实验动物
本研究选用雄性斯普拉格-道利(SD)大鼠,8周龄,体重200克,购自青岛大学附属医院实验动物中心。所有大鼠均给予充足的食物和饮水,饲养环境为室温(24±1℃)、12小时光照/黑暗循环,分笼饲养。所有动物饲养及实验操作均经青岛大学附属医院实验动物福利与伦理委员会批准,且符合实验动物研究报告的动物研究:体内实验报告指南(ARRIVE guidelines)相关要求(审批编号:AHQU-MAL20241224MC)。
2.2 纳米气泡溶氢水的制备
采用纳米气泡溶氢水制备仪(型号:NB-T71A;生产厂家:上海纳米巴伯科技有限公司)制备纳米气泡溶氢水。该仪器通过电解超纯水产生氢气,分离出氢气纳米气泡,最终制得纳米气泡溶氢水,其氢气浓度最高可达2600亿分比浓度(ppb)。制备好的纳米气泡溶氢水储存于铝箔袋中,室温保存,并经γ射线灭菌处理。
2.3 慢性压迫性损伤模型构建
参照既往研究方法(Bennett 和 Xie,1988),构建大鼠慢性压迫性损伤致神经病理性疼痛模型。腹腔注射戊巴比妥钠(50毫克/千克)麻醉大鼠后,暴露左侧坐骨神经(位于股二头肌与浅层臀肌之间)。使用4-0丝线,以1毫米的间隔对左侧坐骨神经进行4处松结扎。整个手术过程在无菌环境下进行,术后对大鼠术部涂抹外用抗生素。以手术当日作为造模第0天。
2.4 实验分组
慢性压迫性损伤模型构建完成后,将36只大鼠随机分为以下6组(每组6只):
1. 假手术组:仅暴露左侧坐骨神经,不进行结扎;
2. 模型组:仅构建慢性压迫性损伤模型,不给予其他干预;
3. 低浓度纳米气泡溶氢水单次注射组(CCI+L1组):慢性压迫性损伤造模后第1天,超声引导下局部注射低浓度纳米气泡溶氢水(浓度1300 ppb,剂量5毫升/千克);
4. 高浓度纳米气泡溶氢水单次注射组(CCI+H1组):慢性压迫性损伤造模后第1天,超声引导下局部注射高浓度纳米气泡溶氢水(浓度2600 ppb,剂量5毫升/千克);
5. 低浓度纳米气泡溶氢水三次注射组(CCI+L3组):慢性压迫性损伤造模后第1、3、5天,超声引导下分三次局部注射低浓度纳米气泡溶氢水(浓度1300 ppb,剂量5毫升/千克);
6. 高浓度纳米气泡溶氢水三次注射组(CCI+H3组):慢性压迫性损伤造模后第1、3、5天,超声引导下分三次局部注射高浓度纳米气泡溶氢水(浓度2600 ppb,剂量5毫升/千克)。
(见图1A)
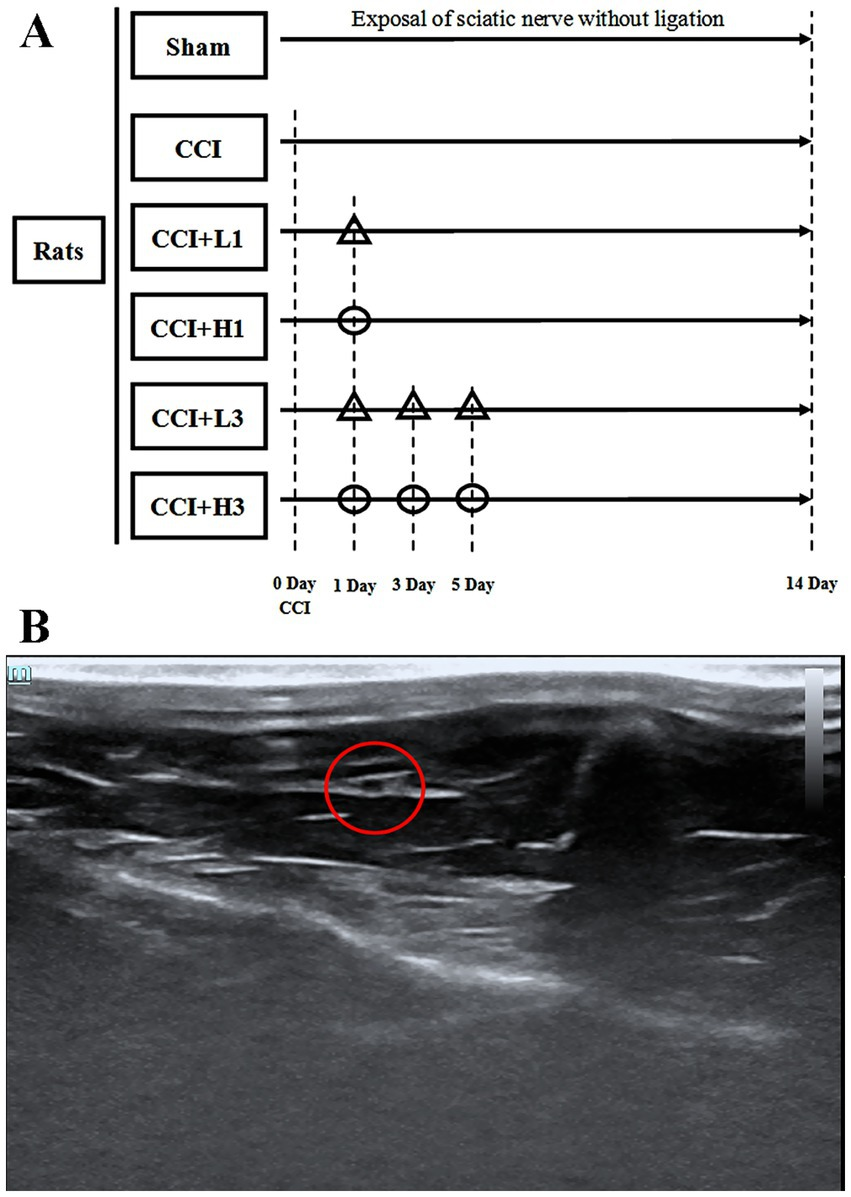
图1 (A)研究方案设计。CCI:慢性压迫性损伤;△:超声引导下坐骨神经局部注射低浓度纳米气泡溶氢水(1300亿分比浓度);○:超声引导下坐骨神经局部注射高浓度纳米气泡溶氢水(2600亿分比浓度)。(B)超声下的坐骨神经影像。红色圆圈标记处为坐骨神经。
2.5 超声引导下大鼠坐骨神经局部注射方法
参照既往研究方法(Wu 等, 2023)开展超声引导下局部注射操作。大鼠吸入2%异氟醚麻醉后,使用超声成像仪(深圳迈瑞生物医疗电子股份有限公司)搭配高频探头(带宽15~30兆赫兹),对大鼠左后肢腹侧区域进行超声扫描(见图1B)。穿刺操作前,需清理观察区域毛发,并采用碘伏进行局部消毒。
2.6 行为学检测
分别于基线期(慢性压迫性损伤造模前1天)及造模后第0、1、3、5、7、14天进行行为学检测。采用冯·弗雷疼痛检测套装(型号CA91367;美国加利福尼亚州圣地亚哥科学仪器公司)测定大鼠缩足阈值(PWT),以此评估机械性痛觉超敏程度;采用热板仪(上海欣软信息科技有限公司)测定大鼠缩足潜伏期(PWL),以此评估热痛觉过敏程度;采用转棒系统(美国加利福尼亚州IITC生命科学公司)测定大鼠运动功能。
缩足阈值检测方法:将大鼠置于金属网笼内,适应15分钟至状态安静。使用冯·弗雷纤维丝垂直刺激大鼠左后足中部,施加的力度以纤维丝弯曲成S形为准,持续刺激5秒。当大鼠出现缩足反应时,记录该纤维丝对应的压力值。检测所用纤维丝的最大压力为26克。连续检测3次,每次间隔5分钟,取平均值作为最终缩足阈值(Wang 等, 2018;Coral-Pérez 等, 2022)。
缩足潜伏期检测方法:将大鼠置于热板仪上,适应15分钟至状态安静。随后将热板仪温度设定为55±0.1℃。当大鼠开始舔舐左后足时,记录所需时间。检测的最长时间限定为25秒。连续检测3次,每次间隔10分钟,取平均值作为最终缩足潜伏期(Wang 等, 2018;Coral-Pérez 等, 2022)。
运动功能检测方法:将大鼠置于转棒系统上。转棒初始转速设定为5转/分钟,并匀速加速至20转/分钟。当大鼠从转棒上掉落时,记录持续时间。检测的最长时间限定为300秒。连续检测3次,每次间隔15分钟,取平均值评估大鼠运动功能(Wang 等, 2018;Coral-Pérez 等, 2022)。
2.7 组织病理学染色
慢性压迫性损伤造模后第14天,对大鼠实施安乐死。取各组大鼠坐骨神经结扎部位组织,经甲醛固定72小时,梯度乙醇脱水后,进行石蜡包埋,制备厚度为5微米的组织切片。对切片进行苏木精-伊红染色,随后在光学显微镜(日本奥林巴斯株式会社)下观察组织形态。
2.8 酶联免疫吸附试验(ELISA)
慢性压迫性损伤造模后第14天,对大鼠实施安乐死。取各组大鼠坐骨神经结扎部位组织及L5背根神经节(DRG),置于-80℃环境保存。将组织样本置于4℃裂解液中,经超声破碎后冰浴孵育30分钟。随后在4℃条件下以13000×g的转速离心10分钟,取上清液。严格按照酶联免疫吸附试验试剂盒(美国马萨诸塞州赛默飞世尔科技公司)说明书,检测白细胞介素(IL)-1β、白细胞介素-6、白细胞介素-10及肿瘤坏死因子(TNF)-α的浓度。
2.9 氧化应激损伤检测
取上述坐骨神经及背根神经节组织的上清液,严格按照试剂盒(南京建成生物工程研究所)说明书,检测超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)及8-羟基脱氧鸟苷(8-OHDG)的含量,以此评估组织氧化应激损伤程度。
2.10 蛋白质印迹法(Western blotting)
慢性压迫性损伤造模后第14天,对大鼠实施安乐死。取各组大鼠L5背根神经节组织,置于-80℃环境保存。将组织样本置于液氮中研磨粉碎,加入含1毫摩尔/升苯甲基磺酰氟的裂解液,孵育10分钟。随后在4℃条件下以14000×g的转速离心10分钟,取上清液煮沸10分钟,制备蛋白样本。
首先采用二辛可宁酸(BCA)法(南京建成生物工程研究所)测定蛋白浓度;随后通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对蛋白进行分离;将分离后的蛋白转移至聚偏氟乙烯(PVDF)膜上,使用5%脱脂奶粉封闭膜。
之后将膜置于核因子E2相关因子2(Nrf2,稀释比例1:1500)、血红素氧合酶1(HO-1,稀释比例1:1000)及硫氧还蛋白还原酶1(稀释比例1:500)的一抗(美国马萨诸塞州赛默飞世尔科技公司)中,4℃孵育过夜。
次日将膜置于二抗(稀释比例1:4000,上海碧云天生物技术有限公司)中,室温孵育1小时。最后采用增强化学发光法(上海碧云天生物技术有限公司)显影,通过Quantity One软件(美国伯乐生命医学产品有限公司上海分公司)分析条带。以β-肌动蛋白(β-actin)作为内参(Coral-Pérez 等, 2022)。
2.11 实时荧光定量聚合酶链式反应(RT-PCR)
严格按照试剂盒说明书,采用TRIzol试剂(美国加利福尼亚州卡尔斯巴德英杰公司)提取背根神经节组织中的总RNA。使用PrimeScript RT Master Mix试剂盒(中国大连宝生物工程有限公司)合成cDNA,采用SYBR Green Supermix试剂盒(美国加利福尼亚州赫拉克勒斯伯乐公司)进行实时荧光定量聚合酶链式反应。
引物序列如下:
核因子E2相关因子2正向引物:5’-TGAAGCTCAGCTCGCATTGA-3′,反向引物:5’-TGCTCCAGCTCGACAATGTT-3′;
血红素氧合酶1正向引物:5’-ATCGTGCTCGCATGAACACT-3′,反向引物:5’-CCAACACTGCATTTACATGGC-3′;
硫氧还蛋白还原酶1正向引物:5’-GTGCACAACGTACCAATCG-3′,反向引物:5’-GCCCCCAAAGGAATAGTAGTAG-3′。
以β-肌动蛋白作为内参(正向引物:5’-CTGAATGGCCCAGGTCTGAG-3′;反向引物:5’-AAGTCAGTGTACAGGCCAGC-3′),采用2-ΔΔCt法计算目的基因的相对表达量。
2.12 统计学分析
所有实验数据均以均值±标准差(`x̄±s`)表示。对于缩足阈值、缩足潜伏期及运动功能相关数据,采用双因素方差分析,组间多重比较采用图基检验;对于蛋白质印迹法、炎症指标及氧化应激损伤相关数据,采用单因素方差分析,组间多重比较采用邦弗朗尼检验。*p*<0.05表示差异具有统计学意义。所有统计学分析均采用SPSS 17.0软件(美国伊利诺伊州芝加哥SPSS公司)完成。
3 结果
3.1 实验动物基本情况
本研究共使用36只大鼠。其中6只大鼠仅暴露坐骨神经未进行结扎(假手术组),其余30只大鼠均成功构建慢性压迫性损伤模型。所有36只大鼠的实验数据均纳入统计学分析。
3.2 纳米气泡溶氢水缓解慢性压迫性损伤诱导的机械性痛觉超敏与热痛觉过敏
实验数据先经双因素方差分析,再通过图基检验进行组间差异分析。基线期时,各组大鼠的缩足阈值和缩足潜伏期无明显差异。与假手术组相比,慢性压迫性损伤造模后第0、1、3、5、7、14天,模型组大鼠的缩足阈值和缩足潜伏期均显著降低。
但模型组大鼠的缩足阈值和缩足潜伏期在造模后第1、3、5天持续下降,至第7、14天趋于稳定。
造模后第0天,模型组、低浓度单次注射组、高浓度单次注射组、低浓度三次注射组及高浓度三次注射组的缩足阈值和缩足潜伏期无显著差异。
造模后第1天,低浓度单次注射组、高浓度单次注射组、低浓度三次注射组及高浓度三次注射组的缩足阈值和缩足潜伏期均高于模型组(*p*<0.05);且高浓度单次注射组与高浓度三次注射组的指标高于低浓度单次注射组与低浓度三次注射组(*p*<0.05);高浓度单次注射组与高浓度三次注射组之间、低浓度单次注射组与低浓度三次注射组之间的指标无显著差异。
造模后第3天,低浓度三次注射组与高浓度三次注射组的缩足阈值和缩足潜伏期分别高于低浓度单次注射组与高浓度单次注射组(*p*<0.05);且高浓度三次注射组的指标高于低浓度三次注射组(*p*<0.05);高浓度单次注射组的指标高于低浓度单次注射组(*p*<0.05)。
造模后第5、7、14天的指标变化趋势与第3天一致(见图2)。此外,转棒试验结果显示,各组大鼠的运动功能均未受到明显影响(见图2)。
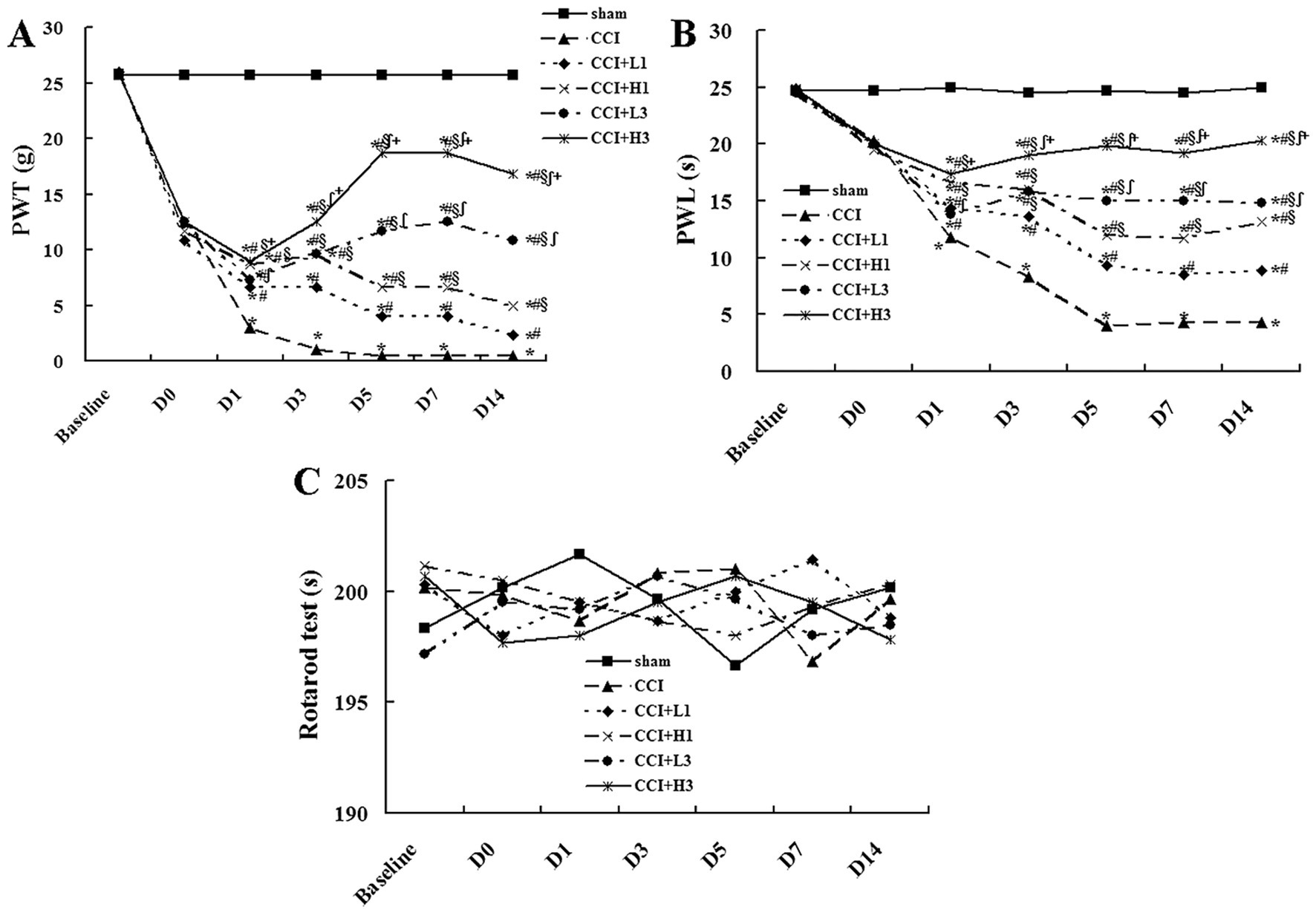
图2 行为学检测结果(n=6;均值) (A)缩足阈值(PWT);(B)缩足潜伏期(PWL);(C)转棒试验测定的运动功能。为避免图像混淆,图中未标注标准差。*p<0.05,与假手术组相比;p<0.05,与慢性压迫性损伤模型组相比;§p<0.05,与低浓度纳米气泡溶氢水单次注射组相比;∫p<0.05,与高浓度纳米气泡溶氢水单次注射组相比;+p<0.05,与高浓度纳米气泡溶氢水单次注射组相比。
3.3 纳米气泡溶氢水减轻慢性压迫性损伤诱导的神经损伤
苏木精-伊红染色结果显示,假手术组大鼠的坐骨神经组织结构完整,神经纤维排列平行且规整,包裹轴突的髓鞘完整,形态清晰均匀。
慢性压迫性损伤模型组大鼠的坐骨神经则出现明显病理改变:神经纤维排列紊乱、结构破坏,部分区域髓鞘崩解,轴索发生变性。
与之相比,低浓度单次注射组、高浓度单次注射组、低浓度三次注射组及高浓度三次注射组大鼠的坐骨神经损伤程度均有所减轻,其中高浓度三次注射组的神经损伤最轻(见图3)。

图3 大鼠坐骨神经组织形态(苏木精-伊红染色,×10倍镜) (A)假手术组;(B)慢性压迫性损伤模型组;(C)慢性压迫性损伤+低浓度纳米气泡溶氢水单次注射组;(D)慢性压迫性损伤+高浓度纳米气泡溶氢水单次注射组;(E)慢性压迫性损伤+低浓度纳米气泡溶氢水三次注射组;(F)慢性压迫性损伤+高浓度纳米气泡溶氢水三次注射组。
假手术组大鼠坐骨神经轴突分布均匀、饱满;慢性压迫性损伤模型组轴突数量稀疏,且大小、粗细、形态均存在差异。注射纳米气泡溶氢水后,大鼠坐骨神经轴突数量增多,分布趋于规整,其中以慢性压迫性损伤+高浓度纳米气泡溶氢水三次注射组的改善效果最为显著。
3.4 纳米气泡溶氢水减轻慢性压迫性损伤诱导的神经炎症反应
采用单因素方差分析进行多组间差异比较,组间两两比较采用邦弗朗尼检验。
与假手术组相比,慢性压迫性损伤模型组、慢性压迫性损伤+低浓度单次注射组、慢性压迫性损伤+高浓度单次注射组、慢性压迫性损伤+低浓度三次注射组及慢性压迫性损伤+高浓度三次注射组大鼠坐骨神经中白细胞介素-1β、白细胞介素-6及肿瘤坏死因子-α的水平均显著升高(*p*<0.05)。
与慢性压迫性损伤模型组相比,上述四个纳米气泡溶氢水干预组大鼠坐骨神经中白细胞介素-1β、白细胞介素-6及肿瘤坏死因子-α的水平均显著降低(*p*<0.05)。
此外,慢性压迫性损伤+低浓度三次注射组与慢性压迫性损伤+高浓度三次注射组的上述促炎因子水平,均低于同浓度单次注射组;且慢性压迫性损伤+高浓度三次注射组的促炎因子水平低于慢性压迫性损伤+低浓度三次注射组(*p*<0.05)。
与之相反,大鼠坐骨神经中白细胞介素-10的水平变化趋势与上述促炎因子完全相反(*p*<0.05,见图4)。
同时,各组大鼠背根神经节中白细胞介素-1β、白细胞介素-6、肿瘤坏死因子-α及白细胞介素-10的水平变化趋势,与坐骨神经组织中的检测结果一致(见图5)。
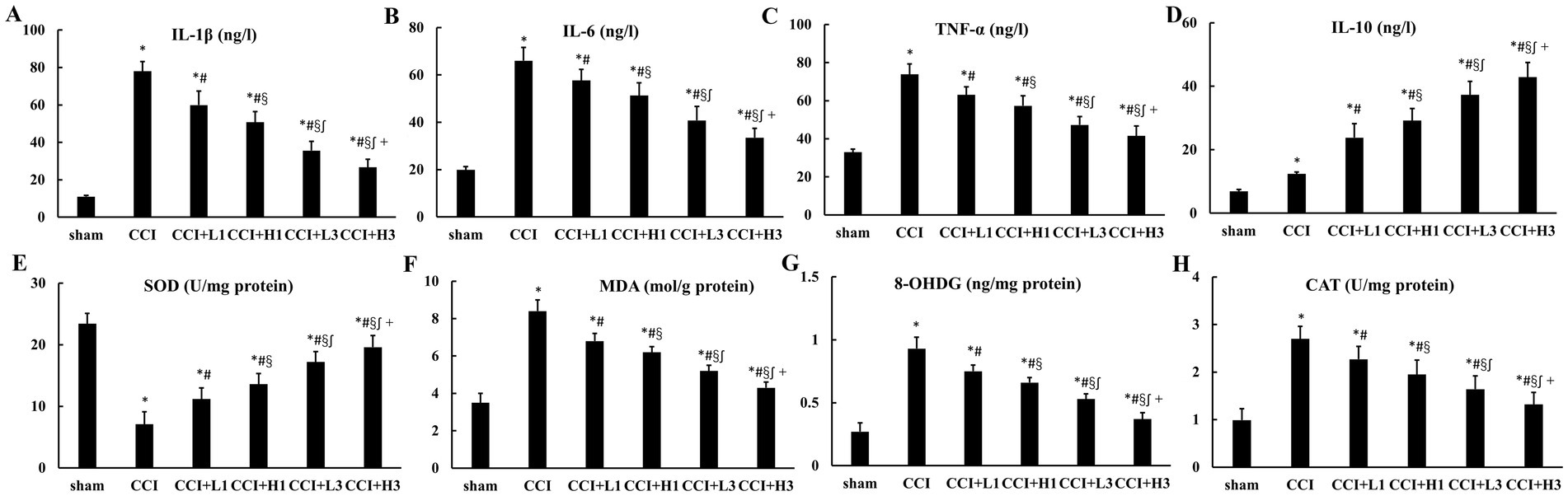
图4 神经组织的炎症反应及氧化应激损伤情况(n=6,均值±标准差)
(A)白细胞介素-1β;(B)白细胞介素-6;(C)肿瘤坏死因子-α;(D)白细胞介素-10;(E)超氧化物歧化酶;(F)丙二醛;(G)8-羟基脱氧鸟苷;(H)过氧化氢酶。
缩略词注释:CCI:慢性压迫性损伤;IL:白细胞介素;TNF:肿瘤坏死因子;SOD:超氧化物歧化酶;MDA:丙二醛;8-OHDG:8-羟基脱氧鸟苷;CAT:过氧化氢酶。
*p<0.05,与假手术组相比;p<0.05,与慢性压迫性损伤模型组相比;§p<0.05,与慢性压迫性损伤+低浓度纳米气泡溶氢水单次注射组相比;∫p<0.05,与慢性压迫性损伤+高浓度纳米气泡溶氢水单次注射组相比;+p<0.05,与慢性压迫性损伤+低浓度纳米气泡溶氢水三次注射组相比。
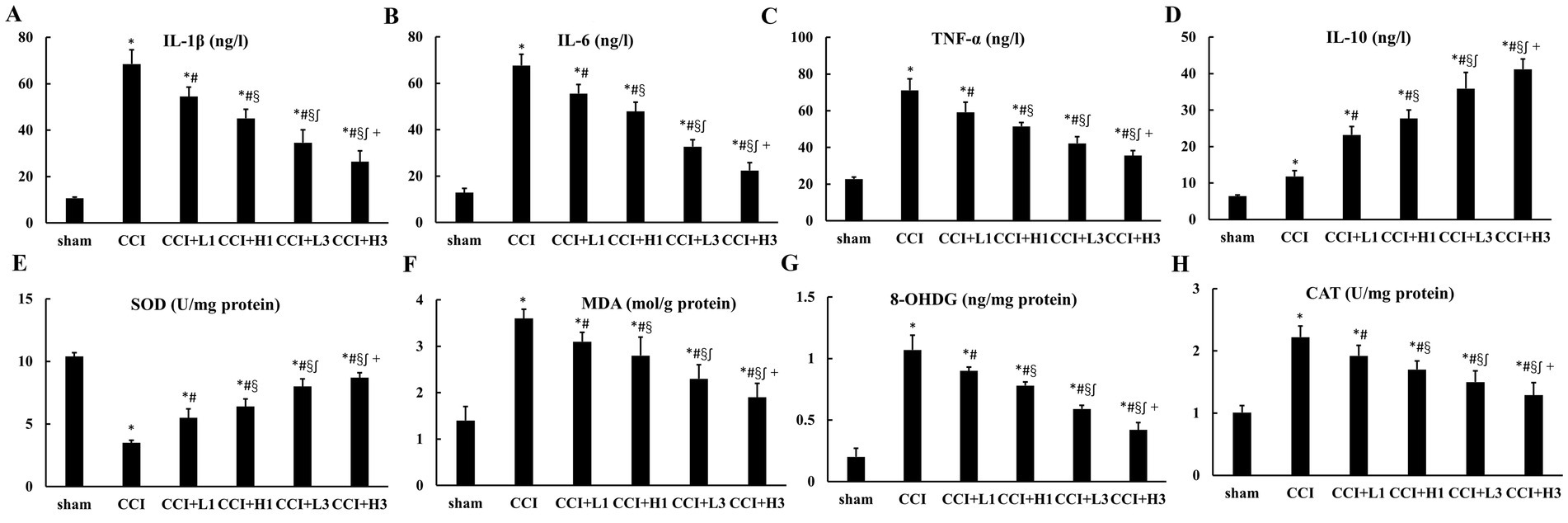
图5 背根神经节的炎症反应及氧化应激损伤情况(n=6,均值±标准差)
(A)白细胞介素-1β;(B)白细胞介素-6;(C)肿瘤坏死因子-α;(D)白细胞介素-10;(E)超氧化物歧化酶;(F)丙二醛;(G)8-羟基脱氧鸟苷;(H)过氧化氢酶。
缩略词注释:CCI:慢性压迫性损伤;IL:白细胞介素;TNF:肿瘤坏死因子;SOD:超氧化物歧化酶;MDA:丙二醛;8-OHDG:8-羟基脱氧鸟苷;CAT:过氧化氢酶。
*p<0.05,与假手术组相比;p<0.05,与慢性压迫性损伤模型组相比;§p<0.05,与慢性压迫性损伤+低浓度纳米气泡溶氢水单次注射组相比;∫p<0.05,与慢性压迫性损伤+高浓度纳米气泡溶氢水单次注射组相比;+p<0.05,与慢性压迫性损伤+低浓度纳米气泡溶氢水三次注射组相比。
3.5 纳米气泡溶氢水减轻慢性压迫性损伤诱导的氧化应激损伤
采用单因素方差分析进行多组间差异比较,组间两两比较采用邦弗朗尼检验。
与假手术组相比,慢性压迫性损伤模型组、慢性压迫性损伤+低浓度单次注射组、慢性压迫性损伤+高浓度单次注射组、慢性压迫性损伤+低浓度三次注射组及慢性压迫性损伤+高浓度三次注射组大鼠坐骨神经中丙二醛和8-羟基脱氧鸟苷的水平均显著升高(*p*<0.05)。
与慢性压迫性损伤模型组相比,上述四个纳米气泡溶氢水干预组大鼠坐骨神经中丙二醛和8-羟基脱氧鸟苷的水平均显著降低(*p*<0.05)。
此外,慢性压迫性损伤+低浓度三次注射组与慢性压迫性损伤+高浓度三次注射组的丙二醛和8-羟基脱氧鸟苷水平,均低于同浓度单次注射组;且慢性压迫性损伤+高浓度三次注射组的上述指标水平低于慢性压迫性损伤+低浓度三次注射组(*p*<0.05)。
与之相反,大鼠坐骨神经中超氧化物歧化酶和过氧化氢酶的水平变化趋势与丙二醛、8-羟基脱氧鸟苷完全相反(*p*<0.05,见图4)。
同时,各组大鼠背根神经节中超氧化物歧化酶、过氧化氢酶、丙二醛及8-羟基脱氧鸟苷的水平变化趋势,与坐骨神经组织中的检测结果一致(见图5)。
3.6 纳米气泡溶氢水激活Nrf2/HO-1-硫氧还蛋白还原酶1通路
采用单因素方差分析进行多组间差异比较,组间两两比较采用邦弗朗尼检验。
与假手术组相比,慢性压迫性损伤模型组、慢性压迫性损伤+低浓度单次注射组、慢性压迫性损伤+高浓度单次注射组、慢性压迫性损伤+低浓度三次注射组及慢性压迫性损伤+高浓度三次注射组大鼠背根神经节中核因子E2相关因子2、血红素氧合酶1及硫氧还蛋白还原酶1的蛋白表达水平均显著降低(*p*<0.05)。
与慢性压迫性损伤模型组相比,上述四个纳米气泡溶氢水干预组大鼠背根神经节中这三种蛋白的表达水平均显著升高(*p*<0.05)。
此外,慢性压迫性损伤+低浓度三次注射组与慢性压迫性损伤+高浓度三次注射组的三种蛋白表达水平,均高于同浓度单次注射组;且慢性压迫性损伤+高浓度三次注射组的蛋白表达水平高于慢性压迫性损伤+低浓度三次注射组(*p*<0.05,见图6)。
同时,各组大鼠背根神经节中核因子E2相关因子2、血红素氧合酶1及硫氧还蛋白还原酶1的mRNA表达水平变化趋势,与对应蛋白的表达水平变化趋势一致(见图6)。
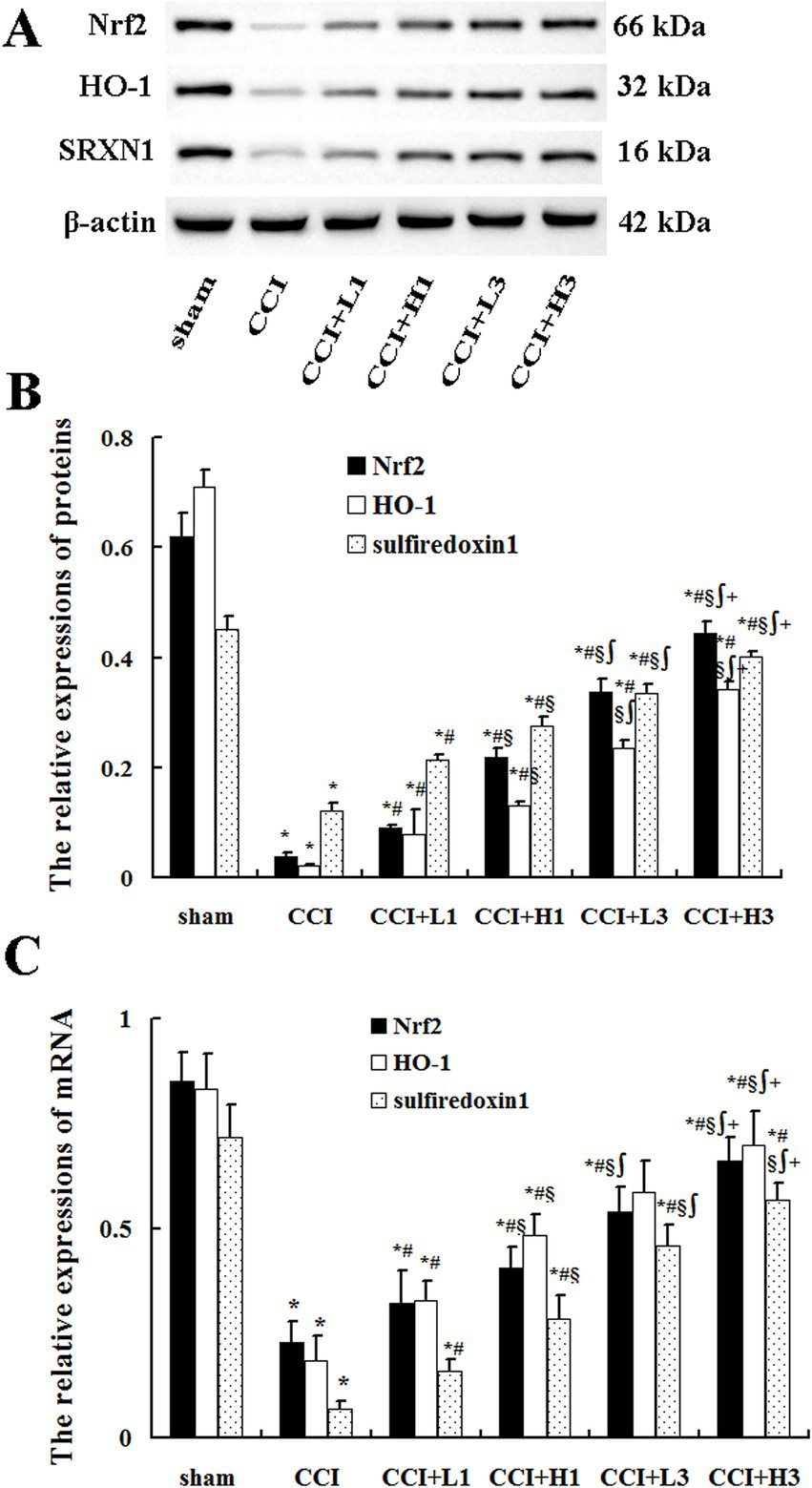
图6 背根神经节中核因子E2相关因子2、血红素氧合酶1及硫氧还蛋白还原酶1的蛋白与mRNA表达水平(n=4,均值±标准差)
(A)核因子E2相关因子2、血红素氧合酶1及硫氧还蛋白还原酶1蛋白条带;(B)核因子E2相关因子2、血红素氧合酶1及硫氧还蛋白还原酶1蛋白相对表达量;(C)核因子E2相关因子2 mRNA、血红素氧合酶1 mRNA及硫氧还蛋白还原酶1 mRNA相对表达量。
缩略词注释:SRXN1:硫氧还蛋白还原酶1。
*p<0.05,与假手术组相比;p<0.05,与慢性压迫性损伤模型组相比;§p<0.05,与慢性压迫性损伤+低浓度纳米气泡溶氢水单次注射组相比;∫p<0.05,与慢性压迫性损伤+高浓度纳米气泡溶氢水单次注射组相比;+p<0.05,与慢性压迫性损伤+高浓度纳米气泡溶氢水单次注射组相比。
3.7 补充实验
为排除溶剂注射造成的影响,我们开展了补充实验,证实溶剂注射不会对慢性压迫性损伤诱导的神经病理性疼痛产生作用。在基线期以及慢性压迫性损伤造模后第0、1、3、5、7、14天,慢性压迫性损伤模型组与慢性压迫性损伤+溶剂注射组大鼠的缩足阈值和缩足潜伏期均无明显差异(见图7)。
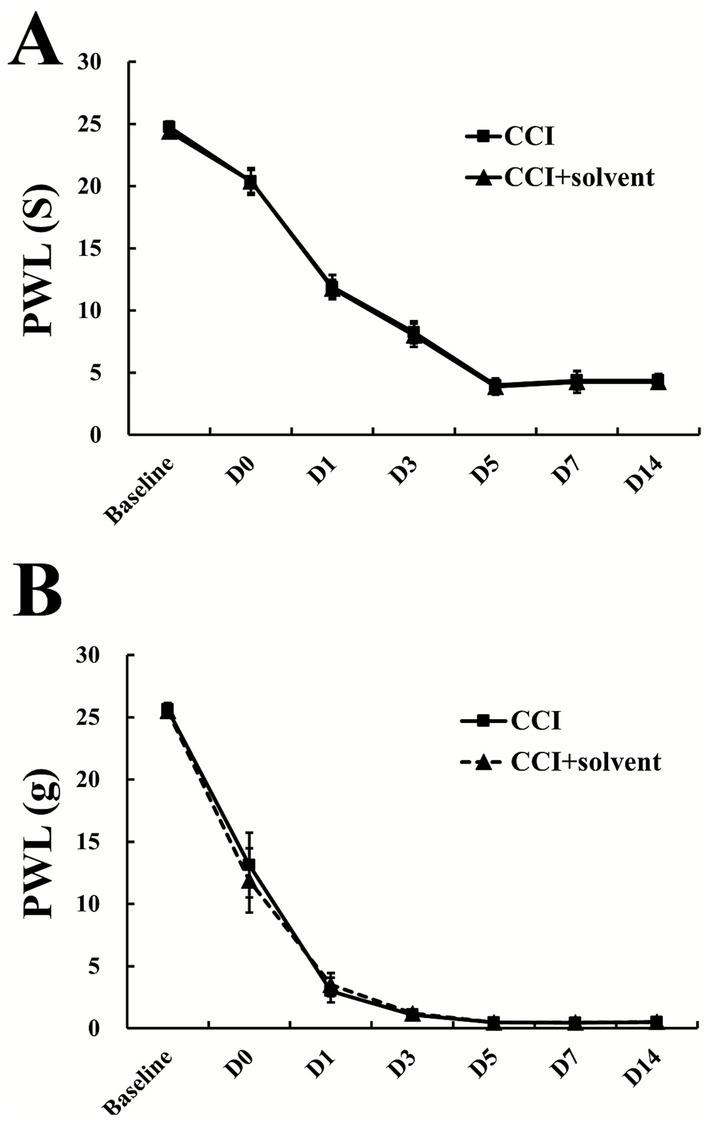
图7 慢性压迫性损伤组与慢性压迫性损伤+溶剂组的行为学检测补充实验结果(n=6,均值±标准差)
(A)缩足阈值;(B)缩足潜伏期
4 讨论
本研究将含有直径小于1微米氢气气泡及溶解态氢气的纳米气泡溶氢水,应用于慢性压迫性损伤大鼠模型。结果显示,纳米气泡溶氢水可减轻坐骨神经损伤、提高缩足阈值与缩足潜伏期、缓解神经及背根神经节的炎症反应与氧化应激损伤,并激活Nrf2/HO-1-硫氧还蛋白还原酶1通路。
4.1 纳米气泡溶氢水改善慢性压迫性损伤大鼠的行为学指标
缩足阈值与缩足潜伏期检测结果证实,纳米气泡溶氢水可缓解慢性压迫性损伤诱导的机械性痛觉超敏与热痛觉过敏。慢性压迫性损伤造模后,单次注射低浓度或高浓度纳米气泡溶氢水均能提高缩足阈值与缩足潜伏期,对机械性痛觉超敏和热痛觉过敏发挥保护作用。上述结果表明,早期给予纳米气泡溶氢水不仅可缓解神经病理性疼痛,还能抑制神经病理性疼痛的进展。此外,高浓度纳米气泡溶氢水重复给药,可进一步增强对机械性痛觉超敏和热痛觉过敏的保护效果。
4.2 纳米气泡溶氢水减轻慢性压迫性损伤大鼠的炎症反应与氧化应激损伤
白细胞介素-1β是一种强效促炎细胞因子,主要由单核细胞、巨噬细胞和树突状细胞分泌,在炎症反应和免疫应答中发挥关键作用(Arbelaez-Bonozo 等, 2024)。白细胞介素-6属于趋化因子家族成员(Lee 等, 2023)。肿瘤坏死因子-α可调控部分免疫细胞功能,参与疾病的发病过程(Tian 等, 2024);同时,肿瘤坏死因子-α可通过细胞膜上的特异性受体向细胞核传递信号,进而促进炎症反应(Tian 等, 2024)。白细胞介素-1β能够诱导白细胞介素-6和肿瘤坏死因子-α释放,还可刺激T细胞活化,引发局部及全身性炎症反应(Li 等, 2022)。
本研究发现,局部注射纳米气泡溶氢水可降低神经及背根神经节中白细胞介素-1β、白细胞介素-6和肿瘤坏死因子-α的水平,同时升高抗炎因子白细胞介素-10的水平,从而抑制炎症反应。这一结果提示,局部注射纳米气泡溶氢水不仅能减轻神经组织的炎症反应,还可下调背根神经节的炎症水平。
氧化应激是指机体在特定条件下,氧化还原平衡被打破,自由基生成量超过机体抗氧化清除能力,导致活性氧在细胞和组织中蓄积,进而引发氧化应激损伤的过程(Zhang 等, 2024)。丙二醛是脂质过氧化损伤的主要产物(Ambe 等, 2024)。8-羟基脱氧鸟苷是反映内源性和外源性因素导致DNA氧化损伤的生物标志物(Lazutka 等, 2024),检测其水平可用于评估体内氧化损伤与修复程度,以及氧化应激与DNA损伤的关联(Lazutka 等, 2024)。
超氧化物歧化酶的主要功能是催化超氧阴离子自由基发生歧化反应,生成过氧化氢和氧气(Sahranavard 等, 2025),是机体内最重要、最有效的自由基清除剂,对维持机体代谢平衡至关重要(Sahranavard 等, 2025)。过氧化氢酶同样是一种重要的抗氧化酶,可催化过氧化氢分解为水和氧气,从而保护细胞免受氧化应激损伤(Zhang 等, 2023)。许多药物的抗氧化应激作用,正是通过提升超氧化物歧化酶和过氧化氢酶的活性来实现的。
本研究表明,局部注射纳米气泡溶氢水可通过提高坐骨神经及背根神经节中超氧化物歧化酶和过氧化氢酶的活性,降低丙二醛和8-羟基脱氧鸟苷的水平,进而抑制氧化应激损伤。这提示局部注射纳米气泡溶氢水既能减轻神经组织的氧化应激损伤,也能抑制背根神经节的氧化应激损伤。
2013年,Chen 等研究发现,鞘内注射富氢水可减轻慢性压迫性损伤大鼠模型的氧化应激损伤,进而缓解神经病理性疼痛(Chen 等, 2013)。2014年,Kawaguchi 等证实,饮用富氢水可通过抑制背根神经节的氧化应激反应,缓解慢性压迫性损伤小鼠模型的痛觉超敏和痛觉过敏症状(Kawaguchi 等, 2014)。2018年,Wang 等报道,腹腔注射富氢水同样能提高慢性压迫性损伤大鼠模型的缩足阈值和缩足潜伏期(Wang 等, 2018)。2022年,Martínez-Serrat 等研究显示,腹腔注射富氢水可抑制慢性压迫性损伤小鼠模型背根神经节的炎症反应和氧化应激损伤(Martínez-Serrat 等, 2022)。
上述研究结果一致表明,氢气具有减轻炎症反应和氧化应激损伤的作用,且不同给药方式会对这一过程产生影响。本研究得出了相似的结论,同时首次证实超声引导下局部注射纳米气泡溶氢水可缓解慢性压迫性损伤大鼠的神经病理性疼痛。
4.3 纳米气泡溶氢水的优势
与鞘内注射、饮水和腹腔注射相比,局部注射纳米气泡溶氢水的疗效更优,且该给药方式更贴近临床常规应用。此外,既往研究多采用持续给药或多次给药的方式(Martínez-Serrat 等, 2022;Wang 等, 2018;Kawaguchi 等, 2014),而本研究发现,纳米气泡溶氢水仅需给药3次,即可对慢性压迫性损伤诱导的神经病理性疼痛产生良好保护作用,这说明纳米气泡溶氢水的疗效具有一定的长期稳定性。本研究还发现,局部注射纳米气泡溶氢水不仅能减轻神经损伤,还可调控背根神经节的蛋白表达,进而缓解疼痛。
本研究还探讨了纳米气泡溶氢水的浓度和给药频率对慢性压迫性损伤模型的影响。首先,高浓度纳米气泡溶氢水在减轻炎症反应、氧化应激损伤、神经损伤,以及缓解机械性痛觉超敏和热痛觉过敏方面的效果,均优于低浓度纳米气泡溶氢水。其次,无论低浓度还是高浓度,早期间断给药3次的保护作用均强于单次给药。上述结果表明,纳米气泡溶氢水对慢性压迫性损伤诱导的损伤的保护作用可能具有剂量依赖性,重复给药可获得更优疗效,且整个实验过程中未观察到不良反应。
4.4 纳米气泡溶氢水的作用机制与Nrf2/HO-1通路相关
核因子E2相关因子2是机体抗氧化防御系统的核心调控因子,参与细胞内多种防御机制相关的信号传导过程(Zeng 等, 2024)。血红素氧合酶1是核因子E2相关因子2的下游靶蛋白,可降解血红蛋白并释放胆绿素、一氧化碳和亚铁离子(Hua 等, 2024)。血红素氧合酶1及其代谢产物可通过抗氧化损伤、调控炎症反应发挥保护作用。当组织或细胞受到损伤刺激或处于应激状态时,血红素氧合酶1可在核因子E2相关因子2的调控下做出应答,表达水平显著上调,进而发挥强效抗氧化作用。完整的Nrf2/HO-1通路可发挥抗氧化、抗炎、维持线粒体稳态、抑制细胞凋亡等多种作用,最终影响疾病结局(Nan 等, 2024)。硫氧还蛋白还原酶1是一种内源性抗氧化蛋白,在细胞内具有重要作用,主要参与蛋白质修复和氧化应激反应,可抵御氧化应激损伤(Wang 等, 2022)。
Firdoos 等研究发现,上调核因子E2相关因子2和血红素氧合酶1的表达,可缓解慢性压迫性损伤大鼠的机械性痛觉超敏和热痛觉过敏,抑制炎症级联反应,并提高抗氧化酶水平(Firdoos 等, 2024)。Zhu 等也证实,慢性压迫性损伤诱导的机械性痛觉超敏、热痛觉过敏、神经炎症和氧化应激,均与Nrf2/HO-1信号通路的抑制有关(Zhu 等, 2023)。2022年,我们团队的前期研究提出,在大鼠肺缺血再灌注损伤模型中,Nrf2/HO-1通路可能通过硫氧还蛋白还原酶1发挥抗氧化和抗炎作用(Wang 等, 2022)。本研究发现,纳米气泡溶氢水可上调Nrf2/HO-1通路及硫氧还蛋白还原酶1的蛋白表达,并缓解慢性压迫性损伤诱导的神经病理性疼痛,这提示纳米气泡溶氢水对慢性压迫性损伤大鼠神经病理性疼痛的保护作用,可能与Nrf2/HO-1-硫氧还蛋白还原酶1通路相关。
5 局限性
本研究存在以下几点局限性。第一,本研究发现纳米气泡溶氢水除了作用于神经组织外,还可调控背根神经节的蛋白表达,但尚未明确其作用于背根神经节的具体机制。我们推测这一现象可能与氢气的高组织渗透性有关。第二,本研究未探讨纳米气泡溶氢水是否选择性作用于与受损神经相关的背根神经节,也未检测L4、L6背根神经节及脊髓中枢的蛋白表达变化情况。第三,本研究未对所有纳米气泡溶氢水样本的氢气浓度进行验证。不过,我们使用实验仪器重复制备了约6份纳米气泡溶氢水样本,其氢气浓度最高可达2600 ppb,该浓度样本用于高浓度组,同批次样本经1倍稀释后(浓度1300 ppb)用于低浓度组。因此,尽管无法保证浓度完全精准达到2600 ppb或1300 ppb,但可确保低浓度组的氢气浓度低于高浓度组。最后,本研究的观察周期仅为14天,且未使用通路抑制剂验证Nrf2/HO-1-硫氧还蛋白还原酶1通路的作用;同时,纳米气泡溶氢水的作用及机制尚未在细胞层面得到证实,上述问题将在后续研究中进一步探讨。
6 结论
超声引导下早期局部注射纳米气泡溶氢水,可通过激活Nrf2/HO-1-硫氧还蛋白还原酶1通路,减轻慢性压迫性损伤大鼠模型的坐骨神经损伤,缓解机械性痛觉超敏和热痛觉过敏症状,并抑制炎症反应与氧化应激损伤。
https://wap.sciencenet.cn/blog-41174-1515593.html
上一篇:少量白藜芦醇与铜有治愈脑胶质母细胞瘤的可能
下一篇:基于自供氢镁增强胶原膜的骨免疫代谢调控用于促进引导性骨再生