近红外驱动的电子转移用于原位凝胶化及强化氢疗
研究亮点
- 近红外光触发的三元聚合物点体系实现了高效析氢。
- 抗坏血酸介导聚乙二醇二丙烯酸酯(PEGDA)水凝胶的原位凝胶化,构建了新型引发体系。
- 杂化水凝胶可实现持续性氢疗与长效活性氧(ROS)清除。
- 该体系的免疫调节作用可促进伤口部位巨噬细胞从M1型向M2型极化。
- 通过近红外光疗增强组织再生,加速糖尿病伤口愈合。
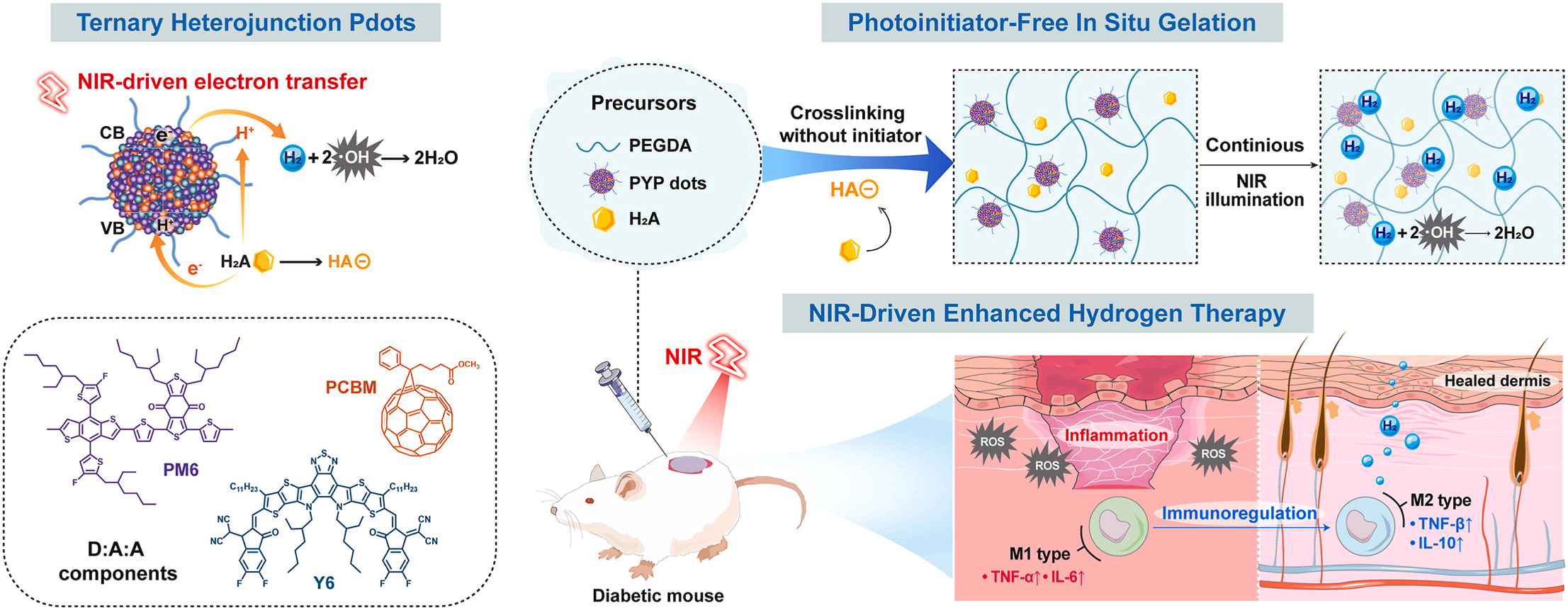
氢疗在缓解氧化应激与炎症、改善伤口愈合方面展现出巨大潜力。然而,其治疗效果受限于氢的递送方式有限以及伤口部位氢的生物利用度不足。本研究设计了一种近红外光触发的原位凝胶化平台,该平台以三元聚合物点为光催化剂、抗坏血酸为电子介质、聚乙二醇二丙烯酸酯(PEGDA)为聚合物基质。相较于二元聚合物点,三元聚合物点(PYP dots)的混合组分实现了更宽范围的光吸收与级联能级排列,显著提高了产氢量。在伤口部位局部注射混合前驱体溶液后,经700nm光照射,抗坏血酸自由基可引发PEGDA的原位凝胶化,无需使用商用光引发剂。所形成的杂化水凝胶能够保留水分与光催化剂,在近红外光照射下实现长时间析氢。通过三元聚合物点催化作用产生的氢,可有效清除伤口部位的活性氧,并促进巨噬细胞从M1型向M2型表型转化。这种光触发平台的免疫调节作用展现出显著的治疗潜力,通过强化氢递送策略加速伤口修复。
参考文章
Zhang, Ziyi, et al. "NIR-Driven Electron Transfer for In Situ Gelation and Enhanced Hydrogen Therapy." Biomaterials (2025): 123822.
该研究论文作者分别来自香港科技大学和南方科技大学。
光响应水凝胶具有优异的生物相容性与可调控特性,已成为光疗[1-3]、组织工程[4-7]及再生医学[8-12]领域的极具潜力的材料。这类水凝胶通常通过短波长光源(紫外光或可见光)触发原位交联制备而成,短波长光可激活商用光引发剂产生自由基,进而实现快速聚合[13-18]。然而,利用紫外光[19,20]与光引发剂[21-24]的光聚合过程可能导致DNA损伤与蛋白质变性,对生物组织造成不可逆伤害。相比之下,近红外光的能量密度低于紫外光与可见光,具有组织穿透性强、生物损伤小的优势,是生物应用中实现光响应材料时空调控的理想光源[25-28]。但目前仅存在少数无需光引发剂、通过近红外光触发聚合构建水凝胶网络的方法[13]。此外,如何增强光响应水凝胶的功能,使其同时应对氧化应激并促进组织修复,仍是亟待解决的问题[29-31]。更关键的是,开发兼具治疗功能与结构交联能力的生物相容性多功能光引发体系,仍是尚未突破的挑战。
氢疗因其独特的抗氧化能力而备受关注,它可选择性地与羟基自由基(•OH)反应,且不会干扰其他由氧化介导的生理过程[32-40]。这一特性能够缓解氧化应激与炎症,从而促进组织再生[41-43]。尽管具备这些优势,氢疗的临床应用仍面临挑战:在生理条件下,氢的水溶性较低,导致伤口部位氢的生物利用度受限,进而制约了治疗效果[44-48]。基于有机聚合物点(Pdots)的光催化体系在产氢方面展现出巨大潜力[49,50],该体系具有高吸收系数[34]、可调控光学带隙[51,52]及优异治疗效果[53]等优点。然而,这些光催化体系的临床转化面临实际障碍。为实现持续性光催化产氢,亟需开发以水凝胶为储库的体系——水凝胶可提供稳定的水分供应,并确保光催化剂有效递送至伤口部位,从而提升治疗性能。
本研究开发了一种近红外驱动的聚合物点-抗坏血酸反应体系,构建了新型、生物相容性良好的多功能光引发范式(方案1)。与依赖惰性商用光引发剂的传统方法不同,PYP点(三元聚合物点)与抗坏血酸协同构成了原位生成的光引发体系:该体系不仅能高效产氢以清除细胞内羟基自由基,还可通过光电化学转化引发聚乙二醇二丙烯酸酯(PEGDA)水凝胶的原位交联。这种双功能体系具有以下优势:(1)光催化组分与引发组分均具备内在生物相容性;(2)治疗与凝胶化过程一体化——凝胶化过程与产氢过程内在耦合,可同时实现结构形成与活性氧清除治疗;(3)通过近红外光触发按需凝胶化,实现时空调控。为实现上述功能,研究首先制备了以PM6为给体、Y6与PC71BM为级联受体的三元聚合物点(PYP dots)。与二元聚合物点相比,这种三元混合策略实现了更长波长的光吸收与更高的析氢反应(HER)速率。抗坏血酸(H₂A)具有双重功能,作为牺牲电子供体(SED)与抗坏血酸自由基前体被引入反应体系。在近红外光照射PYP点后,所产生的空穴将少量抗坏血酸转化为抗坏血酸自由基(浓度为63.47nM),该自由基可在30秒内快速引发PEGDA交联。原位凝胶化后,杂化水凝胶(PYP dots-Gel)可物理性保留水分与光催化剂。作为伤口敷料,PYP dots-Gel在700nm光(功率密度为50mW/cm²)照射下可实现长效强化氢疗,该波长处于光生物调节治疗窗口内,同时可避免热损伤。通过小鼠全层皮肤缺损模型验证了该体系的治疗效果:胶原蛋白再生增强、上皮再形成加速、血管生成增多,均证明伤口愈合得到促进。伤口部位活性氧清除能力显著推动巨噬细胞向M2型极化,促使伤口从炎症状态向增殖状态转变。这种近红外响应平台为氢递送提供了新策略,推动了光催化伤口治疗的发展。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1508601.html?mobile=1
收藏

