 精选
精选
隐藏的大脑连接网络:细胞间纳米管
在多细胞生物中,细胞间通讯至关重要。细胞可通过直接接触(借助配体-受体相互作用)、释放细胞外囊泡及可扩散信使分子等方式进行通讯[1]。除此之外,还存在一种更难以捕捉的细胞间连接形式——能够实现离子、蛋白质及细胞器直接传递的薄 membranous 桥[2]。这类结构被称为隧道纳米管(tunneling nanotubes, TNTs),已被证实可连接免疫细胞[3]、癌细胞[4]及干细胞[5]等多种细胞类型[6]。然而,哺乳动物大脑中是否存在此类结构,长期以来难以证实。在本期杂志第43页,Chang等人[7]报道了在小鼠和人类脑组织中观察到的树突纳米管(dendritic nanotubes, DNTs)。这种以肌动蛋白为主要成分的纤细突起可在神经元间形成连接桥,不仅能传递钙信号,还可转运阿尔茨海默病(Alzheimer’s disease, AD)病理过程中的关键蛋白——β淀粉样蛋白(amyloid-β, Aβ)。这一发现表明,当前对大脑组织结构的认知可能并不完整,我们或许忽略了一层隐藏的连接网络。
斑马鱼原肠胚(早期胚胎)相关研究为体内隧道纳米管网络的存在提供了证据[8],但这类观察得益于斑马鱼胚胎的光学透明特性。在哺乳动物大脑中观察纳米管则面临诸多挑战:这类结构直径极细(仅数百纳米)、通常脆弱易断、可能具有瞬时性,且缺乏独特的分子标志物。传统显微镜技术极易遗漏它们,尤其是当它们嵌入密集的神经元网络中时。Chang等人通过结合超分辨径向波动成像、体积反卷积及优化的组织制备方法,成功克服了这些限制。这些技术不仅能在高分辨率下呈现神经元结构,还能保留作为纳米管主要成分的肌动蛋白纳米结构。借助这些工具,并使用F-肌动蛋白荧光探针,研究人员在体外培养的皮质神经元及小鼠离体皮质组织中观察到了纳米管连接桥。这些连接桥从树突丝状伪足(树突上的纤细突起)延伸而出,与邻近神经元的树突相连。
树突纳米管在概念层面的突破性意义在于,它拓展了已知的神经元间通讯方式。已有研究表明,隧道纳米管可在多种场景下促进细胞间通讯。例如,小胶质细胞和星形胶质细胞(两种非神经元脑细胞)可通过隧道纳米管在细胞间或与神经元之间共享蛋白质和细胞器[9,10]。Chang等人的研究发现,神经元中的树突纳米管比典型的隧道纳米管更短(约3微米,而典型隧道纳米管超过10微米),但由于树突本身可延伸数百微米,树突纳米管仍能有效实现神经组织内的长距离通讯。功能上,树突纳米管既能传递电信号(通过钙流动),也能转运分子量达10千道尔顿(kDa)的分子货物。这种多功能性让人联想到突触、囊泡及缝隙连接(介导相邻细胞间小分子交换的通道),但树突纳米管与这三者均存在本质区别(见图)。它们具有动态性和瞬时性(持续数分钟至数小时),且不受限于特定的接触位点,能够形成灵活的网络,从而增加突触连接及神经元通讯的复杂性。
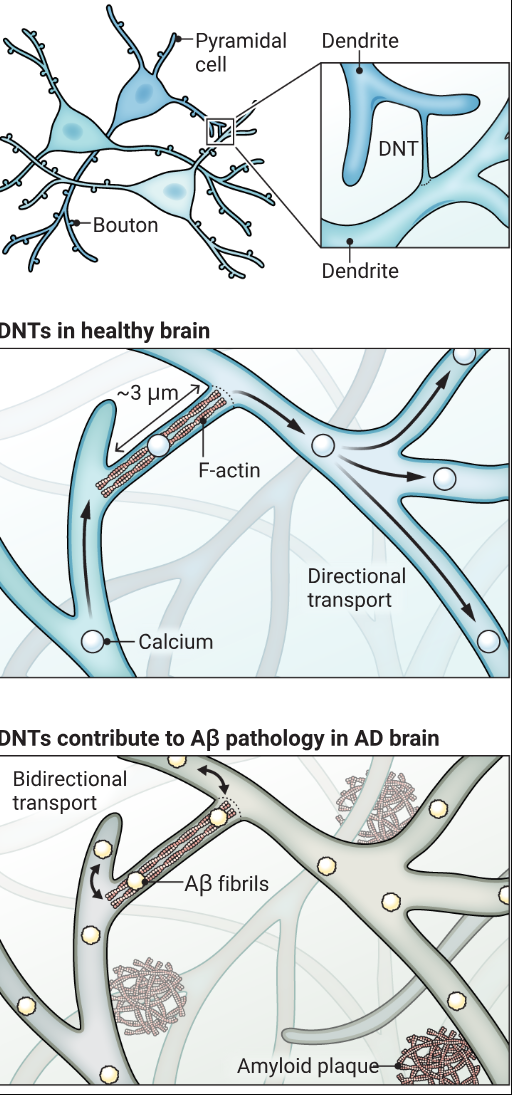
神经元间的“桥梁”
富含F-肌动蛋白的短树突纳米管(DNTs)可连接相邻锥体细胞的树突,既能传递钙信号,也能转运分子货物。例如,在阿尔茨海默病小鼠模型中,树突纳米管可促进神经元间β淀粉样蛋白(Aβ)的转运。
(图示:A. 马斯廷/《科学》杂志)
Chang等人的研究还提供了树突纳米管与阿尔茨海默病相关的证据。在阿尔茨海默病小鼠模型中,仅3月龄小鼠的内侧前额叶皮质中树突纳米管的连接性就已增强——这一时间点远早于淀粉样蛋白斑块(阿尔茨海默病中观察到的毒性Aβ细胞外聚集物)的出现。在前额叶皮质内,研究人员观察到Aβ可通过树突纳米管在神经元间双向传播,而用药物破坏肌动蛋白丝后,这种转运过程会被阻断。作者通过计算机模拟验证了这一体内观察结果,模拟结果进一步支持树突纳米管在Aβ扩散中的作用。这些发现引出了一个矛盾:Aβ在细胞间的扩散可能会稀释毒性负荷,这与此前体外研究中“小胶质细胞纳米管可重新分布α-突触核蛋白和tau蛋白的有害聚集物”的结论一致[10];反之,树突纳米管介导的Aβ转运也可能将毒性蛋白传递到原本未受影响的神经元,从而加速病理扩散。有趣的是,Chang等人发现低浓度Aβ可促进纳米管形成,而高浓度Aβ则会抑制其形成。这会形成一个病理性反馈循环:树突纳米管的减少会加剧细胞内Aβ的积累,而Aβ的积累又会进一步降低纳米管的连接性。因此,根据生理或病理环境的不同,纳米管可能是“盟友”,也可能是“敌人”。
树突纳米管的作用远不止于阿尔茨海默病。其传递钙信号的能力表明,存在一种非突触电耦合形式,这种形式可能调节局部神经环路的活性。由于树突纳米管起源于树突丝状伪足,它们或许能连接相邻的树突区域,使神经元能通过突触之外的途径共享信息。如果树突纳米管也能像其他体外模型中的隧道纳米管那样[10,11]在神经元与神经胶质细胞间形成,那么它们可能介导代谢支持或细胞器转运——这些可能性仍有待探索。对神经科学领域而言,这一发现强调,大脑连接组(大脑中所有神经连接的完整图谱)绝非仅由突触构成的“接线图”[12]。一个真正全面的连接图谱现在应包含这种瞬时存在、纳米尺度的连接——它们的出现与消失为大脑增添了时间尺度从数分钟到数小时的可塑性。更广泛地说,纳米管的存在揭示了一个原理:无论是否存在完全的细胞质连续性,不同组织中的细胞(从免疫细胞到上皮细胞再到神经细胞)都具备某种形式的细胞质交换能力。
目前仍有许多未知之处亟待探索:树突纳米管缺乏特异性分子标志物,难以通过遗传学或生物化学手段追踪;在完整的哺乳动物脑组织中进行实时成像仍面临挑战;其货物转运的选择性(是否优先转运特定蛋白质、RNA或细胞器)尚不明确;尽管Chang等人在小鼠和人类皮质中观察到了树突纳米管,但它们在衰老和疾病过程中的分布规律仍未知。技术进步将是解决这些问题的关键:可遗传编码的报告基因(如标记F-肌动蛋白或特定膜结构域的报告基因)有望揭示纳米管的动态变化;自适应光学技术可改善成像过程中的光畸变和像差;先进的多光子显微镜或许能捕捉到体内纳米管的活动[13]。正如Chang等人所展示的,计算机建模有助于研究人员理解树突纳米管在淀粉样蛋白病理扩散中的作用,但仍需进一步优化以预测体内扩散动力学。将纳米管连接纳入系统神经科学研究,可能会揭示树突纳米管是否影响神经元放电模式、振荡活动或神经环路可塑性。
Chang等人的发现使纳米管成为神经生物学领域中具有明确功能的“参与者”。隧道纳米管与树突纳米管共同构成了细胞间通讯的“第四支柱”,与突触、缝隙连接及细胞外囊泡并列。它们的存在重新定义了连接组的边界,也挑战了“仅突触决定神经元连接方式”的传统观念。在疾病生物学层面,树突纳米管既揭示了病理扩散与积累的机制,也为干预治疗提供了潜在靶点。调控纳米管动态是否能延缓神经退行性病变?或者反过来,能否通过增强纳米管功能促进有益交换(如线粒体或溶酶体转运)?这些问题已不再是纯粹的推测,而是可通过实验验证的假说。树突纳米管的发现表明,即便在研究最为深入的器官中,仍有隐藏的网络等待我们去探索。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1504846.html?mobile=1
收藏

