未来人类靠喝西北风生存的假说!?
本文要点
1. 氢氧化细菌(HOBs)可通过气体发酵将二氧化碳(CO₂)、氢气(H₂),甚至可能将氮气(N₂)转化为生物量,为实现粮食生产与农业脱钩提供了可能。
2. 已有研究表明,在多种微生物菌种和气体类型下,工业化规模的气体发酵均具有可行性。
3. 随着合成生物学工具的日趋成熟、环境问题的日益紧迫,以及消费者偏好随之发生的转变,用于新型食品精准发酵的工程微生物菌株开发正逐步推进。
4. 将工业化规模的气体发酵能力与最先进的精准发酵技术相结合,有望推动气体精准发酵工艺的发展。
5. 若学术界与工业界能重点开发氢氧化细菌相关工具,并提升气体发酵能力,将极大促进相关产品的研发与商业化进程。
摘要
地球九个安全边界出现六大突破凸显可持续粮食生产的必要性(九个安全边界分别是气候变化、生物多样性损失、生物地球化学流动(氮磷循环)、平流层臭氧消耗、海洋酸化、淡水利用、土地利用变化、大气气溶胶负载和化学污染。)。
好氧氢氧化细菌(HOBs)可通过气体发酵将大气中的二氧化碳(CO₂)与绿氢(H₂)转化为生物量,该工艺已应用于食品级单细胞蛋白的生产。这种方法能够构建独立于农业的供应链,所需土地和水资源极少,且具备实现碳中和生产与碳捕获的潜力。
若要突破单细胞蛋白的应用局限,需将氢氧化细菌改造为适用于精准发酵的细胞工厂。合成生物学、代谢工程、计算建模及生物反应器设计等领域的技术进展,已加速了可规模化生物工艺的开发,为气体发酵提供了技术蓝图。本文以分泌型重组乳蛋白为案例,阐述了该技术方向的发展路径,并着重指出了其中的关键挑战与机遇。
Bernal-Cabas M, Kumar K, Terpstra O, van den Bogaard S, Ammar AB, Mäkinen S, Herwig L, de Almeida M, Tervasmäki P, Blank LM, Alter TB, Billerbeck S. Food production from air: gas precision fermentation with hydrogen-oxidising bacteria. Trends Biotechnol. 2025 Sep 9:S0167-7799(25)00321-X.
题目:工业化规模气体发酵的可行性:一种脱离农业的替代食品供应链
据预测,到2080年全球人口将超过103亿[1],而九大地球安全边界(参见术语表)中已有六项被突破[2]。因此,在应对环境挑战的同时确保全球人口的充足粮食供应,已成为至关重要的议题。这一挑战的核心在于满足人类对蛋白质日益增长的消费需求——预计到2050年,全球蛋白质需求量将较当前产量增长40%[3]。
目前,全球消费的蛋白质几乎全部通过传统农业生产获得,包括种植作物以提供植物源蛋白质,以及种植饲料用于畜牧业(参见专栏1)。传统农业贡献了全球37%的温室气体排放,且因消耗大量耕地和淡水,给环境带来了沉重负担[4,5]。
专栏1:替代蛋白质的生产方案及其当前对耕地的依赖
由于蛋白质需求的增长以及地球生态健康面临的挑战,蛋白质来源已从以畜牧业为主的食物链向多元化方向发展,新增了三类主要的替代蛋白质:植物源替代蛋白、微生物源替代蛋白,以及培养肉与培养海鲜。理论上,每种替代蛋白质生产方案在完全优化后,与传统蛋白质生产相比,对地球生态健康的负担都更小。本专栏将气体精准发酵纳入其他替代蛋白质生产方案的框架中进行分析,并指出它们在农业需求(进而在耕地使用)方面的差异。
1. 植物源替代蛋白
通过直接加工大豆、坚果、豌豆、小麦等高蛋白植物原料生产而成。豆腐、丹贝等植物源蛋白产品已消费数百年,且在2023年,植物源产品在替代蛋白领域占据了最高的市场份额(超过88%)[23]。该生产过程依赖农业种植作物,因此植物源替代蛋白产品需要消耗耕地。
2. 培养肉
通过在发酵罐中培养动物细胞来生产肉类,无需饲养活体动物。动物细胞需要葡萄糖或其他高度还原的糖类作为原料,而这些原料目前主要来源于甘蔗、甜菜等作物。这些作物依赖农业种植,因此培养肉生产同样需要消耗耕地。尽管非医药级培养基底物的开发已取得进展,但动物细胞培养所用培养基的成本,仍是制约培养肉产业发展的主要瓶颈。
3. 发酵源微生物蛋白
通过在大型发酵罐中大规模培养丝状真菌、酵母、细菌、藻类等微生物,生产富含蛋白质的生物量(即单细胞蛋白,属于生物量发酵);此外,也可通过改造微生物,使其定向生产目标蛋白质或其他功能性成分(即精准发酵)。在替代蛋白领域,微生物蛋白的市场份额仅次于植物源蛋白,占比超过8%[23]。
根据微生物细胞的营养利用能力,发酵工艺可使用第一代(1G)至第三代(3G)原料。例如,奎奴亚藜®(Quorn®)等真菌蛋白,是利用第一代(糖类)和第二代(农业废弃物)原料培养丝状真菌菌丝体获得的[78];目前,通过改造酵母或细菌进行精准发酵生产的微生物源乳制品或蛋类替代品,同样依赖来源于农业种植的第一代(糖类)和第二代(农业废弃物)原料[4]。
与之不同的是,藻类蛋白(通过对螺旋藻属、小球藻属等高蛋白微藻进行生物量发酵生产[79])可利用第三代原料(CO₂),以光能为能量来源进行生产——这得益于藻类的光合自养特性。因此,与气体精准发酵类似,藻类蛋白的生产无需依赖农业种植和耕地。
鉴于每种生产工艺的复杂性,以及食品系统的整体复杂性,不同替代蛋白生产方案应被视为互补而非竞争关系。良好食品研究所(Good Food Institute)提供了关于各类工艺及产品的最新信息iv。
已有多家企业和研究联盟率先将氢氧化细菌(HOBs)的工业化规模发酵技术应用于食品生产(参见表1)。为缓解这一迫在眉睫的危机,利用细菌、酵母或真菌进行微生物发酵,已成为一种更可持续的食品(尤其是蛋白质)生产方式(参见专栏1)[6]。奎奴亚藜®(Quorn®)便是微生物蛋白产品的典型代表,其原料为拟分枝孢镰刀菌(Fusarium venenatum),该产品已上市40年,充分证明了微生物蛋白替代品在经济上的可行性[6]。
数十年间,微生物发酵技术已在食品领域之外产出了众多实际产品(例如利用细菌和酵母生产胰岛素[7,8]、生产生物乙醇[9]),这些产品所属市场规模庞大,目前价值已达数百万欧元——这一事实进一步证实了“通过发酵生产食品”这一理念的可行性。此外,在学术界和工业界,通过天然微生物或代谢工程改造的微生物细胞工厂,还生产出了无数与食品和非食品相关的产品,如氨基酸、食品工业用酶、抗生素、维生素、香精、脂肪、抗体及材料前体等[10]。
表 1 积极开发基于氢氧化细菌(HOBs)的食品生产平台的企业及研究联盟列表 a,b
类别 | 名称 | 所在地 | 成立时间 | 产品 | 商业模式 / 资助方 | 所用微生物 | 链接 |
企业 | UCDI(二氧化碳利用研究所株式会社) | 日本 | 20 世纪 70 年代 | 蛋白质、燃料、塑料及其他产品 | 企业对企业(B2B) | 无数据(N/A) | v |
Avecom | 比利时 | 1995 年 | 供人类和动物食用的单细胞蛋白(SCP) | 企业对企业(B2B) | 无数据(N/A) | vi | |
蓝晶生物(LanzaTech) | 美国 | 2005 年 | 供人类食用的单细胞蛋白(SCP) | 企业对企业(B2B) | 富养罗尔斯通氏菌(Cupriavidus necator) | vii | |
Unibio | 丹麦 | 2011 年 | UniProtein® 单细胞蛋白(SCP)(水产饲料用) | 企业对企业(B2B) | 无数据(N/A) | viii | |
太阳能食品公司(Solar Foods) | 芬兰 | 2017 年 | Solein® 单细胞蛋白(SCP)(供人类食用) | 企业对企业(B2B) | 黄色杆菌属(Xanthobacter sp.) | ix | |
Novonutrients | 美国 | 2017 年 | 供人类和动物食用的单细胞蛋白(SCP) | 企业对企业(B2B) | 无数据(N/A) | x | |
空气蛋白公司(Air Protein) | 美国 | 2019 年 | 供人类食用的单细胞蛋白(SCP) | 企业对消费者(B2C) | 富养罗尔斯通氏菌(Cupriavidus necator) | xi | |
AerBio | 荷兰 | 2024 年 | Proton™单细胞蛋白(SCP)(动物食用) | 企业对企业(B2B) | 无数据(N/A) | xii | |
Jooules | 新西兰 | 2021 年 | 单细胞蛋白(SCP) | 企业对企业(B2B) | 无数据(N/A) | xiii | |
Econutri | 奥地利 | 2021 年 | 供人类和动物食用的单细胞蛋白(SCP) | 企业对企业(B2B) | 富养罗尔斯通氏菌(Cupriavidus necator) | xiv | |
研究联盟 | 以二氧化碳(CO₂)和氢气(H₂)为原料、基于氢氧化细菌开发创新性生物制造技术的联盟 | 日本 | 2023 年 | 化工产品 / 替代蛋白 | 双日株式会社(Sojitz Corporation)、电力中央研究所(CRIEPI)、绿地球研究所株式会社(Green Earth Institute Co., Ltd.)、DIC 株式会社(DIC Corporation)、东丽株式会社(Toray Industries, Inc.)、大赛璐株式会社(Daicel Corporation) | 无数据(N/A) | xv |
HYDROCOW(通过改造氢氧化细菌将二氧化碳转化为乳清蛋白的联盟) | 欧洲 | 2023 年 | 乳蛋白 | 欧洲创新委员会(European Innovation Council) | 黄色杆菌属(Xanthobacter sp.) | xvi | |
HERO(利用氢氧化细菌将二氧化碳转化为蛋白质的联盟) | 欧洲 | 2024 年 | 单细胞蛋白(SCP)及食品蛋白 | 北欧能源研究机构(Nordic Energy Research) | 混浊红球菌(Rhodococcus opacus) | xvii | |
UNICO2RN | 欧洲 | 2025 年 | 替代蛋白 | 欧洲循环生物基联合机构(Circular Bio-based Europe Joint Undertaking, CBE-JU) | 无数据(N/A) | 无数据(N/A) |
注:a 缩写说明:B2B(企业对企业)、B2C(企业对消费者)、N/A(无数据)、SCP(单细胞蛋白);b 该列表基于广泛的在线检索整理而成,可能存在遗漏。
在水资源利用、土地利用和温室气体排放方面,这类微生物发酵能否优于或至少持平于以农业为基础的食品生产,在很大程度上取决于原料。根据可发酵碳源的来源及其历史用途,原料被划分为不同类别 [11,12]。值得注意的是,历史上原料分类并未考虑氮源,但近年来氮源在可持续性评估中受到了更多关注 [12]:
第一代(1G)原料:指来源于甘蔗、玉米等粮食作物的简单糖类(如葡萄糖)中的碳。这类原料依赖农业生产,因此在可持续性方面优势甚微,甚至会与农业食品生产形成直接竞争。
第二代(2G)原料:碳源来源于木质纤维素类生物质(如农业废弃物、林业生物产品),其可持续性和循环性有所提升,但仍需消耗耕地 [13-15]。
第三代(3G)或下一代原料:碳源来源于非耕地资源(如海藻生物质),且包括一碳气体(C1 气体)。从设计上看,这类原料不会与粮食作物竞争,也不依赖耕地。气体类第三代原料包括二氧化碳(CO₂)、甲烷(CH₄)以及合成气 [一氧化碳(CO)与氢气(H₂)的混合物] 等。在适宜的能量来源(如阳光、氢气、电力)提供还原力的情况下,多种天然或工程微生物可利用这些气体合成生物量 [16-18]。第三代原料与循环原则高度契合,有望实现净零排放甚至负碳排放过程 [19,20]。
目前,大多数用于食品和非食品领域的工业化规模微生物发酵,仍依赖第一代和第二代原料。在过去一个世纪中,历史和经济因素推动了基于第一代、第二代原料的发酵技术创新,最终实现了广泛的商业化规模化应用 [6,16]。相比之下,解决第三代气体类微生物发酵规模化过程中固有的挑战,所获关注较少:气体溶解度低导致传质效率低下;爆炸性气体混合物(如氢气 / 氧气混合物)相关的安全问题仍未解决 [3,20,21];化能自养生物将一碳化合物同化到生物量中的过程本身速度较慢,导致其生长速率偏低 [22]。
然而,在紧迫的可持续发展目标推动下,加之消费者对替代型(微生物来源)蛋白质的态度逐渐转向积极 [23],已有多家企业率先进入商业化气体发酵领域,证明了该技术在不同气体类型和产品类型下的规模化潜力 [17,20,24]。例如,源自新西兰、总部位于美国的蓝晶生物(LanzaTech)公司,率先利用产乙酸菌(如自产乙醇梭菌,Clostridium autoethanogenum)等微生物,实现了非食品相关分子的工业化规模厌氧合成气发酵 [25]。其生产的生物基乙醇,以及即将推出的丙酮、异丙醇等更多产品,可直接替代石油衍生产品,用作燃料和材料前体 [19,26-28]。此外,美国 Calysta 公司已将基于甲烷(CH₄)的好氧发酵规模扩大至 40 万升,用于生产单细胞蛋白(该术语指生物量发酵产品,即天然菌株的可食用干燥生物量为最终产品),并将其作为水产饲料商业化 i。
对我们关注的食品生产而言,最重要的进展是:2024 年,芬兰太阳能食品公司(Solar Foods)将基于二氧化碳(CO₂)和氢气(H₂)的好氧气体发酵规模扩大至 2 万升,利用从波罗的海分离出的新物种 —— 氢氧化细菌黄色杆菌属(Xanthobacter sp.)SoF1,生产食品级单细胞蛋白 Solein®ii。目前,Solein® 已在美国获得 “一般公认安全”(GRAS)自我认证,并在新加坡获得新型食品许可 iii。
随着新一代基于第一代、第二代原料的新型食品即将上市,消费者接受度可能会进一步提高,这将有助于解决监管层面的挑战,进而为气体精准发酵产品进入市场提供助力。尽管消费者接受度的提升仍处于起步阶段,但越来越多的研究开始细致评估消费者对微生物食品的抵触情绪和担忧,为未来解决这些问题铺平了道路 [30,31]。
构建不依赖农业的多样化食物链需具备气体精准发酵能力
这种可规模化生产供人类食用的食品级单细胞蛋白的工业化产能,标志着人类在构建“脱离农业的替代食物链”进程中迈出了重要一步。然而,若要打造一个能够稳定供应各类美味健康食品的韧性供应链,仅依靠单细胞蛋白远远不够,实现产品多样化至关重要。
在第一代(1G)和第二代(2G)原料领域,精准发酵技术——专指利用微生物细胞工厂生产食品成分的技术——已能产出多样化的微生物食品产品,如香精、脂肪、维生素、色素和蛋白质等,这些产品有望替代传统农业来源的同类产品[6]。目前,众多学术实验室和初创企业正积极探索相关概念验证与商业化落地[6]。企业尤其关注乳制品蛋白和蛋类蛋白的生产[4],这既存在市场需求,也具备可持续性优势:当前乳蛋白消费占全球蛋白质消费的12%[32],但其生产过程消耗的耕地面积和淡水量却远超合理比例[33]。
迄今为止,基于气体的精准发酵尚未得到广泛探索。但如今,气体发酵与细胞工程领域的关键技术已日趋成熟,足以降低学术界和工业界在“零碳食品生产工艺”研发过程中的风险。
具体而言,合成生物学领域数十年的研究为微生物改造奠定了坚实基础,这些知识可用于成功改造“能发酵气体的非模式微生物”。例如,蓝晶生物(LanzaTech)便基于合成生物学原理,将非模式产乙酸菌改造为生产燃料和蛋白质的细胞工厂[19,34]。
因此,将当前已成熟的工业化规模气体发酵能力,与最先进的合成生物学技术相结合,可为开发“用于生产新型食品成分的气体精准发酵工艺”注入动力。这类新型食品成分可包括香料、香精、维生素等——此前已有研究在革兰氏阴性菌中实现了这些成分的生产[35,36],未来有望通过改造氢氧化细菌(HOBs),将其拓展至精准发酵工艺中。
本文以“利用改造后的氢氧化细菌分泌乳蛋白”为例,阐述基于气体的精准发酵工艺的开发路径,说明选择该案例的原因、论证技术可行性,并重点指出关键挑战及应对方案。
改造氢氧化细菌,实现乳蛋白的气体精准发酵
目前,已有多家初创企业在第一代/第二代原料精准发酵领域探索乳蛋白(乳制品蛋白)生产[4],且乳蛋白已能在革兰氏阴性菌中实现表达(参见专栏2)。因此,该领域已积累了关于商业可行性和下游加工的相关知识。尽管仍需解决若干关键挑战,但基于气体(空气成分)的乳蛋白生产模式,有望在可持续性方面实现重大突破。
专栏2 前沿进展:革兰氏阴性菌分泌乳蛋白的研究现状
乳蛋白的精准发酵
牛奶由多种经过翻译后修饰的蛋白质构成(见图I),每种蛋白质都具有独特的营养价值、健康益处和食品质构功能[4,80]。
在精准发酵过程中,乳蛋白既可以在微生物细胞内表达,也可以被分泌到细胞外——分泌型表达所需的下游加工流程更简单。目前,真核真菌里氏木霉(*Trichoderma reesei*)中β-乳球蛋白的表达量最高[46]。
革兰氏阴性菌分泌乳蛋白的挑战
革兰氏阴性菌需跨越内、外两层细胞膜分泌蛋白质,这一过程依赖多种复杂的分泌系统。在大肠杆菌(*Escherichia coli*)中,通用分泌途径(Sec途径)、双精氨酸转运途径(Tat途径)以及I型、II型、III型、V型分泌系统已被广泛用于异源蛋白质分泌,据报道部分蛋白产量可达至少6 g/L[60,81,82]。然而,这些分泌系统具有高度的底物特异性,要求蛋白质在周质空间或细胞外能正确折叠,因此相关系统的改造一直是研究热点。此外,还需筛选能引导蛋白质靶向特定分泌机制的信号肽——这类信号肽的适用性会因菌种和底物不同而存在差异[83]。
蛋白质跨越细胞膜的方式主要有两种:一种是通过I型或III型分泌系统,一步完成跨内、外膜转运[82]。例如,I型分泌系统已被多次用于异源蛋白质转运,但产物浓度通常仅在100 mg/L量级[84];另一种是两步转运:首先通过Sec途径或Tat途径将蛋白质从细胞质转运至周质空间,再通过II型或V型分泌系统将其转运至外膜[82]。在某些情况下,通过化学或基因手段破坏外膜稳定性,可使蛋白质渗漏到细胞外环境中。
第二个关键挑战在于乳蛋白的翻译后修饰——这是乳蛋白发挥功能的关键,但在原核生物系统中难以实现[85]。例如,酪蛋白含有1-13个磷酸化位点,其中κ-酪蛋白还含有0-6个糖基化位点[86]和2个二硫键[87];α-乳白蛋白含有4个二硫键和1个磷酸化位点[88,89];而β-乳球蛋白仅含2个二硫键,因此成为原核生物合成中最具潜力的乳蛋白[85]。
实现乳蛋白分泌的策略
实现乳蛋白高效分泌的第一步,是确保其在细胞内的高表达量。目前,所有主要的牛乳蛋白均已能在大肠杆菌中实现胞内表达:αs1-酪蛋白和β-酪蛋白的产量分别可达1 g/L和10 g/L,但均未经过翻译后修饰[90,91]。迄今为止,仅有一篇文献报道了大肠杆菌分泌乳蛋白(αs1-酪蛋白)的案例[92]。不过,我们可从其他真核蛋白质的高效分泌研究中汲取经验,例如Vh抗TNFR1结构域抗体(产量6 g/L)、水蛭素(产量3.1 g/L)[49]以及抗溶菌酶Fab片段(产量1.5 g/L)[49]的分泌研究。这些案例均采用了“Sec周质信号肽+外膜 destabilization渗漏”策略。该策略对β-乳球蛋白的分泌尤为适用,因为β-乳球蛋白的二硫键可在周质空间中形成。
在自养生长条件下,富养罗尔斯通氏菌(*Cupriavidus necator*)也通过“Sec周质信号肽+膜渗漏”策略实现了α-淀粉酶的分泌,产量达236 mg/L——这表明该策略适用于氢氧化细菌[93]。由于Sec途径在细菌中高度保守,这种分泌策略可能也适用于其他氢氧化细菌[94]。
此外,通过I型分泌系统实现“从细胞质到周质空间的一步转运”是另一种可行方案。尽管I型分泌系统在不同菌种间不保守,但已知的“I型分泌系统/分泌肽”组合已被多次跨菌种异源表达。然而,I型分泌系统无法支持二硫键形成,这可能使其难以用于需要复杂折叠的乳蛋白分泌[95-97]。
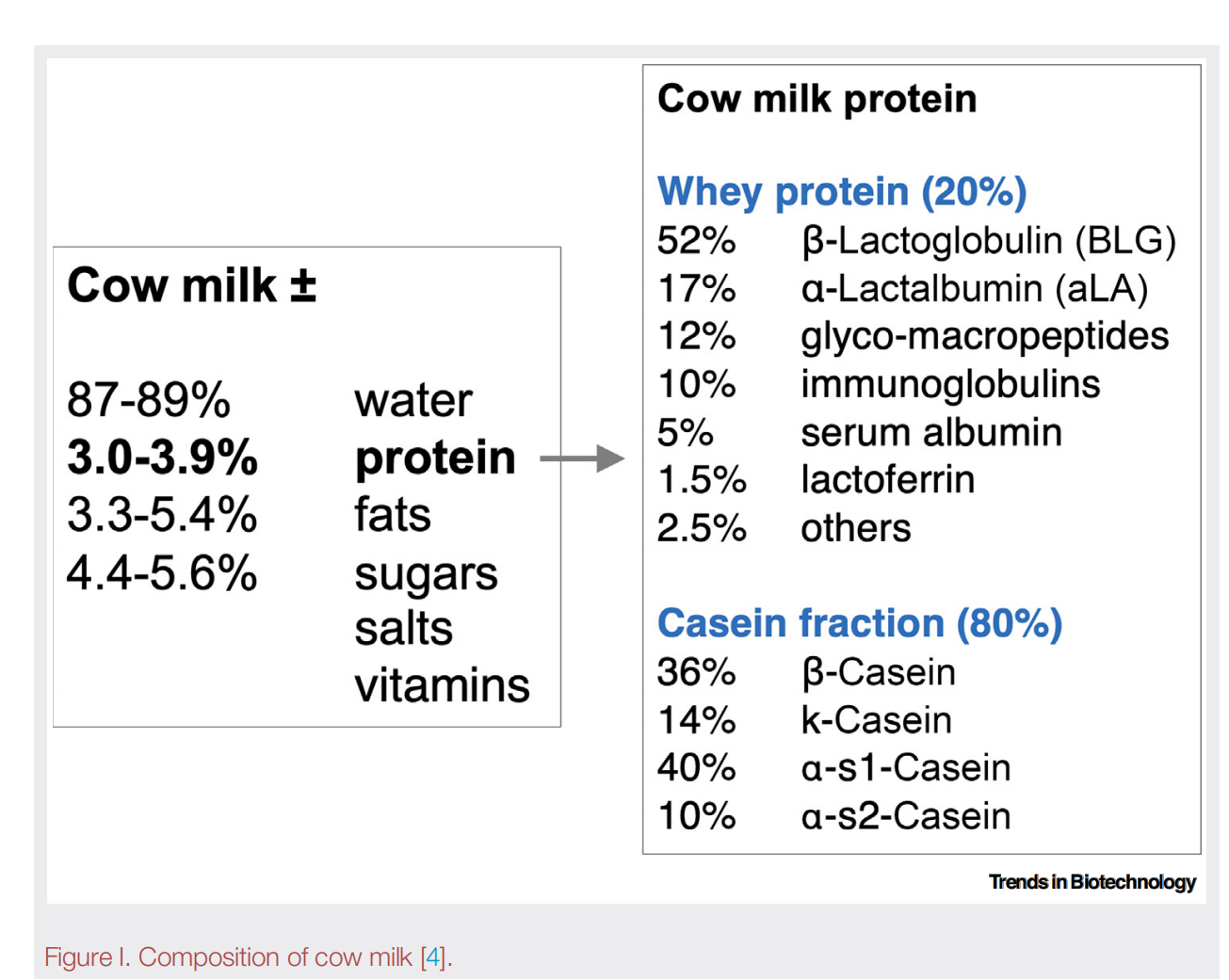
图I 牛乳成分构成[4]
发展机遇
氢氧化细菌(HOBs)可利用空气组分生长:好氧氢氧化细菌(又称“爆鸣气细菌”)是一类进化上具有多样性的微生物,多为革兰氏阴性菌。这类细菌通过卡尔文-本森-巴沙姆循环(Calvin-Benson-Bassham cycle)同化二氧化碳(CO₂),并借助可溶性与膜结合型氢化酶(以氧气为最终电子受体氧化氢气)获取能量。这一特性使其可在生物反应器中培养,只需对氢气(H₂)、氧气(O₂)和二氧化碳(CO₂)的供应进行可控调节即可。值得注意的是,厌氧氢氧化细菌同样存在[37],但由于厌氧培养存在技术挑战,本文暂不对此类细菌展开讨论。
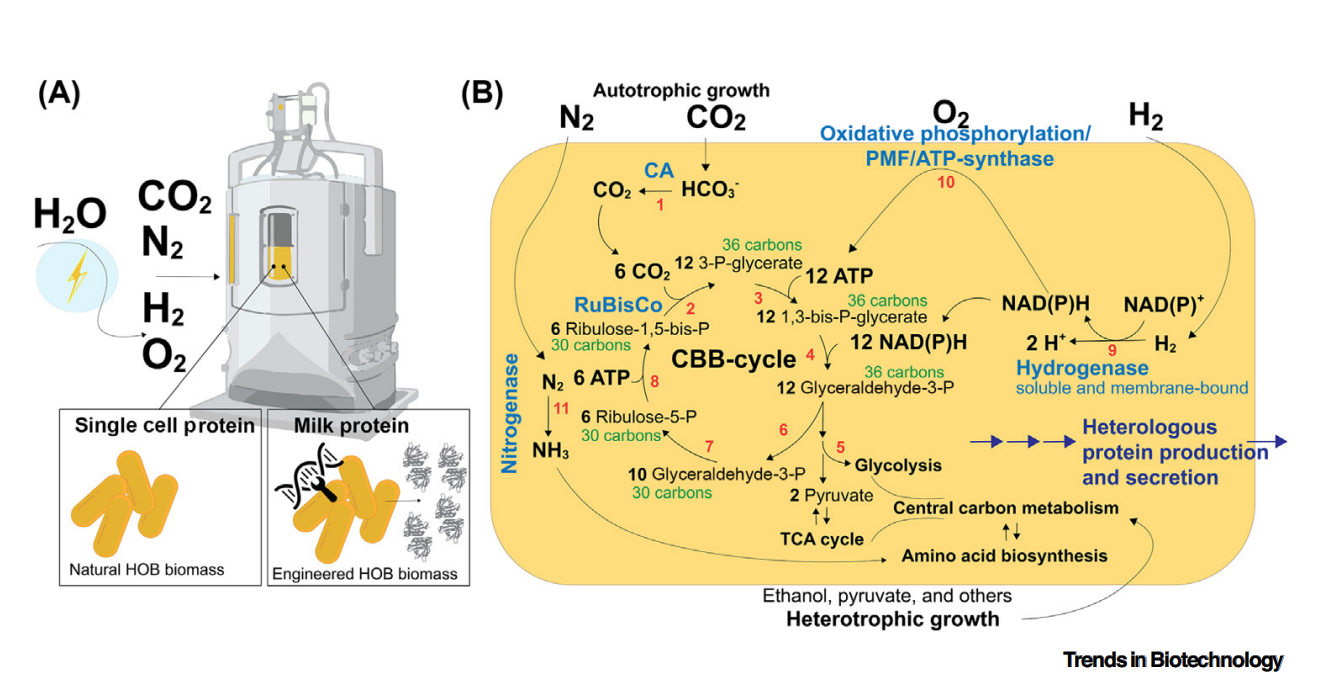
图1 气体发酵生产食品的流程
自20世纪60年代起,氢氧化细菌来源的蛋白质就被视为可行的膳食蛋白质替代品[38]。现有生命周期分析证实,利用氢氧化细菌生产蛋白质对环境的影响,低于所有已评估的植物源或动物源参考蛋白产品——尤其是当采用可再生能源电解水制氢时,环境优势更为显著[39]。此外,部分氢氧化细菌物种可通过固氮酶固定气态氮[37,40]。尽管固氮能力尚未得到广泛研究,但理论上,这一特性使氢氧化细菌成为“仅利用空气中可获取气体(CO₂、N₂、O₂)实现完全自养型食品生产”的理想候选微生物。
氢氧化细菌具备遗传可操作性:富养罗尔斯通氏菌(*Cupriavidus necator*)是研究最为深入的氢氧化细菌,目前已拥有丰富的遗传、基因组及代谢建模工具(最新综述参见[41,42]),并已被用于构建学术研究层面的概念验证型细胞工厂[42]。其他氢氧化细菌物种(尤其是黄色杆菌属,*Xanthobacter*)也已具备克隆工具包、基于质粒的基因表达系统[43]、基因敲除工具[44]及已测序的基因组[45]。此外,好氧氢氧化细菌为异养型微生物,可利用多种有机碳源生长、保藏及改造[45],这使其便于在标准微生物实验室中操作。尽管要将氢氧化细菌打造成稳定的细胞工厂仍需进一步优化,但多个物种已在基因工程及工业生物技术应用领域展现出巨大潜力。
产物分泌可规避高成本下游加工:生命周期分析与技术经济分析表明,下游加工对生产成本及可持续性具有重大影响[3]。蛋白质的分泌特性可实现目标蛋白与生物量的天然分离,从而简化下游加工流程,更易获得纯蛋白产品。
商业化面临的主要挑战
产物产量需满足原型开发与商业化需求:当前,整个替代蛋白领域在“经济高效地扩大生产规模”方面均面临重大挑战。这一问题至关重要,既要满足市场对产品产量的需求,也需实现具有竞争力的定价[23]。此外,微生物蛋白还需解决“营养与感官特性(颜色、气味、质地)匹配传统蛋白”的挑战[23]。
食品加工领域的这一挑战,要求食品技术人员在产品开发早期就能获取足量产品,以开展下游工艺开发与产品配方研究。因此,中等规模培养下的足量产量至关重要。令人鼓舞的是,过去30年间,微生物发酵生产乳蛋白的产量已实现千倍增长——从1990年的0.001 g/L提升至1 g/L[4]。作为参考,牛乳中β-乳球蛋白(BLG)的含量最高约为3 g/L。目前已报道的真核宿主(里氏木霉,*Trichoderma reesei*)分泌乳蛋白的最高产量为1 g/L(β-乳球蛋白)[46]。
由于真核与原核生物在分泌机制、蛋白质折叠及翻译后修饰方面存在差异,细菌分泌天然真核蛋白面临多重挑战(参见专栏2)[47]。尽管如此,部分真核蛋白的细菌分泌产量已达到较高水平:例如,大肠杆菌(*Escherichia coli*)可分泌两种抗体片段——Vh抗TNFR1结构域抗体(产量6 g/L)[48]与抗溶菌酶Fab片段(产量1.5 g/L)[49],还可分泌血液抗凝剂水蛭素(产量3.1 g/L)[49]。这些案例表明,原核生物分泌真核蛋白具有可行性。
所需的研究与创新方向
利用合成生物学的“设计-构建-测试-学习(DBTL)”循环构建革兰氏阴性菌细胞工厂,是实现特定工程目标的成熟且经实践验证的策略——若结合实验室进化与机器学习技术,效果将进一步提升(相关技术路线图已发表[10])。然而,要将DBTL循环适配于氢氧化细菌,仍需开展关键研究与创新。
第一,深入理解氢氧化细菌的生理学特性、代谢机制及应激反应,是进行合理细胞工厂设计的基础。要实现高效的细胞工厂设计,必须了解并预测微生物在特定生长条件下的行为[10]。尽管模式氢氧化细菌(富养罗尔斯通氏菌)已得到部分研究,其代谢模型也已初步建立[42],但仍存在显著认知空白——尤其是对黄色杆菌属(*Xanthobacter* spp.)等研究较少的氢氧化细菌物种。目前,关于氢氧化细菌应激适应、碳流分布、溢流代谢及 redox平衡的关键机制仍不明确,这限制了我们将其改造为高效生产宿主的能力[50]。
下一代测序与质谱技术的普及,使得基因组、转录组及蛋白质组数据的大规模获取成为可能。系统生物学家正越来越多地利用这些数据解析不同微生物的复杂生物学过程,并预测DBTL循环中的生物学结果[51]。然而,针对氢氧化细菌的此类研究投入仍显不足。我们仍需解答以下问题:氢氧化细菌如何应对异源蛋白合成带来的额外应激?异养培养条件下的研究结果如何转化到自养生长场景?氢化酶与固氮途径如何影响 redox平衡?哪种分泌机制最适用于氢氧化细菌?哪些基因及调控修饰对高蛋白产量至关重要?
第二,需开发高效遗传工具,以构建“可高水平分泌异源蛋白”的细胞工厂。合成生物学数十年的发展,已为革兰氏阴性菌开发了丰富的质粒工具包及基于成簇规律间隔短回文重复序列(CRISPR)的基因组编辑工具[52,53],这些工具可从质粒库直接获取。然而,在新的微生物(尤其是生长缓慢的氢氧化细菌)中测试并优化这些工具的性能仍需耗费大量时间——缓慢的生长速率会显著延缓菌株构建与工艺开发进程。通过生物铸造厂(biofoundries)[54]实现自动化与并行化操作,并结合无细胞原型构建技术[55,56],或可大幅加快工具开发速度。一旦开发出高效遗传工具,即可用于构建“分泌蛋白型氢氧化细菌细胞工厂”。
高蛋白分泌产量的实现,依赖于三个关键环节:生物量的持续高效积累、胞内蛋白的高水平表达,以及最终蛋白跨双层膜向胞外的成功分泌(参见专栏2)。要在氢氧化细菌中实现这一目标,需解决以下挑战:
1. 优化自养生长条件下蛋白表达与分泌的资源分配:自养生长能耗极高,氢氧化细菌在该生长状态下可能不会主动分泌蛋白(或分泌量极少),但目前针对这一问题的研究仍十分有限。尽管自养培养时“内源性蛋白分泌量低”这一特性,有利于获取高纯度异源蛋白,但要将细胞资源重新分配至异源蛋白的表达与分泌,仍需进行大量代谢工程改造。结合“纳入资源分配约束的代谢模型(参见专栏3)”与“考虑负担的设计原则”[57],并利用已有的或新开发的强启动子[43,58],或可指导这一改造过程,实现异源蛋白的高水平表达。此外,通过分析应激反应与分子伴侣机制,可为实现蛋白正确折叠提供指导[59,60]。
2. 实现蛋白向胞外的高效分泌:尽管其他革兰氏阴性菌的蛋白分泌机制已较为明确(参见专栏2),但关于氢氧化细菌蛋白分泌的研究仍十分匮乏。需开展研究明确:不同氢氧化细菌物种中哪些分泌系统具有功能?哪些“分泌信号-分泌系统”组合的通用性强,可支持重组蛋白的高效转运?在此过程中,对周质空间与胞外空间进行蛋白质组学分析,并结合Signal P6.0[61]、DeepSecc[62]等预测工具,或可助力信号肽的筛选与鉴定。
3. 改善缓慢生长速率以提高生物量积累效率:可通过“基于代谢模型的合理设计”或“进化适应”,精简氢氧化细菌的酶系统,从而提升生长速率(参见专栏3)。适应性实验室进化(ALE)技术已被证实可有效提高其他自养微生物(如产乙酸菌自产乙醇梭菌,*C. autoethanogenum*)的生长速率[63],因此这一策略或也适用于氢氧化细菌。需特别注意的是,菌株筛选条件应尽可能模拟最终生物工艺条件(参见专栏4),以避免不必要的优化偏差。因此,制定严谨的放大策略对于弥合实验室规模与工业规模条件之间的差距至关重要。通过整合上述策略,可构建稳健的菌株库,进而筛选出适用于工业化生产的候选菌株。
专栏3 评估与改善非模式微生物蛋白生产的计算框架
代谢工程成功的核心要素,是深入理解目标物种的代谢机制与细胞过程。从系统层面解析代谢过程,对于重组蛋白生产尤为重要——在该过程中,需将细胞资源高效导向目标蛋白合成,同时不影响微生物的生长与存活。
基因组规模代谢模型(Genome-scale metabolic models)是强大的计算框架,可绘制微生物的完整代谢图谱,将基因组信息与生化反应关联,进而预测细胞在不同遗传或环境约束下的底物利用方式。通量平衡分析(flux balance analysis)是基因组规模模型的核心方法[98],通过该方法可优化稳态代谢通量分布(如以生物量形成为优化目标),从而识别生物技术应用中的潜在瓶颈或替代途径。因此,基因组规模模型已成为改造模式与非模式微生物菌株的重要工具[99,100]。
以异源蛋白表达为例,通量平衡分析可揭示:当重组蛋白的代谢特征与宿主生物量代谢特征存在差异时,途径水平的通量变化及代谢瓶颈。然而,若缺乏“细胞资源约束”相关的详细机制信息,仍难以解释溢流代谢(overflow metabolism)、过量副产物生成等复杂代谢行为。
资源分配模型通过将代谢反应与关键细胞组分(酶、核糖体、能量等)相关联,满足了这一需求,从而为解析代谢功能提供了“资源感知视角”。在资源分配模型中,酶约束模型[101](尤其是蛋白质分配模型[102])纳入了酶周转数,以及对“翻译相关蛋白”等粗分类别蛋白质的定量描述,能够模拟细胞在将有限资源分配给生长、维持或目标产物合成时的成本-收益权衡。因此,蛋白质分配模型可预测“将内源性稳态蛋白转向异源蛋白表达”所带来的代谢负担及相关表型后果。不过,目前尚未有研究证实,可将资源分配模型模拟获得的见解,转化为“提升重组蛋白产量的菌株设计与工艺设计方案”,而揭示异源蛋白分泌的优势与益处,显然是该模型的一个重要应用方向。
将泛基因组(pangenome)分析与基因组规模模型、资源分配模型相结合,可将研究范围从单菌株基因组扩展到物种水平的比较,从而捕捉多个菌株或近缘物种间的基因存在-缺失变异[103]。通过识别所有菌株共有的核心基因(core genes)和仅存在于部分菌株中的附属基因(accessory genes),泛基因组分析能够挖掘未被利用的遗传多样性,为菌株工程拓展代谢工具库[104]。当泛基因组分析与基因组规模代谢模型、资源分配模型整合时,研究者可将新基因或新途径纳入计算模型,预测其对代谢的影响,并优先确定高通量基因文库构建的潜在靶点[105]。该方法的潜在应用案例包括:跨菌株挖掘和转移蛋白质分泌机制,以及筛选有益基因变异(如改造氢化酶[106]以优化氢固定效率)。
专栏4 工艺条件下从大型文库中筛选高产食品蛋白分泌型氢氧化细菌的方案
在氢氧化细菌改造研究初期,可采用低通量微量滴定板筛选法,结合荧光检测或比色检测,筛选出能分泌目标食品蛋白的潜在候选菌株。随着研究推进,为评估通过随机文库或组合文库获得的基因变异体,筛选出在工业相关条件下达到目标产量的最优菌株,可能需要更高通量的筛选方法。目前已有多种筛选平台可支持此类多维度筛选工作[107]。然而,要在工业生产场景中筛选出最优食品蛋白分泌菌株,需具备以下关键筛选特征:
1. 分隔化
对于基于分泌的筛选,必须将文库中的每个菌株分隔开,以实现“分泌表型与对应基因型”的关联。微量滴定板可在单个孔中实现菌株的分隔,且通过使用市售的384孔或1536孔板,可将反应体积缩小至微升级别。若将单个细胞分隔在油包水液滴(皮升体积)[107]或纳米级海藻酸盐微球(纳升体积)[83,108]中,可进一步提高通量——筛选时可将数百万个独立分隔单元浓缩在较小体积中。此外,考虑到Sec途径和Tat途径分泌的蛋白质会在周质空间积累(参见专栏2),还可将周质空间作为分隔区域[109],这是另一种可行的分隔策略。
2. 工艺条件下筛选
有效的筛选需遵循“筛选结果即目标结果”原则,即所采用的筛选条件应与期望的最终结果高度一致。在氢氧化细菌改造中,这意味着需在自养(氢氧化)条件下进行筛选。成功的放大培养始于有效的缩小模型构建:需在微观尺度上复现气体交换、营养限制、压力、混合效率等关键工艺参数,以确保筛选结果可推广至工业条件。理论上,基于油包水或海藻酸盐分隔的混合筛选系统可应对这一挑战,因为筛选过程中可将混合分隔单元置于大型气体发酵罐中培养。但需注意分隔单元的气体渗透性,目前尚未验证水凝胶基3D聚合物与疏水脂质包裹的油包水液滴,哪种更适用于该场景。
3. 天然食品蛋白的检测方法
在食品相关研究中,带标签的蛋白表达虽有助于早期筛选以加速菌株开发,但在最终产品中,标签会带来监管和理化层面的限制——监管要求可能强制规定产品需为未修饰形式,且标签可能改变蛋白质的感官或质构特性[110,111]。常用的蛋白质筛选标签(如荧光蛋白标签、酶标签)可能对分泌水平产生负面影响,且带标签蛋白的筛选结果与无标签蛋白的实际表现未必具有相关性。因此,需开发不依赖标签的替代检测方法,例如使用极短肽标签或天然标记法。具有潜力的工具包括:共培养可检测短肽标签的全细胞生物传感器[112],或使用可与荧光小分子结合的短标签(筛选时添加该荧光分子即可检测)[113]。此外,通过基于荧光的衍生化反应,也可实现蛋白质的天然标记。
第三,需建立原型验证策略,以在相关工艺条件下测试设计方案。要从改造突变菌株文库中筛选出目标产量的菌株,需在相关工艺条件下进行测试。目前已有多种针对蛋白分泌型细胞工厂的高通量筛选技术[参见专栏4],可用于氢氧化细菌的筛选。但在筛选过程中,难以模拟实际的气体发酵条件。尽管气体发酵在工业界关注度日益提升,但安全且易用的小规模气体发酵设备选择有限——此类设备无法以可承受的成本直接购买,这限制了其在学术机构和早期研发场景中的广泛应用。
在此背景下,可采用替代策略:鉴于氢氧化细菌可异养生长,且多数合成生物学实验室具备小规模异养培养能力(如微量滴定板培养),可结合自养与异养生长条件下的多组学数据(转录组学、蛋白质组学、代谢组学),通过代谢建模确定“胞内通量分布与自养生长尽可能接近”的异养培养条件。同时,可系统分析特定基因设计方案在异养与自养条件下的表型差异,进而开发预测算法。此类工具可基于异养筛选获得的数据,预测菌株在气体发酵条件下的表现。
另一种方案是利用自养培养的氢氧化细菌(HOBs)制备无细胞系统进行原型验证,该系统可作为自养代谢状态的替代模型。无细胞原型验证技术已推动了规模化合成气发酵细胞工厂的设计进程[55]。尽管此类系统非常适合评估高蛋白表达量和代谢活性,但目前在蛋白质分泌评估方面的适用性较低[64]。
最后,尽管氢氧化细菌的改造为可行的生产工艺奠定了基础,但生物反应器和发酵工艺的设计仍需优化,以创造最佳条件来最大化产量。与所有生物工艺一样,在工业规模下实现上述最佳条件,是气体精准发酵面临的主要挑战之一。在大规模发酵过程中,由于大型生物反应器内不可避免地存在溶解底物浓度的空间梯度,微生物会暴露在异质性、动态变化的环境中(这种环境变化被称为“生命周期波动”)。这些环境波动可能导致工业规模下微生物性能下降[65,66]。目前,研究人员正通过计算流体动力学(CFD)模拟和缩小规模生物反应器,探索并量化气体发酵生物反应器中的此类生命周期波动[67,68],这一研究将有助于优化生物反应器设计,并针对性提升氢氧化细菌的稳定性。
此外,针对氢氧化细菌气体发酵的生物反应器设计与优化,还需解决气态底物(尤其是氢气)在水中溶解度极低的固有问题。氢气传递不足会限制微生物生长,因此需要采取策略提高气液传质速率。一种方法是提高气体分压,可通过增加生物反应器内的静水压实现[21],进而提高气体溶解度,提升生物量和蛋白质产量。此外,好氧氢氧化细菌需要氢气和氧气作为底物,而这两种气体混合后具有高度爆炸性,因此必须制定严格的安全规程,并对工艺条件进行精确控制。
总之,高效的气体发酵工艺需要专门的生物反应器设计[69]。外循环气升式反应器[68]便是典型案例之一,该反应器通过向上的气流促进混合、减少浓度梯度,并在一定程度上提高传质速率。目前已有研究基于工艺特定参数,对好氧异养生物工艺[70]和厌氧合成气发酵[69,71]的反应器技术进行了对比分析,但针对氢氧化细菌工艺的此类研究尚未开展。在利用氢氧化细菌规模化生产蛋白质的过程中,平衡工艺效率、设备成本与操作安全性,仍是核心挑战。该领域内完善的研究、工程设计、标准化建设及成本降低措施,不仅能为工业规模气体发酵技术的应用扫清障碍,也将助力其在实验室场景中的推广。
食品蛋白气体精准发酵的替代路径
鉴于上述挑战,探索可并行的第三代(3G)气体精准发酵规模化策略,对于实现零碳或负碳食物链的目标至关重要。尽管氢氧化细菌已通过自然进化具备利用气态底物的能力,但通过合成代谢工程改造模式微生物(如大肠杆菌、多种酵母),使其具备固定二氧化碳[17,72-74]及其他一碳化合物[75]的能力,不失为一种极具吸引力的替代方案。该方案既充分利用了模式微生物在遗传和系统生物学研究方面的丰富积累,又结合了自养生活方式与稳定的蛋白质生产特性。然而,这一研究方向也面临独特挑战[76]——经改造的模式微生物最终仍需应对“自养条件下原型验证”和“工业规模下实现高蛋白产量”等类似难题。
另一种替代思路是构建“整合生物工艺”:先利用氢氧化细菌大规模生产生物量(该技术已实现工业化),再将这些生物量作为原料,通过成熟的细菌和酵母细胞工厂进行精准发酵。除了微生物和生物工艺创新外,从头蛋白质设计[77]领域的进展也可助力开发新型食品蛋白——这类蛋白既能模拟动物源蛋白的功能特性,又能在微生物细胞工厂中更易表达。不过,消费者接受度和监管障碍可能会阻碍此类新型食品进入市场。
结论
氢氧化细菌及其基因工程菌株为蛋白质生产提供了一条负碳、可持续的路径,规避了传统农业的局限性。尽管可食用单细胞蛋白已实现市场化,但本文进一步探讨了如何通过氢氧化细菌的气体精准发酵,实现食品供应链的多样化。
精准发酵技术已产出具有经济可行性的产品,且正日益被视为生产“营养强化型”和“感官优化型”食品的新型平台[6]。因此,下一步需将气体发酵规模化领域的最新进展与精准发酵知识相结合,推动构建脱离农业依赖的食品系统。
尽管本文重点阐述了具体案例研究及相关技术挑战,但要将气体精准发酵发展为可行的产业领域,仍需多方主体协同制定技术路线图,推动科学创新达到较高的技术成熟度水平(TRLs)(参见“关键问题”部分)。下文将概述该技术路线图应包含的核心要点:
第一,持续整合关键数字化能力。具体而言,人工智能(AI)工具将在加速“设计-构建-测试-学习(DBTL)”循环中发挥关键作用;若能在氢氧化细菌研发早期应用这些工具,或将大幅缩短工艺开发周期。AI的应用场景广泛,涵盖代谢建模、多组学数据整合、实时工艺控制、数字孪生构建、生物工艺优化,以及利用AI优化基因设计和预测规模化效果等,所有这些应用都将助力更快、更稳定地实现工艺规模化。若将AI工具与小规模自养试验平台的战略开发相结合,有望显著降低研发过程中的成本与风险,并提高工业化应用的成功率。
第二,除了提升低技术成熟度水平(TRLs)的技术能力外,还需将工艺规模化至工业水平,整合上游原料供应与下游加工技术,并围绕废弃物回收和热能利用设计循环化工艺。由公私合作伙伴资助的产学研合作至关重要:学术机构通常缺乏工业规模生产设施和行业特定洞见,而企业往往难以开展变革性创新所需的高风险、高回报研究。获取中试工厂、开放式创新平台等关键基础设施的使用权,可支持商业化前的规模化试验,帮助初创企业降低市场准入门槛。规模化生产还能产出足量物料,整合下游加工与配方领域的专业技术,最终实现美味食品的产业化交付。在原料供应方面,需联合绿氢生产和碳(CO₂)捕获领域的关键技术方与参与方。最终,需通过生命周期分析对能源、水资源和土地的利用情况进行建模,不仅要将各工艺与传统农业进行对标,还需与其他替代蛋白生产方案(参见专栏1)展开比较。
第三,尽早与监管机构就新型食品和生物安全政策开展沟通至关重要,这有助于理解并解决市场准入障碍。精简且高效的监管流程是确保产品安全且及时上市的关键。技术经济分析应评估工艺可行性、确定商业模式和早期采用者市场,并聚焦具有商业可行性的产品。我们预计,为新型食品建立稳健的供应链将推动气体精准发酵企业的发展,助力食品生产向可持续模式全面转型。
关键问题
1. 氢氧化细菌(HOBs)能否分泌食品蛋白?
2. 蛋白质设计技术能否助力开发“既模拟动物源蛋白功能特性,又在微生物细胞工厂中更易表达”的食品蛋白?
3. 氢氧化细菌能否成为学术界和工业界广泛认可的模式生物?
4. 能否通过有效缩小工艺规模,最终实现工程化工艺的规模化放大?
5. 能否突破生物反应器设计瓶颈,解决“学术研究所需的安全易用型反应器”及“工业界广泛规模化所需的反应器”供应问题?
6. 基于氢氧化细菌的气体精准发酵能否实现规模化生产,并达到商业相关产量标准?
7. 消费者和监管机构是否愿意接受新型气体发酵食品?这一过程中会产生哪些伦理考量?
致谢
本研究得到欧盟创新委员会(EIC)探路者项目HYDROCOW的资助(资助协议编号:101115118)。但本文所表达的观点和看法仅代表作者个人,不必然反映欧盟或欧盟创新委员会的立场。欧盟及资助机构不对本文内容承担任何责任。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1501713.html?mobile=1
收藏

