博文
食物匮乏引发的跨代长寿效应:溶酶体如何调控表观遗传记忆  精选
精选
|
食物匮乏引发的跨代长寿效应:溶酶体如何调控表观遗传记忆
与许多应激源类似,食物匮乏不仅会引发受影响个体产生生理反应,还会对其后代产生影响。有研究表明,祖先经历过食物短缺的人群,其寿命比祖先饮食充足的人群更长[1,2]。无独有偶,在秀丽隐杆线虫(*Caenorhabditis elegans*)中,一次急性饥饿事件甚至能让其后三代线虫的寿命延长[3]。表观遗传机制(不改变DNA序列但可遗传的基因表达变化)——包括组蛋白修饰——被认为与这种跨代记忆有关[4]。然而,这些机制如何与亲代的代谢状态关联,目前尚不明确。在本期《科学》杂志第1353页,张(Zhang)等人[5]的研究表明,在食物限制条件下被激活的降解性细胞器——溶酶体,可通过激发表观遗传变化,促进秀丽隐杆线虫的跨代长寿。值得注意的是,这些变化涉及组蛋白变体HIS-71从体细胞组织(肠道)向生殖细胞系(生殖细胞)的转运。
溶酶体含有对pH敏感的水解酶,这些酶能分解通过多种途径(包括自噬)转运进来的复杂分子。自噬是一种“自我吞噬”过程,溶酶体可通过该过程响应食物限制等信号,消化并回收细胞内的部分成分[6]。脂肪酶(负责分解脂肪的酶)是自噬过程中被激活的一类溶酶体水解酶。此前研究发现,在秀丽隐杆线虫中过度激活溶酶体脂肪酶LIPL-4,可通过释放特定脂质分子(这些分子随后发挥信号因子作用)延长线虫寿命[7],但这种信号传导的跨代效应此前一直未知。
张等人将过表达*lipl-4*转基因的线虫与野生型线虫交配,并让其后代连续多代与野生型线虫交配。通过这一过程,他们培育出了不携带*lipl-4*过表达转基因的野生型后代。研究发现,这些源自*lipl-4*过表达线虫的野生型后代,寿命比普通野生型线虫更长。这表明,即使后代不再携带*lipl-4*过表达转基因,亲代的*lipl-4*过表达仍会影响后代的寿命。研究人员还通过其他基因手段仅在亲代中激活溶酶体,也得到了类似结果。其中一个巧妙的实验设计是:将自噬抑制剂——雷帕霉素复合物1(mTORC1)的直接拮抗剂(单磷酸腺苷激活蛋白激酶,AMPK)与溶酶体膜蛋白融合,从而抑制mTORC1的活性[8]。与*lipl-4*过表达类似,亲代中该转基因的表达也能延长野生型后代的寿命。
这些发现揭示了一个新趋势:溶酶体激活的普遍结果是引发跨代且持续的寿命延长,这种效应甚至能超越最初的刺激。脂肪分解过程中脂质的释放似乎在这一反应中起核心作用。不过,溶酶体可分解多种大分子,因此溶酶体活性产生的其他产物也有可能参与跨代信号传导,这一点仍有待探索。
随后,张等人进一步探究了秀丽隐杆线虫亲代*lipl-4*过表达如何使野生型后代寿命延长。他们推测,参与其他跨代过程的表观遗传变化可能在此发挥作用。研究团队重点考察了组蛋白(调控DNA包装成染色质的蛋白质)的甲基化修饰是否发生改变——这种修饰会影响DNA的可及性,进而调控基因表达。结果发现,在*lipl-4*过表达后转录水平上调的42个基因中,组蛋白H3第79位赖氨酸的二甲基化和三甲基化水平显著升高。这一发现值得关注,因为传统观点认为秀丽隐杆线虫的跨代长寿与组蛋白H3其他赖氨酸残基的甲基化有关[9-11]。
此外,在这些携带表观遗传修饰且转录上调的基因中,有一个是*his-71*——该基因编码秀丽隐杆线虫中与人类组蛋白变体H3.3同源的蛋白。研究人员发现,HIS-71是*lipl-4*过表达引发跨代长寿所必需的,且这一过程涉及HIS-71通过卵黄分泌和内吞作用从肠道向生殖细胞系的跨组织转运(见图)。
张等人的研究成果之所以意义重大,主要有以下几点原因:首先,与常规H3组蛋白不同,H3.3变体无需依赖DNA复制即可整合到染色质中[12]。因此,HIS-71进入目标细胞后,可能比其他组蛋白更灵活、更快速地重塑染色质状态和表观遗传信息。其次,尽管跨代信息必须通过生殖细胞系传递,但HIS-71源自肠道这一现象表明,体细胞组织在决定跨代长寿方面也发挥着关键作用——这与肠道在秀丽隐杆线虫寿命调控中的广泛功能一致[13]。最后,已知肠道向生殖细胞系转运卵黄是为后代提供营养,但通过修饰沿该途径转运的分子,似乎是一种高效的跨代信息传递方式;这种机制的变体可能也参与响应其他信号的跨代记忆形成。
张等人还发现,HIS-71进入生殖细胞系后,可能会受到组蛋白甲基转移酶DOT-1.3(端粒沉默破坏因子1.3)的作用——而DOT-1.3是跨代长寿效应所必需的。由此可见,一系列分阶段的组蛋白甲基化事件(始于体细胞组织,终于生殖细胞系),会在溶酶体脂肪分解下游传递表观遗传信号,最终延长后代的寿命。

尽管张等人的研究在阐明溶酶体活性如何影响表观基因组(进而调控跨代长寿)方面取得了重大进展,但反向信号(从表观基因组到溶酶体)可能也具有重要意义。表观遗传改变可重新调整自噬-溶酶体机制的表达和功能[14],而表观遗传机制缺陷会阻碍线虫响应饥饿时溶酶体形态和活性的跨代变化[15]。如果溶酶体和表观基因组通过相互支持的方式促进跨代反应,就可能形成一种前馈机制,助力跨代信号的放大和有效传递。
此外,有趣的是,研究人员发现的许多能增强跨代长寿的基因变化,同时也能延长亲代自身的寿命。例如,在肠道中过表达*his-71*或在生殖细胞系中过表达*dot-1.3*,不仅能延长转基因亲代的寿命,也能延长野生型后代的寿命。这些发现表明,在寿命和生理层面,连接亲代与后代的纽带十分牢固——这种纽带嵌入在每个个体携带的分子信息中,即便只是单次代谢事件,也能对多代产生深远影响。
溶酶体通过表观基因组传递信号,调控跨代长寿
Lysosomes signal through the epigenome to regulate longevity across generations | Science
编辑摘要
在部分模式生物中,饥饿会诱导表观遗传变化,进而延长饥饿亲代后代的寿命。张等人以秀丽隐杆线虫(*Caenorhabditis elegans*,一种蛔虫)为研究对象,探究了这一效应的作用机制(参见博纳特(Bohnert)撰写的观点文章)。他们的研究发现,溶酶体脂肪酶样蛋白4(LIPL-4)这一酶分子在此过程中发挥关键作用。在此基础上,研究团队逐步解析出一条通路的部分环节:LIPL-4活性增强会激活肠道溶酶体中的信号传导,进而促进组蛋白H3.3变体的转录与合成。蛋白标记实验显示,该组蛋白可被转运至生殖细胞系,并在那里被甲基转移酶修饰后传递给后代,最终实现后代寿命的延长。——L. 布莱恩·雷(L. Bryan Ray)
表观基因组对代谢信号敏感,且在衰老调控中至关重要。溶酶体作为感知代谢信号、调控长寿的信号中枢,其功能不可或缺。本研究发现,在秀丽隐杆线虫中,溶酶体代谢通路可通过表观基因组传递信号,调控跨代长寿。激活溶酶体脂质信号通路与溶酶体单磷酸腺苷激活蛋白激酶(AMPK),或抑制溶酶体雷帕霉素靶蛋白(mTOR)信号通路,均可提高组蛋白H3.3变体的表达水平,并增强其第79位赖氨酸(K79)的甲基化修饰,从而实现多代线虫的寿命延长。这种跨代促长寿效应需依赖组蛋白H3.3从肠道向生殖细胞系的转运,且需要生殖细胞系特异性的H3K79甲基转移酶参与;过表达H3.3或H3K79甲基转移酶,也可重现该效应。由此可见,溶酶体产生的信号可影响表观基因组,并通过连接体细胞与生殖细胞系,介导长寿性状的跨代遗传。
溶酶体在感知营养可利用性方面发挥核心作用。饥饿会促进溶酶体脂肪酶样蛋白4(LIPL-4)的转录,将单磷酸腺苷激活蛋白激酶(AMPK)招募至溶酶体,同时抑制溶酶体中雷帕霉素复合物I靶蛋白(mTORC1)的激活[1-3]。已有研究表明,LIPL-4、AMPK、mTORC1及饥饿均与长寿调控相关[4]。此外,在多种生物中,饥饿还可诱导表观遗传性状的跨代遗传[5,6]。然而,溶酶体信号通路是否以及如何调控表观遗传记忆与跨代长寿,目前仍不明确。
溶酶体脂肪分解增强H3K79甲基化,促进跨代长寿
肠道是线虫主要的代谢组织,在肠道中过表达溶酶体酸性脂肪酶LIPL-4,可诱导溶酶体脂肪分解并延长线虫寿命[7,8]。将长寿的*lipl-4*转基因线虫(*lipl-4* Tg)与野生型(WT)线虫回交时,我们观察到,回交产生的野生型后代寿命延长,这表明LIPL-4诱导的溶酶体脂肪分解可能具有促进跨代长寿的作用。
为验证这一推测,我们将*lipl-4* Tg雌雄同体线虫与野生型雄性线虫交配,检测其第三代(F3)野生型后代(命名为“第二代跨代野生型”,T2 WT)的寿命(图1A)。同时,将野生型雌雄同体线虫与野生型雄性线虫交配,以其第三代后代作为野生型对照(图1A)。结果显示,源自*lipl-4* Tg交配组合的T2 WT后代,寿命显著长于野生型对照(图1A及表S1)。
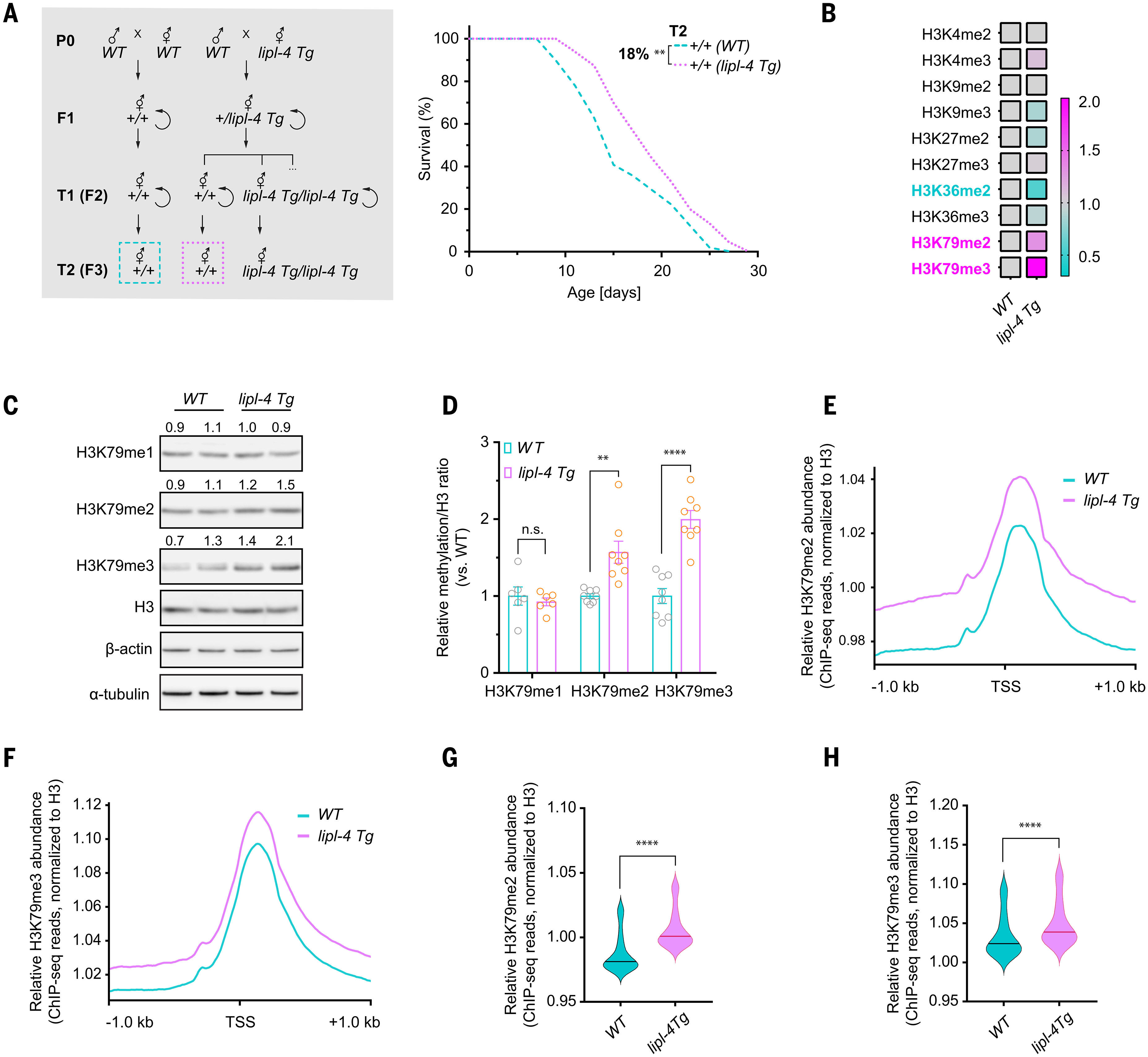
图1 溶酶体脂肪分解诱导长寿与H3K79甲基化的跨代遗传
(A)源自P0代*lipl-4* Tg线虫的T2 WT后代[+/+(*lipl-4* Tg)],与源自P0代野生型线虫的野生型对照[+/+(WT)]相比,寿命显著延长。每个重复样本含90条线虫,共5个生物学重复;***P<0.001,对数秩检验。图中标注了寿命延长的百分比(下方数值相对于上方数值)。寿命重复实验的汇总数据见表S1。虚线框内为寿命分析中所用的遗传交配方案及跨代分组示意图。
(B)蛋白质印迹(Western blot)筛选结果绘制的热图,显示*lipl-4* Tg线虫与野生型线虫中组蛋白H3翻译后修饰(PTM)水平的比值。
(C)蛋白质印迹图像,显示野生型与*lipl-4* Tg线虫中H3K79单甲基化(me1)、二甲基化(me2)、三甲基化(me3)、组蛋白H3、β-肌动蛋白(β-actin)及α-微管蛋白(α-tubulin)的表达水平。
(D)蛋白质印迹所有生物学独立重复实验的汇总柱状图。误差线表示平均值±标准误(SEM);n.s.表示无统计学意义(P>0.05),**P<0.01,****P<0.0001,采用Welch校正的非配对t检验。
(E-H)小提琴图量化显示,与野生型线虫相比,*lipl-4* Tg线虫中H3K79me2和H3K79me3在转录起始位点(TSS)上下游1kb区域的富集程度显著增强(图中中线代表中位数)。****P<0.0001,Wilcoxon检验。
表观遗传变化是介导跨代遗传的关键。在秀丽隐杆线虫中,组蛋白H3第4位赖氨酸三甲基化(H3K4me3)与第9位赖氨酸二甲基化(H3K9me2)均与跨代长寿相关[9,10]。然而,在*lipl-4* Tg线虫中,H3K4me3与H3K9me2的丰度均未发生改变(图1B及图S1A)。我们进一步比较了1日龄成年*lipl-4* Tg线虫与野生型线虫中其他组蛋白H3甲基化修饰(包括H3K4me2、H3K9me3、H3K27me2、H3K27me3、H3K36me2、H3K36me3、H3K79me2及H3K79me3)的水平(图1B及图S1A),发现*lipl-4* Tg线虫中H3K79me2与H3K79me3的水平均显著升高(图1B-D及图S1)。
我们还利用针对H3K79me2、H3K79me3及组蛋白H3的抗体,对1日龄成年野生型与*lipl-4* Tg线虫的提取物进行染色质免疫沉淀(ChIP)实验,随后进行二代测序(ChIP-seq)。将H3K79me2或H3K79me3的信号强度相对于总组蛋白H3进行标准化后发现,与野生型基因组相比,*lipl-4* Tg线虫基因组中H3K79me2与H3K79me3在转录起始位点(TSS)上下游1kb区域的丰度显著增加(图1E-H)。这些结果进一步证实,*lipl-4* Tg线虫中H3K79me2与H3K79me3的丰度确实升高。
https://wap.sciencenet.cn/blog-41174-1503884.html
上一篇:纳米气泡热酸稳定性研究
下一篇:想要突破性科学研究?多吸纳新手