博文
乳果糖氢呼气试验区分低高氢水平肠易激综合征
||
乳果糖氢呼气试验区分低高氢水平肠易激综合征
改良乳果糖氢呼气试验用于小肠细菌过度生长分型——区分低、高呼气氢水平的肠易激综合征
摘要
背景:小肠细菌过度生长(SIBO)被认为与肠易激综合征(IBS)相关。本研究的主要目的是确定乳果糖氢呼气试验(LHBT)诊断SIBO的阳性鉴别阈值;次要目的是将肠易激综合征患者分为SIBO组与非SIBO组。
方法:对206名受试者进行乳果糖氢呼气试验,其中包括74名健康受试者、39名存在肠道病变的SIBO患者、77名肠易激综合征患者,以及16名无氢产生者。结合闪烁显像术与乳果糖氢呼气试验,将口盲传输时间设定为80分钟,并比较各组的氢峰值水平。数据以平均值及95%置信区间表示。
结果:以80分钟为口盲传输时间阈值时,健康受试者乳果糖氢呼气试验的氢峰值为8ppm,SIBO患者为38ppm(p<0.0001)。将20ppm设为诊断阈值时,灵敏度为77%、特异度为88%,阳性预测值与阴性预测值分别为77%和88%。对肠易激综合征患者采用相同阈值时,其平均氢峰值为21(16~26)ppm(与健康受试者相比,p<0.0001),灵敏度为39%、特异度为78%,阳性预测值与阴性预测值分别为77%和84%。以20ppm为界将肠易激综合征患者分组:低氢组氢峰值为6(5~7)ppm(与健康受试者相比无显著性差异),高氢组氢峰值为44(38~49)ppm(与健康受试者相比,p<0.0001)。抗生素治疗后,低氢型肠易激综合征患者的氢水平无变化,而高氢型患者的氢水平降至对照组水平(p<0.01)。
结论:将20ppm设为阈值时,乳果糖氢呼气试验可通过早期高呼气氢峰值鉴别SIBO,并将肠易激综合征分为非SIBO组与SIBO组;其中SIBO组患者或可从抗生素治疗中获益。
总结
1. 乳果糖氢呼气试验可用于诊断小肠细菌过度生长;
2. 将20ppm设为氢浓度诊断阈值时,表明相当比例的肠易激综合征患者存在小肠细菌过度生长;
3. 抗生素治疗后呼气氢水平恢复正常且症状缓解,提示部分肠易激综合征病例与细菌过度生长相关。
1. 引言
越来越多的证据表明,肠道菌群失调在肠易激综合征(IBS)中发挥作用[1-3]。在肠易激综合征患者中,小肠细菌过度生长(SIBO)的检出率为4%~78%[4]。这一患病率的巨大差异可能与种族、微生物环境及所采用的诊断标准有关。无创呼气试验因其可行性强、诊断速度快而得到广泛应用,但空肠近端抽吸物细菌培养仍被视为诊断小肠细菌过度生长的金标准[5]。然而,该方法存在局限性:若未对小肠所有区域进行取样,可能导致取样误差;此外,其污染风险约为20%,且约80%的取样细菌(包括大多数产氢菌)无法培养,使得该诊断方法并非最优选择[5]。
目前已有多种类型的呼气试验用于诊断,但受限于缺乏统一的操作规范和数据解读标准。由于所用底物、检测时间点及氢浓度诊断阈值不同,不同研究对“优化呼气试验诊断小肠细菌过度生长”提出了不同建议。这也促使协作工作组制定了氢呼气试验用于诊断的基本规则[6-8]。其中一个主要问题是:难以设定有效的小肠氢浓度阈值,同时避免盲肠菌群对乳果糖的发酵干扰。
乳果糖氢呼气试验(LHBT)是临床上用于诊断小肠细菌过度生长的无创替代方法,其主要限制因素是呼气氢的检测时间范围。乳果糖是一种不可消化、不可吸收的双糖底物,可被细菌分解产氢,通过检测全小肠内乳果糖的代谢情况可识别小肠细菌过度生长。正常情况下,只有当乳果糖到达盲肠并被该区域菌群发酵后,呼气中才会出现显著量的氢。最初,Bond等人[9]发现健康受试者的口盲传输时间(OCTT)为72分钟,而Mathur等人[10,11]将传输时间设定为90分钟。北美指南随后达成共识,建议在乳果糖氢呼气试验中以90分钟作为诊断小肠细菌过度生长的时间阈值[6];但欧洲指南指出,对于口盲传输时间较快的患者,乳果糖可能在更短时间内到达结肠[7]。
关于氢浓度诊断阈值,不同研究者针对小肠细菌过度生长提出了不同标准,如5ppm、10ppm、12ppm[7]及20ppm[6]。有研究表明,当以20ppm为阈值时,与“空肠培养细菌数≥10³CFU/mL”的诊断符合率为53%[12]。
本研究旨在优化乳果糖氢呼气试验的诊断阈值。通过小肠闪烁显像术确定最佳传输时间后,比较健康对照组、存在小肠解剖病变或动力障碍(易诱发小肠细菌过度生长)的患者,以及肠易激综合征患者的诊断氢浓度水平;并基于这些小肠细菌过度生长诊断标准,将肠易激综合征患者分为SIBO组与非SIBO组。
2. 材料与方法
2.1 伦理考量
根据国家匿名数据相关法规,机构审查委员会(IRB)认为本研究无需获取受试者知情同意。本研究遵循《赫尔辛基宣言》原则,已获得乌普萨拉大学机构审查委员会批准(批准号:2022-04646-01),所有患者身份均已匿名处理。
2.2 闪烁显像术联合乳果糖氢呼气试验准备
招募31名健康受试者(男性14名、女性17名,年龄19~77岁),以乳果糖作为氢呼气试验的传输时间第二标志物,进行小肠闪烁显像检查。
受试者于检查前禁食过夜,次日上午8:00取仰卧位接受检查。静脉注射放射性标志物(120MBq的⁹⁹ᵐTc-HIDA,意大利萨卢贾Amersham Sorin公司)后,该标志物通过胆汁快速排入十二指肠。采用动态模式记录前位图像,每次采集1分钟(详细方法参见[13])。
在闪烁显像检查中,于近端十二指肠和盲肠区域勾勒感兴趣区(ROI),并结合本底放射性评估放射性计数率。当某一感兴趣区内的放射性计数率较本底水平升高超过2倍时,定义为放射性标志物在该区域的出现时间;各感兴趣区中放射性出现的时间点分别视为传输起始时间和传输终点。
注射⁹⁹ᵐTc-HIDA后立即开始显像。当放射性核素在胆囊和中央胆管内积聚时,给予受试者10g乳果糖溶液(浓度670mg/mL,瑞典索尔纳Meda AB公司,商品名Laktulos Meda),同时开始采集呼气样本,直至在盲肠检测到放射性核素;当呼气氢水平较前一次检测升高超过2倍时,记录传输时间(详细方法参见[13])。
2.3 乳果糖氢呼气试验
对206名受试者进行乳果糖氢呼气试验,其中16名无氢产生者被排除在后续研究之外。根据罗马Ⅲ标准,将剩余190名受试者分为三组:
- 健康对照组:74名(男性36名、女性38名,年龄22~79岁);
- 小肠细菌过度生长易感组:39名(存在狭窄、憩室等解剖病变或其他导致小肠内容物淤滞的改变,男性15名、女性24名,年龄18~74岁);
- 肠易激综合征组:77名(男性33名、女性44名,年龄22~75岁),其中便秘型(IBS-C)11名、腹泻型(IBS-D)29名、混合型(IBS-M)37名[14]。
乳果糖氢呼气试验采用配备电化学氢敏电池的呼气采样设备(英国伦弗鲁GMI Medical Ltd公司),该设备的分辨率为1ppm,准确度为±2ppm或满量程的5%,线性范围为2~150ppm。
受试者于前一晚8:00起禁食,次日上午8:00~10:00进行呼气采样。分别在-10分钟和0分钟时采集两份基线呼气末样本;随后摄入10g乳果糖溶液(浓度670mg/mL,商品名Laktulos Meda),并在接下来的180分钟内,每10分钟采集一次呼气氢样本。采样期间,禁止受试者运动、饮水、进食或吸烟,以防干扰导致氢水平假性升高。
本研究排除以下受试者:乳糖酶或蔗糖酶缺乏者、乳糜泻患者、胆汁酸吸收不良者、溃疡性结肠炎患者、克罗恩病患者、胶原性或淋巴细胞性结肠炎患者、胃肠道肿瘤患者,以及存在消化不良或全身性吸收不良体征者。此外,受试者需在乳果糖氢呼气试验前至少28天停用以下药物:抗生素、多巴胺或阿片受体激动剂、质子泵抑制剂及泻药。
以评估期间的氢浓度(单位:ppm)为纵轴、时间(单位:分钟)为横轴,绘制每名受试者的呼气氢浓度曲线。提取氢峰值及0~80分钟曲线下面积(AUC₀₋₈₀)以计算诊断准确性;此外,为确定氢浓度阈值,对呼气氢曲线采用三次多项式拟合,将曲线上升幅度达到3倍时的浓度设定为阈值。
2.4 统计学方法以盲肠内标志物到达时 “氢水平超过本底两倍” 为阈值,采用配对样本 t 检验计算闪烁显像术与乳果糖传输时间之间的统计学差异;通过 Bland-Altman 图对两种方法的检测结果进行一致性分析。随后,以健康对照组为参照,采用方差分析(ANOVA)计算小肠细菌过度生长(SIBO)各研究组之间的差异。为优化乳果糖氢呼气试验(LHBT)数据的评估效果,研究同时分析了不同时间点的氢峰值,以及通过计算 0~80 分钟曲线下面积(AUC₀₋₈₀)得到的呼气氢总积分值。将氢峰值作为 SIBO 诊断阈值的验证过程如下:首先将所有研究组的呼气氢结果按顺序排列,再对呼气氢曲线采用三次多项式拟合以确定氢浓度阈值。当氢曲线在 15ppm 和 20ppm 处出现拐点时,分别视为曲线较基线水平上升 3 倍和 4 倍。为验证 LHBT 的诊断效能,研究还评估了 12ppm、15ppm 和 20ppm 三个候选阈值。采用受试者工作特征曲线(ROC)确定诊断阈值并计算 LHBT 的诊断准确性。数据以 “平均值 ± 括号内 95% 置信区间” 或 “平均值 ± 标准误(SE)” 表示,统计学显著性设定为 p<0.05。3 结果在健康受试者中联合使用闪烁显像术与 LHBT 时,闪烁显像术测得的传输时间为 85(70~101)分钟,LHBT 测得的传输时间为 104(87~121)分钟,且性别间无差异。Bland-Altman 图显示两种方法的传输时间具有可接受的一致性,偏差为 - 19 分钟,仅有少数检测点超出 95% 置信区间(图 1)。
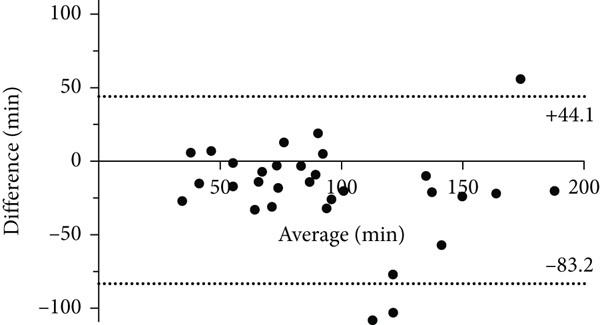
图 1 闪烁显像术与乳果糖法测得传输时间的 Bland-Altman 图图中虚线表示差值及 95% 一致性界限,有 3 名受试者的计算差值超出 95% 置信区间。在后续 LHBT 研究中,健康对照组的口盲传输时间(OCTT)为 91(84~99)分钟;肠易激综合征(IBS)总组的 OCTT 为 104(97~111)分钟(该组包含可能合并 SIBO 的高氢产生亚组)。扣除低氢产生型 IBS 患者 112(103~120)分钟的传输时间后,数据显示高氢产生型 IBS 患者的平均 OCTT 为 91(80~102)分钟。研究以健康对照组 LHBT 传输时间 95% 置信区间的下限为依据,将 0~80 分钟设定为评估小肠氢产生情况的目标时间区间。LHBT 数据显示,所有研究组的氢峰值范围为 1~104ppm,且在 180 分钟评估时间内,乳果糖可从胃到达盲肠。在 29 例腹泻型 IBS(IBS-D)患者中,20 例(69%)表现出显著更高的氢产生量;而在 11 例便秘型 IBS(IBS-C)患者中,仅 2 例(18%)表现出高氢产生量,两组差异具有统计学意义(p=0.0006)(图 2 插入图)。所有患者的呼气氢值均符合多项式方程 f (x)=0.000025x³−0.004x²+0.2641x−1.207(决定系数 r²=0.9804),呈现平滑上升曲线(图 2)。
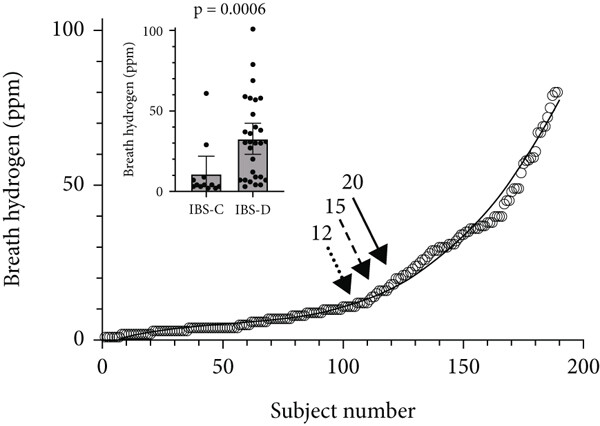
图 2 所有纳入研究受试者(n=190)的呼气氢值排序图箭头指示用于计算诊断准确性的 12ppm、15ppm 和 20ppm 呼气氢节点,实线表示曲线的三次多项式拟合结果。插入图显示便秘型 IBS(IBS-C)与腹泻型 IBS(IBS-D)患者的呼气氢产生量(平均值及 95% 置信区间),数据表明 15ppm 和 20ppm 处的曲线分别较基线上升 3 倍和 4 倍。以 20ppm 氢浓度作为诊断阈值时,各研究组间差异显著:高氢产生型 IBS 患者和 SIBO 易感组患者,与低氢产生型 IBS 患者及健康受试者相比均存在显著差异(均 p<0.0001);而 SIBO 易感组与高氢产生型 IBS 患者之间、低氢产生型 IBS 患者与健康受试者之间均无统计学差异(图 3)。
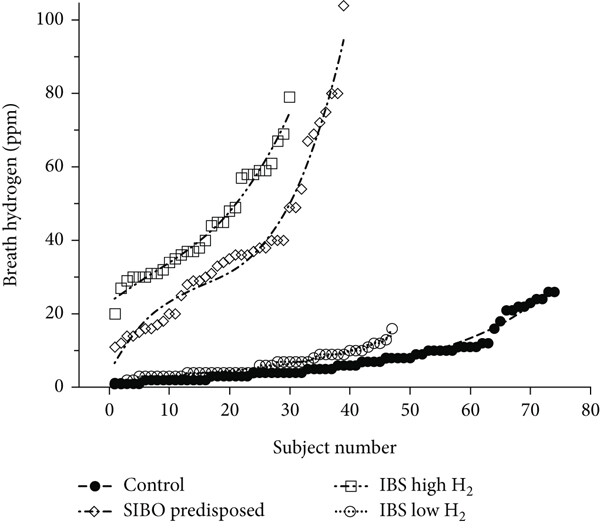
图 3 健康对照组(n=74)、低氢产生型 IBS(n=47)、高氢产生型 IBS(n=30)及 SIBO 易感组患者(n=39)的呼气氢值差异虚线表示各组曲线的三次多项式拟合结果。曲线拟合分析显示,不同组别的呼气氢曲线存在差异,具体多项式方程如下:健康对照组:f (x)=0.000163x³−0.01202x²+0.3629x−0.3487(r²=0.9764)低氢产生型 IBS:f (x)=0.0001749x³−0.007753x²+0.252x+1.172(r²=0.9689)高氢产生型 IBS:f (x)=0.001683x³−0.03529x²+1.27x+23.13(r²=0.9784)SIBO 易感组:f (x)=0.003749x³−0.1711x²+3.306x+3.652(r²=0.9736)为进行对比,研究还分析了呼气氢积分值 AUC₀₋₈₀,结果与氢峰值趋势一致:健康对照组 AUC₀₋₈₀为 206(164~248)ppm・80 分钟,SIBO 易感组为 1502(1315~1689)ppm・80 分钟(与健康对照组相比 p<0.0001);低氢产生型 IBS 为 244(199~288)ppm・80 分钟(与健康对照组相比无显著性差异),高氢产生型 IBS 为 1530(1088~1973)ppm・80 分钟(与健康对照组相比 p<0.0001)。由于氢积分值 AUC 与氢峰值无差异,后续诊断阈值验证均以氢峰值为依据。在不同阈值下对 LHBT 进行 ROC 分析:首先,将 SIBO 易感组与健康对照组在 20ppm 阈值下对比,并与 12ppm、15ppm 阈值对比,结果显示 12ppm 和 15ppm 阈值灵敏度更高,但特异度更低;其次,将 IBS 总组与健康对照组对比,结果显示灵敏度较低,但特异度相当,似然比更低;将 IBS 组以 20ppm 为界分为高氢亚组和低氢亚组后,高氢亚组的灵敏度和特异度与 SIBO 组相似,且似然比更优;低氢产生型 IBS 组与健康受试者相比,灵敏度相似,但特异度更差(表 1、图 4)。
表 1 不同诊断阈值下乳果糖氢呼气试验的受试者工作特征及检测效能
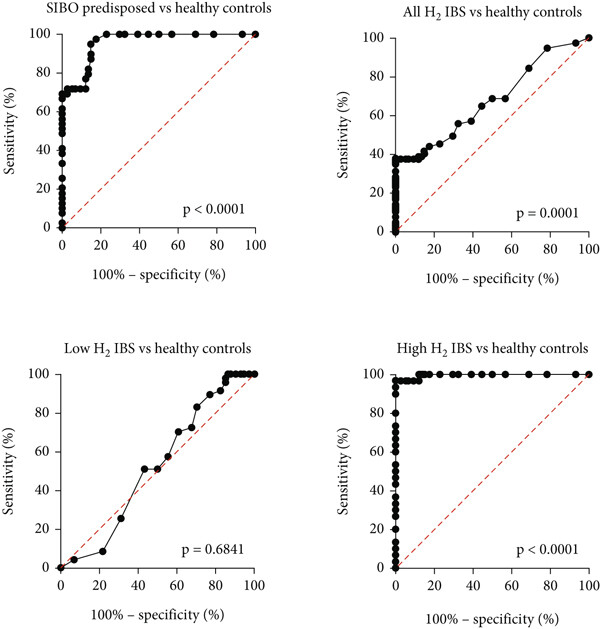
图 4 以 20ppm 为阈值时,乳果糖氢呼气试验在 SIBO 易感组及 IBS(分为低氢、高氢亚组)中的受试者工作特征曲线3.1 不同患者组中的 SIBO 情况健康对照组的平均呼气氢水平为 8(6~9)ppm,最高峰值为 26ppm;SIBO 易感组的平均呼气氢水平为 38(31~45)ppm(与健康对照组相比 p<0.0001),其中 9 例患者的呼气氢低于 20ppm 阈值,最高峰值为 104ppm;IBS 总组的平均呼气氢水平为 21(16~26)ppm(与健康对照组相比 p<0.0001);低氢产生型 IBS 组的平均呼气氢水平为 6(5~7)ppm(与健康对照组相比无显著性差异),高氢产生型 IBS 组为 44(38~49)ppm(与健康对照组相比 p<0.0001),两组最高峰值分别为 16ppm 和 79ppm(图 5)。 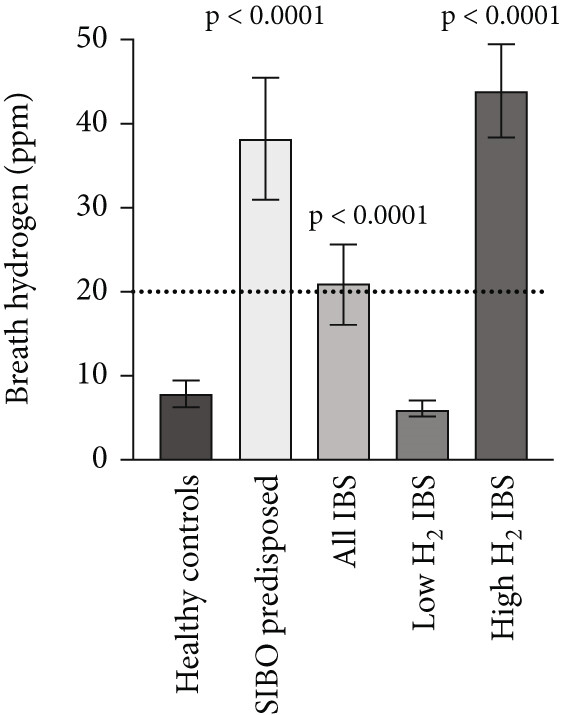 图 5 健康对照组、SIBO 易感组及 IBS(分为低氢、高氢亚组)患者乳果糖氢呼气试验的平均呼气氢水平(含 95% 置信区间)虚线表示 20ppm 诊断阈值。3.2 IBS 患者对 antibiotics 的反应所有 IBS 患者均接受抗生素治疗,并在治疗 14 天后复查:30 例高氢产生型 IBS 患者中,28 例(大多数)的呼气氢水平显著降低(图 6),同时伴有腹胀症状改善(28 例)和腹泻缓解(26 例);而低氢产生型 IBS 患者的呼气氢水平无降低。
图 5 健康对照组、SIBO 易感组及 IBS(分为低氢、高氢亚组)患者乳果糖氢呼气试验的平均呼气氢水平(含 95% 置信区间)虚线表示 20ppm 诊断阈值。3.2 IBS 患者对 antibiotics 的反应所有 IBS 患者均接受抗生素治疗,并在治疗 14 天后复查:30 例高氢产生型 IBS 患者中,28 例(大多数)的呼气氢水平显著降低(图 6),同时伴有腹胀症状改善(28 例)和腹泻缓解(26 例);而低氢产生型 IBS 患者的呼气氢水平无降低。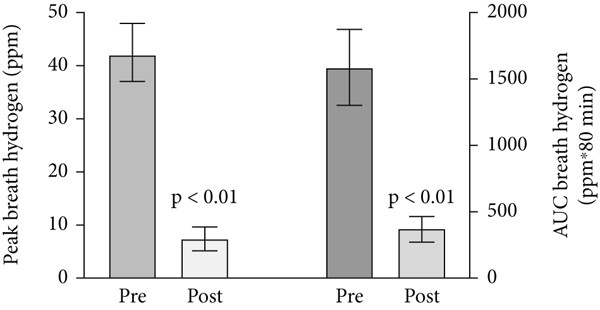 图 6 抗生素治疗对 IBS 患者呼气氢水平的影响左图以氢峰值为指标,右图以 AUC₀₋₈₀为指标(n=77)。Pre 表示抗生素治疗前,Post 表示抗生素治疗后。数据以平均值及 95% 置信区间表示。
图 6 抗生素治疗对 IBS 患者呼气氢水平的影响左图以氢峰值为指标,右图以 AUC₀₋₈₀为指标(n=77)。Pre 表示抗生素治疗前,Post 表示抗生素治疗后。数据以平均值及 95% 置信区间表示。
4 讨论
氢呼气试验是目前广泛应用且公认的 SIBO 无创诊断方法,因为只有微生物才能产生氢。北美呼气试验共识建议,以 90 分钟内氢浓度较基线升高 20ppm 作为诊断标准 [6];而欧洲指南未明确规定诊断检测时间点和氢浓度阈值 [7]。本研究的闪烁显像数据显示,乳果糖可快速到达盲肠,并在 80 分钟时通过氢水平升高被检测到,因此将 0~80 分钟设定为检测时间区间。这种设定可降低单纯因传输过快而导致的 SIBO 过度诊断风险 —— 在该区间内,以高氢产生为指标诊断 IBS 合并 SIBO 时,灵敏度为 39%、特异度为 87%(与健康对照组相比)。作为对比,若将检测时间设定为 60 分钟、仍以 20ppm 为阈值,灵敏度会降至 21%,而特异度保持 86%,这表明缩短检测时间(如 60 分钟)会降低诊断准确性。
理论上,乳果糖的 “先头部分” 可能快速通过肠道到达盲肠,而在 SIBO 情况下,大部分乳果糖会留在小肠内发酵。因此,肠道不同部位的两种发酵来源均可能导致呼气氢升高,使研究者得到非特异性结果。但 Read 及其同事发现,当乳果糖直接注入盲肠时,呼气氢水平需约 40 分钟才能达到 20ppm [15,16]。因此,即使少量乳果糖快速到达盲肠,留在小肠内的大部分乳果糖仍可能是导致呼气氢早期升高的主要原因。本研究通过多项式曲线拟合分析,确定了 15ppm 和 20ppm 两个不同阈值 —— 在这两个阈值处,曲线拐点使多项式导数显著升高,提示氢产生量增加;同时纳入 12ppm 阈值作为对比。对这些阈值的诊断准确性计算显示,采用 20ppm 阈值可提高呼气试验的灵敏度,且不会显著影响特异度或导致 SIBO 过度诊断。因此,本研究选择 20ppm 作为后续诊断阈值,与美国共识一致 [6]。
ROC 及检测效能分析显示,12ppm、15ppm、20ppm 三个阈值的结果相近。在选择最终阈值时,研究认为:特异度是更重要的考量因素(即使会损失一定灵敏度);其次,阳性预测值比阴性预测值更重要。此外,并非所有存在 SIBO 风险因素的患者都患有临床相关的 SIBO—— 本研究中 39 例 SIBO 易感者中,9 例(23%)的呼气氢水平处于正常范围,这一结果也反映了这一点。在本研究设定的条件下,SIBO 易感组和 IBS 总组的诊断准确度分别为 84% 和 81%,优于罗马共识报告中 “与空肠细菌抽吸培养相比 55% 的准确度”[17]。后续一项 LHBT 汇总数据综述显示,灵敏度为 62%、特异度为 86%[18];另有研究证实的检测效能与本研究相似(灵敏度 86%、特异度 77%)[19]。这些差异可能源于 “更明确的氢检测最佳时间区间” 及 “更适宜的诊断阈值” 的应用。
在健康对照组中,少数受试者的呼气氢水平较高,可达 26ppm;而 11 例 SIBO 易感者的呼气氢水平低于 20ppm。在 IBS 患者中,47 例呼气氢水平低于 20ppm,另有 30 例显著高于 20ppm—— 据此可将 IBS 队列分为低氢产生亚组和高氢产生亚组。采用 80 分钟检测时间区间和 20ppm 诊断阈值时,研究发现 39% 临床诊断为 IBS 的患者合并 SIBO。这一结果与以往研究一致 —— 既往研究显示 IBS 患者中 SIBO 的发生率为 30%~85%[20-24]。为验证这一结论,研究对 IBS 患者使用抗生素治疗,结果显示 30 例患者中 28 例的氢产生量恢复正常,证实了治疗反应。抗生素的选择基于对每位患者致病细菌的推测。本研究数据显示,高氢产生型 IBS 可通过治疗缓解症状,这与以往经验一致 [22],但尚未获取 SIBO 复发率的相关信息。然而,理论上所有对照组和患者在接受此类治疗后,氢产生量均应显著降低,因此该对比仅能证实 LHBT 对治疗干预敏感,而 SIBO 相关症状的缓解仍需额外治疗。这一发现提示 SIBO 在 IBS 样症状的病理生理过程中具有重要作用。据此,Esposito 等人提出可通过 LHBT 区分 SIBO 与 IBS [25]。由于 SIBO 是一种复杂疾病,常伴随营养不良和体重下降,因此需根据患者个体情况制定个性化治疗方案。
4.1 研究优势与局限性
本研究从临床队列中随机选取近期确诊为小肠细菌过度生长(SIBO)的患者,旨在观察各研究组之间是否存在差异。尽管已尽力厘清临床体征存疑的病例,但回顾性症状记录仍可能存在回忆偏倚。
研究纳入了健康志愿者,以及年龄相近、存在提示SIBO的胃肠道症状的患者。由于年龄增长可能与“合并慢性腹泻、吸收不良、体重下降及继发性营养缺乏的SIBO”发生相关[26,27],因此本研究数据对普通人群具有参考价值,且各研究组间具有可比性。
本研究选用乳果糖作为底物,原因是其能以未被消化的形式通过小肠,从而提高对小肠近端和远端细菌过度生长的检测灵敏度。但正如闪烁显像术所示,若乳果糖传输速度过快(在80分钟诊断阈值前到达结肠),则可能被误诊为SIBO。因此,本研究主张将80分钟设为诊断阈值以避免假阳性;而欧洲的阈值标准则将时间降至60分钟以避免假阳性[7],但这种做法会增加假阴性的风险。
本研究存在一些局限性:在预备性闪烁显像传输研究中,放射性标志物与乳果糖在十二指肠的到达时间并非完全一致。为尽量缩小这一差异,研究对放射性标志物和乳果糖标志物的检测起始点进行了最佳对齐。此外,盲肠内细菌需通过代谢产生氢气,这一过程会进一步延迟乳果糖传输时间的检测。研究估算两种方法测得的传输时间存在19分钟差异,因此将SIBO的诊断时间区间设定为0~80分钟,以降低假阳性风险。葡萄糖呼气试验可作为乳果糖氢呼气试验(LHBT)的替代方案用于检测SIBO,但在肠易激综合征(IBS)患者中,该试验的阳性率较低,因此这两种检查方法不能互换用于SIBO的诊断[28]。
综上,本研究证实LHBT能够诊断SIBO,明确了其检测时间区间,并验证了诊断所需的氢峰值阈值。此外,本研究还可将IBS患者分为合并SIBO与不合并SIBO两类,这为SIBO患者的治疗开辟了新的可能。
https://wap.sciencenet.cn/blog-41174-1503444.html
上一篇:纳米气泡热酸稳定性研究
下一篇:纯粹的伟大生理学家:奥古斯特·克罗格教授