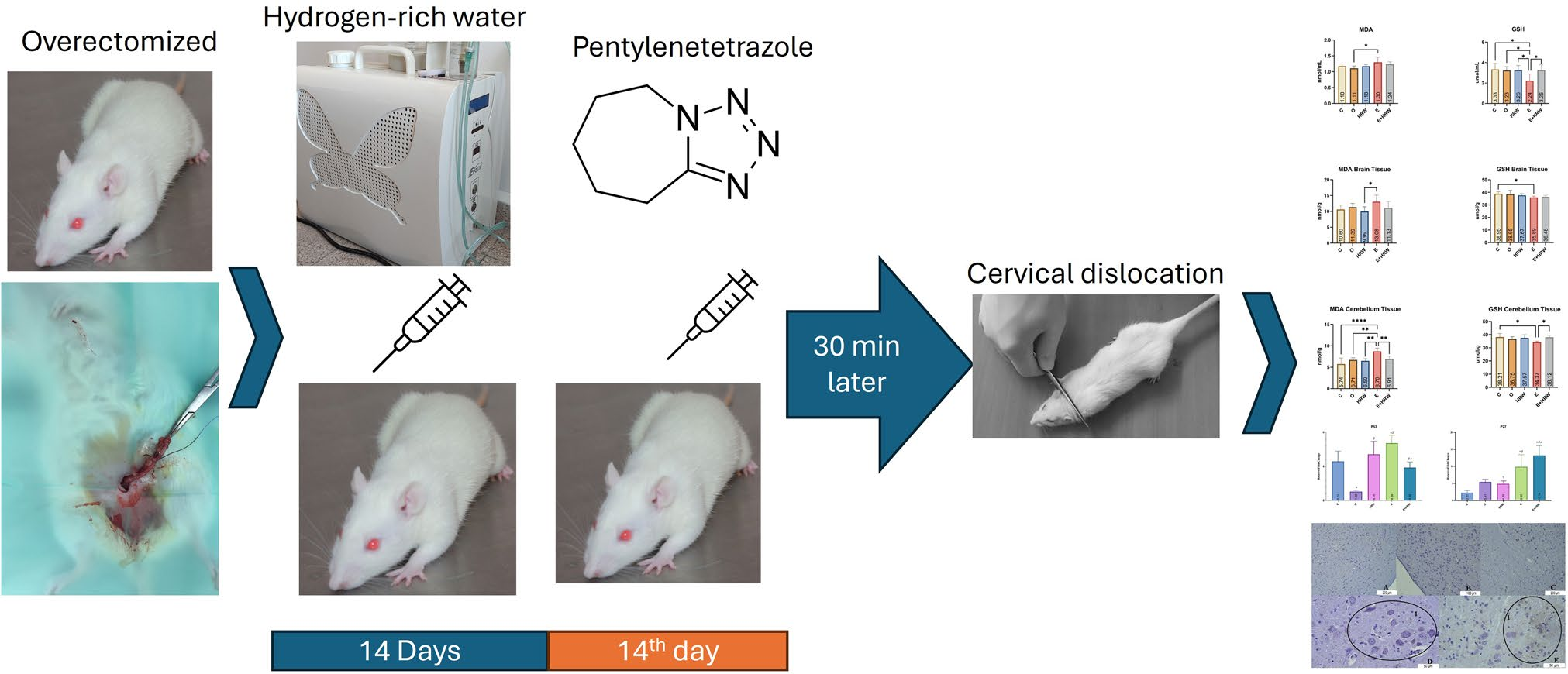
本研究旨在探讨富氢水对戊四氮诱导癫痫的治疗效果。研究共使用30只雌性大鼠,每组6只。除对照组外,其余各组大鼠均接受去卵巢手术。富氢水组(HRW组)和癫痫+富氢水组(E+HRW组)通过腹腔注射方式给予富氢水,持续14天。研究第14天,癫痫组、富氢水组和E+HRW组大鼠均接受单次腹腔注射戊四氮。随后,通过摄像机记录所有大鼠30分钟内的表现,并进行癫痫发作评分。之后,依据伦理规范,在麻醉状态下通过颈椎脱臼法对所有大鼠实施安乐死,并收集大鼠的血液样本及组织(大脑、小脑)样本。
对样本进行生化指标检测,包括丙二醛(MDA)、谷胱甘肽(GSH)、天然巯基、总巯基及二硫键稳态水平;采用聚合酶链式反应(PCR)技术分析P53和P27基因的表达情况;通过组织病理学检查(常规苏木精-伊红染色)及免疫组织化学检查(BCL-2和半胱氨酸天冬氨酸蛋白酶3(caspase-3)免疫试剂染色)观察组织病理变化及相关蛋白表达。
生化检测结果显示,癫痫组(E组)的MDA水平显著升高;尤其在小脑组织中,E+HRW组的MDA水平较E组呈统计学意义上的降低,这一差异具有显著意义。对GSH、总巯基及天然巯基水平的分析显示,E组上述指标均呈统计学意义上的降低;尤其在血液和小脑组织中,E+HRW组的上述指标较E组呈统计学意义上的升高,差异显著。P53和P27基因的表达在统计学上存在显著差异,但数值差异幅度有限。此外,与E组相比,E+HRW组的BCL-2和caspase-3免疫反应性也存在显著差异。
综上,与癫痫组(E组)相比,癫痫+富氢水组(E+HRW组)给予富氢水处理后表现出治疗效果。基于本研究结果,我们认为富氢水可能对癫痫具有一定的改善作用。
Kaya, M., Makav, M., Karadağ Sarı, E. et al. Effect of Hydrogen on Pentylenetetrazole-Induced Seizures in Ovariectomized Rats. Bratisl. Med. J. (2025).
提醒:本研究是动物实验,结果无法预测人体使用效果!
1 引言
癫痫是全球最常见的脑部疾病之一,影响着超过7000万人。其发病在婴幼儿和成人中呈双峰分布。癫痫的类型具有复杂的遗传结构,这一特点推动了疾病认知的范式转变:如今,癫痫不再被视为单一表现、单一病因的疾病,而是被认定为一种具有多种风险因素且遗传易感性显著的症状综合体[1]。癫痫是一种复杂且异质性强的疾病。在信息学和统计工具的支持下,涵盖蛋白质组学、转录组学、宏基因组学、基因组学等多组学相关技术的高通量检测 panel,有望最终对治疗结局产生影响[2]。
氧化应激是已知的病理通路,可解释大多数神经退行性疾病中的神经元损伤。活性氧(ROS)来源于分子氧,由兴奋性氨基酸激活产生,进而导致更多谷氨酸释放,引发癫痫发作持续时间延长和神经元死亡[3]。显然,活性氧在众多生理机制的运作中发挥着重要作用。细胞在正常代谢过程中会产生活性氧,当细胞内活性氧水平升高时,会加剧细胞损伤,最终导致细胞死亡。已知氧化代谢产生的自由基会诱发脂质过氧化,丙二醛(MDA)是评估脂质过氧化常用的标志物。此外,在抗氧化评估中,还原型谷胱甘肽(GSH)的检测对于验证相关结果也具有重要意义[4,5]。在诸多研究中,MDA和GSH均被用于氧化损伤的评估。
氢气(H₂)是一种无毒、非金属的分子,具有无嗅、无味、无色的特性,且能在组织和细胞中快速扩散[13]。氢的还原性也已得到广泛证实[14]。研究表明,氢具有选择性抗氧化活性,能够清除细胞内环境中活性最强的自由基,即羟基自由基(OH)和过氧亚硝酸盐(ONOO⁻)[4,15]。已有大量研究证实了氢的抗氧化特性。
本研究旨在探讨富氢水对戊四氮诱导的癫痫发作的影响。
2 材料与方法
本研究开始前,已获得卡夫卡什大学动物实验当地伦理委员会的批准(批准编号:KAUHADYEK-2024/218)。研究将实验动物分为5组,每组6只,共使用30只Wistar白化雌性大鼠。除对照组外,其余各组雌性大鼠均接受去卵巢手术,以排除雌性激素对研究结果的影响。为确保伤口愈合,去卵巢手术后10天才启动本研究。
各组处理方案:
1. 对照组(C组,n=6):腹腔注射生理盐水,持续14天,不给予任何治疗药物。
2. 去卵巢组(O组,n=6):仅接受去卵巢手术,腹腔注射生理盐水,持续14天。
3. 富氢水组(HRW组,n=6):去卵巢手术后,按5ml/kg的剂量腹腔注射富氢水,持续14天[4,18]。
4. 癫痫组(E组,n=6):研究第14天,单次腹腔注射50mg/kg的戊四氮,诱导实验性癫痫发作[19]。
5. 癫痫+富氢水组(E+HRW组,n=6):先按5ml/kg的剂量腹腔注射富氢水,持续14天;研究第14天,单次腹腔注射50mg/kg的戊四氮,诱导癫痫发作。
富氢水的制备方法如下:使用氢氧机(型号:HB-33 Epoch,中国台湾产),将氢氧气以1.25L/min的流速通入2L纯水中,持续鼓泡30分钟[14]。根据亨利定律,使用 redox探针(型号:SP60X,Consort公司产)检测得出,富氢水中氢气(H₂)浓度约为1mg/L[12]。
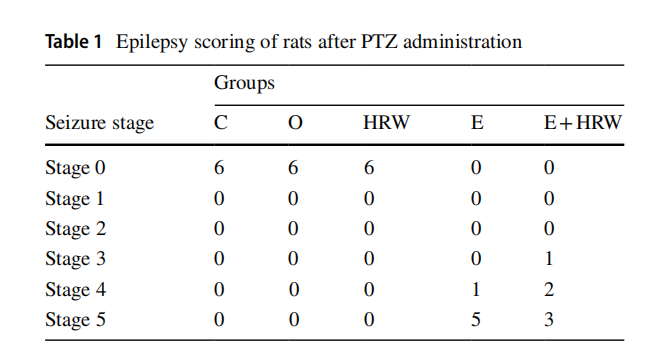
2.1 癫痫发作评分
在持续14天给予富氢水处理后,于第14天单次注射50mg/kg的戊四氮。注射后,将大鼠置于40cm×40cm×30cm的透明有机玻璃盒中,用摄像机记录30分钟,并采用以下标准对记录结果进行评分:按0-5分制为每份记录赋值(详见表1)。Kilinc等人的研究[19]中,明确了以下评分对应的发作阶段:
- 0级:无反应
- 1级:面部动作,伴随耳朵和胡须抖动
- 2级:肌阵挛性抽搐,但无直立动作
- 3级:单侧或双侧肢体阵挛
- 4级:直立姿势,伴随双侧前肢阵挛
- 5级:全身性强直-阵挛发作
表1 戊四氮注射后大鼠癫痫发作评分表
实验结束时,采用麻醉后颈椎脱臼法对大鼠实施安乐死(麻醉剂为盐酸氯胺酮,75mg/kg;赛拉嗪,15mg/kg),该操作符合既定的伦理原则。从所有大鼠的心脏采集血液样本,全血和血清(血清通过3000rpm离心5分钟提取)均在-20℃条件下保存。此外,还取出所有大鼠的大脑和小脑组织:部分脑组织放入无菌冷冻管中,置于-80℃液氮中保存,用于后续的聚合酶链式反应(PCR)分析;剩余脑组织和小脑组织的一半放入10%甲醛溶液中,用于组织病理学分析;另一半样本在磷酸盐缓冲液(pH=7.4)中匀浆,用于后续的生化分析。随后,将上述匀浆样本以3000rpm的转速离心5分钟,离心后的样本在-20℃条件下保存。
2.2 生化分析
血清样本的总巯基(TT)和天然巯基(NT)分析采用Erel和Neselioglu提出的方法[20],通过分光光度法测定。二硫键、二硫键/总巯基×100、二硫键/天然巯基×100及天然巯基/总巯基×100的分析结果,均基于总巯基和天然巯基的检测数据计算得出[21]。全血和组织上清液中的谷胱甘肽(GSH)分析采用Beutler等人提出的方法[22]测定;血清和组织上清液中的丙二醛(MDA)分析则依据Yoshioka等人提出的方法[23]进行。
2.3 组织学检查
将大脑和小脑组织样本置于10%福尔马林溶液中固定24小时,随后按照常规流程包埋于石蜡中。从石蜡块上切取5μm厚的连续切片,对切片进行苏木精-伊红(H&E)染色,之后用光学显微镜(日本奥林巴斯BX43、蔡司Primostar 3)对切片进行观察并拍照。
2.4 免疫组织化学检查
将组织切片贴附在载玻片上,并用铬明矾明胶溶液包被,随后采用链霉亲和素-生物素过氧化物酶法进行检测。免疫组织化学实验全程的所有洗涤步骤均使用磷酸盐缓冲液(PBS,0.1mol/L,pH=7.2)。具体操作如下:
1. 将切片置于用0.1mol/L PBS配制的3%过氧化氢溶液中孵育15分钟;
2. 之后将切片放入柠檬酸盐缓冲液中,用600W微波炉煮沸10分钟;
3. 随后将样本用大体积Ultra V封闭液孵育10分钟;
4. 对切片分别加入半胱氨酸天冬氨酸蛋白酶3(Caspase 3,Santa Cruz公司,货号PA5-20330,稀释比例1:50)和B细胞淋巴瘤-2(Bcl-2,Affinity Biosciences公司,货号Ab-AF6139,稀释比例1:200)一抗处理,之后在4℃条件下孵育12小时;
5. 室温下,依次加入生物素化山羊抗B多克隆抗体溶液和链霉亲和素过氧化物酶溶液,各孵育15分钟;
6. 加入3,3'-二氨基联苯胺-过氧化氢(DAB-H₂O₂)底物溶液以实现显色反应,并用改良型Gill III苏木精溶液进行染色。
为验证免疫反应的特异性,所有实验步骤均需保持一致,同时设置仅用PBS孵育(不加一抗)的切片作为对照。免疫组织化学评估需结合目标细胞的染色特征和染色强度,由两名独立观察者完成;采用半定量评分法,按无反应(-)、弱反应(+)、中度反应(++)和强反应(+++)赋值。
2.5 聚合酶链式反应(PCR)分析
取储存的组织样本10-30mg,使用组织匀浆机(Next Advance公司,Bullet Blender Storm 24)进行匀浆处理,用于后续基因分析。总RNA提取采用Purelink RNA Mini试剂盒(货号12183018A),操作步骤严格遵循试剂盒说明书。使用Optizen NanoQ Lite仪器测定RNA样本的纯度和浓度,RNA样本在260nm/280nm处的吸光度比值介于1.8-2.1之间被定义为纯度合格。
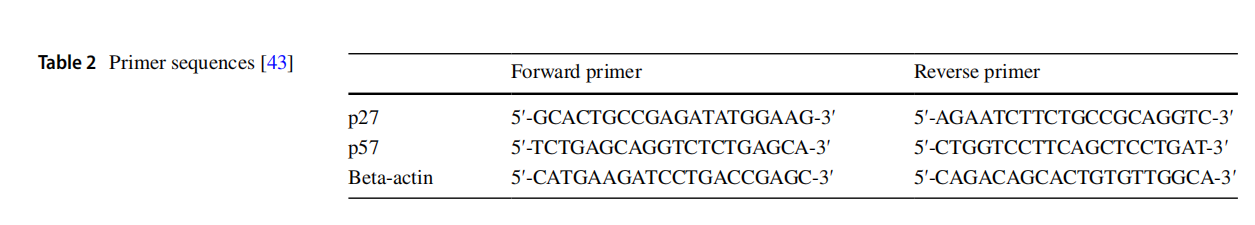
将从组织中提取的总RNA调整至相同浓度后,使用cDNA合成试剂盒(High-Capacity cDNA Reverse Transcription Kit,Applied Biosystems™)进行cDNA合成[24]。采用实时定量聚合酶链式反应(qRT-PCR,StepOnePlus™实时PCR系统)对合成的cDNA进行检测,以确定p53和p27基因的mRNA表达水平(表2)。qRT-PCR实验使用TaqMan预混液(FastAdvance Master Mix,赛默飞世尔科技公司),以β-肌动蛋白(β-actin,Gene Expression Assays,250次反应,货号Rn00667869)作为内参基因,对p53(Gene Expression Assays,250次反应,货号Rn00755717_m1)和p27(Gene Expression Assays,250次反应,货号Rn0058219_m1)基因的表达水平进行标准化校正。基因表达的相对倍数变化采用Livak和Schmittegen于2001年提出的2⁻ΔΔCt法计算[24,25]。
表2 引物序列[43]
2.6 统计学分析
采用GraphPad 8.1.0版本软件(GraphPad Software公司,美国加利福尼亚州圣迭戈)对数据进行分析。组间基因表达相对倍数变化采用单因素方差分析(ANOVA)和事后Tukey氏HSD检验。以p<0.05为差异具有统计学意义。
3 结果
3.1 生化结果
- 丙二醛(MDA)血清指标:癫痫组(E组)的MDA水平与去卵巢组(O组)相比显著升高(P<0.05)(图1)。
- 全血谷胱甘肽(GSH)数据:癫痫组(E组)的GSH水平与其他各组相比显著降低(P<0.05)(图1)。
- 脑组织指标:癫痫组(E组)的MDA水平与富氢水组(HRW组)相比显著升高(P<0.05);癫痫组(E组)的GSH水平与对照组(C组)相比显著降低(P<0.05)(图1)。
- 小脑指标:癫痫组(E组)的MDA水平与其他各组相比显著升高(P<0.05);癫痫组(E组)的GSH水平与对照组(C组)、癫痫+富氢水组(E+HRW组)相比显著降低(P<0.05)(图1)。
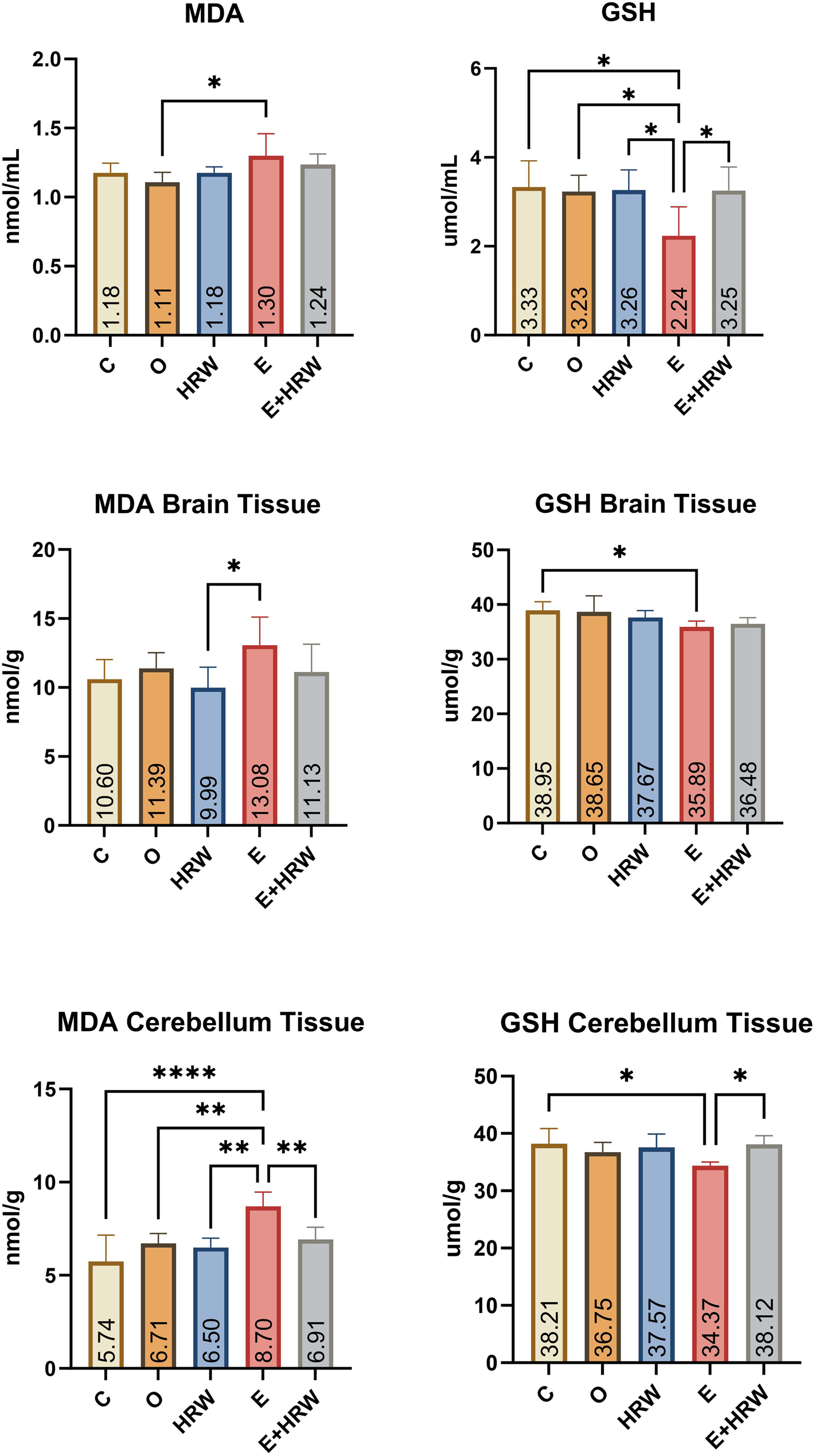
图1 血液、大脑和小脑组织中的MDA及GSH指标
(注:*p<0.05,**p<0.01,***p<0.001,****p<0.0001)
- 总巯基(TT)指标:对照组(C组)与癫痫组(E组)存在差异,癫痫组(E组)的TT水平与对照组(C组)相比显著降低(P<0.05)(图2)。
- 天然巯基(NT)指标:癫痫组(E组)的NT水平与对照组(C组)、去卵巢组(O组)、癫痫+富氢水组(E+HRW组)相比显著降低(P<0.05)(图2)。
- 二硫键指标:癫痫组(E组)的二硫键水平与其他各组相比数值上有所降低,但差异无统计学意义(P>0.05)(图2)。
- 二硫键/NT、二硫键/TT及NT/TT比值:各组间差异均无统计学意义(P>0.05)(图2)。
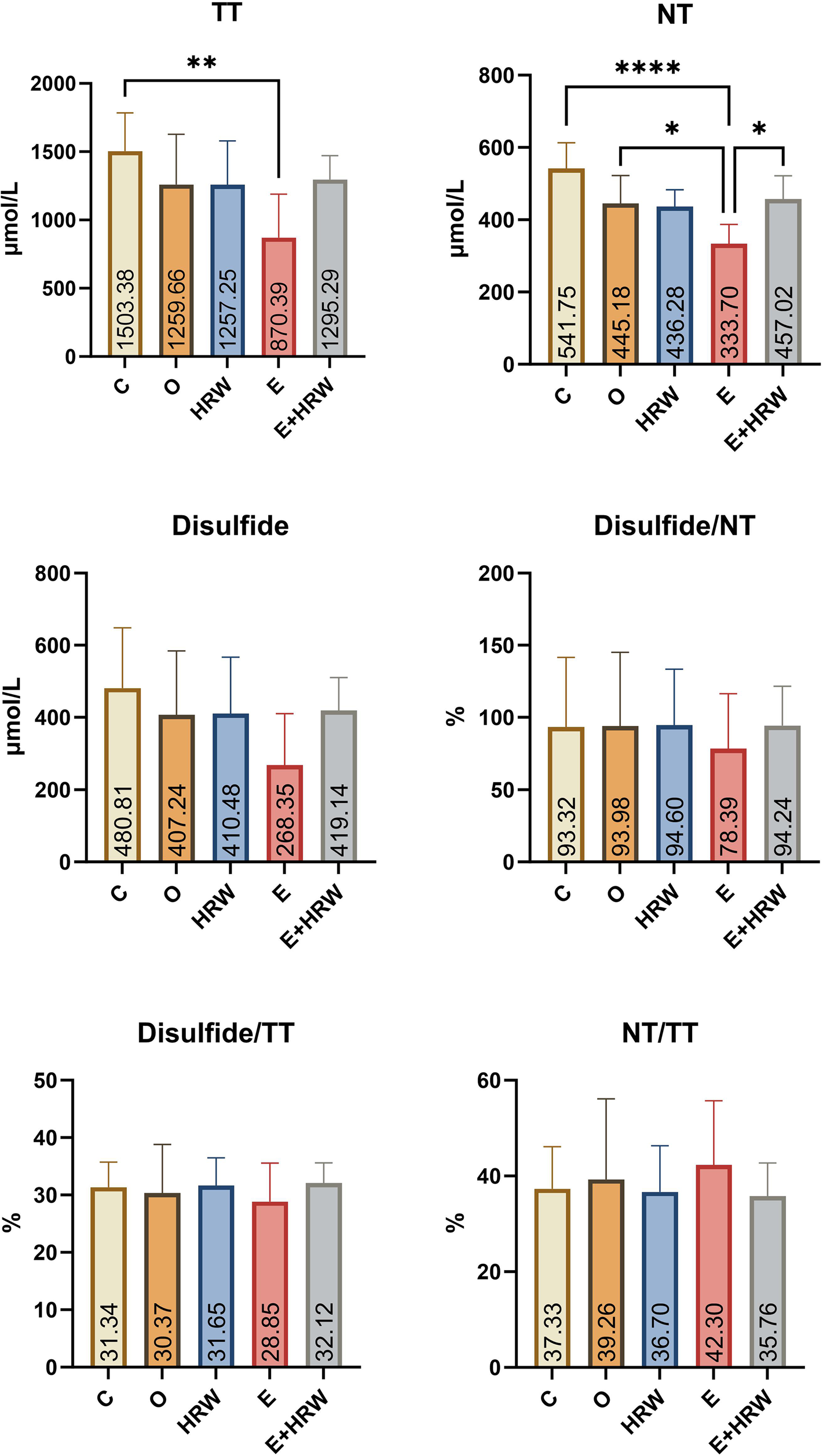
图2 血清中的总巯基(TT)、天然巯基(NT)、二硫键、二硫键/NT、二硫键/TT及NT/TT指标
(注:*p<0.05,**p<0.01,***p<0.001,****p<0.0001)
3.2 基因结果
通过RT-PCR首先检测p53基因的表达情况,结果显示:
- 癫痫组(E组)的p53表达水平显著高于对照组(C组)和去卵巢组(O组)(p值分别为0.007和0.001);
- 富氢水处理相关组(HRW组、E+HRW组)的p53相对倍数变化显著高于去卵巢组(O组)(两组p值均为0.001);
- 癫痫+富氢水组(E+HRW组)的p53水平显著低于癫痫组(E组)(p=0.001);
- 富氢水组(HRW组)和癫痫+富氢水组(E+HRW组)的mRNA表达水平与对照组(C组)相比无显著差异(P>0.05)(图3)。
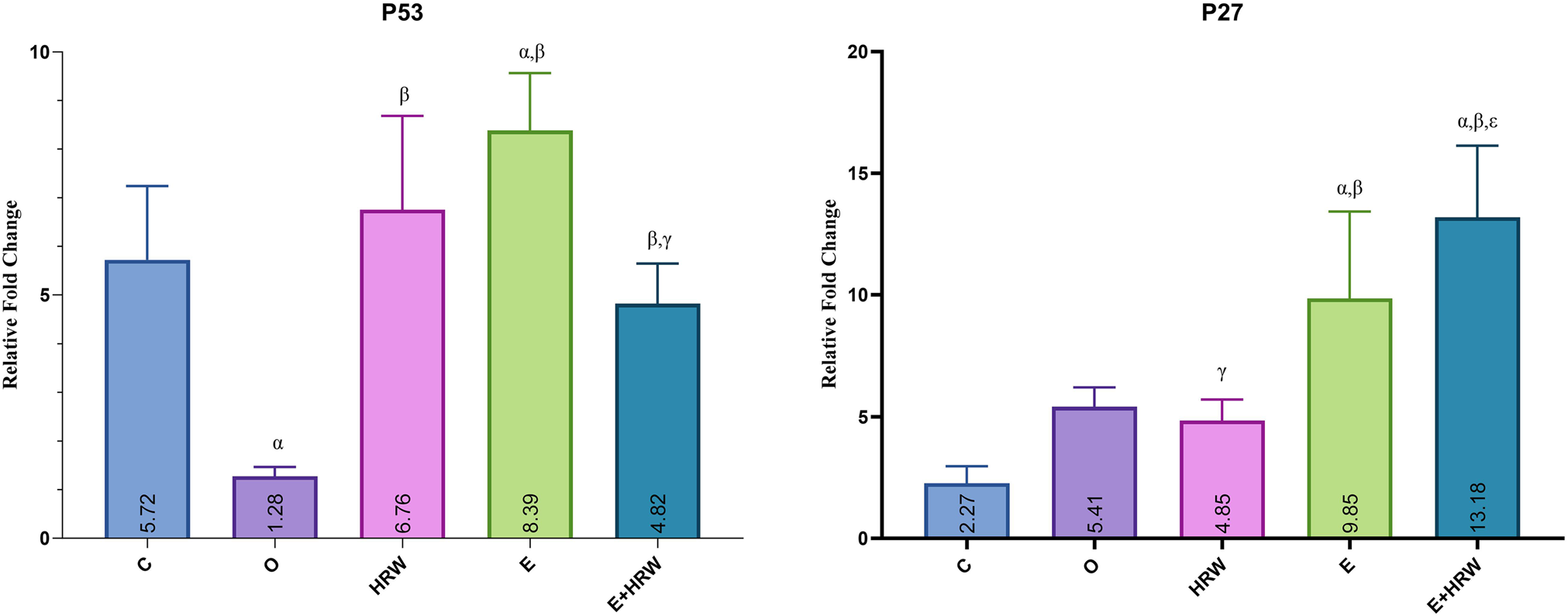
图3 脑组织中p53(A)和p27(B)基因的mRNA相对倍数变化
(注:α表示与对照组比较,β表示与去卵巢组比较,γ表示与癫痫组比较,ε表示与富氢水组比较,p≤0.05)
p27基因的检测结果显示:
- 癫痫组(E组)的p27表达水平显著高于对照组(C组)和去卵巢组(O组)(p值分别为0.001和0.011);
- 癫痫+富氢水组(E+HRW组)的p27表达水平显著高于对照组(C组)、去卵巢组(O组)和富氢水组(HRW组)(三组p值均为0.001);
- 富氢水组(HRW组)的p27水平显著低于癫痫组(E组)(p=0.004)(图3)。
3.3 组织学结果
所有组别的大鼠大脑和小脑组织中均能观察到灰质和白质区域;其中小脑组织的灰质由浦肯野细胞、分子层和颗粒层构成。癫痫组(E组)大鼠的大脑组织出现严重损伤(图4)。
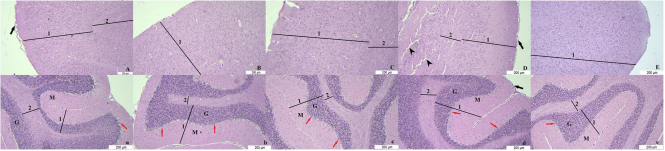
图4 大鼠大脑和小脑组织切片
- 大脑组织:对照组(A)、去卵巢组(B)、富氢水组(C)、癫痫组(D)、癫痫+富氢水组(E);
- 小脑组织:对照组(a)、去卵巢组(b)、富氢水组(c)、癫痫组(d)、癫痫+富氢水组(e)。
(注:箭头指示软脑膜,1指示灰质,2指示白质,三角箭头指示损伤区域,M指示分子层,红色箭头指示浦肯野细胞,G指示颗粒层;染色方法为苏木精-伊红染色)
3.4 免疫组织化学结果
3.4.1 B细胞淋巴瘤-2(Bcl-2)免疫反应性
癫痫组(E组)和癫痫+富氢水组(E+HRW组)的大脑与小脑组织中,均检测到中度Bcl-2免疫反应性(表3、图5、图6)。其中:
- 大脑组织中,Bcl-2免疫反应性主要定位于灰质区域神经元的细胞质内;
- 小脑组织中,免疫反应性则定位于颗粒层和分子层神经元的细胞质内。
表3 大脑与小脑组织中Bcl-2免疫反应性的半定量评分表
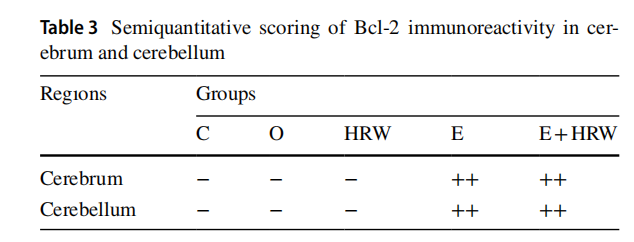
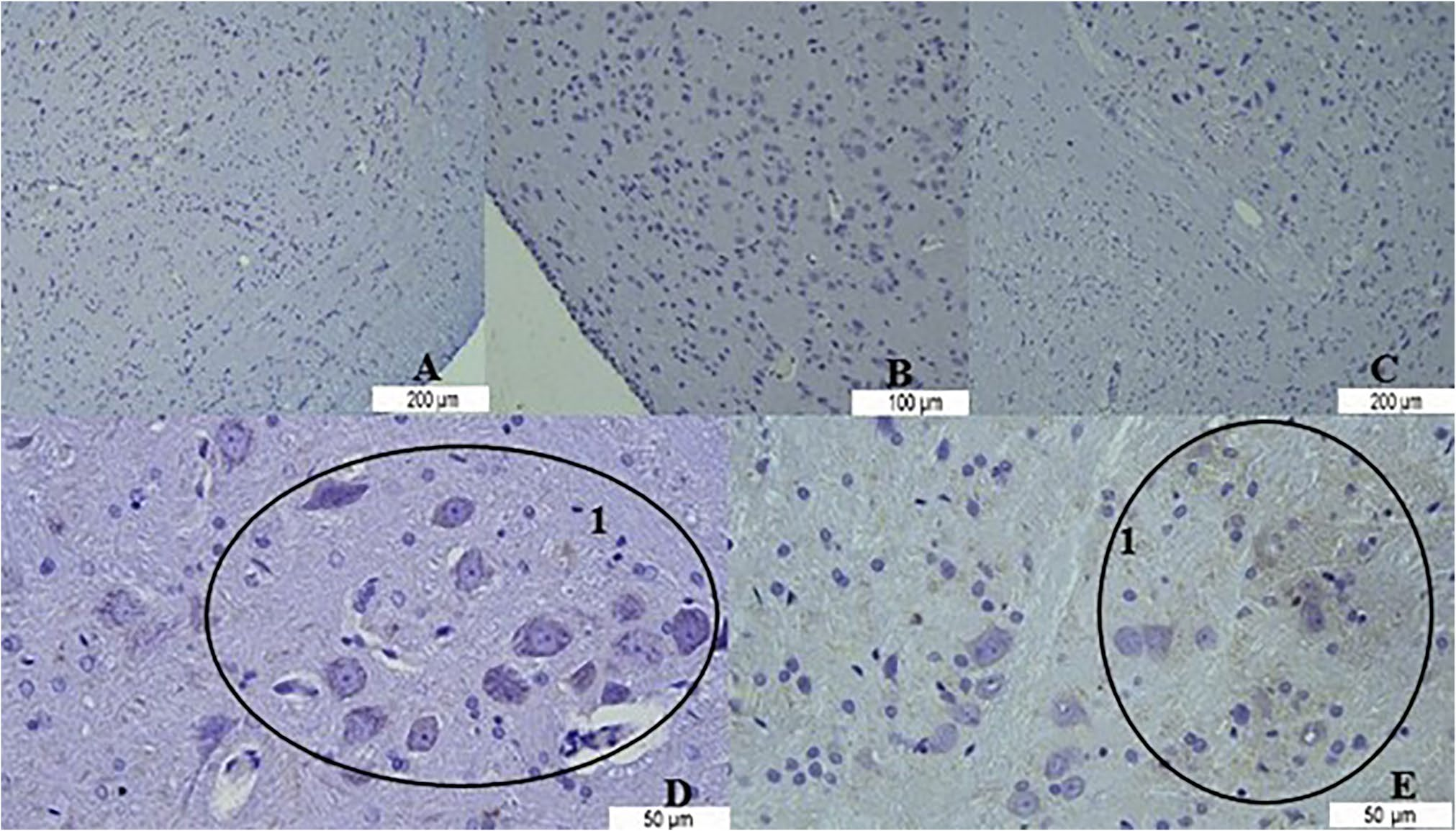
图5 大脑组织中Bcl-2的免疫反应性
对照组:A;去卵巢组:B;富氢水组:C;癫痫组:D;癫痫+富氢水组:E。
(注:标注“1”处为Bcl-2免疫反应性阳性区域)
 图6 小脑组织中Bcl-2的免疫反应性
图6 小脑组织中Bcl-2的免疫反应性
对照组:A;去卵巢组:B;富氢水组:C;癫痫组:D;癫痫+富氢水组:E。
3.4.2 半胱氨酸天冬氨酸蛋白酶3(Caspase 3)免疫反应性
- 大脑组织中:癫痫组(E组)检测到中度Caspase 3免疫反应性,而癫痫+富氢水组(E+HRW组)仅检测到弱免疫反应性(表4、图7);
- 小脑组织中:癫痫组(E组)和癫痫+富氢水组(E+HRW组)均仅检测到弱免疫反应性(表4、图8)。
大脑与小脑组织中,Caspase 3免疫反应性均定位于灰质区域神经元的细胞质内。

表4 大脑与小脑组织中Caspase 3免疫反应性的半定量评分表

图7 大脑组织中Caspase 3的免疫反应性
对照组:A;去卵巢组:B;富氢水组:C;癫痫组:D;癫痫+富氢水组:E。
(注:箭头指示Caspase 3免疫反应性阳性区域)
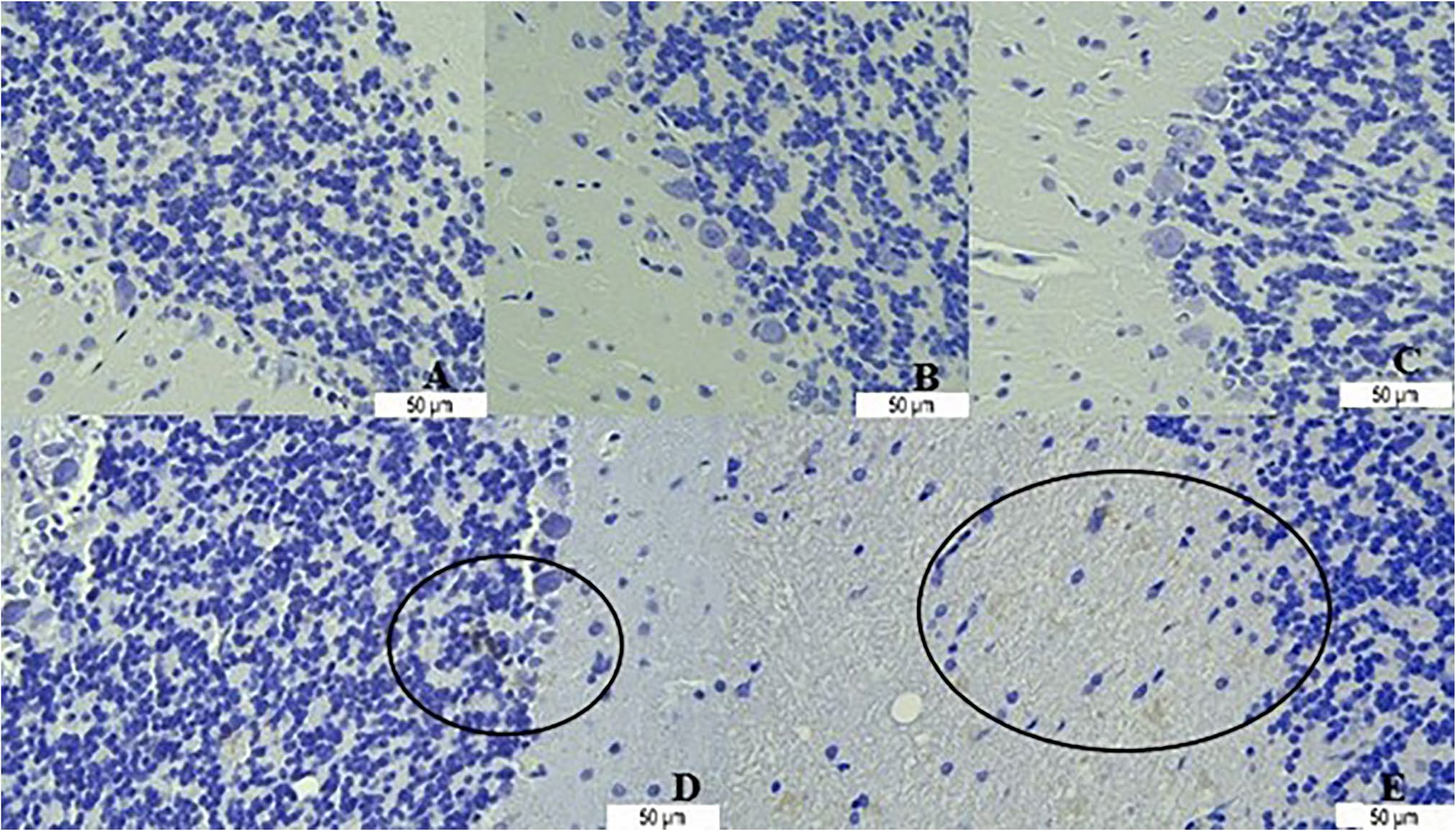
图8 小脑组织中Caspase 3的免疫反应性
对照组:A;去卵巢组:B;富氢水组:C;癫痫组:D;癫痫+富氢水组:E。
(注:圆圈指示Caspase 3免疫反应性阳性区域)
4 讨论
大脑是对氧化应激高度敏感的器官,这一方面是因为大脑内发生的代谢活动极为旺盛,另一方面是因为大脑是人体内耗氧量最高的部位。有研究证据表明,神经元过度兴奋以及自由基过量产生引发的氧化损伤,是导致癫痫发作和疾病进展的重要原因[26]。另有研究报道,脑损伤后神经元死亡会诱发活性氧生成和氧化应激,进而可能引发癫痫[27]。大量研究指出,癫痫发作时,线粒体是活性氧(ROS)产生的主要来源[27,28,29];且脑组织中活性氧的产生主要与线粒体呼吸链的复合体I相关[30]。除线粒体外,活性氧还可来源于其他途径,例如NADPH氧化酶和黄嘌呤氧化酶(XO)——这两种关键酶已被证实可被N-甲基-D-天冬氨酸(NMDA)受体激活[27]。
在参与氧化应激的各类分子中,过氧化氢(H₂O₂)尤为值得关注:它既是一种信号分子,同时当浓度失控时又可能对细胞产生有害影响。过氧化氢水平升高相关的氧化损伤,已被证实与多种疾病相关,包括神经系统疾病和肾脏损伤[31]。因此,需重点关注过氧化氢作为“信号分子”和“损伤因子”对神经系统的双重影响。此外,巯基化合物在维持细胞 redox(氧化还原)稳态中发挥关键作用,而 redox稳态是抵御活性氧有害影响的必要前提。巯基应激(定义为巯基-二硫键稳态失衡)常导致氧化应激,伴随活性氧水平升高,这一过程与多种生理和病理过程相关[32,33]。
氢气(H₂)凭借其抗氧化特性,已成为一种极具潜力的治疗剂。氢的抗氧化作用具有选择性:它仅中和活性最强、危害最大的活性氧(如羟基自由基),同时保留其他参与细胞信号传导的活性氧的有益功能[34]。已有大量研究通过利用富氢水的抗氧化作用,证实其在氧化损伤相关疾病中的积极效果[4,12,17]。此外,研究表明,在包括缺血诱导损伤在内的多种动物模型中,氢气可通过降低氧化损伤标志物和炎症水平,减轻氧化应激[35,36]。有报道指出,在氧化应激为关键致病因素的疾病中(尤其是神经退行性疾病和慢性肾脏损伤),氢气的这种治疗作用可成为有效的干预手段[31]。
本研究旨在评估氢气在戊四氮诱导癫痫发作模型中清除自由基的潜力。研究结果显示,与癫痫组(E组)相比,富氢水处理组(尤其是E+HRW组)存在显著差异,这种差异在组织中丙二醛(MDA)和谷胱甘肽(GSH)指标上表现得尤为明显。此外,血清中巯基-二硫键稳态的检测结果也显示,富氢水处理组与其他组存在差异。这一现象可解释为氢气对活性氧的清除作用——已有大量研究证实氢气对活性氧的积极调控效果[4,12,16,17]。
同时,本研究发现,凋亡标志物Bcl-2和Caspase 3在大脑和小脑组织样本中均表现出免疫反应性;且研究证实,富氢水处理可促进癫痫损伤组织的修复过程。这些证据表明,氢气对癫痫引发的组织神经元损伤(尤其是氧化损伤相关损伤)具有保护作用。
p53是一种关键的转录因子,可调控多条信号通路,形成精细复杂的调控网络,以维持细胞生理功能和稳态。凋亡是p53调控的细胞周期活动之一:p53通过Fas/Apol和Bax/Bcl-2通路调控凋亡,从而维持遗传稳定性;此外,磷酸化的p53还可调控PUMA、PARP、Pml等与凋亡相关的转录因子。p53在神经元凋亡中也发挥关键作用[37,38]。本研究中,癫痫组(E组)的p53基因表达水平显著高于对照组(C组);基因分析结果显示,富氢水处理(HRW)可降低p53的相对倍数变化,且与对照组相比,富氢水处理组的p53水平显著降低。这提示,富氢水对癫痫状态下p53的活性可能具有抑制和保护作用。
肿瘤抑制蛋白p27(常被称为KIP1)在静止期细胞中大量表达[39],细胞质中的p27可保护细胞免受代谢应激诱导的凋亡[40]。近期研究表明,p27在癫痫中发挥关键作用,其表达受抑制会对癫痫发作产生不利影响[41,42]。本研究发现,癫痫模型组(E组)的p27水平降低;此外,尽管未达到统计学差异,但富氢水处理后,癫痫大鼠的p27表达水平有所升高。这种差异可能与富氢水的剂量或给药频率相关,其具体机制及合理作用效果仍需进一步研究阐明。
综上,本研究在癫痫模型中证实了富氢水的治疗作用,明确了氢气疗法在对抗氧化损伤中的有效性。因此,我们推测,氢气有望成为癫痫患者的潜在替代治疗剂。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1502662.html?mobile=1
收藏

