 精选
精选
棕色脂肪细胞中的过氧化物酶体竟存在一种令人惊讶的产热方式
名为过氧化物酶体(peroxisomes)的细胞器被发现可在脂肪组织中发挥产热作用,且其采用的机制与已知产热蛋白UCP1无关。这一过程涉及单甲基支链脂肪酸(monomethyl branched-chain fatty acids,mmBCFAs)的合成与降解,由脂质合成酶FASN和过氧化物酶体酶ACOX2驱动。
Peroxisomal metabolism of branched fatty acids regulates energy homeostasis | Nature
研究背景
棕色脂肪细胞及其亲缘关系密切的米色脂肪细胞,可通过将化学能以热量形式消散,对维持体温和能量平衡至关重要[1]。这一过程通常被认为由一种名为UCP1的蛋白介导。然而,“UCP1缺陷小鼠未必会肥胖”这一观察结果[2]提示,还存在其他产热(生热)机制。目前已有多种不依赖UCP1的通路被提出,但它们对健康功能的相对作用、调控方式及重要性仍在研究中[3]。这些持续开展的研究不仅揭示了脂肪细胞消耗能量的策略具有多样性,也凸显了明确替代产热机制的重要意义。
过氧化物酶体是一种负责脂质分子代谢和活性氧代谢的细胞器,如今已成为这一研究领域中颇具吸引力的候选对象。这类细胞器在产热脂肪中含量丰富,可在寒冷刺激下增殖,并能调控线粒体[4](对能量和热量产生至关重要的细胞器)的分裂。若要理解脂肪组织的产热机制及其对全身能量平衡的影响,我们需明确过氧化物酶体是否能直接产热。
研究发现
我们发现了一种基于过氧化物酶体的产热机制,该机制需要单甲基支链脂肪酸(mmBCFAs)——这类脂肪酸来源于特定氨基酸的分解代谢[5]。为研究这一机制,我们结合了基因表达分析、蛋白定位研究、基因操控,以及体外和体内代谢检测等多种方法。这些方法帮助我们阐明了该产热通路的潜在机制及其在能量稳态中的意义。
我们将野生型小鼠与经基因工程改造、缺失UCP1编码基因的小鼠(Ucp1⁻/⁻小鼠)置于寒冷环境中,同时用去甲肾上腺素(一种激素)处理小鼠棕色脂肪细胞以触发产热,并检测由此引发的各类基因和蛋白表达变化。结果显示,这些条件会通过酶FASN促进mmBCFAs的合成,并上调ACOX2(一种介导β-氧化代谢反应的过氧化物酶体酶)的表达。随后,我们测试了调控ACOX2和FASN表达对产热、耐寒性及全身代谢的影响:
- 特异性删除脂肪组织中编码ACOX2或FASN的基因,会降低小鼠的耐寒性、减少产热能力(图1a),并加剧饮食诱导的肥胖和胰岛素抵抗;
- 相反,在脂肪组织中过表达ACOX2,即使在Ucp1⁻/⁻小鼠中,也能增强产热(图1b)、增加能量消耗并预防肥胖。
值得注意的是,若破坏mmBCFAs的合成,ACOX2过表达对耗氧量和产热的促进作用会完全消失。
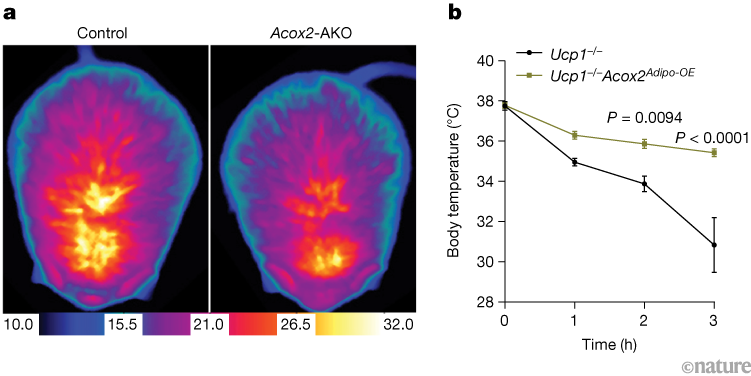
图1 | 酶ACOX2是脂肪组织产热的必要且充分条件
a. 对照组小鼠(左)与经基因工程改造、脂肪组织特异性缺失ACOX2酶的小鼠(Acox2-AKO,右)在寒冷环境中暴露6小时后的红外热成像图。温度单位为摄氏度。与对照组相比,Acox2-AKO小鼠的产热能力下降。
b. 已知参与产热的蛋白UCP1缺失小鼠(Ucp1⁻/⁻小鼠),以及“UCP1缺失且脂肪组织特异性过表达ACOX2”的小鼠(Ucp1⁻/⁻Acox2Adipo-OE小鼠)在寒冷暴露后的核心体温。数据以平均值±标准误(mean ± s.e.m.)表示。
通过蛋白定位研究我们发现,在产热条件下,脂质合成酶FASN会迁移至过氧化物酶体;而在过氧化物酶体中,mmBCFAs会被ACOX2氧化(分解)。这些通路共同构成了一个“无效(非生产性)脂质合成-降解循环”——该循环以ATP分子的形式消耗能量,并释放热量。我们开发了一种靶向过氧化物酶体的温度传感器,用于直接评估产热活性;将其在脂肪细胞中应用后证实,mmBCFA的氧化会升高过氧化物酶体的温度。
研究意义
我们的研究证实,过氧化物酶体的脂质代谢可产生热量,进而影响全身能量稳态。研究结果明确了过氧化物酶体在能量代谢中的作用——不仅超出了其已被明确的功能范畴,还确立了其作为脂肪组织产热关键参与者的地位。这些发现为肥胖和代谢疾病的治疗开辟了潜在途径:通过药物或饮食干预靶向mmBCFAs的过氧化物酶体代谢,有望为当前的肥胖治疗提供补充或替代方案。
然而,我们的研究结果基于动物实验和体外脂肪细胞模型,因此这一通路在人体全身产热中的意义仍有待证实。此外,通过饮食直接调控人体mmBCFA水平的方法也尚未经过验证。
在未来的研究中,我们希望评估过氧化物酶体产热对人体能量代谢的作用,并探索通过药物或营养手段激活或增强FASN-ACOX2通路的方法。
—— Xuejing Liu(刘雪景)与Irfan J. Lodhi,美国密苏里州圣路易斯市华盛顿大学医学院
专家观点
产热脂肪细胞中的过氧化物酶体正逐渐成为能量平衡的调控者。Lodhi实验室发现了这类细胞器的一种意想不到的作用——通过与线粒体动态变化相互作用发挥功能。该通路依赖于单甲基支链脂肪酸的合成与分解,这一过程需要酶FASN和ACOX2的参与。这些发现揭示了过氧化物酶体在全身能量调控中的独特作用,使其功能不再局限于经典的脂质代谢。
—— Lawrence Kazak,加拿大蒙特利尔麦吉尔大学
研究背后的故事
该项目的起点源于一个令人惊讶的观察结果:在寒冷暴露下的棕色脂肪中,尤其是在UCP1缺陷小鼠的棕色脂肪中,过氧化物酶体脂质代谢酶是表达上调最显著的蛋白之一。这一发现促使我们测试过氧化物酶体是否能产热。而FASN-ACOX2通路的发现,则源于定位研究——该研究显示,在产热刺激条件下,FASN会转移到过氧化物酶体中。研究中最令人兴奋的时刻之一,是观察到靶向过氧化物酶体的温度传感器在mmBCFA或去甲肾上腺素处理后实时“亮起”,这直接证实了过氧化物酶体可产热。
—— 刘雪景(X.L.)
要不要我帮你整理一份**该研究核心机制与关键实验对照表**?表格会清晰梳理“过氧化物酶体产热机制”的核心环节、关键分子(如FASN、ACOX2)及对应的验证实验,方便快速理解研究的核心逻辑。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1502858.html?mobile=1
收藏

