背景
高强度运动可诱发运动性肺损伤,其主要诱因是氧化应激水平升高与全身性炎症反应。尽管吸入氢气(H₂)被认为是一种具有抗氧化、抗炎潜力的非药物干预手段,但其在运动场景下的作用仍未明确。本研究旨在探究吸入氢气能否缓解运动员因运动引发的全身性应激反应。
方法
将31名健康运动员分为三组:对照组(14人)、红外毯组(9人)和氢气吸入组(8人)。在冬季训练前后分别采集运动员血液样本,检测以下指标:
- 氧化应激指标:总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA);
- 炎症及肺损伤相关指标:白细胞计数(WBC)、C反应蛋白(CRP);
- 血液学指标:红细胞计数(RBC)、血红蛋白(HB)、红细胞压积(HCT)、平均红细胞体积(MCV);
- 生化指标:肌酸激酶(CK)、血尿素氮(BUN);
- 应激相关激素指标:总睾酮(T)、皮质醇(C)、铁蛋白(FE)。
以肺损伤情况反映运动诱导的肺部应激反应,并推测全身性应激及炎症刺激相关指标变化。
结果
单次运动后干预结果显示,氢气吸入组运动员的抗氧化能力显著提升,白细胞计数(WBC)与C反应蛋白(CRP)水平降低;且该效果在整个冬季训练周期内持续存在。此外,与红外毯组不同,氢气吸入组运动员的红细胞计数(RBC)、血红蛋白(HB)及红细胞压积(HCT)水平维持稳定,表明其携氧能力与血液学指标稳定性得到更好保留。
结论
吸入氢气可通过降低氧化应激与炎症反应,缓解运动诱导的肺损伤。在冬季高强度运动训练中,吸入氢气或可作为一种具有潜力的辅助手段,用于保护运动员的肺功能。
• 在冬季训练开始前,运动员急性运动后进行单次氢气(H₂)吸入干预,可缓解运动诱导的氧化应激与全身性炎症反应。
• 与对照组和红外毯组相比,冬季训练后,氢气吸入组运动员的红细胞相关指标及抗氧化能力维持更稳定。
已知信息与创新点
高强度体力活动会诱发氧化损伤与炎症反应,进而导致运动相关肺损伤。
本研究表明,吸入氢气可通过调节全身性氧化应激与炎症反应,对肺损伤发挥保护作用。
意义与实践建议
氢气治疗或可作为一种新型无创策略,用于降低高水平运动员的肺损伤风险,未来应将其纳入运动员恢复方案的考量范围。
Zhang X, Lu X, Li F, Gu H, Cheng X, Tang J, Zhang X, Jiang J, Feng L, Li X. Alleviation of exercise-induced injury by hydrogen inhalation via the reduction of oxidative stress and inflammation in athletes. J Thorac Dis. 2025 Aug 31;17(8):6151-6162.
Correspondence to: Xuemin Li, MM. Department of Neurosurgery, Putuo Hospital, Shanghai University of Traditional Chinese Medicine, No. 409 Meiling North Road, Caoyang, Putuo District, Shanghai 200063, China. Email: xixi0348@126.com; Jun Jiang, MD; Li Feng, MD. Endoscopy Center, Minhang District Central Hospital, Fudan University, No. 170 Xinsong Road, Shanghai 201100, China. Email: jun_jiang@fudan.edu.cn; feng_li@fudan.edu.cn.
引言
高强度运动可通过激活代谢提升机体适应性,但同时也会诱发氧化应激与炎症反应,这是运动医学领域关注的重点问题[1]。运动过程中,骨骼肌耗氧量骤增,导致活性氧(ROS)过量生成;当活性氧的生成量超过抗氧化系统的清除能力时,便会引发氧化应激[2]。这种代谢失衡会激活核因子κB(NF-κB)等炎症信号通路,促进促炎因子释放,进而招募中性粒细胞与巨噬细胞[3]。由此引发的炎症反应不仅会损害气体交换功能,还会破坏肺泡-毛细血管屏障,导致运动性支气管收缩、肺水肿,长期反复则可能发展为肺纤维化[4,5]。随着时间推移,此类炎症反应可导致弥漫性肺损伤,其特征为肺泡结构破坏、间质水肿、气道通透性增加,最终诱发运动性肺损伤[6]。值得注意的是,反复高强度运动可能引发恶性循环:未被清除的氧化应激与持续的低度炎症会损害肺部的恢复能力,尤其对于未经系统训练或本身存在呼吸系统疾病的人群影响更为显著。此外,长期过度训练还可能导致免疫系统紊乱、心脏增大等问题[7]。因此,寻找可缓解运动诱导的氧化应激与肺部炎症反应的有效策略具有重要意义。除运动后干预外,运动前预防策略也至关重要,例如有研究表明,充分补水可减少运动性支气管收缩,保护肺功能[8]。
目前已有的运动后恢复策略主要聚焦于缓解肌肉疲劳、促进代谢废物清除[9]。其中,红外治疗因可改善局部血液循环、减轻肌肉酸痛、加速恢复,被广泛应用于运动恢复领域[10],常用设备包括红外毯等[11]。红外治疗通过发射可穿透表层组织的红外线,促进血管舒张与组织代谢[12]。然而,红外毯的治疗效果主要局限于浅表组织,其对深部肺部氧化应激与炎症反应的调节能力仍不明确。运动性肺损伤涉及肺泡上皮损伤、氧化失衡及微血管水平的持续炎症,而红外治疗在预防或缓解此类损伤方面的效果有限。因此,需要更具针对性的干预手段来调节全身性氧化应激与炎症反应,从而为高强度运动后的肺功能提供更好的保护。
近年来,氢气(H₂)凭借其独特的抗氧化与抗炎特性,作为一种新型治疗手段受到广泛关注。氢气分子体积小且呈非极性,能够快速穿透生物膜,选择性清除羟自由基(·OH)与过氧亚硝酸盐(ONOO⁻),且不干扰正常的氧化还原信号[13]。此外,氢气还可抑制NF-κB与NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体的激活,从而减少促炎因子释放,缓解组织炎症[14]。越来越多的研究表明,氢气治疗对多种与氧化应激、炎症相关的疾病具有保护作用。值得关注的是,吸入氢气在缓解缺血再灌注损伤与脓毒症所致肺损伤方面已显示出疗效:一项研究证实,在盲肠结扎穿孔小鼠模型中,氢气可通过调节铁死亡与谷胱甘肽代谢通路,缓解肺部氧化应激与炎症反应,减轻急性肺损伤[15];另有研究发现,在小鼠放射性肺损伤模型中,氢气可通过抑制NF-κB信号通路,促进巨噬细胞向M2型极化,从而缓解炎症反应[16];还有研究表明,吸入氢气可通过激活AMP激活的蛋白激酶(AMPK)信号通路,抑制炎症介质释放、下调动力相关蛋白1(Drp1)与半胱氨酸天冬氨酸蛋白酶3(Caspase-3)等凋亡相关蛋白的表达,有效缓解脂多糖(LPS)诱导的急性肺损伤,进而改善肺功能、减轻肺组织炎症与水肿、提高生存率[17]。然而,氢气在预防或缓解运动性肺损伤中的潜在作用尚未得到充分研究。
鉴于传统物理治疗在缓解氧化应激与肺部炎症方面存在局限性,本研究旨在通过评估吸入氢气对高强度运动后氧化应激与炎症反应的抑制作用,明确其对运动性肺损伤的保护效果。同时,通过与红外治疗的疗效对比,阐明两种干预手段的相对有效性,为高强度训练运动员探索更有效的肺部保护与恢复策略。
方法
研究对象
本研究最初从上海市第二体育运动学校招募了46名健康志愿者,年龄15-27岁,长期从事田径、自行车、举重等项目训练(不含游泳项目)。所有参与者均接受过至少3年的常规专业训练,其中多数人在各自运动项目中持续训练5年及以上。研究队列包含男性与女性运动员,各组性别分布详情见表1。分组前所有参与者均接受健康评估,确认无心血管疾病、呼吸系统疾病、代谢紊乱及其他严重基础疾病。部分参与者因未完成运动测试或干预流程被排除,最终纳入分析的样本量为31人。研究于2024年11月至2025年4月开展,所有运动测试、干预措施及生化分析均在上海市闵行区中心医院与上海市第二体育运动学校医务室完成。本研究遵循《赫尔辛基宣言》及其后续修订版的伦理原则,已获得上海市闵行区中心医院伦理委员会批准(批准号:2025-approval-005-015)。所有参与者或其法定监护人在入组前均签署了书面知情同意书。
表 1 参与者冬季训练前与冬季训练后的基线特征
编号 | 性别 | 年龄 | 冬季训练前 | 冬季训练后 | ||||
健康状况 | 既往疾病 | 干预方式 | 健康状况 | 既往疾病 | 干预方式 | |||
MH13 | 男 | 27 | 良 | 无 | 氢气 | 健康 | 无 | 氢气 |
MH15 | 男 | 22 | 健康 | 无 | 氢气 | 健康 | 无 | 氢气 |
MH16 | 男 | 20 | 健康 | 无 | 氢气 | — | — | — |
MH17 | 女 | 20 | 健康 | 无 | 氢气 | — | — | — |
MH18 | 男 | 20 | 健康 | 无 | 氢气 | 健康 | 无 | 氢气 |
MH20 | 女 | 17 | 健康 | 无 | 氢气 | 健康 | 无 | 氢气 |
MH21 | 男 | 19 | 健康 | 无 | 氢气 | 健康 | 无 | 氢气 |
MH22 | 男 | 18 | 健康 | 无 | 氢气 | 健康 | 无 | 氢气 |
MH24 | 女 | 21 | 健康 | 无 | 红外毯 | 健康 | 无 | 红外毯 |
MH25 | 男 | 20 | 良 | 无 | 红外毯 | 健康 | 无 | 红外毯 |
MH26 | 男 | 24 | 良 | 无 | 红外毯 | 健康 | 无 | 红外毯 |
MH27 | 女 | 20 | 健康 | 无 | 红外毯 | 健康 | 无 | 红外毯 |
MH28 | 男 | 21 | 健康 | 无 | 红外毯 | — | — | — |
MH29 | 男 | 22 | 健康 | 无 | 红外毯 | — | — | — |
MH30 | 男 | 20 | 健康 | 无 | 红外毯 | — | — | — |
MH31 | 女 | 18 | 健康 | 无 | 红外毯 | 健康 | 无 | 红外毯 |
MH32 | 男 | 17 | 健康 | 无 | 红外毯 | — | — | — |
MH33 | 男 | 18 | 健康 | 无 | 对照组 | — | — | — |
MH34 | 男 | 17 | 健康 | 无 | 对照组 | — | — | — |
MH35 | 男 | 16 | 良 | 无 | 对照组 | 健康 | 无 | 对照组 |
MH36 | 男 | 18 | 健康 | 无 | 对照组 | 健康 | 无 | 对照组 |
MH37 | 男 | 15 | 健康 | 无 | 对照组 | 健康 | 无 | 对照组 |
MH38 | 男 | 15 | 良 | 无 | 对照组 | 健康 | 无 | 对照组 |
MH39 | 男 | 15 | 健康 | 无 | 对照组 | 健康 | 无 | 对照组 |
MH40 | 女 | 16 | 健康 | 无 | 对照组 | 良 | 无 | 对照组 |
MH41 | 男 | 16 | 健康 | 无 | 对照组 | 健康 | 无 | 对照组 |
MH42 | 女 | 16 | 良 | 无 | 对照组 | 良 | 无 | 对照组 |
MH43 | 男 | 16 | 健康 | 无 | 对照组 | 健康 | 无 | 对照组 |
MH44 | 男 | 16 | 良 | 无 | 对照组 | — | — | — |
MH45 | 男 | 15 | 健康 | 无 | 对照组 | 健康 | 无 | 对照组 |
MH46 | 男 | 16 | 健康 | 无 | 对照组 | 健康 | 无 | 对照组 |
研究设计与干预方案
本研究采用非随机对照干预设计,共纳入 31 名健康志愿者。参与者首先完成标准化运动测试,包括两轮重复短距离冲刺骑行训练,每轮训练包含 10 秒最大功率冲刺(负荷设定为体重的 7.5%)和 110 秒无负荷低速骑行(转速 60 转 / 分钟)(图 1A)。运动测试结束后,根据自愿原则和训练安排将参与者分为三组,并接受以下干预:(I)对照组(n=14):运动后自然恢复,吸入室内空气;(II)红外毯组(n=9):运动后使用红外热疗设备(红外毯)进行 20 分钟干预;(III)氢气组(n=8):运动后立即进行氢气吸入干预。混合气体由氢气发生器(AMS-H-03,上海阿斯科利比斯医疗科技有限公司)产生,吸入气体成分包括 66.7% 氢气、33.3% 氧气、0% 二氧化碳,其余为氮气,气体流量设定为 3 升 / 分钟,持续 20 分钟。干预期间,所有参与者先静坐休息 10 分钟,随后以 60% 峰值摄氧量(VO₂peak)完成 20 分钟中等强度骑行,最后进行 5 分钟恢复期(图 1B)。由于干预方式的特殊性,参与者知晓自身所在分组,干预阶段未采用盲法。
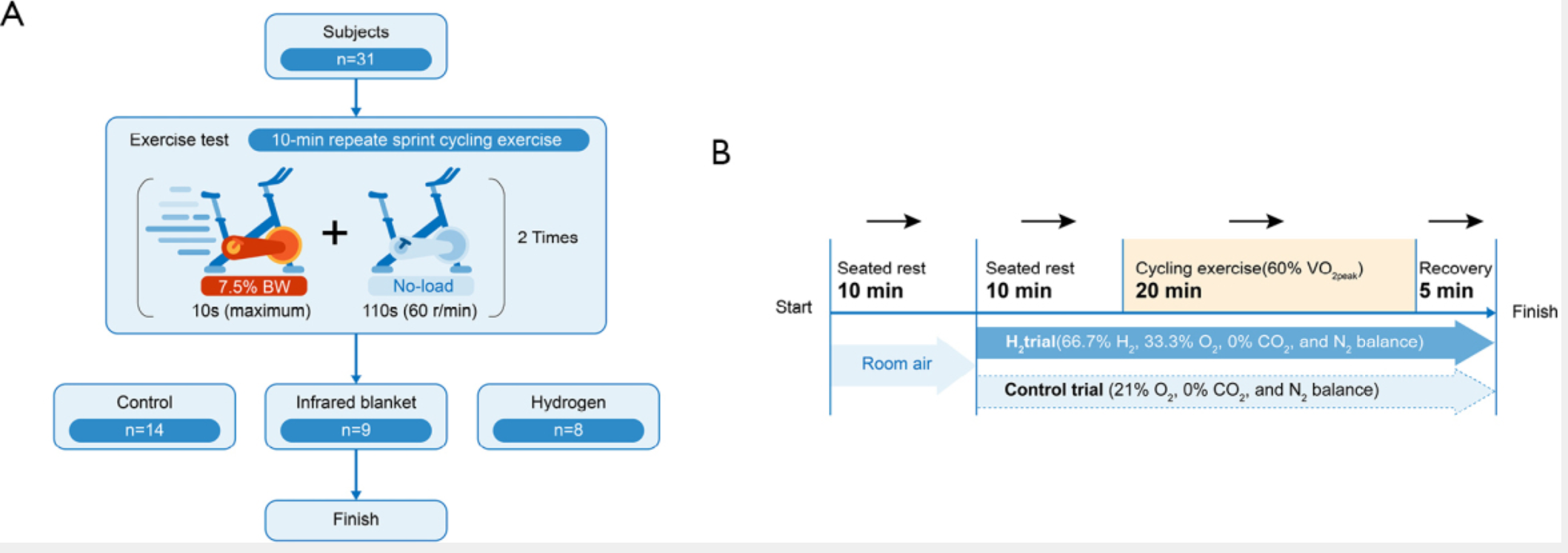 图 1 研究设计与干预方案(A)31 名参与者的招募与分组流程图。所有参与者均完成标准化重复冲刺骑行运动(10 秒体重 7.5% 负荷骑行 + 110 秒 60 转 / 分钟无负荷骑行,重复两次),随后分别接受对照组(n=14)、红外毯组(n=9)或氢气吸入组(n=8)干预;(B)氢气组与对照组试验流程时间线,包括 10 分钟静坐休息(吸入室内空气)、20 分钟 60% 峰值摄氧量骑行运动及 5 分钟恢复期。试验期间,氢气组吸入含 66.7% 氢气、33.3% 氧气、0% 二氧化碳及余量氮气的混合气体,对照组吸入含 21% 氧气、0% 二氧化碳及余量氮气的气体。注:BW = 体重(body weight);VO₂peak = 峰值摄氧量(peak oxygen uptake)。
图 1 研究设计与干预方案(A)31 名参与者的招募与分组流程图。所有参与者均完成标准化重复冲刺骑行运动(10 秒体重 7.5% 负荷骑行 + 110 秒 60 转 / 分钟无负荷骑行,重复两次),随后分别接受对照组(n=14)、红外毯组(n=9)或氢气吸入组(n=8)干预;(B)氢气组与对照组试验流程时间线,包括 10 分钟静坐休息(吸入室内空气)、20 分钟 60% 峰值摄氧量骑行运动及 5 分钟恢复期。试验期间,氢气组吸入含 66.7% 氢气、33.3% 氧气、0% 二氧化碳及余量氮气的混合气体,对照组吸入含 21% 氧气、0% 二氧化碳及余量氮气的气体。注:BW = 体重(body weight);VO₂peak = 峰值摄氧量(peak oxygen uptake)。
冬季训练后评估
初始干预结束后,31 名参与者均继续进行常规冬季训练。冬季训练结束后,原 31 名参与者中有 24 人同意参与随访测试,并根据初始干预分组重新归入对应组别:氢气组(n=6)、红外毯组(n=9)、对照组(n=9)。
血液样本采集
分别于第一次运动测试前 7 小时(第 1 天)、第 2 天至第 4 天运动测试完成后 16 小时,采集参与者肘前静脉空腹血样本。样本在 4℃条件下以 3000 转 / 分钟离心 15 分钟,分离血清后置于 - 80℃保存,用于后续生化分析。
生化分析
采用标准化方法检测血清中氧化应激及炎症相关生物标志物水平。总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA)、睾酮(T)、皮质醇、铁蛋白(FE)及 C 反应蛋白(CRP)水平,使用商用酶联免疫吸附测定(ELISA)试剂盒(南京建成生物工程研究所),严格按照试剂盒说明书操作检测。血液学指标(包括白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(HB)、红细胞压积(HCT)及平均红细胞体积(MCV))采用全自动血液分析仪(XE-2100,日本 Sysmex 公司)检测。肌酸激酶(CK)及血尿素氮(BUN)水平采用全自动生化分析仪(Hitachi 7600,日本东京)通过酶促比色法检测。所有检测均遵循标准实验室操作流程及质量控制规范。
统计学分析
使用 GraphPad Prism 9.0 软件(Dotmatics 公司,美国马萨诸塞州波士顿)进行统计学分析及图表绘制。所有数据以 “均值 ± 标准差(SD)” 表示。鉴于本研究样本量较小且为探索性研究,未进行正式的正态性检验,但通过直方图直观评估数据分布,结果显示数据近似符合正态分布。采用单因素方差分析(ANOVA)比较同一时间点三组(对照组、红外毯组、氢气组)间的差异,随后通过 Tukey 多重比较检验进行组间两两比较。P<0.05 认为差异具有统计学意义。
结果
参与者基线特征
共 31 名健康运动员(年龄 15-27 岁)自愿参与本研究,并完成冬季训练前评估。根据训练计划及个人意愿,参与者被分为三组:对照组(n=14)、红外毯组(n=9)、氢气吸入组(n=8)。参与者的基线特征(包括年龄、性别及健康状况)汇总于表 1。
冬季训练前干预的效果
氧化应激标志物
如图 2A-2C 所示,与对照组相比,红外毯组和氢气组参与者的抗氧化能力均显著增强(表现为 T-AOC 和 SOD 水平升高);相反,脂质过氧化标志物 MDA 的水平在干预组中显著降低。其中,氢气组的改善效果最为显著,提示氢气在缓解运动诱导的氧化应激方面具有更强的作用。
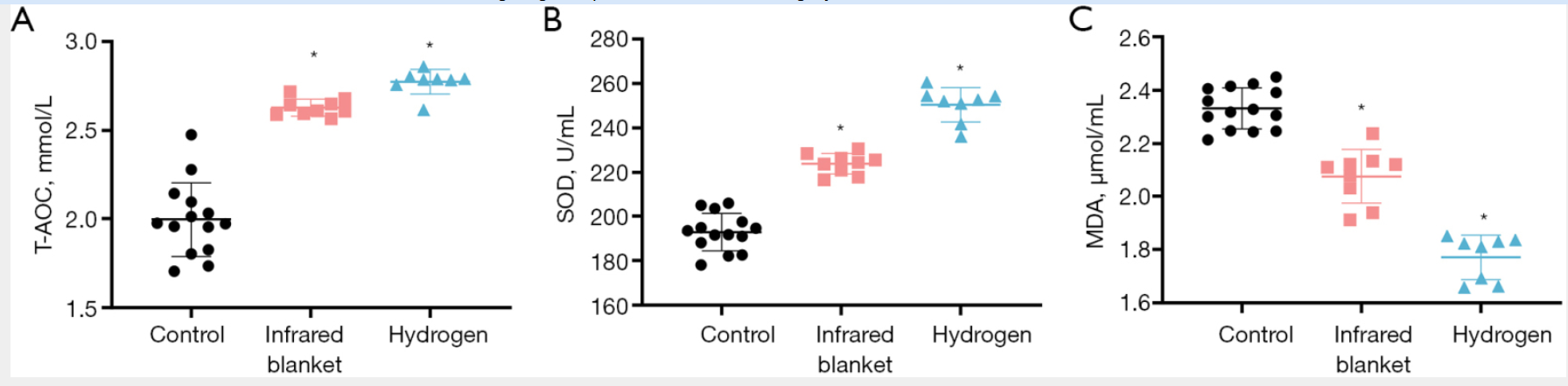 图 2 冬季训练前氢气吸入与红外毯干预对氧化应激标志物的影响(A)总抗氧化能力(T-AOC)、(B)超氧化物歧化酶(SOD)、(C)丙二醛(MDA)水平(三组均于冬季训练前检测)。与对照组相比,两个干预组(红外毯组、氢气组)的 T-AOC 和 SOD 水平均显著升高,且氢气组效果最明显;两个干预组的 MDA 水平均显著降低,氢气组降低更为显著。注:* 表示与对照组相比,P<0.05;MDA = 丙二醛(malondialdehyde);SOD = 超氧化物歧化酶(superoxide dismutase);T-AOC = 总抗氧化能力(total antioxidant capacity)。
图 2 冬季训练前氢气吸入与红外毯干预对氧化应激标志物的影响(A)总抗氧化能力(T-AOC)、(B)超氧化物歧化酶(SOD)、(C)丙二醛(MDA)水平(三组均于冬季训练前检测)。与对照组相比,两个干预组(红外毯组、氢气组)的 T-AOC 和 SOD 水平均显著升高,且氢气组效果最明显;两个干预组的 MDA 水平均显著降低,氢气组降低更为显著。注:* 表示与对照组相比,P<0.05;MDA = 丙二醛(malondialdehyde);SOD = 超氧化物歧化酶(superoxide dismutase);T-AOC = 总抗氧化能力(total antioxidant capacity)。
炎症及组织损伤指标
如图 3 所示,红外毯组和氢气组的白细胞计数(WBC)略低于对照组(图 3A),提示干预后全身性炎症反应减轻。各组的红细胞计数(RBC)、血红蛋白(HB)及红细胞压积(HCT)水平保持相对稳定(图 3B-3D),表明干预未影响整体血液稳态。两个干预组的平均红细胞体积(MCV)均显著降低。氢气组的睾酮(T)水平(图 3F)和铁蛋白(FE)水平(图 3H)显著高于对照组,提示高强度运动后急性内分泌应激反应增强。红外毯组的皮质醇水平(图 3G)显著低于对照组,氢气组皮质醇水平略低于对照组,但差异无统计学意义。在生化损伤标志物方面,各组间血尿素氮(BUN)水平无显著差异(图 3I);氢气组的肌酸激酶(CK)水平显著升高,提示肌肉反应更强(图 3J);尽管差异无统计学意义,但氢气组的 C 反应蛋白(CRP)水平最低,提示其可能具有抗炎作用(图 3K)。总体而言,这些结果表明,即使在冬季训练开始前,吸入氢气也能对全身性炎症反应及神经内分泌应激产生有益影响。
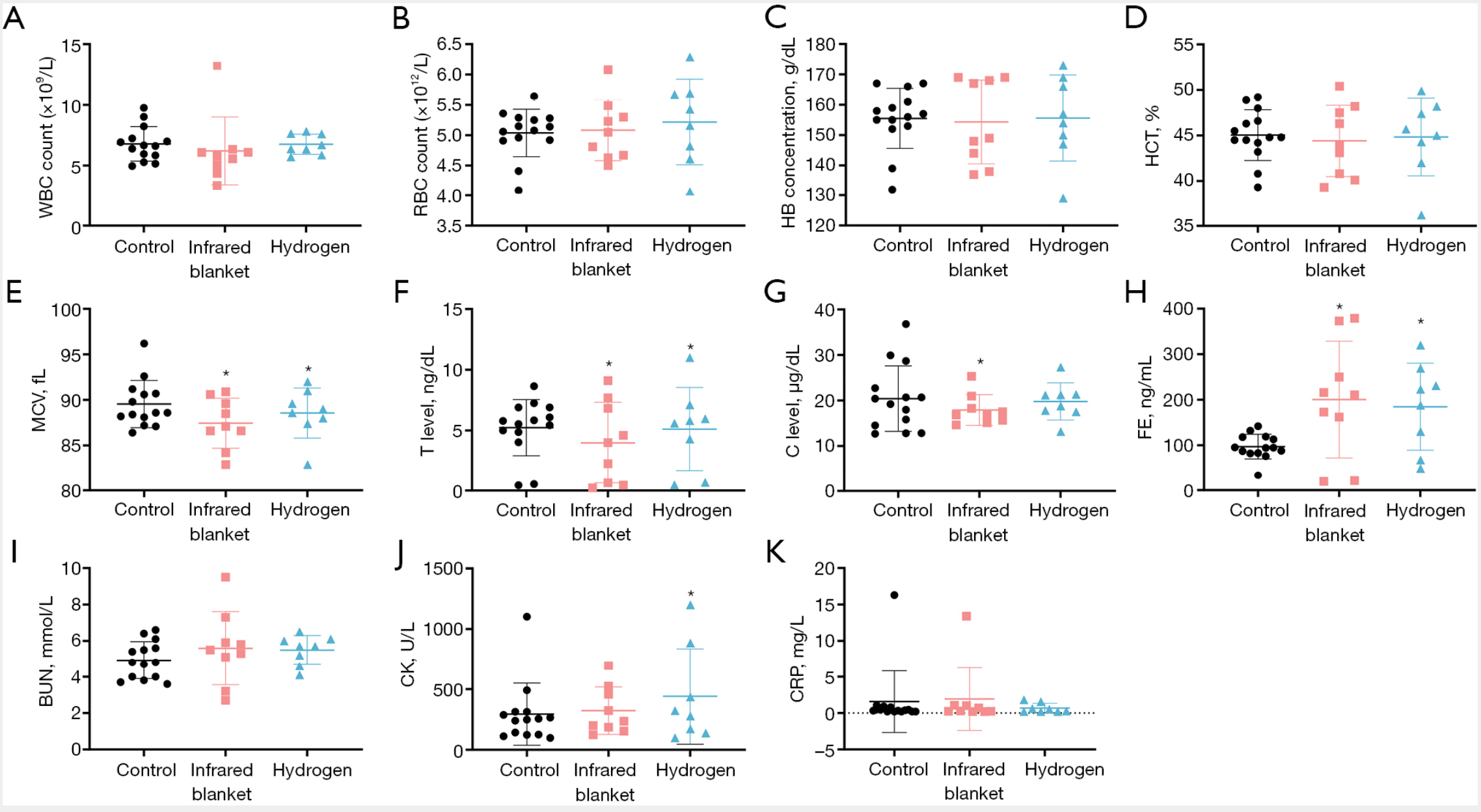 图3 冬季训练前全身性炎症、血液学指标、内分泌指标及生化标志物的变化
图3 冬季训练前全身性炎症、血液学指标、内分泌指标及生化标志物的变化
(A-E)通过检测白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(HB)、红细胞压积(HCT)及平均红细胞体积(MCV),评估全身性炎症状态与血液学状况;(F-H)定量检测睾酮(T)、皮质醇(C)及铁蛋白(FE),作为内分泌指标;(I-K)通过血尿素氮(BUN)、肌酸激酶(CK)及C反应蛋白(CRP)评估肌肉损伤与炎症程度。结果显示,氢气组的睾酮(T)和铁蛋白(FE)水平显著改善,而肌酸激酶(CK)水平明显升高,提示运动后应激反应更显著。注:*表示与对照组相比,P<0.05;BUN=血尿素氮(blood urea nitrogen);C=皮质醇(cortisol);CK=肌酸激酶(creatine kinase);CRP=C反应蛋白(C-reactive protein);FE=铁蛋白(ferritin);HB=血红蛋白(hemoglobin);HCT=红细胞压积(hematocrit);MCV=平均红细胞体积(mean corpuscular volume);RBC=红细胞计数(red blood cell count);T=睾酮(testosterone);WBC=白细胞计数(white blood cell count)。
冬季训练后干预的效果
共有24名参与者完成冬季训练后的随访评估,其具体特征详见表1。三组参与者在年龄和性别分布上保持均衡。
训练后的氧化应激标志物
如图4A-4C所示,红外毯组和氢气组的总抗氧化能力(T-AOC)与超氧化物歧化酶(SOD)水平仍维持在较高水平,而丙二醛(MDA)水平持续下降。这一趋势与训练前的结果一致,表明两种干预措施均具有持续的抗氧化作用。在增强抗氧化防御能力方面,氢气组的效果始终优于红外毯组。
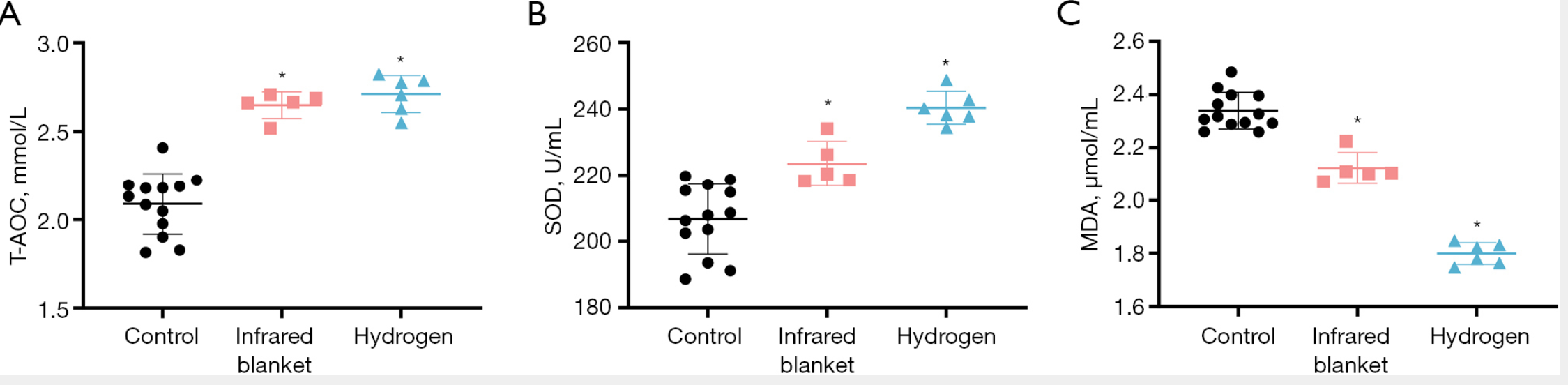 图4 三组参与者训练后氧化应激标志物的变化
图4 三组参与者训练后氧化应激标志物的变化
(A)总抗氧化能力(T-AOC)、(B)超氧化物歧化酶(SOD)、(C)丙二醛(MDA)水平(均于冬季训练后检测)。与对照组相比,氢气组和红外毯组的T-AOC、SOD水平均显著升高,MDA水平显著降低,表明两种干预均具有持续的抗氧化效果。注:*表示与对照组相比,P<0.05;MDA=丙二醛(malondialdehyde);SOD=超氧化物歧化酶(superoxide dismutase);T-AOC=总抗氧化能力(total antioxidant capacity)。
全身性炎症与生理指标
如图5A所示,与对照组相比,红外毯组和氢气组的白细胞计数(WBC)均显著降低,提示运动诱导的全身性炎症反应得到缓解。在血液学指标方面(图5B-5E),红外毯组的红细胞计数(RBC)、血红蛋白(HB)、红细胞压积(HCT)及平均红细胞体积(MCV)水平较对照组显著下降,而氢气组的红细胞计数(RBC)、血红蛋白(HB)、红细胞压积(HCT)水平维持相对稳定,但平均红细胞体积(MCV)也显著降低。如图5F-5H所示,两个干预组的睾酮(T)、皮质醇(C)及铁蛋白(FE)水平均高于对照组,且氢气组的中位值始终高于红外毯组,提示运动后神经内分泌反应更显著。红外毯组和氢气组的血尿素氮(BUN)(图5I)与肌酸激酶(CK)(图5J)水平均显著低于对照组;但训练后,氢气组的C反应蛋白(CRP)水平出现统计学意义上的升高(图5K),而红外毯组未观察到显著变化。综上,这些结果表明,尽管两种干预措施均有助于降低炎症和组织损伤标志物水平,但氢气吸入组的应激激素反应更强,提示长期训练可能引发复杂的生理适应性变化。
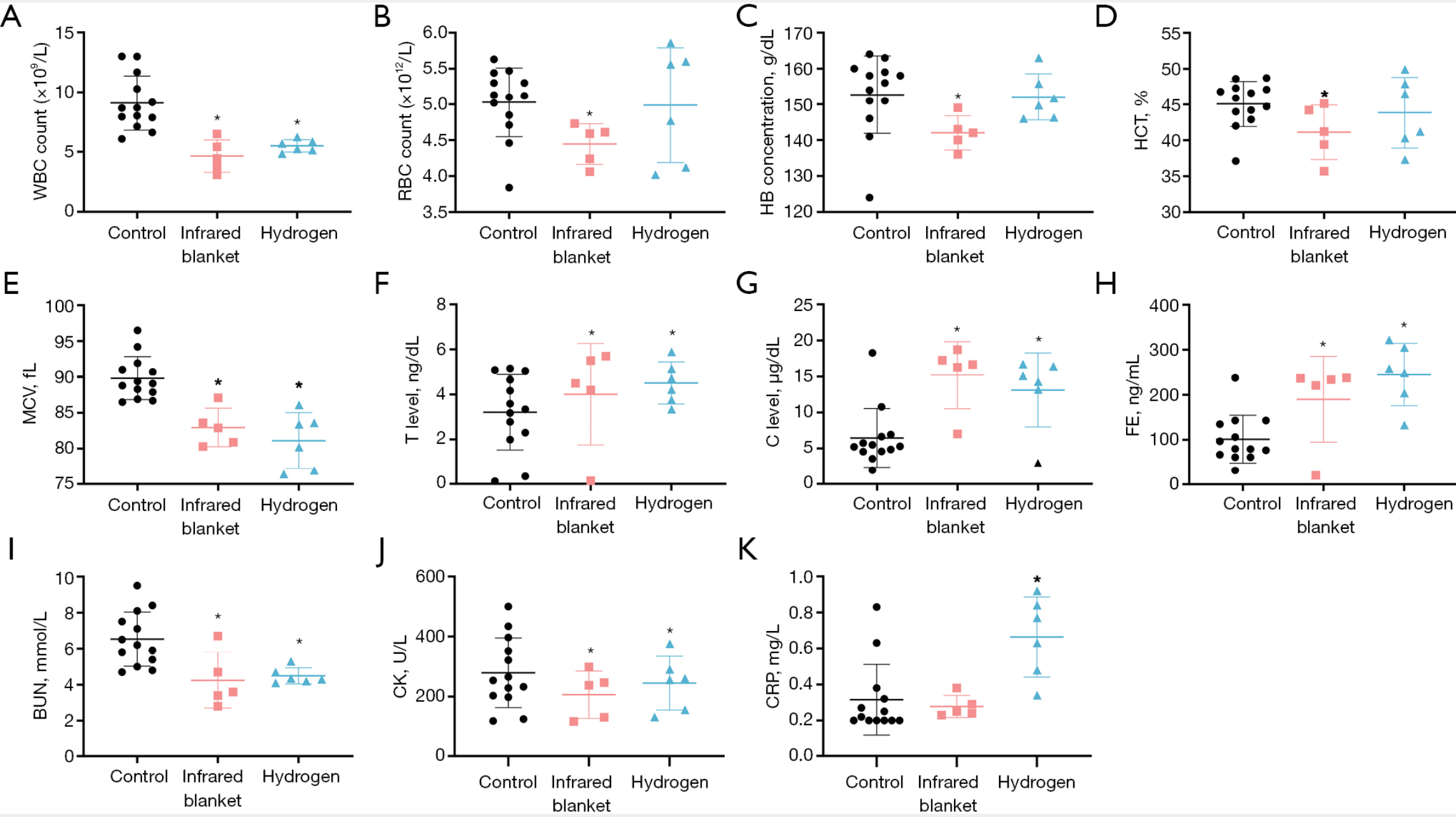 图5 训练后三组参与者炎症、血液学及生理指标的比较
图5 训练后三组参与者炎症、血液学及生理指标的比较
(A)白细胞计数(WBC)、(B)红细胞计数(RBC)、(C)血红蛋白(HB)、(D)红细胞压积(HCT)反映全身性炎症状态与血液学状况;(E)平均红细胞体积(MCV)、(F)睾酮(T)、(G)皮质醇(C)、(H)铁蛋白(FE)反映神经内分泌与铁储存反应;(I)血尿素氮(BUN)、(J)肌酸激酶(CK)、(K)C反应蛋白(CRP)分别作为肌肉应激、肾功能及炎症的评估指标。氢气组和红外毯组对这些标志物的调节作用存在差异,其中氢气组总体上能维持血液学稳态,并表现出更强的应激与恢复反应。注:*表示与对照组相比,P<0.05;BUN=血尿素氮(blood urea nitrogen);C=皮质醇(cortisol);CK=肌酸激酶(creatine kinase);CRP=C反应蛋白(C-reactive protein);FE=铁蛋白(ferritin);HB=血红蛋白(hemoglobin);HCT=红细胞压积(hematocrit);MCV=平均红细胞体积(mean corpuscular volume);RBC=红细胞计数(red blood cell count);T=睾酮(testosterone);WBC=白细胞计数(white blood cell count)。
讨论
本研究评估了氢气吸入和红外热疗毯两种干预措施对运动员运动性肺损伤的保护作用,重点关注氧化应激、全身性炎症及血液学稳态三个方面。结果表明,氧化应激可能在多种肺损伤机制中发挥核心作用。有研究指出,氧化应激通过破坏线粒体结构与功能,诱导铁死亡和自噬,进而导致肺上皮细胞损伤[18];在纳米塑料暴露引发的肺损伤中,氧化应激是关键介导机制,且常伴随铁调素降解、铁离子释放及肺泡-毛细血管屏障功能障碍;另有研究发现,长期香烟烟雾暴露会显著降低大鼠肺组织的总抗氧化能力(T-AOC),削弱活性氧(ROS)的清除能力,通过氧化损伤和DNA修复机制受损加剧肺损伤[19],这提示总抗氧化能力(T-AOC)水平下降在香烟烟雾诱导的肺损伤中起关键作用。基于这一发现,有必要进一步研究明确氢气如何调节总抗氧化能力(T-AOC)水平——阐明该机制或有助于揭示氢气在抗氧化应激及肺损伤保护中的作用原理。本研究结果显示,无论在冬季训练前还是训练后,氢气吸入均比红外热疗具有更强、更持久的抗氧化和抗炎效果:训练前,接受氢气吸入的参与者总抗氧化能力(T-AOC)和超氧化物歧化酶(SOD)水平显著升高,同时丙二醛(MDA)水平降低,表明其抗氧化应激能力增强。
炎症是运动性肺损伤的另一重要诱因[20]。研究表明,过度炎症会损伤肺上皮、破坏肺泡-毛细血管屏障,并引发免疫细胞浸润[21,22]。在临床和运动场景中,C反应蛋白(CRP)和白细胞计数(WBC)是常用的炎症标志物,在炎症相关疾病中具有重要临床价值[23]。其中,C反应蛋白(CRP)水平可在炎症早期快速升高,反映全身性炎症反应的强度,且不易受激素或其他因素干扰,适合动态监测肺部炎症变化[24];白细胞计数(WBC)及其分类计数(如中性粒细胞计数)有助于判断炎症类型与严重程度,在细菌性肺炎等疾病中尤为重要[25]。本研究中,氢气吸入在冬季训练前后均持续降低白细胞计数(WBC)水平,且训练前的C反应蛋白(CRP)水平也受到抑制,这些结果提示氢气可能通过调节免疫反应减轻运动诱导的全身性炎症。而氢气组训练后C反应蛋白(CRP)水平升高,这可能与适应性应激反应有关,而非持续性炎症。
皮质醇是体内典型的应激激素,在高强度运动或炎症反应时,其水平常显著升高,并参与调节代谢、免疫及炎症过程[26]。研究表明,皮质醇分泌过多会加剧肺部炎症、损伤肺泡-上皮屏障,并促进氧化应激反应[27,28]。本研究中,红外毯组的皮质醇水平显著降低,而氢气组仅轻微升高,提示两种干预措施可能通过不同的神经内分泌通路调节应激状态。值得注意的是,此前有研究提出,可通过下丘脑-垂体-肾上腺(HPA)轴等神经内分泌机制调节皮质醇水平,以减轻组织应激和炎症损伤,从而对运动性肺损伤发挥保护作用[29];但目前尚无直接证据表明皮质醇与本研究中两种干预措施存在关联,仍需进一步研究验证。
除氧化应激和炎症外,干预措施还对其他生理及血液学指标产生影响:训练后,氢气组的红细胞计数(RBC)、血红蛋白(HB)、红细胞压积(HCT)等血液学指标维持相对稳定,表明该组参与者在高强度运动中仍能保持良好的携氧能力和血液流变性。研究显示,高强度运动可能降低红细胞膜稳定性、损害血红蛋白(HB)功能,进而影响氧气运输效率[30,31],而氢气或可通过抗氧化作用维持细胞膜完整性,缓解这一不良影响[32]。此外,两个干预组均观察到平均红细胞体积(MCV)降低,这可能反映了训练导致的红细胞再生加速及形态变化,是运动员红细胞小型化的常见适应性反应。
在激素代谢方面,训练后(尤其在氢气组中)睾酮(T)和铁蛋白(FE)水平升高更显著,表明合成代谢能力增强,铁储存能力改善。此前研究发现,铁代谢紊乱是运动性肺损伤的关键机制之一[33,34]:过量游离铁会促进芬顿反应(Fenton reaction)产生羟自由基,加剧氧化损伤[35],而铁蛋白(FE)作为铁离子缓冲剂,可能发挥保护作用。氢气或可通过调节铁蛋白(FE)表达,参与维持肺组织铁稳态,从而减轻氧化与炎症的协同损伤。另有实验表明,氢气可通过调节AMP激活的蛋白激酶(AMPK)和雷帕霉素靶蛋白(mTOR)信号通路,降低肌肉损伤标志物表达,减轻运动诱导的肾小管氧化应激[36]。此外,本研究中氢气组训练后的肌酸激酶(CK)和血尿素氮(BUN)水平较低,提示氢气吸入可有效缓解高强度运动后的骨骼肌应激和蛋白质分解负荷。
本研究中,氢气吸入所用混合气体的组成为1%氢气、21%氧气、0%二氧化碳及78%氮气,与环境空气成分高度接近。尽管氢气是本研究中主要的活性治疗因子,但仍需简要讨论混合气体中其他成分的安全性:在常压条件下,氮气具有生物学惰性,仅在高压环境或快速减压等极端情况下才可能引发炎症反应等不良影响,而本研究不涉及此类场景;同时,所用气体中的氧气浓度与室内空气一致,不会增加氧化负荷。因此,在本研究控制的常氧、常压条件下,该吸入气体混合物具有生理安全性,氮气和氧气均不会对氢气的抗氧化、抗炎效果产生干扰。
此外,尽管本研究纳入了男性和女性运动员,但未进行性别特异性分析。有研究表明,女性主要性激素——雌激素具有抗氧化和抗炎特性,可能调节运动诱导的氧化应激与全身性炎症[37],这种激素影响或导致不同性别对氢气吸入的生理反应存在差异。例如,有研究报道雌激素可减少活性氧(ROS)生成、抑制促炎细胞因子释放,可能使女性对氧化损伤具有更强的抵抗力。因此,未按性别分层分析是本研究的局限性之一,未来研究应考虑性激素水平和月经周期阶段,以更清晰地揭示不同性别在恢复效果上的差异。同时,本研究参与者均从事田径、自行车、举重等陆地项目运动,未纳入游泳等水上项目运动员。由于水中训练会带来独特的生理挑战(如静水压力导致的肺力学改变、屏气模式及体温调节差异),水上项目与陆地项目运动员的运动诱导氧化应激及恢复反应可能存在显著差异[38],因此本研究结果对水上项目运动员的适用性仍不明确,需在未来研究中进一步探索。
本研究从血液学和代谢反应的多个层面,揭示了氢气干预对高强度运动诱导的多系统负荷的缓冲与调节能力,为氢气在运动康复和肺部疾病干预中的应用潜力提供了理论支持。但本研究仍存在一些局限性,需在后续研究中解决:首先,样本量相对较小,可能限制研究结果的统计效力;其次,实验周期较短,无法对训练适应过程中氢气干预持续效果进行长期动态观察;此外,本研究主要观察全身性指标变化,缺乏肺功能或组织水平的直接证据,未来可结合呼吸力学参数或肺部影像学检查,进一步验证氢气对运动相关肺损伤的直接保护作用;最后,机制层面的研究尚不充分,后续可通过分子通路研究,进一步明确氢气调节氧化应激、铁代谢及免疫反应的关键分子靶点。
结论
研究发现,氢气吸入治疗可通过降低氧化应激和全身性炎症,缓解运动诱导的肺损伤,同时有助于维持血液学稳态。与红外毯治疗相比,在冬季高强度训练期间及训练后,氢气吸入在增强抗氧化防御、减轻炎症反应、维持红细胞功能及氧气运输能力方面表现出更大潜力。这些结果表明,氢气吸入或可作为一种安全、有效的辅助手段,用于支持高强度体力活动或运动训练中的恢复过程,减轻肺部应激。未来需开展更大样本量、长期随访的研究,以验证这些初步发现并阐明其潜在机制。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1502152.html?mobile=1
收藏

