微环境响应氢气材料增强肿瘤抑制研究【浙大】
氢基肿瘤治疗具有一定治疗潜力,但其疗效仍受限于细胞内氢气生成不足、释放动力学调控不佳以及免疫应答增强效果有限等问题。为解决这些局限,本研究开发了一种部分还原的锌掺杂沸石咪唑酯骨架材料-8(ReZIF-8),该材料可作为双功能纳米平台,同时实现细胞内氢气生成与锌离子(Zn2⁺)可控过载。ReZIF-8的阳离子表面电荷可促进细胞内吞,而其pH响应特性则有助于实现细胞内氢气(H₂)的可控释放。积累的H₂与Zn2⁺过载协同作用,破坏肿瘤细胞内的氧化还原稳态,诱导活性氧(ROS)依赖性免疫原性细胞死亡(ICD)。这种ICD激活可强效刺激固有免疫应答,并增强抗原交叉呈递。在B16F10黑色素瘤小鼠模型中,瘤内注射ReZIF-8可通过细胞内H₂触发的终末分化与细胞周期阻滞,产生强效抗肿瘤效果。与αPD-1免疫检查点阻断剂联合使用时,治疗效果进一步增强,可延长小鼠生存期并显著抑制转移进展,彰显其转化潜力。ReZIF-8介导的产氢纳米平台可重编程肿瘤内氧化还原平衡,同时诱导ICD、增强抗肿瘤免疫应答并驱动肿瘤细胞终末分化。这种“三管齐下”的机制通过协同调控实现对肿瘤的全面控制。

1 引言
氢气(H₂)因其优异的安全性,已成为一种极具潜力的抗癌剂,能够重塑肿瘤微环境(TME)并诱导线粒体功能障碍介导的细胞死亡[1]。与常用治疗性气体(如一氧化碳[2]、二氧化硫[3]、硫化氢[4]、一氧化氮[5]等)相比,H₂具有出色的选择性抗氧化特性,可调控细胞信号传导与能量代谢[6],在有效抑制肿瘤增殖与转移的同时,减轻放化疗带来的不良反应。值得注意的是,H₂在治疗应用中表现出浓度依赖性的双重性:低浓度H₂可通过调控活性氧(ROS)发挥抗炎与细胞保护作用,而细胞内高浓度H₂则可能损伤线粒体呼吸功能并扰乱氧化还原稳态[7]。目前,氢疗策略主要聚焦于提高肿瘤内H₂积累量,以有效破坏肿瘤内氧化还原平衡、诱导肿瘤细胞死亡,进而改善抗肿瘤免疫应答。然而,氢基治疗仍受限于细胞内H₂生成不足、释放调控不佳及免疫应答增强效果有限等问题[8]。
当前的H₂递送方式包括直接氢气给药[9]、平台介导的氢气递送[10]以及瘤内原位产氢[11]。研究人员正致力于将高容量气体递送平台与氢疗结合,以提升抗肿瘤疗效。在这些策略中,基于金属氢化物的氢气递送平台因其设计灵活性,在抗癌治疗中展现出显著潜力[12]。然而,这类平台的临床转化面临诸多挑战,如合成过程复杂、水反应活性高及生物安全性欠佳[13]。除传统H₂递送策略外,肿瘤内原位产氢作为一种新兴的局部治疗策略,可实现H₂的可控、持续且靶向肿瘤的释放,同时生物毒性极低。但催化原位产氢通常需要外部触发信号,限制了其应用灵活性[14]。通过手术植入产氢镁基微电化学电池(MgG),可在局部产生高浓度H₂与金属离子,通过H₂扩散直接杀伤肿瘤细胞并调控肿瘤微环境[7]。尽管氢疗研究近年来取得进展,但关键挑战仍未解决,其中最核心的是肿瘤细胞内H₂释放效率低与治疗激活效果不佳,这阻碍了氢疗的广泛临床应用。解决这些局限需要创新性方案,核心在于实现细胞特异性与空间可控的细胞内氢气释放。这种精准递送不仅有助于阐明H₂在细胞环境中的调控机制,还能为优化H₂治疗平台提供设计框架。
本研究设计了一种基于锌掺杂还原型ZIF-8(沸石咪唑酯骨架材料-8)纳米颗粒(ReZIF-8)的pH响应型产氢纳米平台。ZIF-8的疏水多孔结构在生理pH条件下可保护锌(Zn)中心免受水相反应影响。ZIF-8由Zn2⁺与2-甲基咪唑(2-mIM)配体连接构成,形成多孔疏水骨架。2-mIM配体上的甲基可构建疏水微环境,通过空间位阻阻碍水分子渗透,从而防止Zn节点水解。关键在于,ReZIF-8的pH敏感性使其具有肿瘤微环境响应特性,在酸性条件下可选择性加速H₂生成与骨架降解。该机制可实现肿瘤组织及溶酶体腔内pH触发的精准产氢(方案1)。细胞内积累的H₂与Zn2⁺过载协同作用,严重破坏线粒体稳态,表现为线粒体膜电位显著去极化与细胞内ROS水平升高,最终导致ROS依赖性肿瘤细胞死亡[4,15]。此外,氢生成过程中pH响应性释放的免疫调节性Zn2⁺可显著增强肿瘤细胞死亡的免疫原性[13,16]。同时,H₂介导的信号级联反应可诱导恶性细胞终末分化并阻滞细胞周期。因此,ReZIF-8平台可实现“三模态”治疗效果:(1)局部氢介导的细胞毒性;(2)分化治疗;(3)免疫微环境重编程。这种由氢气触发的治疗级联反应(涵盖ICD诱导、细胞周期阻滞与肿瘤微环境重塑)与免疫检查点抑制具有显著协同作用,为癌症干预提供了一种新型氢基联合治疗策略。
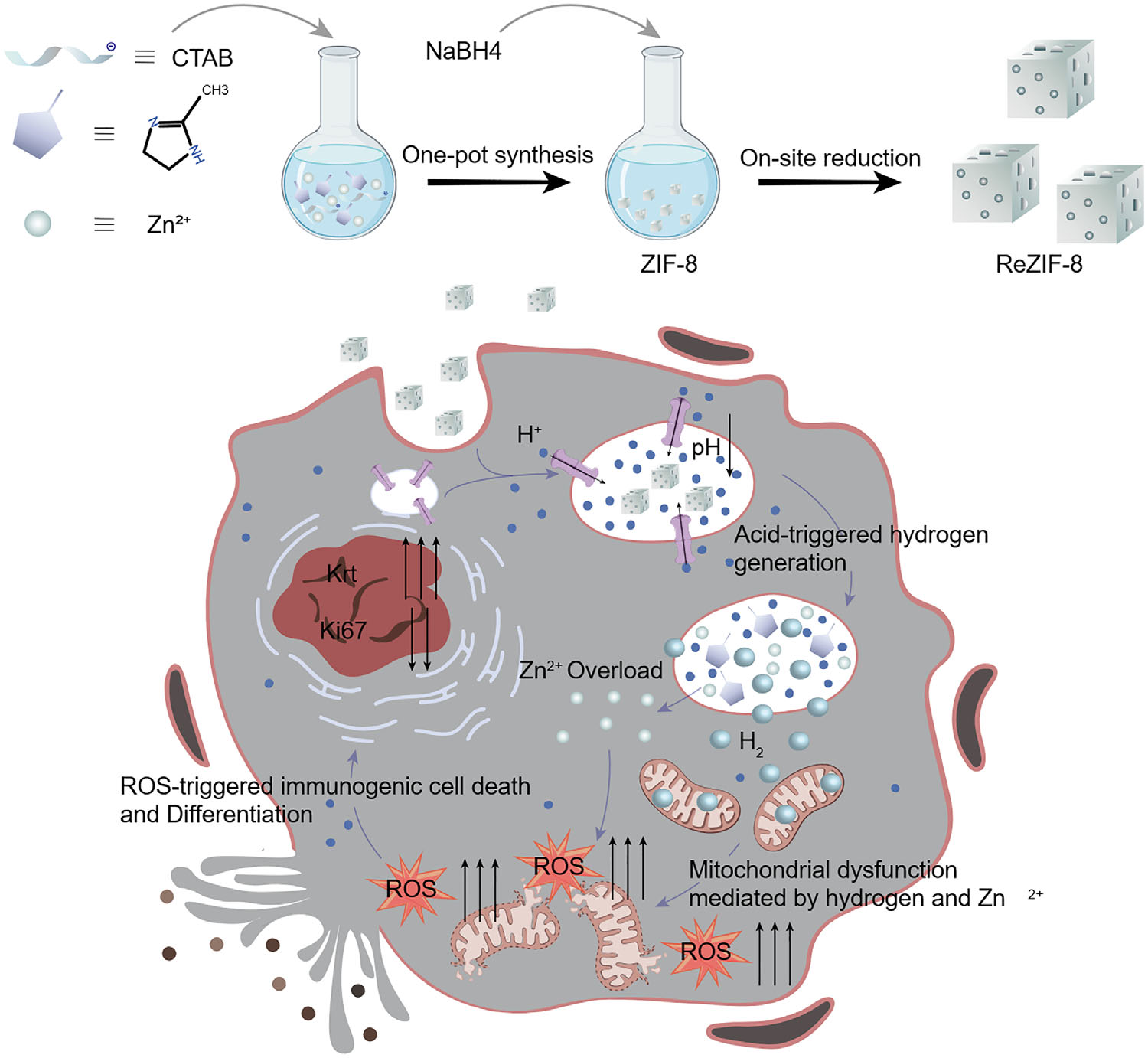
方案模式图
通过一锅法原位还原合成ReZIF-8及其诱导ROS刺激肿瘤细胞免疫原性细胞死亡的示意图。ReZIF-8凭借其表面正电位被肿瘤细胞有效内吞并定位于溶酶体。质子泵介导的质子内流导致溶酶体酸化,触发ReZIF-8的酸响应性降解,释放氢气与锌离子。这些物质共同诱导线粒体膜电位崩溃与细胞内活性氧(ROS)积累,从而激活肿瘤细胞的免疫原性细胞死亡。此外,ReZIF-8可通过氢气阻滞肿瘤细胞周期并促进细胞分化。
2 结果
2.1 ReZIF-8的制备及其产氢能力
前期研究表明,水溶液中的Zn2⁺可被硼氢化钠(NaBH₄)还原形成纳米片(支持信息图S1a)。选区电子衍射(SAED)结果显示,晶格间距分别为0.2863 nm、0.2604 nm和0.167 nm,初步对应于氧化锌(ZnO)的(100)晶面、ZnO的(002)晶面以及锌(Zn)的(102)晶面/ZnO的(110)晶面。这表明该纳米片由金属Zn相和ZnO相共同组成。然而,这类纳米片的水稳定性较差(表现为快速聚集),限制了其生物应用。为解决这一问题,本研究将Zn2⁺嵌入ZIF-8骨架中,并通过可控还原合成锌掺杂还原型ZIF-8(ReZIF-8),同时保留母体骨架结构。
以十六烷基三甲基溴化铵(CTAB)为结构导向剂,在水溶液中使六水合硝酸锌(Zn(NO₃)₂·6H₂O)与2-甲基咪唑(2-mIM,C₄H₆N₂)反应,通过室温沉淀法合成ZIF-8纳米颗粒。随后,在惰性气氛下,使用NaBH₄对制备的ZIF-8进行化学还原,得到ReZIF-8(图1a)。本研究系统考察了可控还原(2小时)与完全还原(>12小时)对ZIF-8骨架的影响。如支持信息图S1b所示,延长还原时间(>12小时)会导致分散液表面产生大量气泡,溶液几乎完全褪色(呈无色),静置后可见沉淀生成;而可控还原(2小时内)仅产生少量表面气泡,分散液保持乳白乳浊状,且未检测到沉淀。这些结果表明,还原时间对维持纳米颗粒完整性至关重要。
对完全还原的ZIF-8及其沉淀进行透射电子显微镜(TEM)分析,结果显示其结构发生彻底改变:经NaBH₄处理12小时后,ZIF-8特有的立方形貌(支持信息图S1e)消失,取而代之的是更小的纳米颗粒;沉淀则呈现由纳米颗粒聚集形成的纺锤形微观结构(微米级)。随后,通过动态光散射(DLS)和TEM对可控还原的ZIF-8样品(即ReZIF-8)进行表征。DLS结果显示,ZIF-8与ReZIF-8的粒径分布相近,平均水合直径为221 nm(图1b)。TEM与DLS测得的粒径存在微小差异,这是由于纳米颗粒在水悬浮液中形成水合层所致。表面电位分析显示,ReZIF-8的zeta电位为+24.74 mV(支持信息图S1d)。这种净正表面电荷可促进ReZIF-8与带负电的肿瘤细胞膜发生静电相互作用,从而增强纳米颗粒的吸附与后续细胞内吞。TEM图像显示,ReZIF-8纳米颗粒保持清晰的立方形貌,粒径均一,约为150 nm(图1c及支持信息图S1e)。X射线能谱(EDS)元素mapping结果证实,组成元素(C、N、O、Zn)在整个纳米颗粒基质中均匀分布(图1c)。

图1.ReZIF-8的制备及其产氢能力。a)ReZIF-8的合成示意图;b)ReZIF-8与ZIF-8的水合粒径分布;c)ReZIF-8的TEM图像及原位EDS分析(比例尺:200 nm);d)ReZIF-8的高分辨率TEM(HR-TEM)图像及局部放大晶格条纹;e)ReZIF-8表面纳米簇晶格条纹的傅里叶变换示意图;f)ReZIF-8与ZIF-8的X射线衍射(XRD)图谱,及与标准ZIF-8和ZnO图谱的对比;g)ReZIF-8与ZIF-8的X射线光电子能谱(XPS)全谱及Zn 2p高分辨谱(含Zn XPS精细谱与LM2谱拟合);h)ReZIF-8与ZIF-8的傅里叶变换红外光谱(FTIR);i)酸性条件下ReZIF-8产气的气相色谱-质谱(GC-MS)分析(保留时间);j)氢气检测探针示意图及酸性条件下ReZIF-8产氢的光学图像;k)不同处理组中甲基蓝(MB)催化加氢反应过程中650 nm处吸光度(OD₆₅₀)变化的紫外-可见(UV-Vis)光谱分析;l)ReZIF-8在pH 5.5磷酸盐缓冲液(PBS)中不同孵育时间的TEM图像(比例尺:500 nm);m)B16F10细胞对Cy5.5标记ReZIF-8的内吞情况(蓝色通道:4',6-二脒基-2-苯基吲哚(DAPI);绿色通道:CellTracker Green;比例尺:10 μm)。
为进一步详细分析ReZIF-8的结构特征,本研究首先通过HR-TEM观察ReZIF-8表面的纳米簇,并采用傅里叶变换分析计算其晶面间距(图1d、e)。测得纳米簇的晶面间距为0.2474 nm,对应于金属锌(Zn⁰)的(002)晶面。ReZIF-8的XRD图谱中36.6°处出现弱衍射峰(图1f),进一步证实了这一归属。同时,XRD图谱显示ReZIF-8保持结晶相纯度,其衍射峰与原始ZIF-8完全一致(图1f),表明金属锌的引入未破坏ZIF-8的主体骨架结构。
ZIF-8的固有介孔使其具备吸附能力。因此,为验证通过ZIF-8还原所得的ReZIF-8中是否残留硼氢化钠(NaBH₄),我们对合成的ReZIF-8进行了11B核磁共振(11B-NMR)和电感耦合等离子体质谱(ICP-MS)分析。与支持信息图S1f、g中的透射电子显微镜-能谱(TEM-EDS)结果一致,ZIF-8和ReZIF-8在11B-NMR谱图中均未出现硼相关化合物的特征峰(支持信息图S2a)。ICP-MS结果证实,ZIF-8和ReZIF-8的硼含量均低于检测限,与双蒸水(ddH₂O)基线水平相当(支持信息图S2b),表明两种材料中均未检测到硼元素。这些结果证实ReZIF-8中不存在NaBH₄残留。
为分析ReZIF-8中锌(Zn)的化学价态,我们采用X射线光电子能谱(XPS)进行元素分析,结果证实ReZIF-8样品中存在与ZIF-8骨架一致的元素(Zn、C、N)(图1g、支持信息图S1h)。ZIF-8经还原后,其Zn 2p峰向较高结合能方向轻微偏移,这提示Zn吸附于ZIF-8表面,且Zn与ZIF-8之间存在较弱的结合或配位作用[17]。为进一步表征电子结构,我们对ZIF-8和ReZIF-8的Zn 2p₃/₂峰进行高分辨率分峰拟合。结果显示,ReZIF-8在1021.34 eV处出现一个清晰的弱峰,对应金属锌(Zn⁰);而ZIF-8仅在1022.12 eV处出现Zn2⁺特征峰,未检测到金属锌来源的Zn⁰。我们通过俄歇电子能谱进一步表征了Zn在2p₃/₂区域的精细光谱特征:ReZIF-8的Zn俄歇电子能谱中存在三个明显峰(图1g),主峰位于993.21 eV,归属于Zn⁰,另外两个次峰对应Zn2⁺。对Zn⁰和Zn2⁺特征峰的定量分析显示,二者比例(Zn⁰:Zn2⁺)为0.4,表明ReZIF-8中金属锌(Zn⁰)占总锌含量的比例约为28.7%。
傅里叶变换红外光谱(FT-IR)分析显示,两种材料中均存在ZIF-8骨架的特征振动模式:≈3000 cm⁻1处为C-H伸缩振动峰,≈1600 cm⁻1处为咪唑酯配体的C═N伸缩振动峰,421 cm⁻1处为Zn-N配位键振动峰(图1h),这证实材料中金属-配体配位结构完整。ZIF-8与ReZIF-8的红外光谱高度一致,表明还原过程在成功引入金属锌物种的同时,保留了ZIF-8骨架的基本化学连接方式。
为评估ReZIF-8的肿瘤微环境响应性降解特性,我们将其纳米颗粒置于模拟肿瘤细胞外酸性环境和细胞内溶酶体环境的酸性缓冲液(pH 5.5)中孵育,并通过时间分辨TEM观察其结构变化:(1)初始阶段(0-12小时):颗粒表面侵蚀,部分发生无定形化;(2)中间阶段(24小时):超过50%的颗粒出现明显结晶度丧失;(3)终末阶段(48小时):骨架几乎完全崩解(图1l、支持信息图S1i)。同时,我们通过顶空气相色谱-质谱(GC-MS)对产氢量进行定量分析,色谱图显示在保留时间1.68分钟处出现特征峰,与氢气标准品的保留时间完全匹配(图1i)[18]。在不同pH条件(pH 7.4、5.5、4.75)下对ReZIF-8的释氢动力学进行系统评估,结果显示其催化活性具有pH依赖性(支持信息图S1j)。体积法测量表明,酸性越强,H₂释放速率越快,在强酸性条件(pH 4.75)下可快速达到近峰值释放量。这些结果证实ReZIF-8在酸性条件下可生成H₂。
为表征生成H₂的还原能力,我们测试了该气体在铂(Pt)存在下能否将亚甲基蓝(MB)催化还原为无色形式。向酸性MB-Pt溶液中分别加入磷酸盐缓冲液(PBS)、ZIF-8和ReZIF-8后,10分钟内PBS组和ZIF-8组溶液仍保持蓝色,且无气泡产生(图1j);而ReZIF-8组溶液迅速由蓝变无色,同时伴随大量气泡生成。通过紫外-可见分光光度计分析650 nm处吸光度(OD₆₅₀)随时间的变化(图1k),结果显示ReZIF-8组亚甲基蓝浓度下降,而ZIF-8组无明显变化。这种基于氧化还原耦合的可视化实验,确凿证实了ReZIF-8独特的酸响应产氢能力。
接下来,我们研究了肿瘤细胞对ReZIF-8的摄取情况。将Cy5.5标记的ReZIF-8与细胞共孵育4小时后,采用激光共聚焦扫描显微镜(CLSM)观察其细胞内定位——细胞核用Hoechst 33342(蓝色)染色,细胞质用CellTracker Green(绿色)标记。共定位结果显示,ReZIF-8的红色荧光与细胞质绿色荧光重叠,证实其可进入肿瘤细胞(图1m)。
2.2 ReZIF-8在体外通过活性氧(ROS)和线粒体损伤诱导强效免疫原性细胞死亡(ICD)
鉴于ReZIF-8的产氢过程对细胞内酸性环境具有响应性,我们通过CLSM研究了肿瘤细胞内ReZIF-8与溶酶体的共定位情况。结果显示,Cy5.5标记的ReZIF-8荧光信号与溶酶体示踪剂(LysoTracker Green)荧光信号在至少12小时内保持高度重叠(皮尔逊相关系数>0.7),表明ReZIF-8在溶酶体中大量滞留(图2a、支持信息图S3a)。这种溶酶体滞留为细胞内H₂生成提供了触发条件。
对ReZIF-8和ZIF-8在B16F10肿瘤细胞上的细胞毒性评估显示:ZIF-8浓度需超过100 μg/mL才表现出细胞毒性,而ReZIF-8的毒性显著增强,浓度超过75 μg/mL即可发挥细胞毒性(图2b)。活/死细胞染色实验表明,在锌离子(Zn2⁺)浓度相同的条件下处理12小时后,PBS组和ZIF-8组细胞以存活为主,而ReZIF-8(75 μg/mL)组细胞呈现强烈红色荧光,表明其细胞死亡率显著高于对照组(支持信息图S3b)。ZIF-8与ReZIF-8的细胞毒性差异,与ReZIF-8(经还原)可在细胞内生成H₂有关。值得注意的是,在相同处理浓度下,ReZIF-8对RAW 264.7免疫细胞的毒性显著低于对B16F10肿瘤细胞的毒性,提示肿瘤细胞对H₂介导的杀伤作用具有选择性敏感性(支持信息图S3c)。这可能进一步表明,氢疗在靶向氧化还原代谢紊乱细胞时,具有更高的敏感性和选择性。

图2 ReZIF-8在体外通过活性氧(ROS)和线粒体损伤诱导强效免疫原性细胞死亡(ICD)
a)ReZIF-8-Cy5.5在溶酶体中随时间变化的共聚焦共定位图像,右侧柱状图为皮尔逊相关系数(通过Image J分析);b)不同浓度ReZIF-8和ZIF-8对B16F10细胞存活率的影响(n=3-4;采用双向方差分析(two-way ANOVA)结合Šídák多重比较检验;****P<0.0001);c)Annexin V-Alexa Fluor 647/碘化丙啶(PI)染色的代表性流式细胞术散点图;d)不同处理组B16F10细胞中晚期凋亡/坏死细胞(Annexin⁺PI⁺)和存活细胞(Annexin⁻PI⁻)的统计分析(n=4;采用单因素方差分析(one-way ANOVA)结合Dunnett多重比较检验;以PBS组为对照;****P<0.0001);e)PBS或ReZIF-8处理B16F10细胞4小时后的JC-1线粒体膜电位染色共聚焦图像(比例尺:50 μm);f)PBS、氯化锌(ZnCl₂)、ZIF-8和ReZIF-8处理B16F10细胞4小时后的ROS荧光共聚焦图像(蓝色通道:DAPI;绿色通道:DCFH-DA;比例尺:20 μm);g)ReZIF-8处理后不同时间点B16F10黑色素瘤细胞ROS水平的定量分析(采用CellROX Red检测);h)ReZIF-8处理后B16F10细胞的代表性生物透射电子显微镜(Bio-TEM)图像(比例尺:2 μm);i)细胞死亡抑制剂(坏死抑制剂Necrostatin-1、铁死亡抑制剂Ferrostatin-1、焦亡抑制剂Z-VAD-FMK、ROS清除剂β-巯基乙醇(β-ME))在同步/异步处理条件下对ReZIF-8处理的B16F10细胞存活率的影响(n=4;采用单因素方差分析结合Dunnett多重比较检验;以ReZIF-8组为对照;****P<0.0001);j)共培养体系示意图:将ReZIF-8处理的B16F10-OVA细胞通过上清转移或直接接触方式与RAW 264.7细胞或骨髓来源树突状细胞(BMDCs)共培养;k)直接共培养条件下,BMDCs和RAW 264.7细胞表面标志物CD80、CD86、CD40表达水平的流式细胞术分析(n=4;采用单因素方差分析结合Dunnett多重比较检验;以PBS组为对照;****P<0.0001);l)上清共培养条件下,BMDCs表面CD80和CD86共表达水平的流式细胞术评估(n=4;采用单因素方差分析结合Dunnett多重比较检验;以PBS组为对照;****P<0.0001)。所有统计数据均以“均值±标准差(SD)”表示。
为进一步验证ReZIF-8与ZIF-8的细胞毒性差异,我们将细胞与ReZIF-8或其他处理剂共培养24小时后,通过流式细胞术进行凋亡-坏死检测。如图2c、d及支持信息图S3d所示,PBS组和ZnCl₂组分别有约95%和80%的细胞保持存活,仅少数细胞处于晚期凋亡或死亡状态,表明该浓度下Zn2⁺毒性极低;ZIF-8组约40%的细胞存活;而ReZIF-8组存活细胞占比不足5%,同时约70%的细胞处于晚期凋亡状态,显著高于PBS组、ZnCl₂组和ZIF-8组。这些结果证实ReZIF-8可有效诱导肿瘤细胞死亡。
已有研究表明,低浓度H₂可调节炎症反应,而高浓度H₂则通过破坏氧化还原稳态抑制细胞线粒体呼吸,进而导致癌细胞凋亡和损伤。为探究ReZIF-8诱导肿瘤细胞死亡的机制,我们采用JC-1荧光染料作为线粒体膜电位指示剂。结果显示,未处理细胞的线粒体膜电位完整(呈红色荧光),而经ReZIF-8处理4小时后,红色荧光显著减弱、绿色荧光增强,表明线粒体发生去极化(图2e)。这一结果证实ReZIF-8诱导的细胞死亡与线粒体膜破坏相关。此外,既往研究提示H₂会扰乱肿瘤细胞内的氧化还原平衡,因此我们采用DCFH-DA和CellROX Red荧光探针检测细胞内ROS水平变化。如图2f、g所示,ReZIF-8对肿瘤细胞ROS水平具有双向调控作用:初期(2小时内)降低ROS积累,随后(4小时后)导致ROS水平升高。这提示H₂作为还原剂,在作用初期会短暂清除ROS,而长时间作用(>4小时)后,由于H₂积累和线粒体功能受干扰(图2e),会导致ROS过量生成。值得注意的是,处理4小时后,ZIF-8组、ZnCl₂组和PBS组均仅呈现微弱绿色荧光,表明单纯Zn2⁺过载无法显著升高ROS水平;而ReZIF-8通过产氢与Zn2⁺过载的协同作用,触发氧化应激和ROS积累。此外,ReZIF-8处理后肿瘤细胞的超薄TEM切片显示,ReZIF-8在溶酶体中积累,随后诱导线粒体肿胀,进而导致细胞膜破裂和细胞质泄漏,最终引发细胞死亡(图2h、支持信息图S3e)。
线粒体膜电位检测(图2e)和ROS检测(图2f)结果,与12小时活/死染色结果(支持信息图S3b)高度一致。ReZIF-8通过释氢和Zn2⁺过载的双重机制,表现出快速强效的细胞毒性;而ZIF-8仅通过时间依赖性Zn2⁺过载发挥作用,细胞毒性过程缓慢且效率低下。这些结果证实,ReZIF-8将细胞内产氢与Zn2⁺过载相结合的机制具有策略优势。为全面表征ReZIF-8诱导的细胞死亡通路,我们采用坏死抑制剂(Necrostatin-1)、铁死亡抑制剂(Ferrostatin-1)、焦亡抑制剂(Z-VAD-FMK)和β-巯基乙醇(β-ME),在共处理和单独处理两种模式下进行系统拯救实验。结果显示,仅高浓度β-ME(2 mM)能显著抑制细胞死亡,其他抑制剂的拯救效果微乎其微(图2i)。这表明ReZIF-8触发了一种独特的ROS依赖性细胞死亡通路,该通路不同于坏死、铁死亡、焦亡等传统H₂诱导的死亡机制,揭示了细胞内H₂在肿瘤细胞死亡调控中的新作用。
为评估ReZIF-8诱导的线粒体损伤是否会触发免疫原性细胞死亡(ICD)及后续免疫激活,我们将ReZIF-8处理的B16F10-OVA肿瘤细胞(或其培养上清)与RAW 264.7巨噬细胞或骨髓来源树突状细胞(BMDCs)共培养,随后进行流式细胞术分析(图2j)。如图2k、l所示,无论采用何种共培养方式,与PBS组、ZnCl₂组和ZIF-8组相比,ReZIF-8处理均能显著上调RAW 264.7细胞和BMDCs表面CD80、CD86、CD40的表达水平。这表明H₂与Zn2⁺过载的协同作用,显著增强了肿瘤细胞死亡的免疫原性。值得注意的是,ReZIF-8显著提高了BMDCs中SIINFEKL-H2Kb(OVA抗原肽-MHC I类分子复合物)的水平(支持信息图S3f),提示其通过激活BMDCs促进ICD,进而增强抗原呈递。与ZIF-8相比,ReZIF-8的免疫激活效果更显著,表明其免疫增强作用与产氢相关。此外,我们检测了共培养细胞上清中促炎细胞因子水平,结果显示ZnCl₂组、ZIF-8组与PBS组的细胞因子水平无显著差异,而ReZIF-8组的肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)水平显著高于对照组(支持信息图S3g),进一步证实ReZIF-8通过H₂与Zn2⁺过载的协同作用增强免疫激活。综上,这些结果表明ReZIF-8通过破坏线粒体功能、激活共刺激因子以促进抗原呈递,从而诱导ICD。
2.3 ReZIF-8在体内抑制黑色素瘤生长并诱导其终末分化
首先,我们通过向小鼠皮下注射100 μg ReZIF-8,评估其体内生物相容性。注射后7天收集外周血,进行血液学和肝功能分析以评估全身影响。结果显示,ReZIF-8处理组与PBS处理组小鼠的血液学指标和肝功能均无显著差异,表明ReZIF-8具有良好的生物安全性(支持信息图S4a)。
接下来,我们在B16F10黑色素瘤荷瘤C57BL/6小鼠模型中评估ReZIF-8的抗肿瘤疗效。治疗方案如图3a所示:以PBS组为空白对照,ZnCl₂组和ZIF-8组为材料对照,ReZIF-8组为实验组。治疗结果显示,治疗期间四组小鼠的体重无显著差异(图3b),表明ReZIF-8无明显毒副作用。如图3c、e、f所示,治疗后19天,ReZIF-8处理组荷瘤小鼠的平均肿瘤体积抑制率达91.67%;而ZnCl₂组和ZIF-8组的肿瘤抑制率仅约30%,表明其治疗效果显著受限。生存曲线显示,三个对照组小鼠在30天内几乎全部死亡(图3d),而ReZIF-8组60%的小鼠在31天后仍存活。这些结果有力证实ReZIF-8
为进一步验证ReZIF-8处理后的肿瘤微环境,我们对处理后的肿瘤组织进行了末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)染色(常用于检测细胞凋亡)和Ki67染色(细胞增殖标志物)。TUNEL染色中,凋亡细胞呈绿色荧光,而4',6-二脒基-2-苯基吲哚(DAPI)染色可反映细胞总数及分布情况。如图3g所示,ReZIF-8组观察到显著的绿色荧光,表明ReZIF-8可诱导大量肿瘤细胞死亡;同时,ReZIF-8组的Ki67染色区域明显减少,说明ReZIF-8能有效抑制小鼠黑色素瘤细胞增殖。组织切片结果进一步证实了ReZIF-8对黑色素瘤细胞增殖的抑制作用。
随后,我们通过RNA测序(RNA-seq)分析,评估ReZIF-8对B16F10黑色素瘤荷瘤C57BL/6小鼠模型的调控效应。于第7天对小鼠进行瘤内注射ReZIF-8或磷酸盐缓冲液(PBS),每3天重复一次,共进行3个周期。之后收集皮下黑色素瘤组织进行RNA-seq分析。差异基因表达分析显示,角蛋白家族基因(Krt1/10)表达上调,提示ReZIF-8可诱导黑色素瘤细胞向表皮细胞分化;骨膜蛋白(Postn)和半乳糖凝集素3/7(Lgals3/7)表达升高,表明细胞-基质相互作用发生改变;而乳腺癌易感基因1(Brca1)表达下调,意味着DNA修复功能受损且增殖能力下降(图3h)。

对显著上调和下调的基因进行基因本体(GO)分析发现,在生物学过程(BP)类别中,上调基因在“角质化”和“角质形成细胞分化”相关通路中富集程度极高(图3i);细胞组分(CC)和分子功能(MF)的富集术语也指向黑色素瘤细胞的分化重编程,例如与角质化、角质化包膜、钙离子结合及表皮结构分子相关的条目。黑色素细胞起源于神经嵴细胞,而“神经细胞迁移”“树突形态发生”等下调的生物学过程(GO-BP)可能表明肿瘤细胞的恶性潜能降低(图3j)。同时,下调的MF术语“环磷酸腺苷(cAMP)磷酸二酯酶活性”值得关注——cAMP作为关键的第二信使,在维持肿瘤细胞增殖能力和抗凋亡能力中发挥重要作用。此外,ABC型谷胱甘肽S-缀合物转运体活性的下调,可能使肿瘤细胞对药物和氧化应激损伤的敏感性增加,这与ReZIF-8通过活性氧(ROS)依赖性通路诱导肿瘤细胞死亡的实验结果一致。
京都基因与基因组百科全书(KEGG)富集术语也显示出终末分化相关通路的富集(支持信息图S4b)。与RNA-seq数据一致,免疫荧光(IF)实验证实ReZIF-8可上调小鼠治疗后黑色素瘤组织中角蛋白1(Krt-1)的表达(图3k)。值得注意的是,在人皮肤 cutaneous 黑色素瘤(SKCM)组织与正常皮肤组织中,该分化标志物的表达趋势相似(支持信息图S4c),进一步说明ReZIF-8通过终末分化重编程发挥抑癌作用。通过对差异基因进行基因集富集分析(GSEA)发现,ReZIF-8处理组与PBS对照组在角质化、固有免疫系统及凋亡相关通路中存在显著差异(图3l)。利用TIMER2.0数据库和MCP-counter工具[19]对批量RNA-seq数据进行免疫浸润分析,初步提示ReZIF-8处理可能促进肿瘤内巨噬细胞和树突状细胞(DCs)的浸润,这对免疫治疗具有重要意义(图3m)。此外,在差异表达基因中,我们发现ReZIF-8处理的肿瘤组织中CD86、CD3G、白细胞介素33(IL-33)、白细胞介素36(IL-36)等免疫相关基因显著上调。通过GEPIA2数据库和TCGA/GTEx数据库[20]进行生存分析发现,人皮肤 cutaneous 黑色素瘤患者中CD86和CD3G的高表达与总生存期(OS)和无病生存期(DFS)的延长呈显著正相关,表明这些基因与良好预后相关(支持信息图S4d)。综上,上述RNA-seq结果表明,ReZIF-8通过诱导黑色素瘤细胞再分化以使其退出细胞周期[21],并促进免疫浸润,从而实现肿瘤抑制。
2.4 ReZIF-8通过重塑肿瘤免疫微环境增强检查点抑制剂疗效
肿瘤内的固有免疫细胞是启动特异性适应性免疫的关键[22]。因此,我们检测了ReZIF-8处理后肿瘤内固有免疫细胞的激活水平。在4个治疗周期后收集不同处理组的肿瘤组织,制成单细胞悬液并进行流式细胞术分析。如图4a、c所示,ReZIF-8处理使肿瘤内树突状细胞浸润量增加2.63倍,巨噬细胞募集量增加1.80倍,与计算预测结果一致。此外,ReZIF-8处理组小鼠黑色素瘤中的树突状细胞和巨噬细胞成熟水平更高:树突状细胞成熟率(CD80⁺CD86⁺树突状细胞占比)从平均13.45%提升至49.05%,增幅约3.64倍(图4b);巨噬细胞成熟水平(CD80⁺CD86⁺巨噬细胞占比)从5.675%提升至29.20%,增幅达5.14倍(图4d)。两种细胞中CD40的表达量也显著升高(支持信息图S5a)。
由于树突状细胞和巨噬细胞的高成熟度对肿瘤特异性抗肿瘤免疫具有积极影响,我们进一步分析了不同处理组黑色素瘤中T细胞的浸润情况。结果显示,ReZIF-8处理可显著促进肿瘤浸润淋巴细胞扩增,其中CD8⁺T细胞数量是PBS对照组的2.0倍,CD4⁺T细胞数量是PBS对照组的2.79倍(图4e、f)。这些结果表明,ReZIF-8可显著增强黑色素瘤内免疫细胞浸润,有效逆转肿瘤低免疫原性特征,将“冷肿瘤”表型转化为“热肿瘤”微环境。
在肿瘤浸润免疫细胞中,CD69是免疫细胞激活的早期标志物,在免疫应答的调控与启动中发挥作用。因此,我们定量分析了肿瘤浸润T细胞和自然杀伤(NK)细胞中CD69的表达,以此作为评估其抗肿瘤免疫激活状态的功能指标。结果显示,ReZIF-8处理组小鼠肿瘤组织中,CD8⁺T细胞、CD4⁺T细胞和NK细胞的CD69表达量均显著更高(图4g)。我们进一步分析了不同处理条件下肿瘤浸润NK细胞和T细胞的细胞毒性,结果显示,与所有对照组相比,ReZIF-8处理可显著提高黑色素瘤内NK细胞、CD4⁺T细胞和CD8⁺T细胞中γ-干扰素(IFN-γ)的表达(图4h、支持信息图S5c)。这些数据证实了ReZIF-8具有重塑肿瘤免疫微环境的特性。
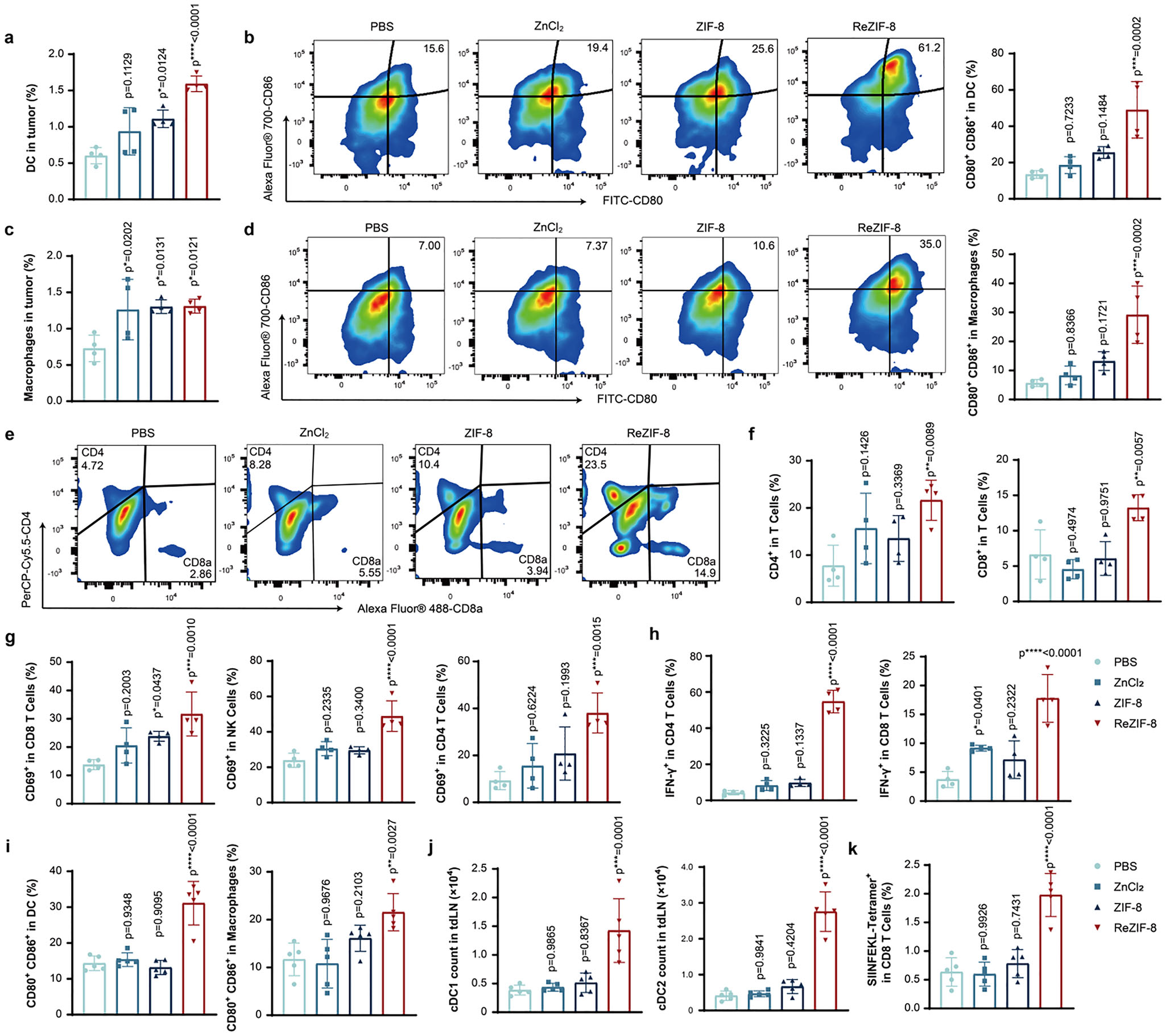
图4 ReZIF-8通过重塑肿瘤免疫微环境增强检查点抑制剂疗效
a)不同处理组黑色素瘤中树突状细胞(DCs;CD45⁺CD11c⁺)数量的流式细胞术分析;b)不同处理组肿瘤浸润树突状细胞成熟水平(CD80⁺CD86⁺)的代表性流式图及统计结果;c)不同处理组黑色素瘤中巨噬细胞(CD45⁺F4/80⁺)浸润量的流式细胞术定量分析;d)不同实验条件下黑色素瘤内成熟巨噬细胞(CD80⁺CD86⁺)的代表性流式图及统计分析;e)不同处理组小鼠黑色素瘤中CD4⁺T细胞和CD8⁺T细胞的浸润量(从CD45⁺CD3⁺细胞中圈选);f)不同方案处理下黑色素瘤中CD4⁺T细胞和CD8⁺T细胞浸润量的统计结果;g)黑色素瘤中肿瘤浸润T细胞和NK细胞的激活水平(CD69⁺);h)不同处理组肿瘤内IFN-γ⁺CD4⁺T细胞和IFN-γ⁺CD8⁺T细胞的水平。注:a)-h)的显著性分析中,样本量均为n=4;i)-k)的显著性分析中,样本量均为n=5;所有显著性分析均采用单因素方差分析(one-way ANOVA)结合Dunnett多重比较检验,以PBS组为对照;*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
考虑到肿瘤微环境的免疫抑制特性可能对ReZIF-8的治疗效果产生负面影响,我们对肿瘤浸润调节性T细胞(Tregs)、髓系来源抑制细胞(MDSCs)及M2型极化肿瘤相关巨噬细胞(TAMs)的数量进行了系统定量。结果显示,ReZIF-8处理未增加M2型巨噬细胞浸润,但显著降低了肿瘤内调节性T细胞的数量;不过,ReZIF-8组髓系来源抑制细胞水平显著升高,这可能是由于ReZIF-8诱导的免疫原性细胞死亡(ICD)触发了强烈的炎症反应,从而将髓系来源抑制细胞募集到炎症部位所致(支持信息图S5b)。
肿瘤引流淋巴结(tdLNs)是癌症-免疫循环中的关键枢纽,在启动局部抗肿瘤免疫中发挥核心作用。为全面评估ReZIF-8诱导的免疫应答,我们在小鼠体内建立了卵清蛋白(OVA)过表达的B16黑色素瘤模型(B16F10-OVA),采用与B16F10模型相同的治疗方案(接种后第7天开始,每3天一次,共4次)进行处理,之后收集肿瘤引流淋巴结,对以下细胞进行定量评估:成熟树突状细胞(CD11c⁺CD80⁺CD86⁺)、激活的巨噬细胞(F4/80⁺CD80⁺CD86⁺)及OVA特异性T细胞(SIINFEKL四聚体⁺CD3⁺CD8⁺)。结果显示,ReZIF-8处理显著提高了肿瘤引流淋巴结内巨噬细胞和树突状细胞的成熟状态(图4i),同时促进了1型常规树突状细胞(cDC1,CD11c⁺CD103⁺CD11b⁻)和2型常规树突状细胞(cDC2,CD11c⁺CD11b⁺CD103⁻)亚群的扩增(图4j)——这种树突状细胞亚群极化可有效启动肿瘤特异性免疫。此外,定量分析显示,ReZIF-8处理后肿瘤引流淋巴结中OVA特异性T细胞的浸润量增加(图4k、支持信息图S5d)。
为拮抗免疫抑制机制,我们将ReZIF-8与αPD-1(程序性死亡受体1抗体)疗法联合使用,以阻断由黑色素瘤细胞及髓系来源抑制细胞、M2型肿瘤相关巨噬细胞、调节性T细胞等免疫抑制细胞群介导的PD-1/PD-L1(程序性死亡受体配体1)通路对T细胞的抑制作用。如图5a所示,ReZIF-8与αPD-1具有协同作用,可提高肿瘤应答率,进一步抑制肿瘤生长(图5b、e、支持信息图S5g),且未导致小鼠体重显著下降(图5c),表明该联合疗法具有可接受的全身毒性和良好的抑癌效果。生存曲线显示,联合治疗组小鼠的生存期显著延长,在42天时仍保持60%的存活率(图5d)。

图5 ReZIF-8增强免疫检查点抑制剂的疗效并提升全身性抗肿瘤免疫
a)ReZIF-8联合αPD-1疗法的动物实验设计示意图;b)联合治疗组、单药治疗组及PBS对照组的肿瘤生长曲线(n=7;采用双向方差分析(two-way ANOVA)结合Dunnett多重比较检验,以PBS组为对照;****P<0.0001);c)不同处理组小鼠的体重变化曲线(n=7);d)联合治疗组、单药治疗组及PBS对照组小鼠的生存曲线(n=7);e)不同处理组的代表性肿瘤照片;f)不同处理组小鼠脾脏中CD4⁺T细胞和CD8⁺T细胞的数量(从CD45⁺CD3⁺细胞中圈选,n=5;采用单因素方差分析结合Dunnett多重比较检验,以PBS组为对照;****P<0.0001);g)小鼠脾脏中CD4⁺T细胞和CD8⁺T细胞激活水平(CD69⁺)的统计分析(n=5;采用单因素方差分析结合Dunnett多重比较检验,以PBS组为对照;****P<0.0001);h)不同处理组黑色素瘤组织的TUNEL染色和Ki67免疫组化分析(比例尺:200 μm);i)黑色素瘤远端肿瘤抑制动物模型示意图;j)不同处理组小鼠近端(已治疗)和远端(未治疗)肿瘤的生长曲线(n=6;采用双向方差分析结合Dunnett多重比较检验,以PBS组为对照;***P<0.001);k)远端抑制模型中不同组小鼠的生存曲线(n=6);l)不同处理组的肿瘤生长轨迹(n=6);m)ReZIF-8联合αPD-1疗法增强全身性抗肿瘤免疫应答的机制示意图。所有统计数据均以“均值±标准差(SD)”表示。
为评估全身性抗肿瘤免疫效应,我们在指定时间点通过流式细胞术分析小鼠脾脏免疫细胞。结果显示,联合治疗显著增加了脾脏中CD4⁺T细胞和CD8⁺T细胞的数量(图5f、支持信息图S5e);对照组小鼠脾细胞中CD69的表达无显著差异,而ReZIF-8+αPD-1联合治疗组脾细胞的CD69表达量显著升高(图5g),且该组可防止T细胞过早耗竭(支持信息图S5f)。肿瘤组织的TUNEL染色和Ki67染色证实,免疫检查点抑制剂(ICIs)与ReZIF-8联合使用可进一步抑制肿瘤细胞增殖,并协同诱导肿瘤细胞死亡(图5h)。
此外,我们利用双侧肿瘤模型评估治疗后的全身性免疫效应(图5i),发现联合治疗对近端(已治疗)和远端(未治疗)肿瘤均有抑制作用,对远端肿瘤的抑制率达92%(图5j、l);同时,小鼠的存活率显著提高(图5k)。综上,ReZIF-8通过ROS驱动的ICD逆转黑色素瘤的免疫抑制微环境,增强局部抗肿瘤免疫;其与αPD-1的协同作用可放大这一效应,将免疫应答扩展至全身,从而抑制远端肿瘤进展(图5m)。
3 结论
本研究通过硼氢化钠对ZIF-8中的Zn2⁺进行可控还原,开发出一种pH响应型产氢纳米平台(ReZIF-8)。与传统需外部触发的气体疗法不同,ReZIF-8凭借其固有的pH敏感性,可在酸性肿瘤微环境(TME)中自主生成氢气(H₂)。ReZIF-8被细胞内吞后,肿瘤局部的酸性环境会驱动其同时释放H₂和Zn2⁺,进而诱导:线粒体不稳定(膜电位ΔΨm丧失)、ROS介导的氧化还原失衡及免疫原性细胞死亡(ICD)。
这种自放大的免疫刺激级联反应通过募集抗原呈递细胞和效应T细胞,激活固有免疫和适应性免疫,从而增强肿瘤抗原交叉呈递。同时,H₂驱动的终末分化可使肿瘤细胞进入类衰老停滞状态,与细胞毒性作用形成互补。ReZIF-8与αPD-1检查点阻断疗法的协同作用,可将局部免疫刺激扩展为全身性抗肿瘤免疫。该联合疗法不仅能有效清除肿瘤细胞,还能通过“训练”机体免疫细胞使其更好地识别和攻击肿瘤细胞,从而降低肿瘤转移和复发风险。
关键在于,ReZIF-8通过“氧化应激-分化-免疫”这一自维持三联机制发挥作用,具有以下优势:(1)肿瘤微环境特异性激活(pH驱动的选择性);(2)脱靶毒性极低;(3)合成可规模化(室温还原即可制备)。本研究证实,基于金属有机框架(MOF)的H₂递送系统可作为一种转化范式,实现气体疗法、离子干扰与免疫疗法的协同应用。
4 实验部分
4.1 试剂与材料
2-甲基咪唑(纯度99%,分子式C₄H₆N₂)、六水合硝酸锌(纯度99.998%,分子式Zn(NO₃)₂·6H₂O)、硼氢化钠(NaBH₄)、十六烷基三甲基溴化铵(CTAB)均购自Sigma-Aldrich Merck KGaA公司。
DMEM培养基、RPMI 1640培养基、胎牛血清(FBS)、0.25% EDTA-胰蛋白酶、磷酸盐缓冲液(PBS)、青霉素-链霉素溶液、增强型细胞计数试剂盒-8(Enhanced CCK-8)、Hoechst 33342荧光染料、CellTracker Green(细胞示踪绿)、Cy5.5荧光染料、DAPI荧光染料、LysoTracker Green(溶酶体示踪绿)、活/死细胞染色试剂盒、小鼠粒细胞-巨噬细胞集落刺激因子(GM-CSF)重组蛋白及小鼠白细胞介素-4(IL-4)重组蛋白均购自赛默飞世尔科技(Thermo Fisher Scientific Inc.)公司。
JC-1线粒体膜电位检测试剂盒购自碧云天生物技术(Beyotime Co., Ltd.)公司。
Alexa Fluor 647标记的膜联蛋白V(Annexin V)、碘化丙啶(PI)、PerCP-eFluor 710标记的抗小鼠CD80抗体、PE-Cy7标记的抗小鼠CD86抗体、FITC标记的抗小鼠CD40抗体、抗小鼠CD16/CD32抗体、AlexaFlour 700标记的抗小鼠CD86抗体、APCFire750标记的抗小鼠CD11c抗体、BV785标记的抗小鼠F4/80抗体、FITC标记的抗小鼠CD80抗体、Pacific Blue标记的抗小鼠CD45抗体、PerCP-Cy5.5标记的抗小鼠CD40抗体、eFluor660标记的抗小鼠CD11b抗体、AF488标记的抗小鼠CD8a抗体、APC标记的抗小鼠CD206抗体、APCF750标记的抗小鼠CD3抗体、PerCP-Cy5.5标记的抗小鼠CD4抗体、BV605标记的抗小鼠CD69抗体、PerCP-Cy5.5标记的抗小鼠CD127抗体均购自BioLegend公司。
肿瘤坏死因子-α(TNF-α)酶联免疫吸附测定(ELISA)试剂盒、白细胞介素-6(IL-6)ELISA试剂盒购自伊莱瑞特生物技术(Elabscience Biotechnology Co., Ltd.)公司。
抗小鼠PD-1(CD279)体内抗体(In VivoMAb)购自Bio X Cell公司。
坏死抑制剂(Necrostatin-1)、铁死亡抑制剂(Ferrostatin-1)、焦亡抑制剂(Z-VAD-FMK)、β-巯基乙醇(β-ME)、2',7'-二氯荧光素二乙酸酯(DCFH-DA)均购自美仑生物科技(MedChemExpress)公司。
4.2 细胞系
小鼠黑色素瘤细胞系B16F10(编号CRL-6475,RRID:CVCL_0159)和小鼠巨噬细胞系RAW 264.7(编号TIB-71,RRID:CVCL_0493)均购自美国典型培养物保藏中心(ATCC)。
B16F10-OVA细胞系(卵清蛋白过表达的B16F10细胞)由武汉大学鲍鹏教授馈赠。
B16F10细胞和B16F10-OVA细胞采用完全RPMI 1640培养基培养,RAW 264.7巨噬细胞采用灭活DMEM培养基培养。
骨髓来源树突状细胞(BMDCs)由骨髓间充质干细胞(BMSCs)诱导分化获得:从小鼠股骨和胫骨骨髓腔中冲洗获取BMSCs,用含GM-CSF(20 ng/mL)和IL-4(10 ng/mL)的RPMI 1640培养基培养;培养第2天弃去上清液,更换含GM-CSF和IL-4的新鲜RPMI 1640完全培养基;第4天后进行半量换液;培养6天后收集BMDCs用于功能实验。
所有细胞培养基均添加10% FBS和1%青霉素-链霉素混合液,细胞置于37℃、5% CO₂培养箱中培养,且所有细胞均无支原体和细菌污染。
4.3 可还原ZIF-8纳米颗粒(ReZIF-8)的合成
室温条件下,用6 mL去离子水溶解六水合硝酸锌(0.103 mol/L)和十六烷基三甲基溴化铵(2.75 mmol/L),制备得到溶液A;同时,用42 mL去离子水溶解2-甲基咪唑(0.752 mol/L),制备得到溶液B。将溶液A缓慢加入溶液B中,持续搅拌12小时。
另取0.5 g硼氢化钠,在室温下用适量去离子水溶解,将该溶液逐步加入上述ZIF-8溶液中,继续搅拌2小时。随后,将所得溶液在4℃下用超滤管离心,收集产物并用去离子水洗涤2次;将离心得到的沉淀均匀分散于10 mL去离子水中。
取1 mL上述分散液进行冷冻干燥,记录其质量;同时取10 μL ReZIF-8分散液稀释100倍,采用电感耦合等离子体发射光谱仪(ICP-OES)测定锌离子浓度,并根据实测锌浓度与初始锌投入量的比值计算反应产率。
在后续细胞实验和动物实验中,通过ICP-OES对各组锌离子溶液进行标准化处理,以排除锌离子对肿瘤治疗效果的干扰。
4.4 ReZIF-8的理化性质表征
将离心后的ReZIF-8溶液稀释至适宜浓度,取10 μL滴加在碳支持膜上,室温晾干后进行仪器分析,观察其形貌与粒径;同时采用X射线能谱仪(EDS)分析颗粒的元素组成,仪器加速电压设定为100 kV。
将离心后重新分散的ReZIF-8分散液稀释至适宜浓度,采用动态光散射仪(DLS)测定样品的水合粒径,同时用该仪器测定样品的表面电位。
将冷冻干燥后的ReZIF-8样品研磨成细粉,制备溴化钾(KBr)压片,在400-4000 cm⁻1波数范围内进行红外光谱(IR)分析;将冻干样品充分研磨后,分别进行X射线衍射(XRD)分析和X射线光电子能谱(XPS)分析。
收集冻干样品与盐酸(HCl)溶液反应产生的气体,采用气相色谱仪(GC)进行分析。
将亚甲基蓝(MB)溶解于含铂(Pt)粉末的0.1 mol/L HCl溶液中,制备浓度为100 μg/mL的MB溶液,采用紫外-可见分光光度计测定该溶液的紫外-可见吸收峰;同时,在相同吸收波长下,以不同浓度溶剂的吸光度绘制标准曲线,通过记录吸光度随时间的变化,评估样品与溶剂反应过程中的产氢能力。
4.5 ReZIF-8在酸性条件下的降解能力
将ReZIF-8纳米颗粒分别在酸性缓冲液中孵育0分钟、20分钟、40分钟、1小时、2小时、4小时、8小时、12小时、24小时和48小时,通过透射电子显微镜(TEM)观察其形貌变化,验证ReZIF-8在酸性条件下的降解能力。
4.6 B16F10细胞对ReZIF-8的摄取实验
将生长状态良好的B16F10肿瘤细胞以1×10⁵个/孔的密度接种于玻璃底培养皿中,每孔加1 mL培养基,孵育24小时。弃去培养基,加入Cy5.5标记(红色荧光)的ReZIF-8材料,孵育6小时。弃去上清液,按照试剂盒说明书,用Hoechst 33342(蓝色荧光)标记细胞核,用CellTracker™ Green(绿色荧光)标记细胞质;洗涤数次后,采用荧光显微镜观察细胞对ReZIF-8的内吞情况。
4.7 B16F10细胞中ReZIF-8与溶酶体的共定位实验
将生长状态良好的B16F10肿瘤细胞以1×10⁵个/孔的密度接种于玻璃底培养皿中,每孔加1 mL培养基,孵育24小时。弃去培养基,加入Cy5.5标记(红色荧光)的ReZIF-8材料,在不同时间点孵育。弃去上清液,按照试剂盒说明书,用DAPI(蓝色荧光)标记细胞核,用LysoTracker Green(绿色荧光)标记溶酶体;采用荧光显微镜观察肿瘤细胞内ReZIF-8与溶酶体的共定位情况。
4.8 ReZIF-8对B16F10肿瘤细胞的细胞毒性评估
将生长状态良好的B16F10肿瘤细胞以1×10⁴个/孔的密度接种于96孔细胞培养板中,每孔加100 μL培养基,置于37℃、5% CO₂培养箱中培养24小时。将浓度为1 mg/mL的ReZIF-8溶液用完全培养基稀释,制备成浓度梯度溶液(0、3.125、6.25、12.5、25、50、75、100、150、200 μg/mL),每孔加入100 μL梯度溶液,每个浓度设5个复孔。继续孵育24小时后,弃去培养基,每孔加入100 μL用完全培养基稀释的10%增强型CCK-8试剂,孵育0.5-1小时。最后,用酶标仪测定各孔在450 nm波长处的吸光度,并根据吸光度值计算细胞存活率(%),计算公式如下(公式1):
![]()
注:As为实验孔吸光度,Ak为对照孔吸光度,Aβ为空白孔吸光度。
4.9 ReZIF-8诱导B16F10肿瘤细胞死亡类型的验证
4.9.1 活/死细胞染色实验(验证ReZIF-8对B16F10肿瘤细胞的杀伤作用)
将生长状态良好的B16F10肿瘤细胞以1×10⁵个/孔的密度接种于玻璃底培养皿中,每孔加1 mL培养基,孵育24小时。弃去培养基,加入ReZIF-8材料孵育12小时。弃去上清液,按照试剂盒说明书,用钙黄绿素AM(Calcein AM)和PI进行共染色;洗涤数次后,采用荧光显微镜观察活/死细胞染色结果——绿色荧光代表活细胞,红色荧光代表死细胞。
4.9.2 凋亡/坏死检测实验(验证ReZIF-8对B16F10肿瘤细胞的杀伤作用)
将生长状态良好的B16F10肿瘤细胞以1×10⁵个/孔的密度接种于24孔细胞培养板中,每孔加1 mL培养基,孵育24小时。弃去培养基,加入ReZIF-8材料孵育24小时。用不含EDTA的胰蛋白酶收集细胞,按照FITC-Annexin V/PI凋亡/坏死检测试剂盒说明书进行染色;最后,采用流式细胞术检测ReZIF-8处理后肿瘤细胞的凋亡和坏死情况。
4.10 ReZIF-8对线粒体的影响
将生长状态良好的B16F10-OVA细胞以1×10⁵个/孔的密度接种于玻璃底培养皿中,培养24小时后,加入ReZIF-8孵育4小时。弃去培养基,用PBS洗涤细胞,加入JC-1工作液,在37℃避光条件下孵育20分钟。随后用JC-1染色缓冲液洗涤细胞2次,立即用荧光显微镜观察;根据红色荧光(JC-1聚集体)与绿色荧光(JC-1单体)的比值,分析线粒体膜电位变化。
ReZIF-8对B16F10细胞内活性氧(ROS)的影响
将生长状态良好的B16F10-OVA肿瘤细胞以1×10⁵个/孔的密度接种于玻璃底培养皿中,培养24小时。更换培养基,加入ReZIF-8孵育4小时。弃去上清液后,用PBS洗涤细胞。随后,按照试剂盒说明书,用DAPI进行细胞核染色,用DCFH-DA荧光探针进行细胞质染色。避光孵育后,再次洗涤细胞,通过荧光显微镜观察,以检测细胞内ROS水平。
ReZIF-8对肿瘤细胞形态影响的生物透射电子显微镜(Bio-TEM)分析
采用生物透射电子显微镜(TEM)研究肿瘤杀伤过程:将生长状态良好的B16F10肿瘤细胞以1×10⁵个/孔的密度接种于24孔细胞培养板中,每孔加1mL培养基,孵育24小时。弃去培养基后,加入ReZIF-8材料孵育8小时。随后弃去上清液,用胰蛋白酶消化收集细胞,在2.5%戊二醛溶液中4℃固定过夜。后续制备样品并在生物透射电子显微镜下观察。TEM样品制备步骤如下:
1. 弃去固定液,用0.1mol/L磷酸盐缓冲液(pH 7.0)冲洗样品3次,每次15分钟;
2. 用1%四氧化锇溶液固定样品1-2小时;固定后,小心移除四氧化锇废液,再用0.1mol/L磷酸盐缓冲液(pH 7.0)冲洗样品3次,每次15分钟;
3. 用梯度浓度乙醇溶液(30%、50%、70%、80%)脱水样品,每种浓度处理15分钟;接着用梯度浓度丙酮溶液(90%、95%)处理,每种浓度15分钟;最后用纯丙酮处理样品2次,每次20分钟;
4. 先用Spurr包埋剂与丙酮的混合液(体积比1:1)处理样品1小时,再用Spurr包埋剂与丙酮的混合液(体积比3:1)处理样品3小时;最后将样品置于纯包埋剂中,室温放置过夜;
5. 对样品进行包埋、切片和染色,随后进行观察。
ReZIF-8诱导细胞死亡机制的探究
首先,将生长状态良好的B16F10肿瘤细胞以1×10⁴个/孔的密度接种于96孔细胞培养板中,每孔加入100μL培养基。随后将培养板转移至37℃、5%CO₂培养箱中孵育24小时。之后设置对照组,将样品平均分为两大实验组:
- 第一组:每孔加入100μL浓度为75μg/mL的ReZIF-8溶液,共孵育12小时;弃去上清液后,分别加入10μmol/L和20μmol/L的坏死抑制剂(Necrostatin-1)、铁死亡抑制剂(Ferrostatin-1)、焦亡抑制剂(Z-VAD),以及2mmol/L的β-巯基乙醇(β-ME),继续培养12小时;
- 第二组:将10μmol/L和20μmol/L的上述坏死抑制剂、铁死亡抑制剂、Z-VAD-FMK,以及2mmol/L的β-ME,分别与75μg/mL的ReZIF-8共孵育24小时。
最后,用酶标仪测定各孔在450nm波长处的吸光度,并根据吸光度值计算细胞存活率(%,计算公式见公式1)。
ReZIF-8处理后的B16F10-OVA肿瘤细胞对RAW 264.7细胞和BMDCs的激活作用
将生长状态良好的B16F10-OVA肿瘤细胞以1×10⁵个/孔的密度接种于24孔细胞培养板中,每孔加0.5mL培养基,孵育12小时。加入ReZIF-8继续孵育12小时。随后,将生长状态良好的RAW 264.7细胞/骨髓来源树突状细胞(BMDCs)以1×10⁵个/孔的密度(每孔0.5mL)加入同一24孔板中,再培养24小时。
异步处理组操作如下:B16F10-OVA肿瘤细胞经ReZIF-8处理12小时后,收集细胞上清液;将1×10⁶个BMDCs与5倍稀释的细胞上清液共孵育。
最后,用CD80、CD86、CD40抗体混合物对细胞进行染色,通过流式细胞术检测经ReZIF-8处理的B16F10-OVA肿瘤细胞所刺激的RAW 264.7细胞/BMDCs的成熟情况。
ReZIF-8与B16F10、RAW 264.7体外共培养上清液中细胞因子水平的检测
收集凋亡/坏死处理后的细胞培养上清液,以10000转/分钟的转速离心10分钟,每管分装100μL,置于-80℃冰箱保存。随后按照各试剂盒说明书,测定肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)等细胞因子的水平,以验证ReZIF-8处理B16F10肿瘤细胞后对RAW 264.7细胞的免疫调节作用。
动物实验
所有动物实验均经浙江大学动物实验中心机构动物护理和使用委员会(IACUC)批准(中国浙江)。所有小鼠实验操作均遵循《中华人民共和国国务院批准的实验动物管理条例》。所有雌性C57BL/6JGpt小鼠(6-8周龄)均购自江苏集萃药康生物科技股份有限公司(中国南京)。根据实验动物福利要求,所有荷瘤小鼠若肿瘤体积超过1500mm3,需实施安乐死以减轻其痛苦。
黑色素瘤(B16F10)小鼠模型的构建
培养B16F10肿瘤细胞,收集并计数,制备终浓度为5×10⁶个/mL的细胞悬液。将100μL该细胞悬液皮下注射到C57BL/6JGpt小鼠右侧胁腹。
远端黑色素瘤(B16F10)模型构建方法:同样培养B16F10肿瘤细胞,收集并计数,制备终浓度为5×10⁶个/mL的细胞悬液;将100μL该细胞悬液皮下注射到C57BL/6JGpt小鼠右侧胁腹;另外,在小鼠右侧胁腹注射5×10⁵个B16F10肿瘤细胞4天后,再向同一小鼠左侧胁腹皮下注射100μL浓度为2.5×10⁶个/mL的细胞悬液。
ReZIF-8在小鼠体内的生物相容性评估
给C57BL/6JGpt小鼠皮下注射100μg ReZIF-8,7天后收集小鼠外周血,进行血液学和肝功能分析,以评估其全身作用。
体内批量RNA测序(Bulk RNA-Seq)
用ReZIF-8或PBS处理小鼠3个周期后,收集小鼠肿瘤组织。去除表皮组织,将剩余组织浸入Trizol试剂中,用组织研磨仪匀浆至完全破碎。按照标准Trizol法提取RNA,先通过琼脂糖凝胶电泳和Nanodrop测定评估RNA纯度和浓度。用Oligo(dT)磁珠分离mRNA,随后通过PCR构建文库。采用Q-PCR定量文库的有效浓度,根据有效浓度和目标测序深度将文库混合,在Illumina NovaSeq X Plus平台上进行150bp双端测序(PE150)。对原始测序数据进行质量控制后,使用R语言进行差异表达分析、GO功能富集分析、KEGG通路富集分析和基因集富集分析(GSEA)。
ReZIF-8对小鼠黑色素瘤的治疗效果评估
将已构建黑色素瘤(B16F10)动物模型的小鼠分为4组,每组5-6只。在第7、10、13、16天,分别给各组小鼠瘤内注射100μL PBS、Zn2⁺溶液、ZIF-8溶液和ReZIF-8溶液(每只小鼠100μg),所有组的Zn2⁺浓度保持一致。同时,从第7天开始,每3天记录所有小鼠的体重、肿瘤体积和存活情况,直至小鼠按伦理准则自然死亡。
注:式中a、b分别代表肿瘤的长径和短径(肿瘤体积计算公式未列出,此处保留原文注释逻辑)。
材料肿瘤治疗效果的流式细胞术分析
在动物模型构建第18天,通过颈椎脱臼法处死小鼠,用经酒精消毒的手术器械切除肿瘤。对肿瘤组织进行免疫染色前的一系列预处理后,向收集的细胞团中加入100μL抗小鼠CD16/CD32抗体稀释液进行细胞封闭,混匀后室温孵育10分钟。将细胞分为两部分处理:
- 一部分细胞按照说明书加入染色抗体混合物(AF700标记抗小鼠CD86抗体、APCFire750标记抗小鼠CD11c抗体、BV785标记抗小鼠F4/80抗体、FITC标记抗小鼠CD80抗体、Pacific Blue标记抗小鼠CD45抗体、PerCP-Cy5.5标记抗小鼠CD40抗体、eFluor660标记抗小鼠CD11b抗体),4℃避光孵育30分钟;
- 另一部分细胞按照说明书加入染色抗体混合物(AF488标记抗小鼠CD8a抗体、APC标记抗小鼠CD206抗体、APCF750标记抗小鼠CD3抗体、BV785标记抗小鼠F4/80抗体、Pacific Blue标记抗小鼠CD45抗体、PerCP-Cy5.5标记抗小鼠CD4抗体),4℃避光孵育30分钟。
之后,用离心机以400×g转速离心5分钟,用洗涤缓冲液洗涤细胞2次,以去除多余染料。最后,用300μL PBS将细胞团重悬于流式细胞术管中,进行流式细胞术分析。
肿瘤组织免疫染色预处理步骤如下:
1. 收集肿瘤,用PBS冲洗;
2. 在含2%胎牛血清(FBS)的1640培养基中制备酶溶液,其中包含1mg/mL VI型胶原酶、0.1mg/mL透明质酸酶和0.2mg/mL DNA酶;
3. 将肿瘤切成小块,放入4mL离心管中,每个肿瘤加入约2mL酶溶液;
4. 在37℃、700转/分钟的摇床上消化样品1-2小时;消化后,将固液混合物通过70μm细胞筛,获得细胞悬液;
5. 以400×g转速离心细胞悬液5分钟,弃去上清液,用红细胞裂解液裂解红细胞,洗涤细胞1-2次,得到细胞团。
ReZIF-8联合αPD-1免疫检查点抑制剂对黑色素瘤的治疗效果评估
将已构建黑色素瘤(B16F10)动物模型的小鼠分为4组,分别为PBS组、αPD-1组、ReZIF-8组和ReZIF-8+αPD-1组,每组5-6只。在第7、10、13、16天,分别给对应组小鼠瘤内注射100μL PBS、ReZIF-8溶液(每只小鼠100μg)和ReZIF-8+αPD-1混合溶液。在第8、11、14、17天,给对应组小鼠腹腔注射αPD-1(每只小鼠100μg)。所有组的ReZIF-8和αPD-1浓度保持一致。同时,从第7天开始,每3天记录所有小鼠的体重、肿瘤体积和存活情况,直至小鼠按伦理准则自然死亡。
材料全身免疫效应的流式细胞术分析
在动物模型构建第18天,通过颈椎脱臼法处死小鼠,用经酒精消毒的手术器械取出脾脏。对脾脏组织进行免疫染色前的一系列预处理后,向收集的细胞团中加入100μL抗小鼠CD16/CD32抗体稀释液进行细胞封闭,混匀后室温避光孵育10分钟。以400×g转速离心5分钟后,向细胞中加入100μL Zombie UV可固定活/死染色剂工作液,混匀后室温避光孵育10-20分钟。按照说明书,向每个样品中加入染色抗体混合物(APCFire750标记抗小鼠CD3抗体、AF488标记抗小鼠CD8抗体、Pacific Blue标记抗小鼠CD45抗体、BV605标记抗小鼠CD69抗体、PerCP-Cy5.5标记抗小鼠CD127抗体),4℃避光孵育30分钟。之后,用离心机以400×g转速离心5分钟,用洗涤缓冲液洗涤细胞2次,去除多余染料。最后,用300μL PBS将细胞团重悬于流式细胞术管中,进行流式细胞术分析。
脾脏组织免疫染色预处理步骤如下:
1. 收集脾脏,用PBS冲洗;
2. 将脾脏置于40μm细胞筛上,用装有1mL无血清1640细胞培养基的1mL注射器的软胶头轻轻研磨脾脏;
3. 用1mL 1640培养基冲洗细胞筛和注射器推杆,将滤液收集到流式细胞术管中;
4. 以400×g转速离心过滤后的细胞悬液5分钟,弃去上清液,用红细胞裂解液裂解红细胞,洗涤细胞1-2次,得到细胞团。
为进一步验证材料的全身免疫效应,将已构建双灶黑色素瘤(B16F10)动物模型的小鼠分为4组,分别为PBS组、αPD-1组、ReZIF-8组和ReZIF-8+αPD-1组,每组5-6只。在第7、10、13、16天,分别给对应组小鼠注射100μL PBS、ReZIF-8溶液(每只小鼠100μg)和ReZIF-8+αPD-1混合溶液。在第8、11、14、17天,给对应组小鼠注射αPD-1(每只小鼠100μg)。所有组的ReZIF-8和αPD-1浓度保持一致。同时,从第7天开始,每3天记录所有小鼠的体重、右侧肿瘤体积和存活情况;从第10天开始,每3天记录左侧肿瘤体积,直至小鼠按伦理准则自然死亡。
统计分析
实验数据以“均值±标准差(mean±SD)”表示。采用单因素方差分析(one-way ANOVA)结合Dunnett多重比较检验、双因素方差分析(two-way ANOVA)结合Dunnett多重比较检验、双尾Mann-Whitney U检验和log-rank(Mantel-Cox)检验计算统计显著性。所有情况下,显著性水平定义为:*P<0.05,**P<0.01,***P<0.001,****P<0.0001。使用GraphPad Prism 9.0软件进行统计分析。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1502209.html?mobile=1
收藏

