 精选
精选
机械压力会导致癌细胞开始扩散
根据“增殖或迁移”(grow or go)模型,癌细胞可在侵袭状态与增殖状态之间切换。一项皮肤癌斑马鱼模型研究显示,周围组织对癌细胞产生的机械压力会触发这种侵袭性状态的切换。由此可见,物理环境可通过重编程细胞来决定癌症的发展行为。
Mechanical confinement governs phenotypic plasticity in melanoma | Nature
研究背景
癌细胞的行为常被描述为遵循“增殖或迁移”模型,该模型认为癌细胞可在快速分裂的增殖状态(“增殖”)与具有侵袭性的迁移状态(“迁移”)之间可逆切换[1]。这种状态切换取决于细胞所处环境:肿瘤生长由细胞增殖驱动,而癌症转移则始于肿瘤对邻近组织的侵袭。具有侵袭性的细胞通常对药物具有一定抗性,因此这种状态切换或许能解释为何部分癌症难以治疗[2]。
数十年来,癌症研究已明确了与增殖和侵袭行为相关的基因及蛋白质,但触发这种状态切换的因素始终不明确。找到这些因素,有望为阻断癌症进展、提高患者生存率提供治疗靶点。
研究发现
我们以黑色素瘤(皮肤癌)斑马鱼模型为研究对象,探究癌细胞从增殖状态向侵袭状态的切换机制。斑马鱼(*Danio rerio*)身体透明度较高,相比其他模式生物,更便于观察肿瘤的生长与转移过程[3];同时,斑马鱼的基因易于操控,且约70%的基因与人类同源[3],这些特性使其成为理想的研究模型。
我们观察到,斑马鱼体内处于活跃侵袭状态的黑色素瘤细胞,常被周围组织挤压(图1)。由此我们提出假设:机械力是否会挤压癌细胞的细胞核、改变DNA结构,进而导致基因表达变化,最终促使细胞向侵袭状态转变?为验证这一假设,我们构建了体外实验系统来挤压人类黑色素瘤细胞,并检测压力对细胞结构、细胞核结构、染色质(DNA的包装形式)结构及基因表达的影响。
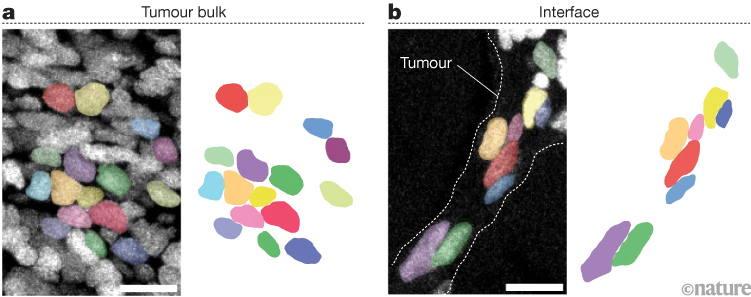
图1 侵袭性肿瘤细胞被周围组织挤压
a、b为斑马鱼黑色素瘤(皮肤癌)组织切片的免疫荧光显微镜图像,分别展示肿瘤主体(a)及肿瘤与周围组织的交界区域(b)。切片经 Hoechst 染料染色以标记细胞核;每幅图右侧为去除图像叠加层、仅显示伪彩色标记单个细胞核的结果。交界区域的细胞会受到机械压力挤压。比例尺为10微米。
图片来源:Hunter, M. V. 等/《自然》(CC BY 4.0)
通过将成像技术与生物信息学、生物物理学方法相结合,我们发现:受到挤压的黑色素瘤细胞会强化其细胞“骨架”(细胞骨架)和细胞核结构,以抵抗约束带来的机械应力。这一过程依赖于一种名为LINC复合体(核骨架-细胞骨架连接复合体)的蛋白质结构——该结构连接细胞骨架与核膜,可在细胞内传递机械力。这种力的传递会导致一种名为HMGB2的DNA修饰蛋白表达量增加,而HMGB2会重组DNA结构,以缓解染色质所承受的机械应力。表达上调的HMGB2还会激活多个促进细胞侵袭性和药物抗性的基因表达。
最后,我们通过在人类、斑马鱼和小鼠的黑色素瘤细胞中分别进行HMGB2基因敲除和过表达实验证实:HMGB2是调控癌细胞从增殖状态向侵袭状态切换的关键分子。
研究意义
我们的研究进一步证实,癌症并非仅由DNA突变驱动——这一观点正得到越来越多证据的支持。尽管已知肿瘤周围的细胞(统称为肿瘤微环境)会影响癌症行为,但本研究首次明确:这些细胞对肿瘤施加的物理力,会直接影响肿瘤的侵袭性强弱及扩散速度。而这些特性的调控,是由HMGB2等可改变细胞染色质结构的蛋白质介导的。
本研究聚焦于压力这一机械力类型,但人体内的癌细胞可能还会受到其他类型力的作用,例如拉力(拉伸力)以及血液中快速流体流动产生的剪切应力。了解这些力如何影响癌症行为,对于开发“针对肿瘤细胞机械刺激响应”的治疗方法至关重要。目前尚不清楚机械力诱导的肿瘤细胞行为变化能持续多久、是否具有可逆性,以及细胞是否会对机械应力产生“长期记忆”。此外,机械应力还有可能作为一种选择压力,使那些最能适应血液环境和转移部位等机械挑战环境的肿瘤细胞得以富集。
本研究虽以黑色素瘤为研究对象,但机械信号传导可能在其他类型癌症中也发挥重要作用。我们对胰腺癌尤其感兴趣:胰腺癌是人类中质地最坚硬的肿瘤之一,具有高度侵袭性,且预后极差。目前,我们正利用胰腺癌斑马鱼模型,寻找受机械力调控的因子——这些因子有望成为治疗这一难治性疾病的靶点。
(作者单位:Miranda V. Hunter 任职于美国纽约州纽约市纪念斯隆-凯特琳癌症中心;Richard M. White 任职于英国牛津大学)
专家观点
作者利用黑色素瘤斑马鱼模型,研究了位于肿瘤与周围环境交界区域的一小部分稀有癌细胞的机械生物学特性。总体而言,这是一篇极具洞察力的论文,它将机械生物学特征(细胞核变形)与黑色素瘤的行为切换关联起来。通过将斑马鱼体内实验与体外生物物理检测相结合,研究人员详细剖析了其中的作用机制。
(点评专家:Xavier Trepat,任职于西班牙巴塞罗那加泰罗尼亚生物工程研究所)
研究背后的故事
长期以来,我们一直关注肿瘤微环境如何影响癌症行为。此前我们曾发表研究[4]指出,肿瘤与周围组织交界区域的细胞,其基因表达会发生显著变化。基于该研究,我们进一步探究了这些交界区域细胞如何促进癌症侵袭。我们将研究靶点锁定为HMGB2,是因为此前研究发现它是在肿瘤边缘表达量最高的基因之一。
研究的关键转折点发生在我们观察到:HMGB2高表达的细胞似乎也承受着巨大的机械应力。“机械约束可能触发癌症侵袭”这一想法极具吸引力,我们无法忽视。在摸索出如何通过挤压培养的人类细胞来验证假设后,后续研究便顺利推进。
(讲述人:M.V.H.)
编辑视角
这篇论文之所以引人注目,是因为它充分利用斑马鱼这一模式生物,揭示了一种此前未知的机制——机械力可通过该机制调控细胞行为切换,具体而言,即调控黑色素瘤细胞在增殖状态与侵袭状态之间的切换。
(点评编辑:Barbara Marte,《自然》杂志高级编辑)
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1500710.html?mobile=1
收藏

