富氢水通过缓解氧化应激减轻断奶仔猪腹泻
广西大学动物科学技术学院,
佛山科学技术学院生命科学与工程学院,
摘要(简化版)
仔猪早期断奶会引发断奶应激,导致细胞内活性氧积累,进而诱发氧化应激并造成肠黏膜损伤,目前针对该问题尚无有效解决方案。富氢水具有选择性抗氧化特性,可减轻氧化应激损伤,是一种极具潜力的抗氧化干预手段。本研究以富氢水替代断奶仔猪的日常饮水,探究其对仔猪生长性能、血清抗氧化能力、肠道形态、肠道菌群组成及肝脏代谢的影响。核心研究结果表明,富氢水可通过缓解氧化应激降低仔猪腹泻发生率。该研究为富氢水作为无残留、环境友好型抗氧化剂在商业化养猪生产中的应用奠定了科学基础。
Zhang P, Yang J, Lu Z, Liang Q, Yang X, Wang J, Guo J, Zhao Y. Hydrogen-Rich Water Attenuates Diarrhea in Weaned Piglets via Oxidative Stress Alleviation. Biology (Basel). 2025 Aug 5;14(8):997.
摘要
仔猪早期断奶会引发断奶应激,进而诱发氧化应激,最终阻碍仔猪生长发育。富氢水(HRW)具有选择性抗氧化特性,能减轻氧化应激损伤,是理想的干预手段。本研究旨在评估富氢水对断奶仔猪的影响,重点探究其对仔猪生长性能、腹泻发生率、抗氧化功能、肠道形态、肠道菌群及肝脏代谢物的作用。结果显示:
1. 富氢水显著提高断奶仔猪的平均日采食量(ADFI),并显著降低腹泻率;
2. 血清氧化应激指标分析表明,富氢水显著提高总抗氧化能力(T-AOC)和总超氧化物歧化酶(T-SOD)活性,同时显著降低丙二醛(MDA)浓度;
3. 肠道形态评估显示,富氢水显著提高十二指肠、空肠和回肠的绒毛高度与隐窝深度比值(VH/CD);
4. 菌群分析表明,富氢水显著提高结肠中普雷沃氏菌(*Prevotella*)的丰度,同时增加空肠和盲肠中阿克曼氏菌(*Akkermansia*)等有益菌丰度,降低大肠杆菌(*Escherichia*)等有害菌丰度;
5. 肝脏代谢组分析显示,富氢水显著改变断奶仔猪肝脏中的代谢物组成,差异富集的代谢物主要集中在与氧化应激相关的KEGG通路,包括ABC转运蛋白、丙酮酸代谢、自噬、FoxO信号通路、谷胱甘肽代谢、 ferroptosis(铁死亡)及AMPK信号通路。
综上,富氢水可通过增强抗氧化能力减轻断奶仔猪腹泻并促进其生长。该研究为富氢水在养猪生产中的应用提供了科学依据,也为进一步探究富氢水对动物健康及生产性能的作用机制提供了参考。
1. 引言
早期断奶是商业化养猪生产中广泛采用的技术措施[1]。然而,断奶后仔猪饮食的突然转变会使其承受剧烈应激,引发断奶应激综合征。该综合征的典型特征是细胞内活性氧(ROS)水平升高,进而导致肠黏膜损伤[2]。研究表明,断奶后仔猪从液态奶过渡到固态饲料,会出现采食量下降、体重增长减缓,同时腹泻发生率升高[3]。因此,缓解仔猪断奶应激已成为现代养猪生产中亟待解决的关键问题。
富氢水(HRW)作为一种新型功能性水,在分子氢(H₂)介导下展现出独特的健康保健生物功效。H₂具有高度选择性的抗氧化能力,其分子体积小,能轻松穿透细胞膜并与细胞内活性氧发生反应[4];且H₂还原性温和,不会干扰生物体内正常的生理氧化还原反应[5]。研究证实,H₂可选择性清除羟基自由基和过氧亚硝酸盐阴离子,从而减轻肝、心、肠等器官因缺血再灌注引发的氧化应激损伤,最终实现细胞保护[6]。此外,H₂还可通过抑制Caspase-1活性发挥抗凋亡作用,调节促炎细胞因子,抑制创伤性脑损伤诱导的急性肺损伤[7],其抗氧化、抗炎及抗凋亡特性已得到广泛认可[8]。尽管临床试验和相关研究的初步结果显示富氢水具有一定功效,但仍需更多研究验证这些结论。
本研究旨在系统评估富氢水对断奶仔猪生长性能、肠道健康及肝脏代谢的影响,以期为富氢水作为新型、无残留、环境友好的绿色抗氧化剂在养猪生产中的应用提供科学依据。
2. 材料与方法
2.1 试验动物与分组
选取60头21日龄断奶去势公仔猪(长白×大白杂交种,购自山西嘉百种猪育种有限公司,吕梁)进行试验。仔猪初始体重为6.42±0.85 kg(均值±标准差),组间体重无显著差异(p>0.05)。将仔猪随机分为2个饮食处理组,每组6个重复,每个重复5头猪:
- 对照组(C):饮用经过滤净水系统处理的纯净水;
- 富氢水组(H):试验全程饮用浓度为2000 ppb(十亿分之一)的富氢水。
试验周期为14天。试验组所需富氢水由定制化氢气发生器(佛山金明环境科技有限公司,佛山)制备:先将仔猪饮用水经净水系统过滤,再通过电解模块产生氢气,利用加压泵在高压条件下将氢气溶解于纯净水中,最后将富氢水储存于压力罐中,输送至仔猪饮水乳头。为确保溶解氢浓度稳定,该装置设计有压力感应启动机制:仅当仔猪饮水导致乳头处压力下降时,系统才启动富氢水的制备与输送。试验期间,每日对富氢水组饮水乳头输出水的溶解氢浓度进行2次监测。
2.2 动物饲养管理
所有试验猪饲养于环境可控的猪舍内,采用标准化自然光照与机械通风。试验全程(14天)通过自动温控系统将环境温度维持在25±1℃,相对湿度维持在60%~70%。仔猪自由采食,每日分别于08:00和16:00定时投喂饲料。
2.3 生长性能测定
试验第1天和最后1天,所有断奶仔猪经12小时禁食后进行个体称重。试验期间每日记录饲料投喂量、剩料量及腹泻发生情况,计算以下指标:腹泻发生率、平均日增重(ADG)、平均日采食量(ADFI)及饲料转化率(FCR)。
2.4 样品采集与处理
试验最后1天,所有仔猪经12小时禁食后,从其前腔静脉采集血液样本,待血液凝固后分离血清,用于后续抗氧化能力指标分析。每组随机选取6头仔猪进行安乐死,采集十二指肠、空肠和回肠片段用于肠道形态分析;采集空肠、回肠、盲肠、结肠和直肠的肠腔内容物用于肠道菌群分析;采集肝脏组织样本并立即置于液氮中速冻,用于后续代谢组分析。
2.5 抗氧化指标测定
采用成熟的生化检测方法评估血清抗氧化能力:通过ABTS自由基阳离子脱色法测定总抗氧化能力(T-AOC),通过WST-1还原法测定总超氧化物歧化酶(T-SOD)活性,通过硫代巴比妥酸反应底物法测定丙二醛(MDA)浓度。所有操作严格遵循试剂盒说明书(南京建成生物工程研究所)进行。
2.6 肠道形态学分析
将固定后的肠道片段进行标准化组织学处理:4%多聚甲醛固定24小时→流水冲洗2小时→梯度乙醇脱水→二甲苯透明→石蜡包埋→制作5μm切片。切片经二甲苯脱蜡→梯度乙醇复水→苏木精-伊红(H&E)染色→1%酸-乙醇分化→流水返蓝→梯度乙醇脱水→二甲苯透明→中性树胶封片后,使用Image-Pro Plus软件测量绒毛高度和隐窝深度,计算每个样本中完整绒毛的绒毛高度与隐窝深度比值(VH/CD)。
2.7 肠道菌群分析
采用QIAamp Fast DNA粪便迷你试剂盒(天根生化科技,北京)从肠腔内容物中提取微生物基因组DNA。以338F/806R为引物,扩增细菌16S rRNA基因的V3-V4高变区;纯化后的扩增产物连接Illumina接头构建文库,在Novaseq 6000平台(Illumina,美国加利福尼亚州圣迭戈)进行双端测序(2×250 bp)。生物信息学处理包括:使用Trimmomatic进行原始测序数据质量控制,FLASH进行双端序列拼接,QIIME2(UCHIME算法)去除嵌合体,基于SILVA数据库(v138)采用朴素贝叶斯分类器进行物种注释,使用R语言vegan包计算α多样性指数(Shannon指数、Simpson指数),通过Bray-Curtis距离分析β多样性(主坐标分析,PCoA)。
2.8 肝脏代谢组分析
将肝脏组织在液氮中研磨粉碎,用含内标的70%甲醇水溶液提取代谢物;涡旋混匀并离心后收集上清液,于-20℃孵育30分钟;再次离心获取澄清上清液,用于液相色谱-串联质谱(LC-MS/MS)分析。色谱分离采用ACQUITY Premier HSS T3色谱柱(Waters,美国马萨诸塞州米尔福德),流动相A为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸的乙腈溶液,流速0.4 mL/min,梯度洗脱程序为:0~1分钟5%B,1~9分钟5%~95%B,9~10分钟95%B,10~10.1分钟95%~5%B,10.1~12分钟5%B。质谱检测采用SCIEX TripleTOF 6600系统,正离子模式电离,离子源为电喷雾电离(ESI),扫描模式为信息依赖采集(IDA),质量范围50~1000 m/z,TOF-MS累积时间200 ms/谱图,采用动态背景扣除,数据分析软件为Analyst TF 1.7.1(Sciex,加拿大安大略省康科德)。原始数据通过Metware Cloud平台(https://cloud.metware.cn,访问时间2025年8月2日)进行峰对齐与注释、多变量统计分析(主成分分析PCA/正交偏最小二乘判别分析OPLS-DA)及京都基因与基因组百科全书(KEGG)通路富集分析。
2.9 统计分析
所有数据以“均值±标准误(SEM)”表示,采用SPSS 27.0软件进行分析。组间差异采用Student's t检验进行事后比较,p<0.05表示差异具有统计学意义,0.05<p<0.10表示存在统计学趋势。
3. 结果
3.1 富氢水对断奶仔猪生长性能及腹泻发生率的影响
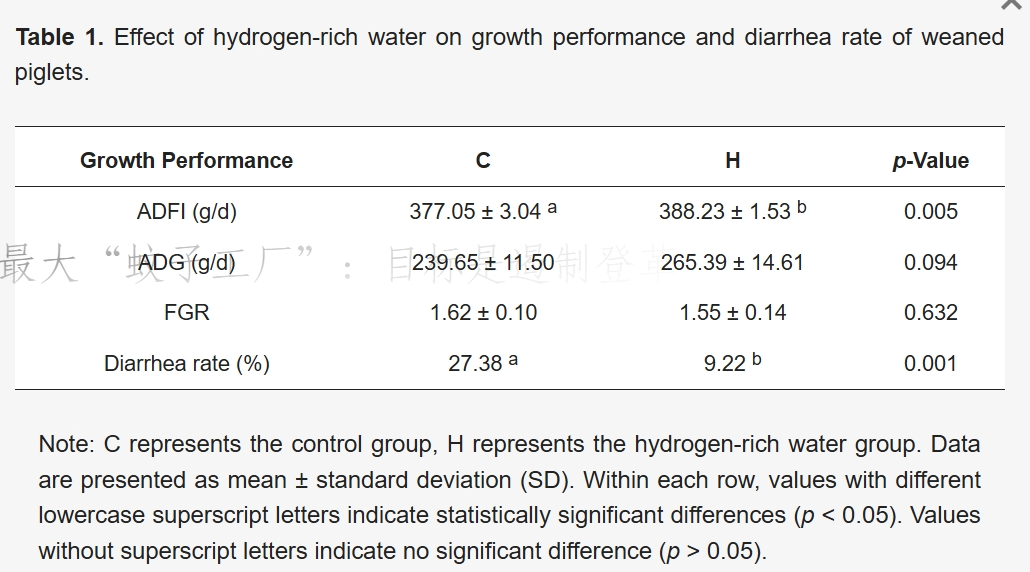
补充富氢水可改善断奶仔猪的生长性能。与对照组相比:
- 富氢水组(H组)仔猪的平均日采食量(ADFI)显著提高(p=0.005);
- 平均日增重(ADG)呈上升趋势(p=0.094);
- 饲料转化率(FCR)组间无显著差异(p=0.632);
- 腹泻发生率显著降低(p=0.001)(表1)。
上述结果表明,富氢水干预可提高断奶仔猪的平均日采食量,降低腹泻发生率。
表1 富氢水对断奶仔猪生长性能及腹泻率的影响
3.2 富氢水对断奶仔猪血清抗氧化指标的影响
补充富氢水可显著增强断奶仔猪的全身抗氧化能力。其中,总抗氧化能力(T-AOC)显著升高(p<0.01)(图1a);总超氧化物歧化酶(T-SOD)活性显著增强(p<0.01)(图1b);丙二醛(MDA)浓度显著降低(p<0.01)(图1c)。这些数据共同表明,富氢水可有效改善断奶仔猪的抗氧化防御机制。
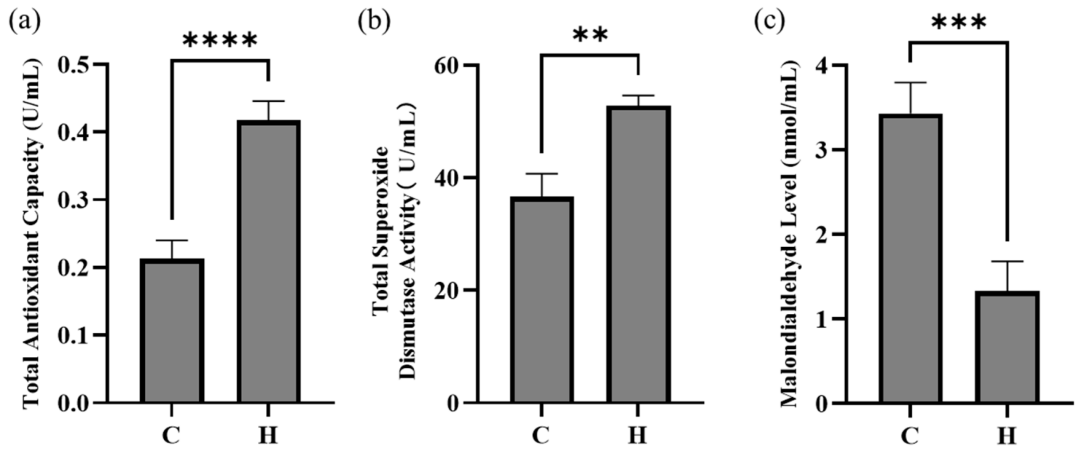
图1 断奶仔猪血清抗氧化指标:(a)总抗氧化能力,(b)总超氧化物歧化酶活性,(c)对照组与富氢水组的丙二醛浓度。图中C代表对照组,H代表富氢水组。与对照组相比,**p<0.01,***p<0.001,****p<0.0001。
3.3 富氢水对断奶仔猪肠道形态的影响
鉴于腹泻发病机制与肠道功能密切相关,本研究对肠道黏膜结构变化进行了评估(图2)。补充富氢水可显著改善断奶仔猪的小肠形态,十二指肠、空肠和回肠的绒毛高度与隐窝深度比值(VH/CD)均显著升高(表S1)。这些形态学上的改善表明,富氢水能够增强肠道屏障完整性,维持胃肠道稳态。
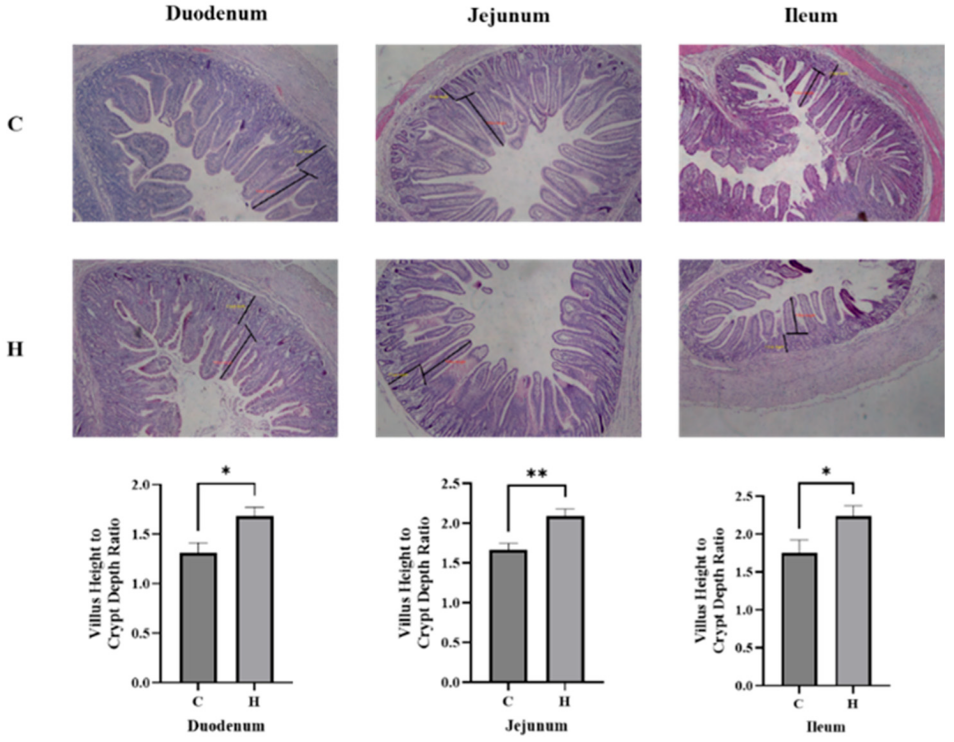
图2 断奶仔猪小肠段组织形态学分析:图中C代表对照组,H代表富氢水组。与对照组相比,*p<0.05,**p<0.05。
3.4 富氢水对断奶仔猪肠道菌群的调控作用
肠道菌群在维持肠道稳态中发挥关键作用。微生物谱分析(表S2)显示,空肠、回肠、盲肠、结肠和直肠中分别检测到485个、350个、578个、596个和530个扩增子序列变体(ASV)(图3a)。然而,补充富氢水显著降低了仔猪肠道内ASV的丰度,这可能是由于有害菌生长受到抑制所致。α多样性分析表明,富氢水对微生物群落多样性无显著影响(Simpson指数和Shannon指数的p值均>0.05)。对比分析显示,大肠(盲肠/结肠/直肠)的群落多样性高于小肠(空肠/回肠)(图3b、c)。
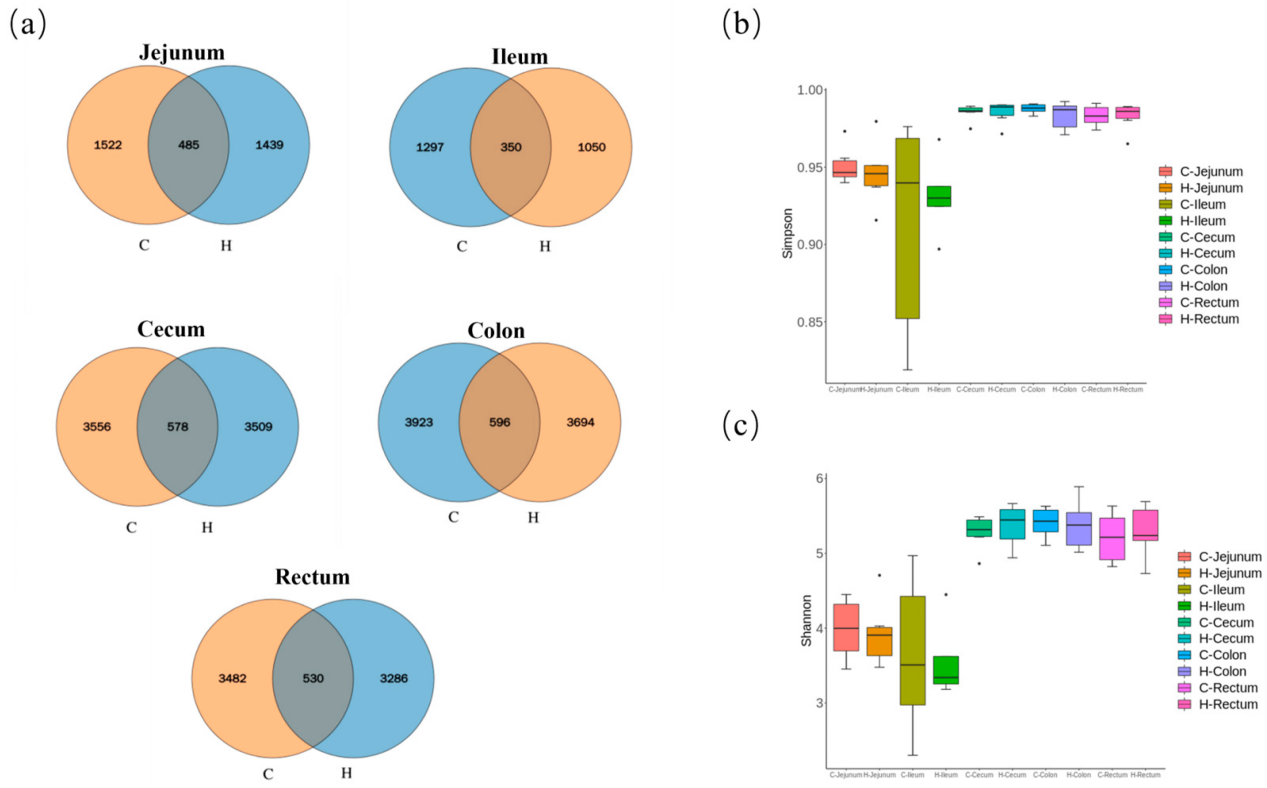
图3 断奶仔猪肠道微生物谱:(a)各肠道段核心ASV的韦恩图;α多样性指数:(b)Simpson指数,(c)Shannon指数。注:图中C代表对照组,H代表富氢水组。箱线图各元素定义如下:箱体上下限分别代表上四分位数和下四分位数,中线代表中位数,须代表在四分位数间距1.5倍范围内的最小值和最大值,异常值为超出须范围的单个数据点。
3.5 肠道菌群组成分析
为探究富氢水对肠道菌群的影响,本研究在门水平和属水平上对各组仔猪的肠道菌群组成变化进行了对比分析。肠道微生物组成分析显示,在门水平上:空肠、回肠、盲肠和结肠中相对丰度最高的菌群为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteriota);而直肠中优势菌群为厚壁菌门、拟杆菌门、螺旋体门(Spirochaetes)和放线菌门。
在属水平上:
- 空肠中的高丰度属包括棒状杆菌属(*Corynebacterium*)、乳杆菌属(*Lactobacillus*)、葡萄球菌属(*Staphylococcus*)、魏斯氏菌属(*Weissella*)、地芽孢杆菌属(*Terrisporobacter*)、严格梭菌属1(*Clostridium_sensu_stricto_1*)和图利菌属(*Turicibacter*);
- 回肠中的优势属包括严格梭菌属1、放线杆菌属(*Actinobacillus*)、罗姆布茨菌属(*Romboutsia*)、图利菌属、棒状杆菌属、链球菌属(*Streptococcus*)和乳杆菌属;
- 盲肠中的主要菌属包括未分类毛螺菌科(*unclassified_Lachnospiraceae*)、普雷沃氏菌科NK3B31群(*Prevotellaceae_NK3B31_group*)、别样普雷沃氏菌属(*Alloprevotella*)、未分类普雷沃氏菌科(*unclassified_Prevotellaceae*)、普雷沃氏菌属9(*Prevotella_9*)、粪杆菌属(*Faecalibacterium*)和普雷沃氏菌属(*Prevotella*);
- 结肠中的优势属包括普雷沃氏菌科NK3B31群、未分类毛螺菌科、未分类普雷沃氏菌科、别样普雷沃氏菌属、普雷沃氏菌属9和普雷沃氏菌属;
- 直肠中的主要菌属包括普雷沃氏菌科NK3B31群、未分类毛螺菌科、普雷沃氏菌属9、未分类普雷沃氏菌科、普雷沃氏菌属、粪杆菌属和巨单胞菌属(*Megamonas*)(图4)。
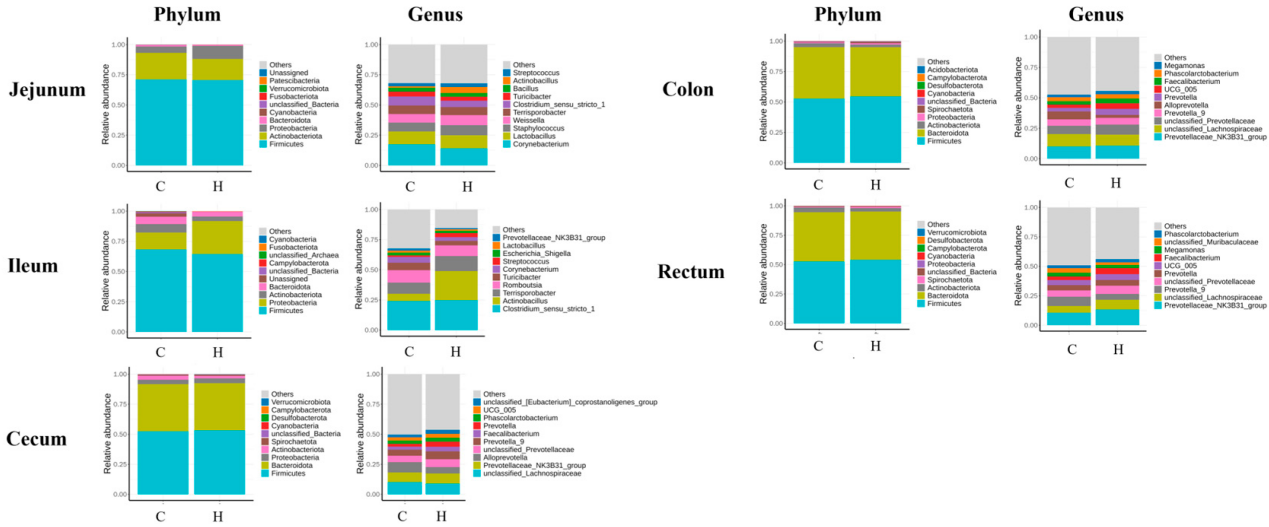
图4 肠道微生物组成的空间异质性:注:图中C代表对照组,H代表富氢水组。彩色柱形代表不同菌群的相对丰度。
3.6 线性判别分析效应量(LEfSe)分析
为验证“富氢水通过重构微生物群落调节仔猪肠道稳态”这一假设,本研究采用LEfSe分析法对菌群组成进行分析,筛选各组间具有显著差异的标志性菌群。图5为 cladogram(进化分支图),展示了各肠道段从门水平到种水平的差异丰度微生物。其中:
- 空肠中,富氢水组(H组)富集的菌群包括未分类阿克曼氏菌(*s_unclassified_Akkermansia*)、阿克曼氏菌科(*f_Akkermansiaceae*)、阿克曼氏菌属(*g_Akkermansia*)、未分类韦荣氏球菌(*s_unclassified_Veillonella*)、疣微菌纲(*c_Verrucomicrobiae*)和杜氏菌属(*g_Dubosiella*);
- 回肠中,富氢水组富集的菌群包括链球菌属(*g_Streptococcus*)和巴斯德氏菌科(*f_Pasteurellaceae*);
- 盲肠中,富氢水组富集的菌群包括普雷沃氏菌属(*g_Prevotella*)、双环瘤胃球菌(*s_Ruminococcus_bicirculans*)、萨特氏菌科(*f_Sutterellaceae*)和硒单胞菌(*s_Selenomonas*);
- 结肠中,富氢水组富集的菌群包括消化球菌属(*g_Peptococcus*)、颤杆菌属(*g_Oscillibacter*)和13AD3011科群(*g_Family_XIII_AD3011_group*);
- 直肠中,富氢水组富集的菌群包括毛螺菌属(*g_Lachnospira*)、罗姆布茨菌属(*g_Romboutsia*)和反刍真杆菌群(*g_Eubacterium_ruminantium_group*)。
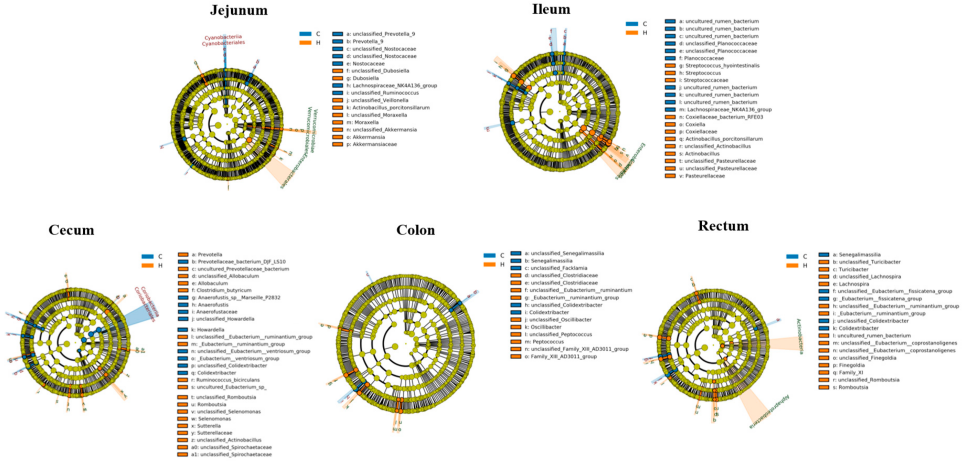
图5 LEfSe分析识别的差异标志性微生物进化分支图:注:图中C代表对照组,H代表富氢水组。径向系统发育树从内到外的环依次代表门、纲、目、科、属、种水平的分类层级。每个节点代表某一分类水平的分类单元,节点直径与相对丰度成正比。组间无显著差异的分类单元统一标记为黄色;差异丰度分类单元按其最高丰度所在组进行着色,每个彩色节点代表在该组中显著富集的微生物标志物。
3.7 微生物功能基因预测分析
为验证富氢水是否通过微生物介导的信号通路调节仔猪肠道功能,本研究采用PICRUSt2软件对微生物群落进行功能谱分析。该分析基于标记基因序列预测宏基因组功能,进而推断通路水平的变化。通过分析微生物样本中的标记基因,利用PICRUSt2软件对微生物群落功能进行预测,结果显示:
- 盲肠中,富氢水组的标志性微生物群落主要富集于其他氨基酸代谢、外源物质生物降解与代谢、核苷酸代谢、氨基酸代谢和能量代谢相关功能;
- 结肠中,富氢水组的标志性微生物群落主要富集于碳水化合物代谢、聚糖生物合成与代谢、其他次生代谢物生物合成、转运与分解代谢、能量代谢、核苷酸代谢及复制与修复相关功能;
- 直肠中,富氢水组的标志性微生物群落主要富集于信号转导、外源物质生物降解与代谢、能量代谢、原核生物群落、细胞运动、膜转运及全局与概览图谱相关功能(图6)。
这些结果表明,富氢水组标志性微生物群落的核心功能涉及物质代谢调控,提示富氢水可通过调节肠道菌群改善仔猪肠道物质代谢,维持肠道稳态。
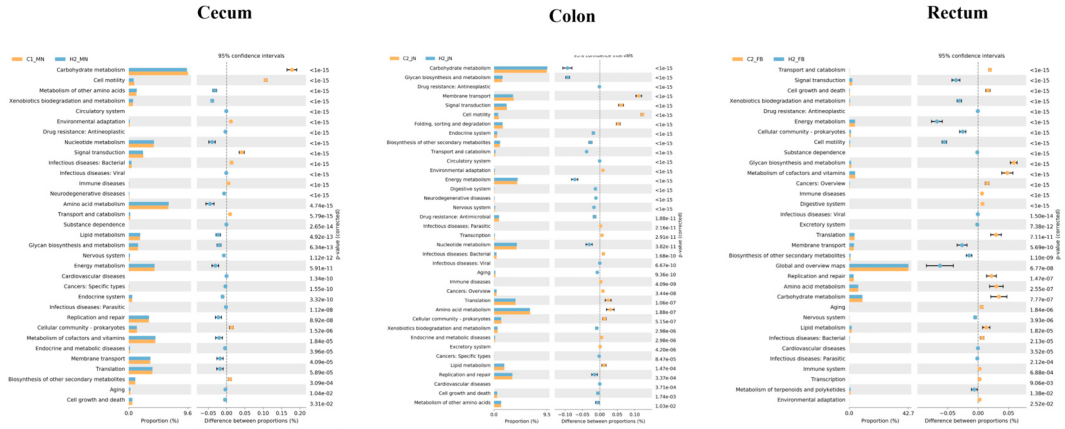
图6 微生物群落功能预测:注:图中C代表对照组,H代表富氢水组。左侧图展示两组中各功能特征的相对丰度占比;中间部分展示差异丰度占比及95%置信区间;最右侧列显示相应的p值。
3.8 富氢水对断奶仔猪肝脏代谢物的影响
断奶会导致仔猪体内氧化还原失衡,进而引发肝脏氧化损伤。对肝脏代谢物的鉴定结果显示,共检测到2333种代谢物(表S3),这些代谢物主要分为以下类别(图7a):氨基酸及其代谢物(22.19%)、苯及其取代衍生物(15.33%)、杂环化合物(9.75%)、有机酸及其衍生物(8.87%)、醛、酮、酯类(7.52%)以及醇和胺类(5.72%)。
样本主成分分析(PCA)结果显示,对照组(C组)与富氢水组(H组)的代谢物存在显著差异(图7b)。采用正交偏最小二乘判别分析(OPLS-DA)模型,将变量重要性投影(VIP)得分>1且p值<0.05的代谢物定义为显著差异丰度代谢物,筛选结果以火山图呈现(图7c)。与对照组相比,富氢水组共检测到444种已知的显著差异代谢物,其中279种代谢物显著上调,165种代谢物显著下调。这些结果表明,富氢水可能通过多靶点、多通路的方式调控宿主代谢网络。
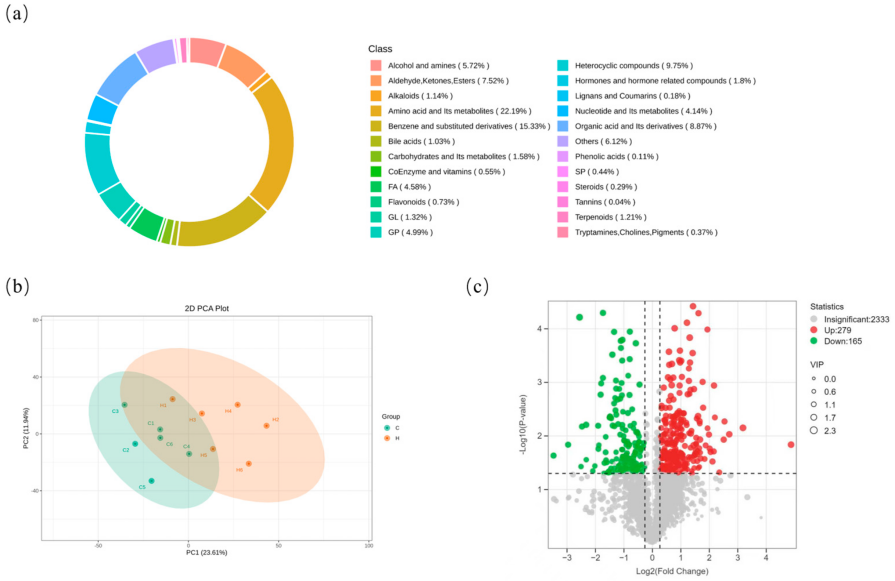
图7 肝脏代谢物鉴定:(a)代谢物类别组成;(b)样本主成分分析;(c)差异丰度代谢物火山图。图中C代表对照组,H代表富氢水组。
3.9 差异丰度代谢物及KEGG通路富集分析
根据折叠变化(fold-change)值,对排名前10的显著上调和下调代谢物进行排序(图8a)。富氢水组中显著升高的代谢物(VIP≥1,与对照组相比p<0.05)包括异戊酰辅酶A(Isovaleryl-CoA)、谷氨酰胺-组氨酸-亮氨酸-苯丙氨酸-甘氨酸、谷氨酸-苏氨酸-组氨酸-谷氨酸、天冬酰胺-丝氨酸-亮氨酸-精氨酸、大果崖柏醇I、6,8a-断-6,8a-脱氧-5-氧阿维菌素'1b'糖苷配基、丝氨酸-谷氨酰胺-亮氨酸-赖氨酸、苯丙氨酸-亮氨酸-酪氨酸-天冬氨酸、羧甲氧基琥珀酸和dTDP-2,3,6-三脱氧-3-C-甲基-4-O-甲基-3-亚硝基-β-L-阿拉伯糖-己吡喃糖。
富氢水组中显著降低的代谢物(VIP≥1,与对照组相比p<0.05)包括磷脂酰乙醇胺、磷脂酰乙醇胺、诺龙(Nandrolone)、α-D-核糖1-甲基磷酸5-磷酸、二油酰磷脂酰丝氨酸2,2,5,7,8-五甲基-6-色原醇、3-硫代十四烷酸、水苏糖(Stachyose)、菝葜皂苷元和羟基丁丙诺啡。
对VIP排名前50的代谢物进行相关性分析,筛选出排名前5的正相关和负相关对(图8b)。正相关对包括磷脂酰乙醇胺与布约胺A(Bouillonamide A)、磷脂酰乙醇胺与赖氨酸-酪氨酸-酪氨酸-精氨酸-缬氨酸、大豆苷(Daidzin)与黄素腺嘌呤二核苷酸、布约胺A与simeprevir(一种抗病毒药物)、谷氨酸-酪氨酸-精氨酸-天冬氨酸与丝氨酸-苯丙氨酸-天冬氨酸-赖氨酸-丝氨酸;负相关对包括C22葡萄糖神经酰胺(C22 GlcCer)与PLC硫代磷脂酰肌醇二磷酸(PLC Thio-PIP2)、 kojibiose(一种二糖)与苯丙氨酸-亮氨酸-酪氨酸-天冬氨酸、kojibiose与丝裂霉素(Sericetin)、磷脂酰乙醇胺与丝氨酸-酪氨酸-酪氨酸-谷氨酰胺-丝氨酸、磷脂酰乙醇胺与十溴二苯醚。
基于差异丰度代谢物分析结果,进行KEGG通路富集分析。如图8c所示,差异丰度代谢物显著富集的关键代谢通路包括柠檬酸循环(三羧酸循环,TCA循环)、ATP结合盒转运蛋白(ABC转运蛋白)、胰高血糖素信号通路、味觉转导、丙酮酸代谢、自噬、近端小管碳酸氢盐重吸收、叉头框蛋白O(FoxO)信号通路、碳代谢、糖基磷脂酰肌醇(GPI)锚生物合成、谷胱甘肽代谢、铁死亡(ferroptosis)、精氨酸和脯氨酸代谢、蛋白质消化吸收、磷脂酶D信号通路、腺苷5'-单磷酸(AMP)激活蛋白激酶(AMPK)信号通路、缝隙连接、丙氨酸、天冬氨酸和谷氨酸代谢。值得注意的是,自噬、FoxO信号通路、谷胱甘肽代谢、铁死亡和AMPK信号通路等多个富集通路均与氧化应激反应密切相关。
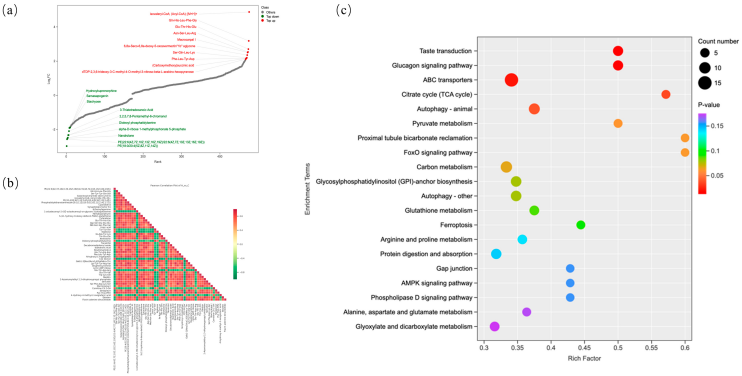
图8 差异丰度代谢物分析:(a)基于折叠变化的差异丰度代谢物排名;(b)差异丰度代谢物相关性热图;(c)差异丰度代谢物富集的KEGG通路。注:(a)每个点代表一种独特的代谢物,绿色点代表前10个显著下调的代谢物,红色点代表前10个显著上调的代谢物;(b)颜色深度代表皮尔逊相关系数的大小,红色表示强正相关,绿色表示强负相关,颜色越深表示相关系数的绝对值越大;(c)点的颜色深度反映富集显著性(p值大小),红色越深表示富集的统计学显著性越高;点的大小对应每个通路中富集的差异丰度代谢物数量。
4 讨论
仔猪断奶会引发应激反应,导致其生长性能下降、腹泻发生率升高及死亡率上升,进而损害经济效益[9]。已有研究表明,饮用富氢水可缓解镰刀菌霉菌毒素导致的仔猪平均日增重(ADG)和平均日采食量(ADFI)降低[10]。本研究中,与对照组相比,富氢水处理显著降低了仔猪腹泻发生率(p<0.05),同时显著提高了平均日采食量(p<0.05)。值得注意的是,尽管平均日采食量增加,仔猪体重却未出现相应增长,这可能意味着其代谢优先级发生了重新分配,例如将能量更多用于免疫调节或缓解氧化应激。未来需通过量热法量化能量分配,以验证这一假设。
断奶应激会破坏仔猪体内的氧化还原稳态,导致活性氧(ROS)过量产生,进而引发细胞和组织损伤[11]。这一病理生理过程与已有研究结论一致——富氢水在不同物种中均展现出缓解氧化应激的功效。在小鼠模型中,富氢水可显著降低丙二醛(MDA)水平,并提高超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的活性[12]。本研究将这一发现拓展至猪类动物:结果显示,富氢水可显著提高断奶仔猪血清总抗氧化能力(T-AOC)、增强总超氧化物歧化酶(T-SOD)活性,并降低血清丙二醛(MDA)水平。综合以上数据可知,富氢水能够增强断奶仔猪的全身抗氧化防御能力。
肠道形态与功能对断奶仔猪的健康和生长发育至关重要。新生仔猪肠道发育尚未成熟,而断奶应激会导致肠道黏膜发生结构和功能改变,具体表现为绒毛萎缩、隐窝加深、肠道通透性增加,以及消化吸收功能和屏障功能受损[1]。绒毛高度与隐窝深度比值(VH/CD)升高是肠道功能显著改善的标志,这主要通过提高吸收效率和优化上皮稳态实现[13]。已有研究证实,对于饲喂受镰刀菌污染饲料的仔猪,饮用富氢水可显著提高其小肠的绒毛高度与隐窝深度比值[10]。本研究同样发现,与对照组相比,富氢水可显著提高仔猪小肠三段(十二指肠、空肠、回肠)的绒毛高度与隐窝深度比值。这些结果表明,富氢水或可缓解断奶应激对仔猪肠道造成的损伤。
研究表明,饮用富氢水有助于改善肠道菌群组成、维持微生态平衡并促进肠道健康[14]。本研究发现,补充富氢水对肠道菌群的α多样性无显著影响;但已有研究证实,在热应激小鼠中,富氢水可显著减轻肠道氧化损伤、纠正菌群失调、减少致病菌数量并富集益生菌[15]。这与其他研究结论一致:氢气虽会对特定微生物产生影响,但其对整体菌群结构的作用有限[16],这可能与肠道内复杂的代谢相互作用有关。综合这些发现可知,富氢水虽未改变肠道菌群的整体多样性,但可能通过重构菌群组成优化其功能。
本研究结果证实,仔猪大肠(盲肠、结肠、直肠)的菌群多样性高于小肠(空肠、回肠)。这与已有文献结论相符——有研究报道,人类结肠内细菌密度可达1011–1012 CFU/mL,而小肠内细菌密度仅为103–10⁵ CFU/mL[17]。这种数量级上的差异是导致肠道不同部位菌群多样性差异的直接原因。该现象可能与食物在肠道内的转运时间不同有关:食物在大肠内停留时间更长,为微生物定植和增殖提供了更充足的发酵窗口,从而提高了菌群多样性。
线性判别分析效应量(LEfSe)结果显示,空肠、回肠、盲肠、结肠和直肠中分别存在9种、4种、13种、8种和7种具有显著差异的标志性菌群。其中,富氢水组(H组)小肠内富集的菌群包括阿克曼氏菌科、阿克曼氏菌属和未分类韦荣氏球菌。这些菌群可调节肠道屏障完整性、免疫反应、炎性细胞因子分泌、宿主代谢通路及短链脂肪酸代谢[18,19]。氧化应激减轻可能有利于阿克曼氏菌增殖[20],这或许是富氢水组仔猪腹泻发生率降低、肠道形态改善的原因之一。
富氢水组盲肠内富集的菌群包括双环瘤胃球菌(s_Ruminococcus_bicirculans,具有利用植物多糖、分解纤维素和淀粉酶活性的功能[21])和硒单胞菌(s_Selenomonas,可通过糖酵解和三羧酸循环参与碳水化合物代谢[22]);结肠内富集的菌群包括消化球菌属(Peptococcus,可降解多糖和蛋白质,产生乙酸和丁酸);直肠内富集的菌群包括罗姆布茨菌属(g_Romboutsia,参与碳水化合物代谢并产生短链脂肪酸)和毛螺菌属(g_Lachnospira,可降解复杂碳水化合物,产生乙酸、丙酸和丁酸[23])。综合来看,这些菌群变化表明大肠内未消化饲料残渣的发酵作用增强,这可能提高饲料利用效率,并为仔猪生长提供额外能量。因此,富氢水或可缓解仔猪断奶应激、维持肠道稳态并促进营养吸收。
代谢组学分析显示,饮用富氢水后仔猪肝脏代谢物发生显著变化。京都基因与基因组百科全书(KEGG)通路富集分析发现,柠檬酸循环(三羧酸循环,TCA循环)被显著富集。柠檬酸循环可生成三磷酸鸟苷(GTP),将黄素腺嘌呤二核苷酸(FAD)和烟酰胺腺嘌呤二核苷酸(NAD)还原为还原型黄素腺嘌呤二核苷酸(FADH₂)和还原型烟酰胺腺嘌呤二核苷酸(NADH),同时通过为细胞生长和功能提供三磷酸腺苷(ATP)及代谢中间产物,成为能量代谢的核心枢纽[24]。
其他被显著富集的通路包括:胰高血糖素信号通路(可能通过调节肠道激素影响肠道功能[25])、ATP结合盒(ABC)转运蛋白通路(通过排出外源物质、毒素和代谢物维持体内稳态[26])、谷胱甘肽代谢通路(对维持氧化还原平衡、抗氧化防御和解毒功能至关重要[27])。此外,自噬是维持氧化还原稳态的关键过程,活性氧激活的自噬可通过降解受损成分减轻氧化损伤[28];叉头框蛋白O(FOXO)信号通路可增强机体抗氧化应激能力并维持线粒体完整性[29];铁死亡(Ferroptosis)是由谷胱甘肽过氧化物酶4(GPX4)失活驱动的调控性细胞死亡[30];AMP激活蛋白激酶/沉默信息调节因子1(AMPK/SIRT1)通路可在氧化应激环境下减轻内质网应激和线粒体功能障碍[31]。综合来看,这些代谢重编程现象表明,富氢水主要通过调控氧化应激相关通路缓解仔猪断奶应激。
5 结论
本研究表明,断奶仔猪饮用富氢水可显著提高平均日采食量(ADFI)、增强血清抗氧化能力,同时降低腹泻发生率;此外,富氢水还能改善仔猪肠道形态、调节肠道菌群组成并改变肝脏代谢。这些多方面的改善效应可能是通过调控氧化应激通路实现的。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1500496.html?mobile=1
收藏

