 精选
精选
THEORY OF OXYGEN TRANSPORT TO TISSUE - PMC
四、组织中氧转运模型
A. 均质组织中的扩散
均质组织中的氧扩散遵循反应 - 扩散方程:

式中,Pt为组织氧张力,Dt为扩散系数,αt为溶解度系数,M为氧气被消耗的不可逆化学反应速率。需注意的是,此情况与 “氧气与血红蛋白、肌红蛋白的可逆化学反应” 存在显著差异。化学反应速率可作为Pt的函数,目前常用的氧消耗模型包括:
(a)零级动力学模型:

其中,Pm为 “反应速率达到最大值一半时的氧分压(PO2)”。当Pm→0时,米氏动力学模型趋近于零级动力学模型,即M→M0;当氧张力较小时(Pt≪Pm),米氏动力学模型趋近于一级动力学模型。混合动力学模型(c)可视为米氏动力学模型(d)的分段线性近似。
基于 “氧气代谢的双细胞色素模型” 假说,研究人员提出了米氏动力学模型的推广形式 [125]:
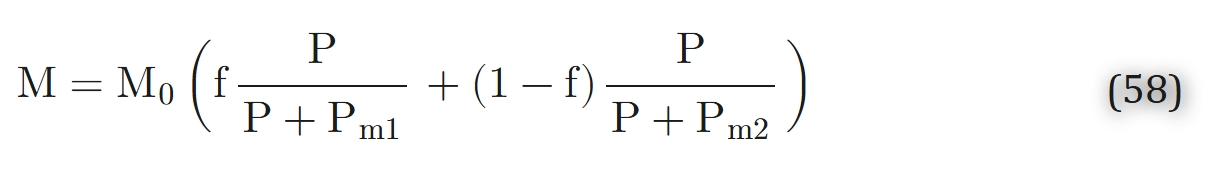
式中,0≤f≤1,Pm1与Pm2均为常数。
对于 “占据x≥0空间的半无限大组织层”,在稳态条件下可轻松求解公式 53。若采用零级动力学模型,其解为:
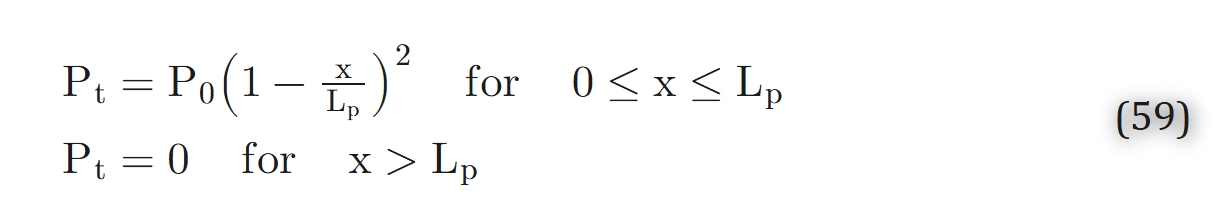
其中,Lp=M02DtαtP0为 “氧张力降至零的渗透深度”。希尔(Hill)[64] 还给出了公式 53 在平面和柱形几何模型下的其他多种解。若采用一级动力学模型,其解为:
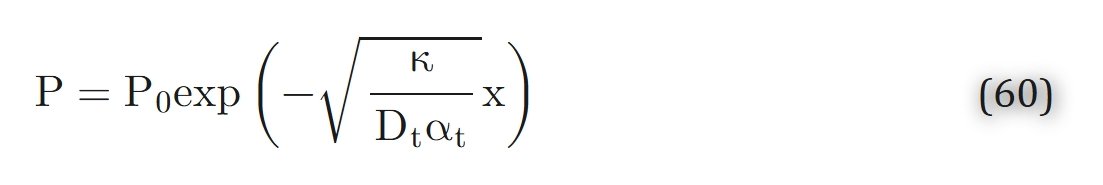
因此,与零级动力学模型不同,在一级模型中组织内各处的氧分压(PO2)均为正值,即氧分子可从边界无限深入组织内部。混合动力学模型和米氏动力学模型也会呈现类似特征 —— 因为当Pt较小时,它们的行为与一级动力学模型一致。
通常可对公式 53 进行一次积分:
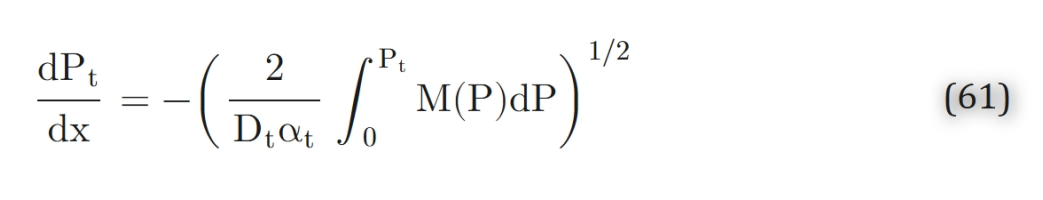
结合边界条件Pt(0)=P0对公式 61 积分,可得到公式 53 的隐式解:
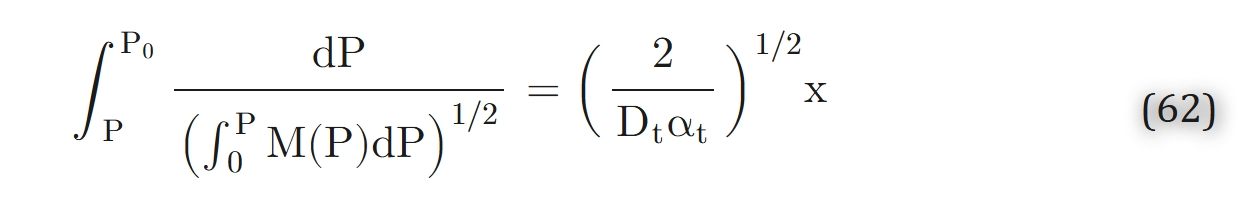
对于某些M(P)函数(如多项式形式的M(P)),可通过解析方法计算公式 62 中的积分,从而得到封闭形式的解。而对于米氏动力学模型,公式 62 中的外层积分无法通过解析方法计算,因此必须采用数值积分
希尔(Hill)[64] 还研究了稳态和非稳态条件下,平面和柱形组织层中氧气与乳酸的同步扩散过程。此外,研究人员还得到了其他几何模型下组织扩散的解。
零级动力学模型对应的非稳态问题求解存在数学和计算上的难点 —— 这是因为存在 “分隔氧分压为零与非零区域的移动边界”,而确定该边界的运动规律是求解过程的一部分 [24,32,42]。在数学文献中,这类含移动边界的问题被称为 “斯特凡问题(Stefan problems)”。
B.非均质组织中的扩散
上一节的模型假设组织在空间上是均质的,但实际上组织由细胞和细胞外间隙组成。此外,组织内部还存在异质性(如线粒体对氧气的离散消耗导致的异质性),这些异质性可能会影响组织内的氧分布。
首先,我们考虑 “细胞内外扩散差异” 导致的细胞水平组织异质性。希尔(Hill)[64] 已对该问题进行了定性分析。Tai 与 Chang [176] 提出了 “由具有不同扩散特性的平面层组成的组织模型”(图 11)。扩散系数与溶解度系数的乘积通常被称为渗透率或克罗格系数(Krogh coefficient),即K=Dα。该模型假设:细胞内和细胞外介质的渗透率可分别用Kc和Ke表征,且细胞以恒定速率m(零级动力学)消耗氧气。若ϕe为细胞外物质的体积分数,则组织的体积平均氧消耗率为M=(1−ϕe)m。“非均质介质层的有效渗透率” 定义如下:对于一个 “消耗率均匀为M的均质介质”,若其边界处的氧分压差值与非均质介质相同,且对应边界处的氧通量也相等,则该均质介质的渗透率即为非均质介质层的有效渗透率。在该模型中,细胞层与细胞外层层叠方式分为 “平行” 和 “串联” 两种,其对应的有效渗透率分别为:
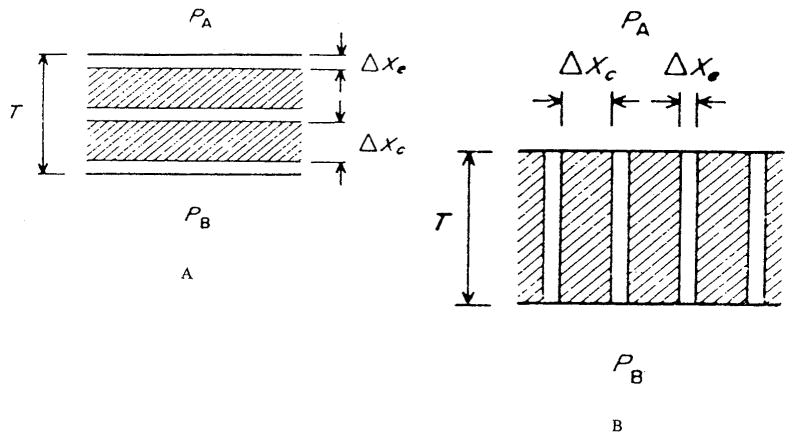
图11.异质组织模型的定义示意图:(a)串联模型;(b)并联模型。(来源:Tai, R. C. 与 Chang, H. -K.,《理论生物学杂志》,第43卷,第265页,1974年。已获转载许可。)
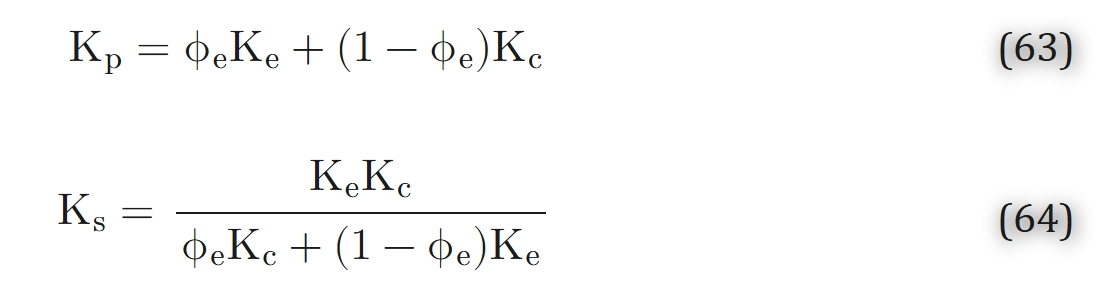
式(63)和式(64)可由Tai与Chang[176]提出的方程推导得出。需注意,Kp(并联模型渗透率)和Ks(串联模型渗透率)与组织切片厚度无关,仅取决于各区域渗透率及细胞外间隙体积分数。通过直接比较可证明,Kp \geq Ks。Tai与Chang[176]还对早期模型[67]进行了拓展,以分析“在距组织边界特定距离处,细胞呼吸速率未达最大值”的情况。该呼吸速率的确定,需求解“零级动力学下球形或椭球形细胞内氧气分布”问题(此时细胞中心区域处于缺氧状态)。Stroeve[174]进一步推进了相关研究:他通过解析法求解了“零级或一级动力学下球形细胞内部及周围的扩散方程”,随后对结果进行体积平均。其研究方法借鉴了麦克斯韦(Maxwell)推导异质材料传输特性的经典方法。对于零级动力学,他得到以下表达式: 研究表明,对于其他几何结构的介质,其渗透率的上下边界分别为串联模型与并联模型的渗透率(即式63和式64);具体而言,满足Ks< K0< Kp。若通过
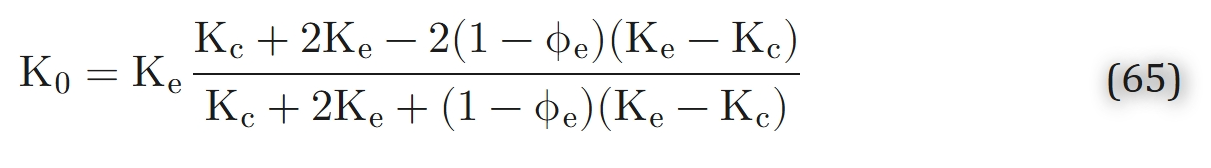
实验测得有效渗透率,且已知细胞外介质的渗透率,则可利用式(63)至式(65)估算细胞渗透率Kc。Stroeve[174]利用猫大脑皮层的实验数据,通过上述三个模型(式63至式65)估算了Ke/Kc(细胞外介质渗透率与细胞渗透率的比值)。结果显示,Kc(细胞渗透率)的预测值是Ke(细胞外介质渗透率)的数倍,这表明氧气扩散的阻力主要集中在细胞内部。此后,研究人员针对一级动力学(式55)和混合动力学(式56)也得到了类似表达式[184]。在细胞内部,氧气几乎完全在线粒体中被消耗。因此,从理论上讲,细胞内氧分压(PO2)的分布可能存在显著异质性:线粒体周围的氧分压降幅较大,而胞质其余区域的氧分压分布则相对平缓。然而,Clark等人提出了极具说服力的观点,认为线粒体周围的氧分压降幅不应超过百分之几托(torr,压强单位)。对于半径为Rm的球形线粒体,可通过求解“球坐标系下线粒体周围氧气分布的扩散方程”轻松得到上述估算结果:
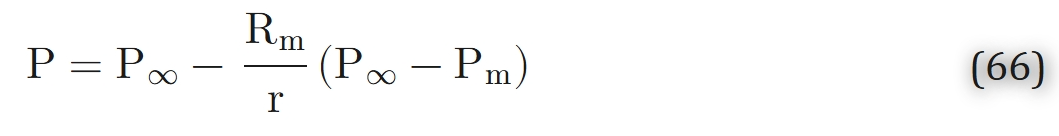
式中,P∞为细胞内远离线粒体表面处的氧分压,Pm为线粒体表面的氧分压。此时,线粒体表面的氧气通量j满足j = K(P∞/Pm)/Rm,其中K为胞质的氧气渗透率。另一方面,在稳态条件下,氧气通量与线粒体表面积的乘积等于线粒体消耗的氧气量,即:

式中,Vm=4\pi Rm^3/3$为线粒体体积,m_m为单位线粒体体积的氧气消耗速率。将式(66)与式(67)联立,经简单代数运算可得:
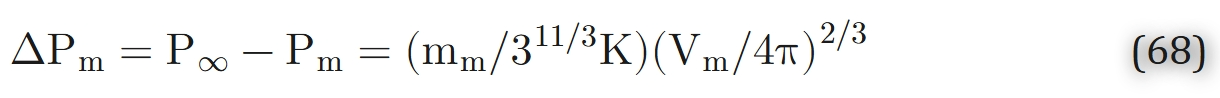
采用骨骼肌线粒体的典型参数[20]:mm = 1.4·10−6 mol/ml/s, K = 2.13·10−14 mol/cm/s/torr, Vm = 0.38 μm3, 代入式(68)可得ΔPm = 0.04 torr。对于其他形状的线粒体,该估算值可能会有数量级为1的变化,但在所有情况下,其值均远低于1托。由此可见,组织中氧气扩散的阻力分布于细胞内部,而非集中在单个线粒体周围的狭窄区域内。换言之,若线粒体分布均匀,则氧气消耗的离散特性不会影响氧气分布的整体模式。然而,若线粒体存在显著的聚集现象,细胞内氧气的分布可能会发生改变。已有实验证据表明,线粒体可能在毛细血管和肌膜周围聚集。Mainwood与Rakusan[116]建立了一个“细胞内氧气扩散模型”,该模型同时考虑了三磷酸腺苷(ATP)或磷酸肌酸从线粒体向细胞其他区域的扩散过程。图12展示了该模型在“所有线粒体聚集于毛细血管3微米范围内”这一极端情况下的预测结果。这些计算表明,线粒体分布的异质性理论上可能影响细胞内的氧分压分布。但目前尚无基于系统收集的实验数据对该影响进行的定量分析。
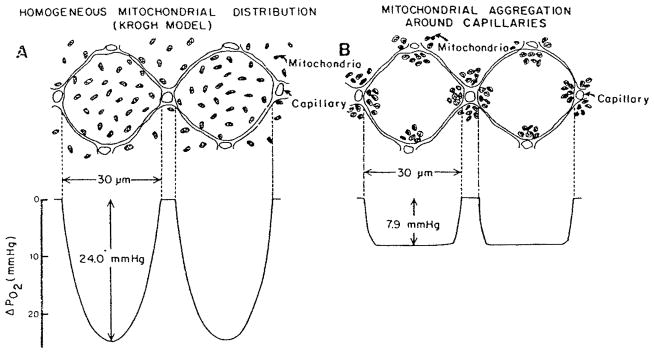
图12.细胞与毛细血管比例为1:1的圆柱形细胞内氧分压(PO₂)分布:(a)线粒体均匀分布;(b)线粒体聚集于毛细血管3微米范围内。(来源:Mainwood, G. W. 与 Rakusan, K.,《加拿大生理学与药理学杂志》,第60卷,第98页,1982年。已获转载许可。)
朗缪尔(Longmuir)[112]提出了一种与现有认知截然不同的细胞内氧转运观点。他认为,氧气会沿着高溶解度通道从血液转运至线粒体,而内质网可能起到氧气通道的作用。由于胞质中氧气溶解度较低,其内部几乎不含氧气。然而,这一假说的理论验证与实验验证仍有待开展。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1499977.html?mobile=1
收藏

