 精选
精选
细胞需要感知营养素的存在与否,以便据此调整自身的新陈代谢和生长状态。GATOR2蛋白复合物是细胞营养素感知过程中的关键节点。目前,科学家已明确两种营养素感知蛋白与GATOR2结合并改变其构象的作用机制。
研究背景与意义
细胞必须在营养素供应与能量需求之间维持代谢平衡。当代谢压力发生变化时,细胞需感知营养素状态的波动,并相应调整生长程序。特定的蛋白传感器会检测细胞内的各类营养素,并将营养素状态传递至信号节点,这些节点负责调控促进生长的“营养需求”信号。当营养素信号通路调控失衡时,这种代谢平衡便会被打破。因此,生物体稳态、健康状态及生存能力的协调调控,在一定程度上依赖于对营养素存在与否及相关信号提示的识别——因为这些因素会影响生长过程中的能量消耗与需求。
深入理解这一过程的驱动因素及其作用方式,可为研发癌症、结节性硬化症等疾病的治疗方法提供思路。在这些疾病中,过度活跃的“营养需求”信号会导致病情快速恶化。
核心发现
mTORC1蛋白复合物会响应细胞内营养素的存在,协调细胞代谢活动。它识别这些输入信号的能力,依赖于由另一种名为GATOR2的蛋白复合物所调控的一系列协同信号级联反应[1-3]。要实现这一调控,GATOR2必须与营养素感知蛋白结合,例如感知亮氨酸的Sestrin2蛋白[4],以及感知精氨酸的CASTOR1蛋白[5]。然而,此前人们对这一调控过程的分子机制缺乏了解,这限制了我们通过调控该通路进行治疗的能力。
研究团队结合细胞生物学与结构生物学的多种研究方法,揭示了细胞感知膳食营养素的机制。GATOR2具有“无人机”状的结构主体,在八边形框架上延伸出动态的“螺旋桨”结构,这一框架可与营养素感知蛋白结合。研究发现,Sestrin2和CASTOR1通过一种名为“别构效应”的现象,改变GATOR2的结构构象,从而传递营养素供应相关信息。具体而言:
- Sestrin2会限制GATOR2其中一个“螺旋桨”(即WDR24蛋白亚基)的运动,削弱GATOR2向mTORC1传递信号的能力(见图1);
- 与之相反,CASTOR1会重塑GATOR2“无人机”的结构,将其八边形框架转变为方形,并直接影响GATOR2与相关蛋白的相互作用——这些蛋白负责在GATOR2与mTORC1之间传递“营养需求”信号。
通过影响被营养素传感器灭活的GATOR2复合物比例,上述机制为mTORC1传递特定氨基酸存在与否的信息提供了一种可调节的响应方式。
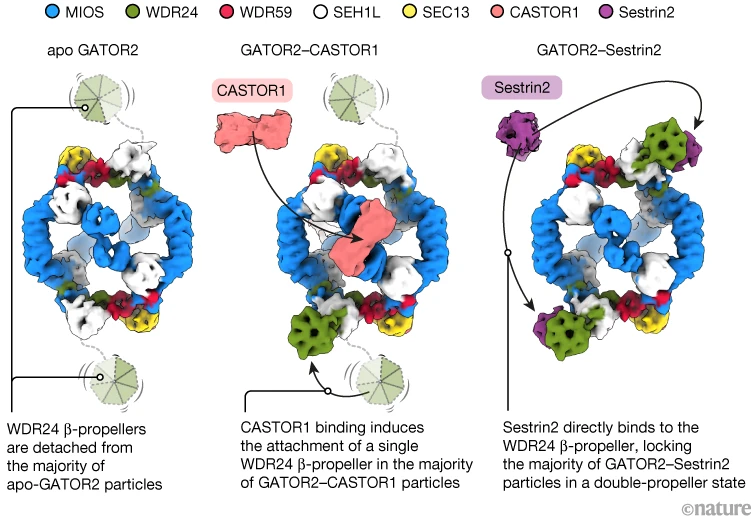
图1:营养素传感器改变GATOR2蛋白复合物的动态WDR24“螺旋桨”结构
营养素感知蛋白(如CASTOR1和Sestrin2)可与GATOR2蛋白复合物结合,而GATOR2在细胞营养素状态信号传递中发挥关键作用。
- 左侧:GATOR2的非活性“apo状态”(无配体结合状态),其包含多个蛋白亚基,整体呈“无人机”状,具有八边形框架和两个WDR24“螺旋桨”;
- 中间:感知精氨酸的CASTOR1与GATOR2结合后,将GATOR2的八边形框架转变为方形,并使其中一个WDR24“螺旋桨”与之结合;
- 右侧:感知亮氨酸的Sestrin2与WDR24“螺旋桨”和GATOR2框架的交界处结合,使GATOR2复合物锁定在双螺旋桨状态。
(图片来源:Valenstein, M. L. 等/《自然》(CC BY-NC-ND 4.0 许可协议))
研究启示与待解问题
该研究首次揭示了利用已知传感器调控mTORC1激活的营养素感知过程。这些机制层面的发现表明,mTORC1通路之所以能快速精准地被激活,是因为GATOR2的构象可通过一种可调节机制,响应营养素供应的波动而发生改变。
需要注意的是,本研究聚焦于细胞对精氨酸和亮氨酸的感知,因此对于其他传感器(如感知葡萄糖或蛋氨酸的传感器)的类似作用机制,目前仍缺乏了解。此外,mTORC1的激活更多是对营养素整体供应充足性的响应,而非单一氨基酸的供应情况。当前仍未明确的问题包括:
1. 当多种传感器同时与GATOR2结合时,信号如何整合;
2. GATOR2如何将整合后的营养素信号传递给mTORC1,以调整细胞生长程序。
mTORC1功能调控失衡与多种疾病相关,包括癌症、糖尿病及部分神经系统疾病。然而,目前作用于mTORC1的药物存在毒性,且细胞可通过代谢重编程相关突变产生耐药性。本研究为针对该通路的治疗策略提供了初步蓝图。此外,鉴于GATOR2具有较大的分子框架,它可能还与其他尚未被发现的营养素传感器存在关联,甚至可能存在组织特异性传感器,可对mTORC1活性进行位点特异性调控。相较于广泛抑制整个mTORC1蛋白复合物,靶向这类特异性传感器可能会降低治疗对患者的毒性。
(作者:卡伦·Y.林德-加雷利(Karen Y. Linde-Garelli)、卡斯珀·B.罗加拉(Kacper B. Rogala),任职于美国加利福尼亚州斯坦福大学医学院)
专家点评
mTORC1复合物会根据营养素可利用性及生长因子信号,调控哺乳动物细胞的生长。Sestrin2和CASTOR1感知不同氨基酸的可利用性后,通过GATOR2将信号传递至mTORC1。研究团队通过巧妙的方法,克服了此前观察到的GATOR2复合物组成多样性问题,阐明了Sestrin2、CASTOR1与GATOR2之间的相互作用机制。尤其值得肯定的是,作者对早期结构数据进行了细致的重新分析与比较。
(点评人:本刊审稿人)
研究背后的故事
蛋白复合物在自然状态下具有动态性,而更大的组装体往往拥有更复杂的结构和结构灵活性。GATOR2包含16个蛋白亚基,这些亚基需在细胞内组装,并通过动态构象变化与营养素传感器相互作用。要理解这一机制,研究团队需要从细胞中分离出GATOR2。然而,在最初的纯化过程中,他们发现仅有1%的蛋白颗粒是完整的复合物,其余99%均已解离。这使得研究人员无法区分蛋白的自然运动与非特异性解离引发的运动,进而限制了对GATOR2作用机制的理解。
为解决这一难题,团队设计了GATOR2的“单链变体”——通过将单个亚基连接,将原本16个亚基的复杂性降至8个。这一改造避免了亚基的解离,从而使研究人员能够对GATOR2的结构动态变化进行分析。
(讲述人:K.Y.林德-加雷利、K.B.罗加拉)
编辑视角
该研究以前所未有的分辨率,揭示了氨基酸传感器通过GATOR2调控mTORC1的机制,解决了营养素感知领域长期存在的机制性问题。研究结合结构生物学与功能实验,发现了一种共有的别构调控机制,并获得了稳定的GATOR2复合物,为后续研究奠定基础。有趣的是,这项工作不仅推动了基础科学认知,还识别出潜在药物靶点,使其在基础研究与治疗研发领域均具有重要意义。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1499664.html?mobile=1
收藏

