 精选
精选
2型糖尿病电场磁场治疗实验【2020】
摘要
异常的氧化还原信号是包括2型糖尿病(T2D)在内的多种慢性代谢性疾病病理生理学机制的核心。目前旨在重建全身氧化还原稳态平衡的方法效果有限,而一种无创、可持续的干预手段,或将为通过长期调控氧化还原信号治疗2型糖尿病提供可能。
本研究发现,静磁场与静电场(static magnetic and electric fields, 静磁电场)可通过无创方式调节全身谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的氧化还原对,营造更健康的还原性全身氧化还原环境。值得注意的是,在2型糖尿病小鼠模型中应用静磁电场后,仅需3天即可快速改善胰岛素抵抗与葡萄糖耐受不良,且未观察到不良反应。通过超氧化物歧化酶2(SOD2)清除肝脏线粒体中氧代谢产生的顺磁性副产物,可完全消除上述胰岛素增敏效应,这表明线粒体超氧化物是介导这些治疗性变化的关键因素。本研究揭示了一种显著的氧化还原调节现象,该现象可利用内源性电磁感受机制实现2型糖尿病(乃至其他氧化还原相关疾病)的无创治疗。
静磁电场:本研究使用静磁场+静电场联合暴露
Carter CS, et al. Exposure to Static Magnetic and Electric Fields Treats Type 2 Diabetes. Cell Metab. 2020 Oct 6;32(4):561-574.e7. doi: 10.1016/j.cmet.2020.09.012. Erratum in: Cell Metab. 2020 Dec 1;32(6):1076.
引言
地球生命是在静磁场(B场)与垂直方向静电场(E场)共同存在的环境中演化而来的。然而,这两种场与生命系统的相互作用,仍是生物学领域中了解最为有限的课题之一。在所有主要生物类群中,许多生命体可感知静电磁场(EMFs),并借此实现细胞迁移、地理空间定位及长距离导航。尽管相关机制尚不明确,但电磁场诱导的定向反应据称是通过调节内源性氧化还原反应实现的,具体而言,是通过顺磁性自由基的量子自旋态相互作用发挥作用。不过,除空间定位外,电磁感知的生理功能仍有待探索。
葡萄糖代谢同样是在电磁场存在的环境中演化形成的,且目前越来越多的研究表明其受氧化还原稳态调控——即促氧化剂与抗氧化剂之间的平衡。氧化还原稳态异常会促进胰岛素抵抗与高血糖的发生发展。2型糖尿病患者体内促氧化剂(如超氧化物(O₂•⁻)、过氧化氢(H₂O₂))水平升高,而以谷胱甘肽为主的抗氧化剂水平降低。这种氧化还原失衡会导致全身处于氧化环境中,进而修饰半胱氨酸残基,破坏蛋白质功能与胰岛素作用。通过持续给予抗氧化剂重建全身氧化还原平衡,可提高2型糖尿病患者的胰岛素敏感性,这表明氧化还原稳态对葡萄糖代谢及胰岛素效用具有调控作用。遗憾的是,基于氧化还原机制的2型糖尿病干预手段尚未转化至临床应用,原因在于这类干预所需物质半衰期短(如谷胱甘肽半衰期<10分钟),需频繁或持续给药,且可能伴随副作用,导致患者依从性降低。因此,亟需开发新的方法来调节全身氧化还原稳态,以针对性解决2型糖尿病的核心病理机制。
鉴于氧化还原系统既参与介导电磁场的生物学效应,又调控葡萄糖代谢,我们推测电磁场可能通过氧化还原系统影响葡萄糖代谢。然而,目前关于电磁场对葡萄糖调控具有生理效应的证据十分有限。以往探究电磁场对葡萄糖代谢潜在影响的研究得出了相互矛盾的结果:部分研究表明电磁场会升高空腹血糖,而另一些研究则认为电磁场无此作用。这些研究不仅采用的场参数不同,缺乏对血糖水平和胰岛素敏感性的灵敏检测手段,且未使用胰岛素抵抗动物模型。因此,电磁场对葡萄糖调控的影响尚未在体内得到系统评估。
本研究旨在探究静磁场与静电场的生物学效应,尤其聚焦于联合应用静磁场与静电场对血糖的影响。研究采用三种2型糖尿病小鼠模型:多效性人类疾病巴德-比德尔综合征(Bardet-Biedl Syndrome, BBS)相关的肥胖糖尿病小鼠模型、瘦素受体缺陷(db/db)小鼠模型,以及60%高脂饮食(high fat diet, HFD)喂养的饮食诱导型糖尿病小鼠模型。研究结果表明,联合应用静磁场与静电场(静磁电场)可通过氧化还原依赖性机制,改善这些模型小鼠的高血糖与胰岛素抵抗。
结果
暴露于静磁电场可改善血糖水平
将成年正常血糖小鼠[包括正常饲料喂养(normal chow diet, NCD)小鼠与野生型(wildtype, WT)小鼠],以及两种2型糖尿病肥胖小鼠模型(高脂饮食喂养小鼠与db/db小鼠)持续暴露于静磁电场环境中(磁场强度3毫特斯拉,垂直电场强度7千伏/米),为期30天(图1A)。选择上述场强的原因是其约为地球静磁场与垂直静电场强度的100倍,可最大限度降低自然波动带来的干扰。对照组小鼠饲养于结构相似但无电磁效应的装置中,以排除温度、湿度、光照、声音、触觉、气味等潜在环境因素的干扰。所有小鼠均饲养于非金属笼具中,避免电磁干扰,且可在笼内自由活动。通过检测空腹血糖(fasting blood glucose, FBG)与进行葡萄糖耐量试验(glucose tolerance tests, GTTs)评估小鼠血糖状况。
令人意外的是,与对照组相比,BBS模型小鼠暴露于静磁电场后,空腹血糖显著降低45%(图1B);高脂饮食喂养小鼠与db/db小鼠的空腹血糖均显著降低33%,且后两种模型小鼠的葡萄糖耐受不良症状得到逆转(图1C、图1D)。而正常血糖小鼠暴露于静磁电场后,其空腹血糖与葡萄糖耐量均未出现显著变化(图1C、图1D)。

图1:暴露于静磁电场可改善葡萄糖耐量
(A)静磁场(sB)与垂直方向静电场(sE)示意图,二者联合称为静磁-静电场(静磁电场)。
(B)巴德-比德尔综合征(BBS)小鼠及其野生型(WT)同窝小鼠暴露于静磁电场 30天后,经16小时禁食后的空腹血糖(FBG)水平(野生型小鼠,每组n=5;BBS小鼠,每组n≥7)。
(C)正常饲料喂养(NCD)小鼠与高脂饮食喂养(HFD)小鼠暴露于静磁电场 30天后的葡萄糖耐量试验(GTT)结果,其中空腹血糖(FBG)以0分钟时间点呈现(左图),曲线下面积(AUC)结果(右图)(正常饲料喂养小鼠,每组n≥22;高脂饮食喂养小鼠,每组n=7)。
(D)野生型(WT)小鼠与瘦素受体缺陷小鼠(db/db)暴露于静磁电场 30天后的葡萄糖耐量试验(GTT)结果,其中空腹血糖(FBG)以0分钟时间点呈现(左图),曲线下面积(AUC)结果(右图)(每组n≥8只小鼠)。
(E)正常饲料喂养(NCD)、高脂饮食喂养(HFD)及db/db小鼠暴露于静磁电场 30天后,经16小时禁食后的血浆胰岛素水平(每组n≥8只小鼠)。
(F)正常饲料喂养(NCD)、高脂饮食喂养(HFD)及db/db小鼠暴露于静磁电场 30天后的胰岛素抵抗稳态模型评估(HOMA-IR)结果(每组n≥8只小鼠)。
(G)高脂饮食喂养(HFD)小鼠每日暴露于静磁电场 7小时或24小时、持续30天后的葡萄糖耐量试验(GTT)与空腹血糖(FBG)结果(左图),及曲线下面积(AUC)结果(右图)(每组n≥8只小鼠)。
数据以“均数±标准误”(mean ± SEM)表示。(A-F)组数据采用双尾非配对t检验分析;(G)组数据采用单因素方差分析(one-way ANOVA),并通过Tukey法进行多重比较校正。ns表示无统计学意义;*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
为验证上述效果是否需要两种场共同作用,研究人员将高脂饮食喂养(HFD)小鼠分别暴露于静磁场(sB)、静电场(sE)或联合静磁-静电场(静磁电场)中30天,随后进行葡萄糖耐量试验(GTT)。有趣的是,与未接受处理的小鼠相比,暴露于静磁场(sB)显著加重了小鼠的血糖异常与葡萄糖耐受不良,而静电场(sE)无显著影响(图S1A)。这一结果与此前研究中“暴露于静磁场会加重血糖异常”的结论一致。本研究发现,仅联合静磁-静电场(静磁电场)可显著改善葡萄糖耐量(图S1A)。因此,后续所有实验均采用静磁电场进行干预。
为验证长期暴露于静磁电场的有效性,研究人员将高脂饮食喂养(HFD)小鼠暴露于静磁电场中22周。结果显示,与未接受处理的小鼠相比,处理组小鼠的空腹血糖(FBG)降低40%,表明持续暴露于静磁电场 5个月期间,其降糖效果仍具有持续性(图S1B、S1C)。这一发现提示,长期暴露于静磁电场不会引发代谢代偿效应,从而不会削弱其降糖作用。22周后停止静磁电场暴露,小鼠空腹血糖在停药7天内回升至原有水平(图S1B、S1C)。研究人员还采用配对设计,在db/db小鼠中验证了停药后的反弹效应:分别在静磁电场处理前、处理16天及停药4天三个时间点进行葡萄糖耐量试验(GTT)(图S1D)。结果显示,暴露于静磁电场 16天后,小鼠葡萄糖耐量较处理前改善36%(图S1E);停药后4天,葡萄糖耐量回升至处理前水平(图S1E)。综上,这些结果表明静磁电场诱导的血糖改善效果具有持续性,且在停药7天内会出现反弹。
接下来,研究人员探究静磁电场是否通过升高胰岛素水平发挥降糖作用。将高脂饮食喂养(HFD)与db/db小鼠持续暴露于静磁电场中30天,经16小时禁食后检测血浆胰岛素水平。结果显示,所有暴露于静磁电场的小鼠空腹血浆胰岛素水平均未升高,且高脂饮食喂养的静磁电场处理组小鼠胰岛素水平反而降低43%(图1E)。高脂饮食喂养处理组小鼠空腹胰岛素水平降低,这一结果与胰岛素敏感性改善的特征相符。而db/db处理组小鼠胰岛素水平未降低,可能是由于瘦素信号改变、胰岛素抵抗严重程度差异及胰岛功能损伤更显著等模型特异性因素,导致其对静磁电场的反应存在差异。尽管如此,这些结果提示静磁电场是通过提高胰岛素敏感性而非促进胰岛素分泌发挥作用。为评估静磁电场对胰岛素敏感性的影响,研究人员计算了胰岛素抵抗稳态模型评估(HOMA-IR)指数,结果显示与未处理组相比,静磁电场可显著改善高脂饮食喂养(HFD)与db/db这两种胰岛素抵抗小鼠模型的胰岛素抵抗状态(图1F)。因此,静磁电场的降糖效应可能源于其对胰岛素作用的增强。 (静磁电场具有类似二甲双胍样的作用?)
这些显著的效应促使研究人员评估一种更易实施的治疗方案。目前2型糖尿病(T2D)治疗药物需患者每日自行给药,患者依从性面临较大挑战,进而影响治疗效果。由于静磁电场具有自动化潜力,研究人员推测若能缩短治疗时间,静磁电场或可作为一种被动干预手段,在患者睡眠期间实现对2型糖尿病的管理。因此,研究人员将高脂饮食喂养(HFD)小鼠在其常规睡眠时段(上午7点-下午2点)每日暴露于静磁电场 7小时,持续30天。结果显示,每日暴露7小时的小鼠与持续暴露的小鼠在葡萄糖耐量改善方面效果相当,表明无需持续暴露即可达到治疗效果(图1G)。

静磁电场暴露可提高胰岛素敏感性并改善胰岛素抵抗
为明确静磁电场暴露是否调控胰岛素敏感性,研究人员进行了正常血糖-高胰岛素钳夹试验(图S2A)。将正常饲料喂养(NCD)与高脂饮食喂养(HFD)小鼠暴露于静磁电场中长达30天,经6小时禁食后进行钳夹试验。在钳夹期间,为维持稳态胰岛素水平下的正常血糖,暴露于静磁电场 30天的正常饲料喂养小鼠与高脂饮食喂养小鼠,其葡萄糖输注率(GIR)分别显著提高17%与104%(图2A、2B、S2B、S2C)。仅需持续暴露静磁电场 3天即可观察到胰岛素敏感性的改善,且每日暴露7小时也能达到同等效果(图2B)。与胰岛素敏感性提高一致的是,暴露于静磁电场仅3天,正常饲料喂养小鼠与高脂饮食喂养小鼠的胰岛素刺激葡萄糖处置率就分别显著提高14%与62%(图2C、2D)。此外,静磁电场暴露未增强正常饲料喂养小鼠中胰岛素对葡萄糖生成的抑制作用;仅在高脂饮食喂养小鼠中,暴露于静磁电场 30天后才观察到该抑制作用的增强,这表明静磁电场暴露后葡萄糖输注率(GIR)升高的主要驱动因素是胰岛素刺激的葡萄糖处置(图2E、2F)。
有趣的是,在正常饲料喂养(NCD)与高脂饮食喂养(HFD)小鼠中,静磁电场暴露未显著提高任何检测组织的胰岛素刺激葡萄糖摄取量(图3A、3B)。然而,在两种小鼠模型中,静磁电场暴露均显著增强肝脏中葡萄糖向糖原的转化(糖原合成),但对骨骼肌中的糖原合成无此效应(图3C、3D)。仅联合静磁-静电场(静磁电场)可显著提高高脂饮食喂养小鼠的肝糖原水平(图3E)。在db/db小鼠暴露于静磁电场后,以及在原代人肝细胞中,均观察到肝糖原水平升高,表明这种肝脏特异性效应不仅存在于啮齿类动物中(图3F、3G)。这些数据表明,静磁电场暴露可显著提高胰岛素敏感性,并提示肝脏是其主要作用靶器官。
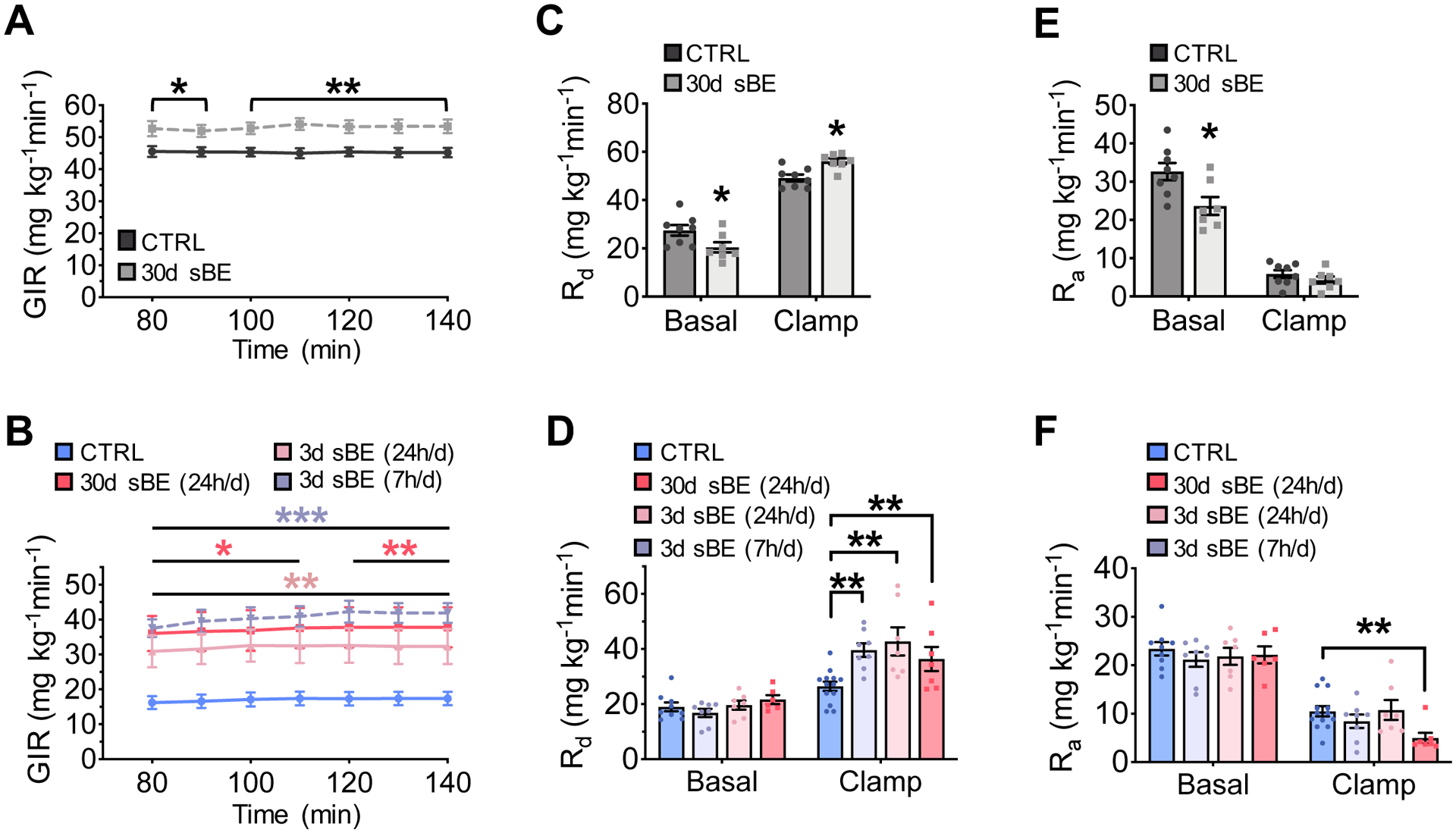
图2:静磁电场暴露可提高胰岛素敏感性
(A–F)对暴露于静磁电场的正常饲料喂养(NCD)小鼠与高脂饮食喂养(HFD)小鼠,经6小时禁食后进行正常血糖-高胰岛素钳夹试验。
(A)持续暴露于静磁电场 30天的正常饲料喂养(NCD)小鼠的葡萄糖输注率(GIR)(每组n≥7只小鼠)。
(B)高脂饮食喂养(HFD)小鼠分别经以下方式暴露于静磁电场后的葡萄糖输注率(GIR):持续(24小时/天)暴露30天、持续(24小时/天)暴露3天、每日暴露7小时且总计暴露3天(每组n≥7只小鼠)。
(C)正常饲料喂养(NCD)小鼠的葡萄糖处置率(Rd)(每组n≥7只小鼠)。
(D)高脂饮食喂养(HFD)小鼠的葡萄糖处置率(Rd)(每组n≥7只小鼠)。
(E)正常饲料喂养(NCD)小鼠的葡萄糖生成率(Ra)(每组n≥7只小鼠)。
(F)高脂饮食喂养(HFD)小鼠的葡萄糖生成率(Ra)(每组n≥7只小鼠)。
数据以“均数±标准误”(mean ± SEM)表示。正常饲料喂养(NCD)小鼠数据采用双尾非配对Student’s t检验分析;高脂饮食喂养(HFD)小鼠数据采用单因素方差分析(one-way ANOVA),并通过Dunnett法进行多重比较校正。*P<0.05,**P<0.01,***P<0.001。
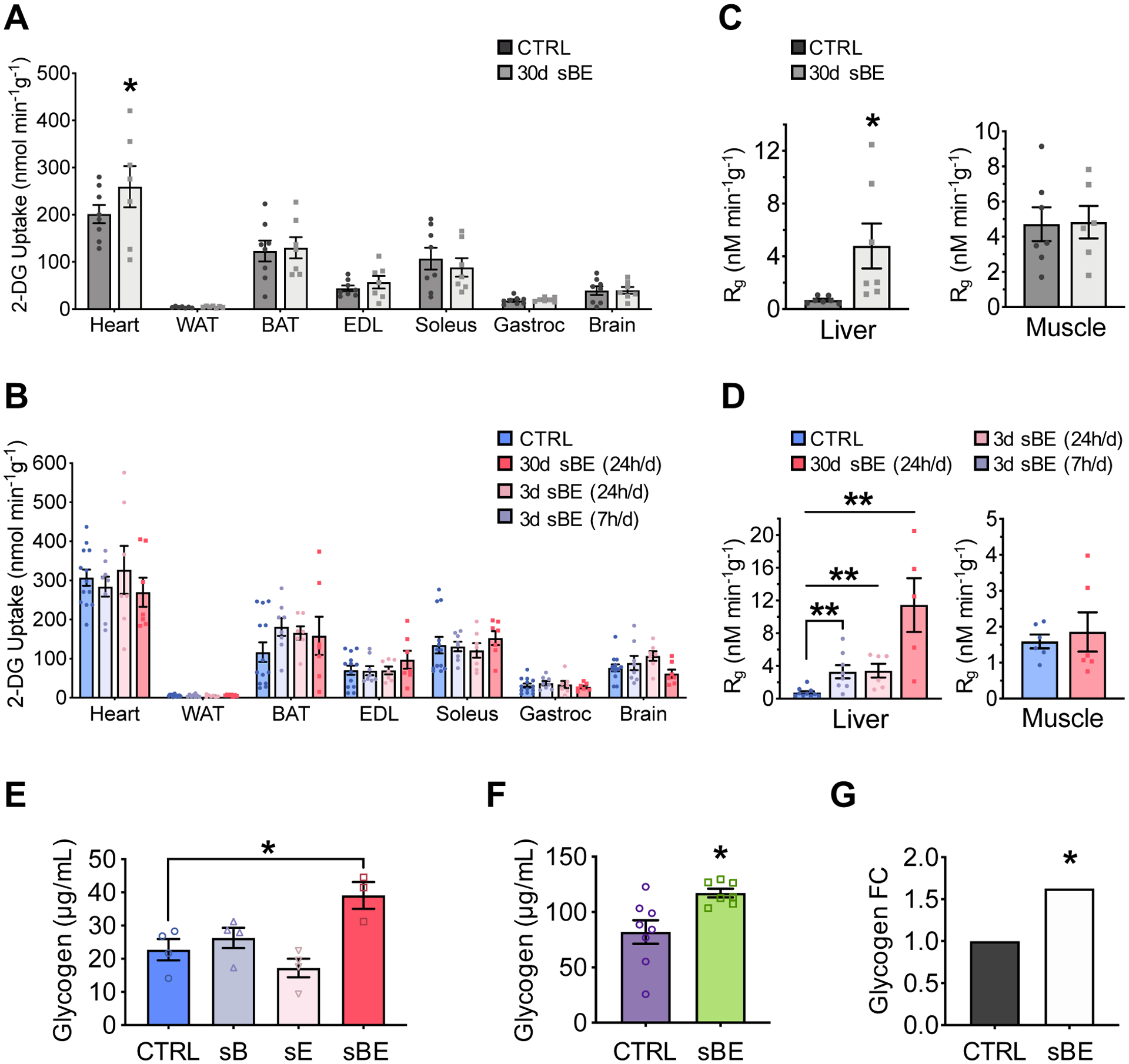
图3:静磁电场暴露可促进葡萄糖向肝糖原的转化
(A–D)正常血糖-高胰岛素钳夹试验条件下的检测结果:
(A、B)¹⁴C-2-脱氧葡萄糖在组织中的摄取量:(A)正常饲料喂养(NCD)小鼠(每组n≥7);(B)高脂饮食喂养(HFD)小鼠(每组n≥7)。
(C、D)¹⁴C-2-脱氧葡萄糖向肝糖原与肌糖原的转化量:(C)正常饲料喂养(NCD)小鼠(每组n≥7);(D)高脂饮食喂养(HFD)小鼠(每组n≥6)。
(E)高脂饮食喂养(HFD)小鼠分别暴露于静磁场(sB)、静电场(sE)或联合静磁-静电场(静磁电场)25天后的总肝糖原水平(每组n≥7)。
(F)db/db小鼠暴露于静磁电场 30天后的总肝糖原水平(每组n≥7)。
(G)原代人肝细胞暴露于静磁电场 6小时后生成的糖原量,以倍数变化表示(在5个不同日期进行实验,共5个生物学重复样本,n=5)。
数据以“均数±标准误”(mean ± SEM)表示。(A)(C)(F)组数据采用双尾非配对Student’s t检验分析;(B)(C)(D)(E)组数据采用单因素方差分析(one-way ANOVA),并通过Dunnett法进行多重比较校正;(G)组数据采用混合效应模型分析。*P<0.05,**P<0.01。
静磁电场暴露不增强胰岛素信号通路中间分子的磷酸化水平
对暴露于静磁电场 3天的正常饲料喂养(NCD)与高脂饮食喂养(HFD)小鼠,通过静脉注射胰岛素或溶媒(PBS)刺激15分钟后,检测其胰岛素信号通路活性。胰岛素刺激可通过增强蛋白质磷酸化水平,激活肝脏、白色脂肪组织(WAT)和骨骼肌这三个调控葡萄糖稳态的关键组织中的胰岛素信号。尽管静磁电场暴露能提高胰岛素敏感性,但与未处理小鼠相比,其并未增强肝脏、白色脂肪组织或骨骼肌中AKT(蛋白激酶B)和GSK3β(糖原合成酶激酶3β)的磷酸化水平,这提示存在一种不依赖于“胰岛素信号通路中间分子磷酸化水平升高”的胰岛素增敏机制(图S2D–S2L)。
静磁电场暴露无不良反应
研究人员探究了静磁电场暴露所带来的显著胰岛素敏感性改善是否伴随不良反应:将小鼠持续暴露于静磁电场至少30天后进行评估,结果显示:未观察到异常组织病理学改变;血压无变化;超声心动图显示暴露于静磁电场的小鼠心功能正常(图S3A、表S1)。静磁电场暴露小鼠的葡萄糖排泄量未升高,排除了尿糖升高的可能(图S3B–S3D)。正常饲料喂养(NCD)与db/db小鼠的体重、食物摄入量及能量消耗均无变化(图S3E–S3G);但高脂饮食喂养(HFD)小鼠出现体重降低、能量消耗增加、食物摄入量上升及呼吸商降低的现象,提示不同模型对静磁电场的反应存在模型特异性差异(图S3G)。基于静磁电场暴露对肝脏葡萄糖代谢的影响,研究人员进一步评估了肝脏线粒体超微结构,结果显示线粒体形态正常(图S3H、S3I)。综上,静磁电场暴露的耐受性良好,其对胰岛素作用的改善效应不太可能是由不良反应继发引起的。
静磁电场暴露降低氧化应激并激活NRF2信号通路
由于胰岛素信号通路的变化无法解释静磁电场的胰岛素增敏效应,研究人员将机制研究重点转向其他可能调控胰岛素敏感性的通路。已有研究表明,氧化还原失衡与氧化应激是胰岛素抵抗发病机制的重要促成因素。为验证静磁电场是否通过氧化还原依赖性机制发挥生物学效应,研究人员检测了循环中的F2-异前列腺素(F2-IsoPs)水平——该物质是花生四烯酸在活性氧(ROS)驱动下发生氧化的产物,常作为临床检测脂质过氧化及全身氧化应激的标志物(Milne等,2007)。代谢健康状况与胰岛素敏感性均与循环F2-异前列腺素水平呈负相关。
研究人员对暴露于静磁电场 3天的正常饲料喂养(NCD)与高脂饮食喂养(HFD)小鼠,分别进行16小时禁食与4小时复饲处理,以评估静磁电场在禁食与进食状态下对全身氧化负荷的影响。结果显示,高脂饮食喂养(HFD)小鼠的F2-异前列腺素水平更高,表明糖尿病状态下全身氧化应激更显著,这与此前研究结论一致。与未处理对照组相比,静磁电场暴露使正常饲料喂养(NCD)与高脂饮食喂养(HFD)小鼠在禁食状态下的循环F2-异前列腺素水平分别降低19%与20%,并使高脂饮食喂养(HFD)小鼠在复饲状态下的循环F2-异前列腺素水平降低37%(图4A)。
为明确这些显著变化是否与适应性氧化还原反应相关,研究人员检测了核因子E2相关因子(NRF2)的表达水平——NRF2是细胞氧化还原稳态的核心调控因子。该转录因子激活后会转移至细胞核内,通过调控抗氧化反应元件的表达启动氧化还原应答。高脂饮食喂养(HFD)小鼠暴露于静磁电场 3天后,肝脏细胞核内NRF2水平显著升高(图4B)。这些结果表明,静磁电场暴露可激活适应性氧化还原反应,从而降低糖尿病动物的氧化应激水平。
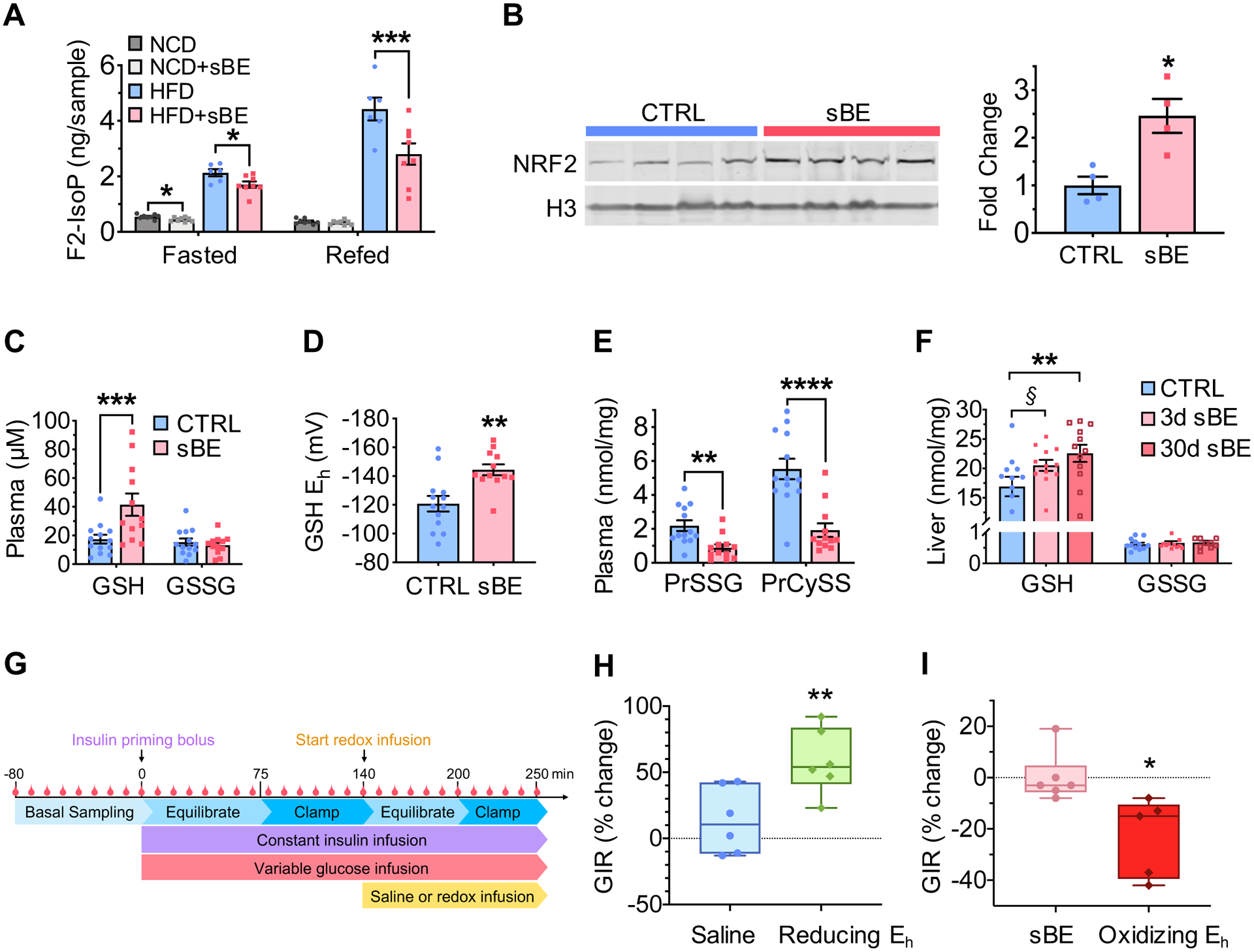
图4:静磁电场暴露通过改变全身氧化还原状态增强胰岛素应答
(A)暴露于静磁电场 3天的正常饲料喂养(NCD)与高脂饮食喂养(HFD)小鼠,经16小时禁食与4小时复饲后的血浆F2-异前列腺素水平(每组n=8只小鼠)。
(B)暴露于静磁电场 3天的高脂饮食喂养(HFD)小鼠肝脏细胞核组分中NRF2的Western blot检测图(左图)及定量分析结果(右图),以组蛋白3(H3)为内参进行标准化(每组n=4只小鼠)。
(C–E)对照组高脂饮食喂养(HFD)小鼠与暴露于静磁电场 3天的高脂饮食喂养(HFD)小鼠血浆中相关分析物的检测结果:
(C)血浆中谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的浓度(每组n≥12只小鼠)。
(D)血浆中GSH的半电池还原电位(每组n≥12只小鼠)。
(E)血浆中蛋白质谷胱甘肽化(PrSSG)与蛋白质半胱氨酸化(PrCySS)水平(每组n≥12只小鼠)。
(F)暴露于静磁电场 3天与30天的高脂饮食喂养(HFD)小鼠肝脏中GSH与GSSG的检测结果,以浓度(每毫克蛋白质中纳摩尔数,nmol/mg蛋白)表示(每组n≥10只小鼠)。§P=0.07,**P<0.01。
(G)正常血糖-高胰岛素钳夹试验流程示意图,其中包含还原性或氧化性氧化还原溶液的输注步骤。
(H–I)对高脂饮食喂养(HFD)小鼠进行的配对正常血糖-高胰岛素钳夹试验:
(H)未处理的高脂饮食喂养(HFD)小鼠先以150 mg/dL血浆葡萄糖为基础值进行钳夹,随后在输注生理盐水或GSH/GSSG还原性溶液(还原性Eh)期间,维持该血糖浓度再次进行钳夹,图中为葡萄糖输注率(GIR)的百分比变化(生理盐水输注组,n=6只小鼠;还原性Eh输注组,n=6只小鼠)。
(I)暴露于静磁电场 3天的高脂饮食喂养(HFD)小鼠先以150 mg/dL血浆葡萄糖为基础值进行钳夹,随后在输注生理盐水或GSH/GSSG氧化性溶液(氧化性Eh)期间,维持该血糖浓度再次进行钳夹,图中为葡萄糖输注率(GIR)的百分比变化(静磁电场暴露+生理盐水输注组,n≥5只小鼠;静磁电场暴露+氧化性Eh输注组,n≥5只小鼠)。
数据以“均数±标准误”(mean ± SEM)表示。(A)(F)组数据采用Sidak多重比较t检验分析;(B–E)组数据采用双尾非配对Student’s t检验分析;(H)(I)组数据采用双尾配对Student’s t检验分析。*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
静磁电场暴露诱导具有胰岛素增敏作用的全身氧化还原应答
全身氧化还原环境由反应迅速的抗氧化系统调控,这些系统可作为还原剂中和氧化剂。谷胱甘肽-氧化型谷胱甘肽(GSH/GSSG)与半胱氨酸-胱氨酸(Cys/CySS)是巯基氧化还原对,也是哺乳动物体内两种主要的抗氧化系统。GSH/GSSG与Cys/CySS系统几乎存在于所有细胞中,且具有高度区室化特征,在血浆等细胞外区室中也有分布。此外,巯基介导的半胱氨酸修饰是一种替代性信号传导机制,可能不依赖于蛋白质磷酸化而直接调控蛋白质功能。
研究人员推测,这些氧化还原系统可能是解释静磁电场暴露改善全身氧化应激的关键机制,因此进一步探究静磁电场暴露是否会诱导这些重要氧化还原对发生适应性变化。结果显示,暴露于静磁电场 3天后,小鼠循环GSH水平升高2.4倍;通过能斯特方程计算可知,与未暴露的糖尿病小鼠相比,其氧化还原环境的还原电位降低25毫伏(mV),即更偏向还原性(图4C、4D)。有趣的是,分布更广泛的Cys/CySS氧化还原对未发生变化,提示静磁电场对GSH/GSSG氧化还原对具有特异性的全身调控作用(图S4A、S4B)。此外,与未处理小鼠相比,暴露于静磁电场 3天的高脂饮食喂养(HFD)小鼠,其循环中的蛋白质S-谷胱甘肽化(PrSSG)与蛋白质S-半胱氨酸化(PrCySS)水平分别降低60%与65%,这与全身循环氧化还原环境向还原性方向偏移的特征一致(图4E)。
暴露于静磁电场 3天时,小鼠肝脏GSH水平呈升高趋势(P=0.07);暴露30天时,肝脏GSH水平显著升高(图4F)。静磁电场暴露后,肝脏蛋白质的S-谷胱甘肽化与S-半胱氨酸化水平变化无统计学意义(图S4C)。这些数据表明,静磁电场暴露可改变肝脏氧化还原环境,且提示肝脏可能是静磁电场介导全身氧化还原环境变化的来源。
为探究酶活性变化是否能解释上述氧化还原改变,研究人员检测了肝脏中GSSG还原酶、硫氧还蛋白还原酶及葡萄糖-6-磷酸脱氢酶的活性,结果显示这些氧化还原调控酶的活性均未发生变化(图S4D–S4F)。该结果进一步支持“静磁电场可能不依赖于谷胱甘肽氧化还原代谢调控酶的活性变化,而直接改变氧化还原稳态”这一观点。
循环GSH水平的显著升高,促使研究人员探究血浆GSH/GSSG氧化还原电位的变化是否直接介导了静磁电场的胰岛素增敏效应。在正常血糖-高胰岛素钳夹条件下,通过向高脂饮食喂养(HFD)小鼠体内输注经氧化还原调整的GSH/GSSG溶液约1小时,在体内构建了更偏向还原性的GSH/GSSG氧化还原电位环境(图4G)。值得注意的是,输注1小时与静磁电场暴露效果类似的还原性氧化还原环境,可模拟静磁电场的胰岛素增敏效应(图4H)——这与人类研究结论一致,即向2型糖尿病患者输注GSH具有胰岛素增敏作用。相反,通过输注经调整的GSH/GSSG溶液构建更偏向氧化性的氧化还原环境,以逆转静磁电场诱导的循环氧化还原稳态变化,可减弱静磁电场对胰岛素作用的改善效应(图4I)。这些数据表明,全身氧化还原环境可快速调控胰岛素应答,且静磁电场通过促进全身氧化还原环境向还原性方向偏移,发挥胰岛素增敏作用。
静磁电场暴露改变活性氧(ROS)稳态
巯基抗氧化剂会在过量氧化剂(包括活性氧)存在时被激活。长期以来,研究认为活性氧通过尚未明确的机制在胰岛素抵抗的发病中发挥致病作用。鉴于许多活性氧(如超氧化物O₂•⁻)具有自由电子,有研究提出这类物质可介导弱电磁场的生物学效应。基于超氧化物的顺磁性特征及其在2型糖尿病病理生理过程中的作用,研究人员探究了静磁电场暴露是否会改变超氧化物(O₂•⁻)稳态。
结果显示,当Hepa1–6肝细胞暴露于3.0毫特斯拉(mT)的静磁电场(而非0.5毫特斯拉的静磁电场)时,二氢乙锭(DHE)与MitoSOX的氧化水平显著低于未处理细胞,提示胞质与线粒体中的稳态超氧化物(O₂•⁻)水平均降低(图5A、S5A)。此外,与未处理细胞相比,暴露于3.0毫特斯拉(而非0.5毫特斯拉)静磁电场的肝细胞中, Amplex Red(稳态过氧化氢H₂O₂水平的指示物)的氧化水平升高(图5A、S5A)。这一结果与“超氧化物通过歧化反应转化为过氧化氢,导致二者生成比例改变”的机制一致。
研究人员进一步在高脂饮食喂养(HFD)小鼠体内评估了静磁电场对超氧化物(O₂•⁻)相关标志物的影响:体内与体外成像显示,静磁电场暴露3天后,小鼠肝脏中DHE的氧化水平降低,但肾脏与心脏中无此变化,这与体外细胞实验结果一致(图5B、5C、S5B)。暴露于静磁电场的小鼠肝脏中,超氧化物歧化酶(SOD1、SOD2)与过氧化氢酶的活性及表达水平均无变化(图5D–5F)。这些数据表明,静磁电场可通过非酶促方式改变肝脏中超氧化物(O₂•⁻)的代谢。
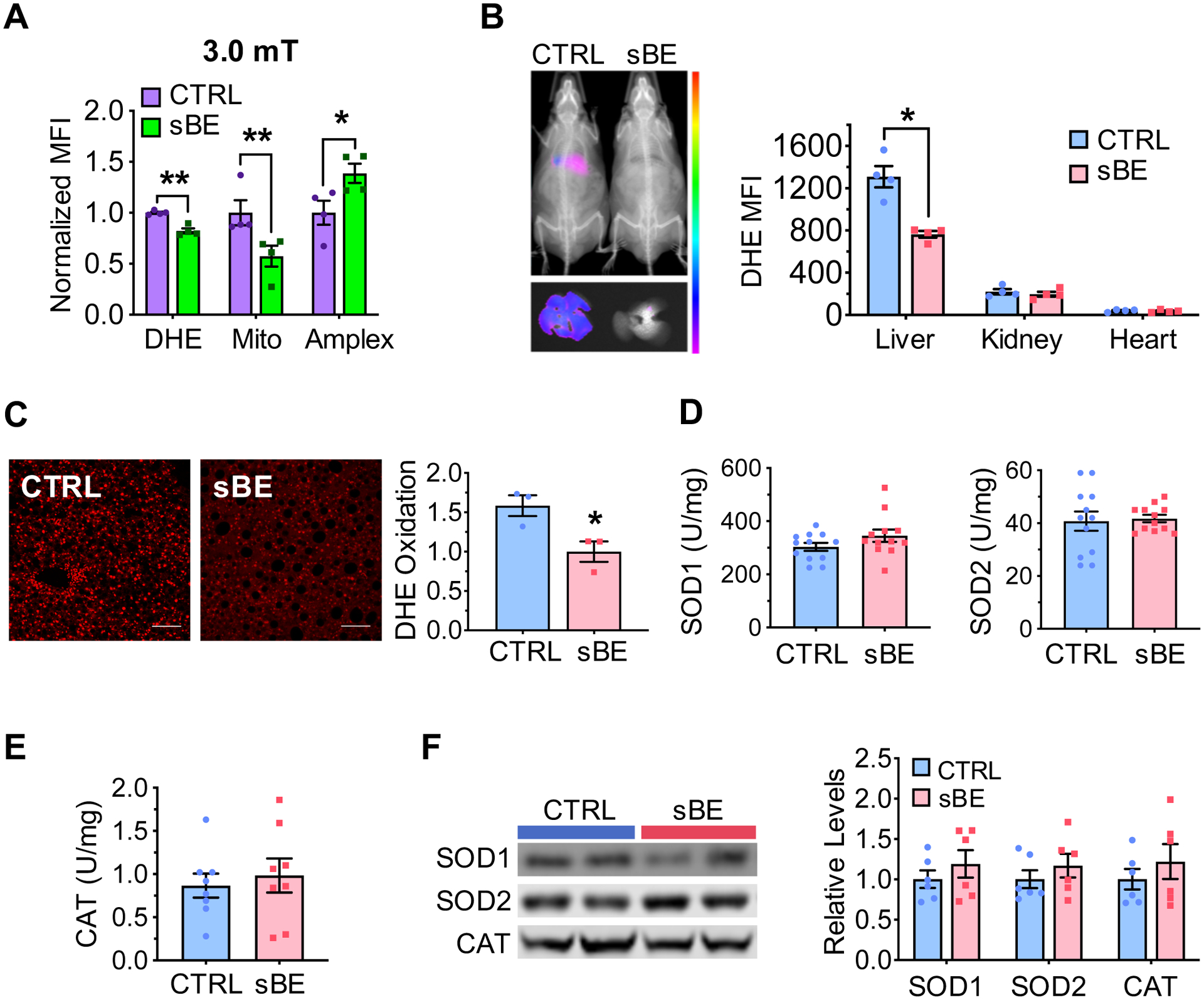
图5:静磁电场暴露可改变活性氧(ROS)稳态,且不影响活性氧相关酶的功能
(A)暴露于3.0毫特斯拉(mT)静磁-静电场(静磁电场)的Hepa1-6细胞中,二氢乙锭(DHE)、线粒体超氧化物指示剂(MitoSox,简称Mito)和 Amplex Red(简称Amplex)的标准化平均荧光强度(MFI)(每组n=4个生物学重复样本)。
(B)暴露于静磁电场 3天的高脂饮食(HFD)小鼠体内二氢乙锭(DHE)氧化的代表性图像(左图):上图为小鼠全身图像,下图为肝脏图像;右图为肝脏、肾脏和心脏中DHE氧化的平均荧光强度(MFI)量化结果(每组n=4只小鼠)。
(C)暴露于静磁电场 3天的高脂饮食(HFD)小鼠肝脏切片(比例尺:100微米)的代表性图像(左图,经DHE染色);右图为以平均荧光强度为指标的DHE氧化量化结果(每只小鼠分析300个细胞核,每组n=3只小鼠)。
(D–F)高脂饮食(HFD)小鼠暴露于静磁电场 3天后,检测其肝脏中与活性氧(ROS)相关的酶功能:
(D)肝脏中超氧化物歧化酶1(SOD1,左图)和超氧化物歧化酶2(SOD2,右图)的活性(每组n=12只小鼠)。
(E)肝脏中过氧化氢酶活性(每组n=8只小鼠)。
(F)肝脏中SOD1、SOD2和过氧化氢酶(CAT)蛋白表达的蛋白质印迹图像(左图)及量化结果(右图)(每组n=6)。
数据以“均数±标准误”(mean ± SEM)表示。(A)组数据采用Sidak多重比较t检验分析;(B–F)组数据采用双尾非配对Student’s t检验分析。*P<0.05,**P<0.01。
肝脏线粒体活性氧(ROS)介导静磁电场的胰岛素增敏效应
基于超氧化物(O₂•⁻)具有未成对电子的特性,我们推测其可能是介导静磁电场代谢效应的关键磁感受自由基。为验证O₂•⁻的作用,在3天静磁电场暴露期间,向高脂饮食(HFD)小鼠施用两种不同的药理学超氧化物歧化酶(SOD)模拟物——GC4403(特异性)和TEMPOL(非特异性),以清除体内的O₂•⁻。
GC4403是一种锰(II)五氮大环化合物,可自由穿过细胞膜,且对O₂•⁻具有高度特异性:其锰中心通过在Mn(II)和Mn(III)之间循环,将O₂•⁻转化为过氧化氢(H₂O₂)。TEMPOL(即4-羟基-2,2,6,6-四甲基哌啶-1-氧自由基)是一种膜渗透性抗氧化剂,属于非金属依赖性SOD模拟物,多项研究已证实其可清除O₂•⁻。研究发现,施用任意一种超氧化物清除剂,均可完全阻断静磁电场的胰岛素增敏效应(图6A、6B、图S6A–S6C)。
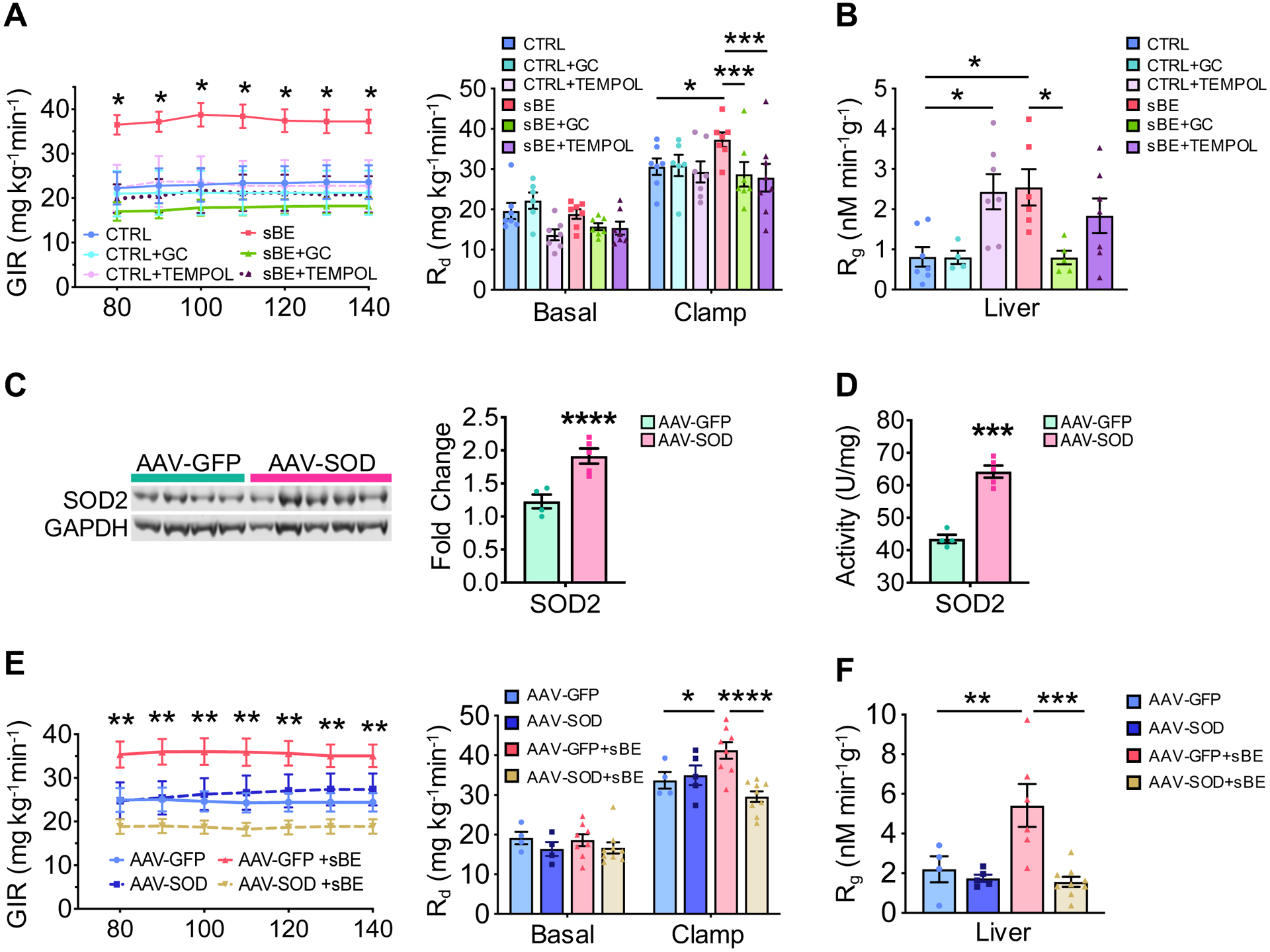
图6:肝脏超氧化物介导静磁电场暴露的胰岛素增敏效应
(A–B)高脂饮食(HFD)小鼠在暴露于静磁电场的同时,连续3天施用药理学超氧化物歧化酶模拟物(GC或TEMPOL),经6小时禁食后进行正常血糖-高胰岛素钳夹试验:
(A)葡萄糖输注率(GIR,左图)和葡萄糖处置率(Rd,右图)(每组n≥6只小鼠)。
(B)¹⁴C-2-脱氧葡萄糖向肝糖原的转化量(每组n≥6只小鼠)。
(C)在高脂饮食(HFD)小鼠中,通过肝脏特异性载体过表达人超氧化物歧化酶2(AAV-SOD组)或对照组绿色荧光蛋白(AAV-GFP组)后,肝脏中SOD2的蛋白表达水平(AAV-GFP组,n=4只小鼠;AAV-SOD组,n=5只小鼠)。
(D)AAV-GFP组与AAV-SOD组小鼠肝脏中SOD2的活性(AAV-GFP组,n=4只小鼠;AAV-SOD组,n=5只小鼠)。
(E–F)AAV-SOD组与AAV-GFP组高脂饮食(HFD)小鼠暴露于静磁电场 3天后,经6小时禁食后进行正常血糖-高胰岛素钳夹试验:
(E)葡萄糖输注率(GIR,左图)和葡萄糖处置率(Rd,右图)(AAV-GFP组,n=4只小鼠;AAV-SOD组,n=5只小鼠;AAV-GFP+静磁电场组,n=8只小鼠;AAV-SOD+静磁电场组,n=9只小鼠)。
(F)¹⁴C-2-脱氧葡萄糖向肝糖原的转化量(AAV-GFP组,n=4只小鼠;AAV-SOD组,n=5只小鼠;AAV-GFP+静磁电场组,n=8只小鼠;AAV-SOD+静磁电场组,n=9只小鼠)。
数据以“均数±标准误”(mean ± SEM)表示。(A–B)组和(E–F)组数据采用双因素方差分析(two-way ANOVA),并通过Sidak法进行多重比较;(C–D)组数据采用双尾非配对Student’s t检验分析。*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
基于现有数据表明肝脏和线粒体是静磁电场的重要作用靶标,我们进一步探究静磁电场的胰岛素增敏效应是否依赖于肝脏线粒体超氧化物(O₂•⁻)。为验证对线粒体O₂•⁻的作用特异性,我们采用靶向肝脏的腺相关病毒载体(AAV2/8血清型),并结合由α1-抗胰蛋白酶与白蛋白增强子融合而成的肝脏特异性嵌合启动子,在高脂饮食(HFD)小鼠中过表达人超氧化物歧化酶2(SOD2)(图6C、6D)。
SOD2对线粒体O₂•⁻的清除具有高度特异性:其线粒体引导序列需经过切割、金属结合并在内膜折叠后,才具备超氧化物歧化酶活性。病毒转导后,将高脂饮食(HFD)小鼠暴露于静磁电场 3天,随后通过正常血糖-高胰岛素钳夹试验评估其胰岛素敏感性。结果显示,肝脏中SOD2的过表达完全阻断了静磁电场的胰岛素增敏效应,包括静磁电场对葡萄糖输注率(GIR)、葡萄糖处置率(Rd)及葡萄糖向肝糖原转化的促进作用均被完全抑制(图6E、6F、图S6D–S6F)。这些结果表明,肝脏线粒体超氧化物(O₂•⁻)是介导静磁电场胰岛素增敏效应的关键信号分子。
讨论
地球生命在微弱的静磁场与静电场环境中演化了数十亿年,但这些场的生物学效应尚未被充分理解。本研究证实,联合应用静磁场与静电场(静磁电场)可通过氧化还原依赖性机制发挥显著的胰岛素增敏效应:该效应起效迅速(每日暴露7小时、持续3天即可显现),且无不良反应。此外,研究发现静磁电场可快速且强效地促进糖原合成,不仅能增强小鼠体内肝脏糖原生成,还可作用于原代人肝细胞——这一结果与胰岛素应答增强的特征一致,提示静磁电场的效应可能不仅限于啮齿类动物。
研究表明,静磁电场的胰岛素增敏效应至少部分是通过调节全身谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)氧化还原环境实现的:暴露于静磁电场 3天可显著升高血浆GSH水平,使全身氧化还原环境大幅偏向还原性;且在钳夹试验条件下,全身输注经氧化还原调整的溶液可快速改变胰岛素敏感性。这些发现与此前研究结论一致,即细胞外氧化还原环境可调控胰岛素敏感性与糖原合成。
已有研究提出,氧化还原系统可通过半胱氨酸残基上的氧化还原依赖性蛋白质翻译后修饰(PTM)(主要是S-谷胱甘肽化和S-半胱氨酸化)调控代谢。这些修饰通过改变蛋白质功能,快速调节代谢酶活性与能量代谢。本研究发现,暴露于静磁电场 3天即可降低循环蛋白质的S-谷胱甘肽化和S-半胱氨酸化水平,这一结果符合以下两点推论:1)健康的、更偏向还原性的全身环境会清除这些氧化还原相关翻译后修饰;2)静磁电场可通过非磷酸化翻译后修饰快速调控蛋白质功能与胰岛素敏感性,这是一种潜在的信号传导机制。
经氧化还原调整的溶液输注后,胰岛素应答在短时间内即发生改变,结合静磁电场可调节氧化还原相关翻译后修饰的观察结果,提示存在一种快速响应的氧化还原依赖性开关——该开关可调控胰岛素敏感性,且能被静磁电场调节。因此,快速的非遗传机制(如氧化还原依赖性翻译后修饰)可能参与调控胰岛素敏感性相关蛋白质的功能。由于受影响的主要氧化还原对是GSH/GSSG(而非Cys/CySS),推测GSH敏感性靶标可能在此过程中发挥作用。
巯基氧化还原适应通常在氧化事件(包括活性氧平衡紊乱)发生时启动,以维持氧化还原稳态。研究发现,改变活性氧稳态(尤其是超氧化物生成)可作为关键起始信号,激活起源于线粒体的“线粒体 hormesis”(线粒体毒物兴奋效应)——该效应通过增强抗氧化能力,抵御氧化应激的有害影响。
与线粒体毒物兴奋效应激活的特征一致,本研究发现静磁电场暴露可改变肝脏线粒体活性氧水平、增强肝脏核因子E2相关因子(NRF2)的激活(表现为核内NRF2水平升高)、提升GSH/GSSG抗氧化能力(血浆氧化还原电位变化可证实),并减轻氧化应激(循环异前列腺素水平降低可证实)。已有研究表明,激活线粒体毒物兴奋效应并诱导抗氧化应答(尤其是GSH氧化还原系统的应答),对代谢与胰岛素敏感性具有有益作用,但活性氧在此过程中的具体作用机制仍未完全明确。
不同活性氧的反应活性与分子靶标存在差异,因此轻微改变活性氧的化学计量比可能导致截然不同的生物学效应。与这一观点及此前关于电磁场(EMFs)的研究一致,本研究证实静磁电场可通过改变超氧化物(O₂•⁻)的歧化代谢,调节活性氧稳态。由于活性氧的相互作用具有多样性且反应活性极高,解析特定活性氧信号的生物学效应面临较大挑战;同样,明确介导外源性刺激生物学应答的特定活性氧类型也十分困难。正因如此,目前尚无研究能明确证实某一特定类型的活性氧参与介导外源性电磁场的效应。
基于此前研究,我们推测超氧化物(O₂•⁻)作为顺磁性传感器,可启动或介导静磁电场的代谢效应。为验证这一假设,我们在静磁电场暴露期间,通过药理学手段全身性清除O₂•⁻,并通过遗传学手段特异性清除肝脏中的O₂•⁻。结果显示,利用线粒体SOD2清除目标介导信号(即O₂•⁻)后,静磁电场的胰岛素增敏效应被完全阻断,这表明肝脏线粒体O₂•⁻是介导静磁电场效应的关键信号。这些发现拓展了此前关于电磁场对活性氧影响的认知,证实代谢表型(如胰岛素应答)依赖于顺磁性自由基(如O₂•⁻)的稳态。
据我们所知,本研究首次通过清除线粒体O₂•⁻和调节全身氧化还原环境,完全阻断并调控了电磁场诱导的生物学效应。因此,我们提出以下假说:暴露于静磁电场可改变肝脏线粒体活性氧的微环境,该微环境作为生物学信号,触发具有胰岛素增敏作用的适应性全身氧化还原应答。目前仍需进一步研究以阐明其中确切的作用机制。
尽管我们已确定超氧化物(O₂•⁻)是介导这些效应的关键分子,但静磁-静电场(静磁电场)与顺磁性活性氧(ROS)相互作用的物理机制仍未明确,且受当前技术限制,相关研究仍面临重大挑战。关于这种相互作用,目前存在两种常见假说:
第一种假说认为存在一种能对电磁场(EMFs)产生物理响应的磁感受器(例如通道的开放或关闭)。然而,本研究中所用的这类弱磁场强度可能不足以从物理层面改变通道的门控特性。
第二种假说(也更具合理性)是“自由基对机制(RPM)”,该机制被认为是迁徙动物磁感受能力的基础。此假说提出,弱电磁场可改变自由基中间体的自旋状态,进而改变其反应产物及下游效应。与自由基对机制一致的是,静磁电场暴露可改变反应产物,并可能改变超氧化物(O₂•⁻)的生成速率,通过改变氧化还原环境来增强胰岛素敏感性。因此,我们提出:静磁电场的生理效应至少部分是通过自由基对机制,与超氧化物(O₂•⁻)发生自旋状态相互作用,或改变其生成速率实现的。
尽管我们发现超氧化物(O₂•⁻)发挥关键作用,但静磁电场的代谢效应仍可能涉及其他活性物质,包括活性氮物质和自由基(如半醌型黄素、FADH•)。除证实超氧化物(O₂•⁻)的作用外,我们还发现肝脏线粒体是静磁电场的作用靶标。这很可能是因为肝脏是代谢中枢,且由于解毒酶的存在及会产生超氧化物(O₂•⁻)作为反应副产物的呼吸反应,肝脏也是超氧化物(O₂•⁻)的主要来源。要充分理解这些机制,仍需进一步研究。不过,我们的研究结果提示,哺乳动物体内存在进化上保守的电磁感受机制,该机制可调控胰岛素应答。
尽管现有治疗选择多样,但许多2型糖尿病(T2D)患者的治疗仍以失败告终,导致其心血管疾病风险显著升高,且死亡年龄提前。目前迫切需要开发简单的治疗策略,满足以下两点要求:1)针对2型糖尿病的根本病因(包括氧化还原失衡);2)不对患者依从性产生负面影响。
为解决这些问题,研究人员已尝试开发调节血糖的简便方法。但近年来的方法要么未针对氧化还原失衡这一根本病因,要么需要使用外源性转基因、铁磁性纳米颗粒或植入电敏感细胞,从而限制了其临床应用价值。
我们的研究表明,静磁电场疗法具有完全自动化的潜力,是一种全新的无创手段——它通过与内源性顺磁性分子(如O₂•⁻)相互作用,并通过适应性恢复健康的氧化还原稳态机制(如GSH/GSSG),来改善胰岛素抵抗。因此,本研究发现了静磁场与静电场的一种新型生理效应,该效应或可用于2型糖尿病及其他潜在氧化还原相关疾病的自动化、长期无创管理。
研究局限性
本研究存在一定局限性:
1. 模型局限性:我们仅在小鼠胰岛素抵抗模型中证实了静磁场与静电场的强效胰岛素增敏作用,仍需在大型哺乳动物及人类中开展研究,以验证这种无创方法的安全性和有效性。
2. 参数优化需求:静磁电场各组成部分的剂量效应关系及其作用时机可能需要进一步优化。
3. 活性氧类型的不确定性:尽管我们证实肝脏线粒体超氧化物(O₂•⁻)介导了静磁电场的治疗效应,但其他类型的活性氧也可能发挥重要作用,未来研究需进一步明确该效应中的其他关键分子。
4. 机制研究的技术限制:由于体内测量自旋状态的技术有限,难以明确静磁电场与活性氧相互作用的具体机制,未来需开展研究以阐明调控细胞内分子自旋状态的生物学效应。
5. 关键蛋白未明确:尽管我们发现存在介导静磁电场胰岛素增敏效应的氧化还原开关,但介导该效应的具体蛋白质仍未确定,未来需通过研究明确构成该氧化还原开关的蛋白质(静磁电场暴露可激活该开关,从而发挥胰岛素增敏作用)。
详细实验方法
主要联系人
如需获取更多信息或申请资源与试剂,请联系主要联系人Calvin S. Carter(邮箱:calvin-carter@uiowa.edu)和Val C. Sheffield(邮箱:val-sheffield@uiowa.edu),相关需求将由他们协助处理。
材料可用性
本研究中使用的小鼠品系均可从杰克逊实验室(Jackson Laboratory)商业获取。Sheffield实验室此前构建的BBS小鼠已存入杰克逊实验室,同样可商业获取。
实验模型与研究对象详情
小鼠模型
C57BL/6J(编号#000664)、高脂饮食(HFD)喂养小鼠(编号#380050)及db/db小鼠(编号#000697)均购自杰克逊实验室,饲养于爱荷华大学动物设施内,环境光照可控(12小时光照/12小时黑暗),小鼠可自由进食。实验开始前,小鼠需在动物设施中适应至少1周。
Bbs1M390R/M390R小鼠由Sheffield实验室通过室内交配构建,饲养于相同环境条件下。本研究中,C57BL/6J小鼠和高脂饮食小鼠均使用雄性,db/db小鼠同时使用雄性和雌性。实验所用小鼠年龄约为16-20周,健康状况良好。高脂饮食小鼠从6周龄开始饲喂高脂饲料,饲喂10-14周后进行实验。所有小鼠均根据年龄和体重随机分组,实验操作均遵循机构动物护理和使用委员会(IACUC)的指导原则。
细胞培养
- Hepa1-6细胞:雌性细胞系(ATCC CRL-1830,RRID:CVCL_0327),培养于含10%胎牛血清(Gibco)的DMEM培养基中,培养条件为37°C、5% CO₂。实验时,细胞以12孔板形式培养,每孔接种约3×10⁵个细胞。
- 原代人肝细胞:来源于雄性供体(Axol Biosciences公司)。按照Axol Biosciences公司提供的说明书,使用专用解冻液和培养基在37°C下解冻细胞。实验时,肝细胞以6孔板形式培养,每孔接种约1×10⁶个细胞,待细胞完全汇合后开始实验。
实验方法详情
静磁电场暴露处理
- 静磁场产生:由电源(Sorensen公司)为多匝螺线管线圈供电,产生强度为0.5-5.0毫特斯拉(mT)的磁场,约为地球磁场强度的10-100倍。磁场强度(B)通过以下公式计算:
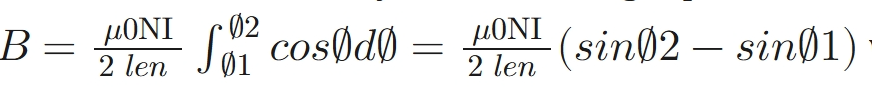
其中,μ₀为真空磁导率,N为线圈匝数,I为线圈电流,len为螺线管长度,∅为螺线管轴线法线与线圈绕线的夹角。
- 静电场产生:由改良电源(Analog Technologies公司)产生强度为5.0-10.0千伏/米(kV/m)的垂直静电场,约为地球垂直电场强度的100倍。
- 暴露方式:样本置于螺线管内部。小鼠实验中,将小鼠饲养在无磁性笼具(Innovive公司)中,对笼具中的小鼠进行全身静磁电场暴露,小鼠可在笼内自由活动(小鼠相对于磁场B的朝向不影响暴露效果)。所有对照组小鼠均置于环境条件(温度、湿度、光照)可控的惰性装置中。
正常血糖-高胰岛素钳夹试验
1. 手术准备:在小鼠颈静脉植入导管,术后让小鼠完全恢复6天,再进行钳夹试验。
2. 试验条件:小鼠禁食6小时,在无束缚、清醒状态下进行试验。通过输注D-[3-³H]-葡萄糖追踪全身葡萄糖流量。
3. 胰岛素输注:经过80分钟基础采样期后,开始输注胰岛素:高脂饮食小鼠先静脉推注40毫单位(mU)胰岛素,随后以4 mU/(kg·min)的速率持续输注;正常饲料(NCD)喂养小鼠先静脉推注25 mU胰岛素,随后以2.5 mU/(kg·min)的速率持续输注。
4. 葡萄糖摄取检测:在钳夹试验结束前65分钟,1分钟内单次推注[1-¹⁴C]-2-脱氧-D-葡萄糖(2DG)。通过检测组织中¹⁴C-2-脱氧-D-葡萄糖-6-磷酸(2DGP)的示踪剂丰度,测定特定组织的葡萄糖摄取量:钳夹试验达到稳态后,推注2DGP;试验结束后,收集目标组织(心脏、性腺白色脂肪、棕色脂肪、伸趾长肌、比目鱼肌、腓肠肌、大脑)并立即冷冻,储存在-80°C备用。对于较大组织(如心脏、白色脂肪、棕色脂肪、大脑、腓肠肌),若未使用完整组织,则需确保每次检测均包含相同区域。
5. 样本处理与分析:将组织用0.6 M高氯酸进行机械匀浆和裂解,用10 M氢氧化钾中和,随后采用氢氧化钡-硫酸锌法(Ba(OH)₂-ZnSO₄法)沉淀2DGP(Ayala等,2006)。组织特异性葡萄糖清除率的计算方法为:组织中2DGP的放射性活度除以血浆放射性活度积分面积,再乘以衰减期内的平均血浆葡萄糖浓度(Rg),得到葡萄糖摄取速率并标准化。
6.葡萄糖处置率(Rd)与生成率(Ra)计算:采用³H标记葡萄糖示踪剂,通过液体闪烁计数法测定血浆和输注液中的³H放射性活度,使用葡萄糖分析仪(Analox公司)测定血浆葡萄糖浓度,参照已有方法(Ayala等,2011;Ayala等,2006;Ayala等,2010;McGuinness等,2019),结合Steele公式(Steele等,1956)计算Rd和Ra。采用化学发光ELISA法测定血浆胰岛素水平。
¹⁴C-2-脱氧葡萄糖(2DG)向糖原的转化及糖原检测
1. 组织糖原提取与放射性检测*:参照已有方法(Hans-Georg Joost,2012),取0.2-0.4克肝脏组织或0.5-1.0克肌肉组织,加入3毫升30%氢氧化钾(KOH)煮沸20分钟;取1毫升组织裂解液,加入2毫升100%乙醇,4°C孵育过夜(若组织量较少,可调整KOH用量)。随后以18,000×g离心30分钟,收集沉淀;将沉淀置于沸水中10分钟以蒸发残留乙醇,室温下用1毫升水重悬;加入2毫升100%乙醇,冰浴孵育2小时后,再次以18,000×g离心30分钟;重复上述“煮沸-重悬-乙醇沉淀-离心”步骤一次,最后用500微升水重悬沉淀,取500微升样本通过液体闪烁计数法测定放射性活度(dpm)。
2. 结果标准化:将测得的dpm值按组织重量标准化(dpm/毫克组织),参照上述组织葡萄糖摄取的计算方法,计算葡萄糖向糖原转化的Rg值。
3. 原代人肝细胞糖原检测:原代人肝细胞(Axol Biosciences公司)按制造商说明书解冻和培养:37°C解冻后,以每6孔板1×10⁶个细胞的密度接种,待细胞完全汇合后进行静磁电场暴露处理。先用磷酸盐缓冲液(PBS,Gibco公司)洗涤细胞两次,随后进行2小时血清和葡萄糖饥饿处理;饥饿结束后,将细胞置于糖原合成培养基(含低葡萄糖DMEM、10 nM胰岛素、10 nM地塞米松和2 mM L-谷氨酰胺)中,分为静磁电场处理组和对照组,培养6小时;最后收集细胞,使用糖原检测试剂盒(Cayman公司,编号700480)按说明书测定糖原生成量。
葡萄糖耐量试验(GTT)
小鼠禁食6小时后,通过尾静脉采血,使用血糖仪(Freestyle Lite)测定血糖;随后腹腔注射2克/千克体重的葡萄糖溶液,分别在注射后15、30、60、90和120分钟测定血糖。
血浆与血清分析
- 样本收集:通过尾静脉采集小鼠血液,室温放置30分钟以制备血清;或在冰上加入肝素或乙二胺四乙酸(EDTA,终浓度0.5 mM)以制备血浆。随后在4°C条件下,以400×g离心20分钟,分离血清或血浆。
- 胰岛素检测:小鼠禁食16小时后,采用胰岛素检测试剂盒(Crystal Chem公司)按说明书测定血浆胰岛素水平。
胰岛素抵抗稳态模型评估(HOMA-IR)
HOMA-IR指数计算公式为:空腹胰岛素(mU/L)×空腹血糖(nmol/L)/22.5。
F2-异前列腺素检测
由范德堡大学医学中心类花生酸核心实验室(Vanderbilt University Medical Center Eicosanoid Core Laboratory)采用气相色谱-质谱联用技术(GC-MS),参照已有方法(Milne等,2007)测定F2-异前列腺素水平。
体外活性氧(ROS)检测
Hepa1-6细胞(ATCC CRL-1830)培养于含10%胎牛血清(FBS,Gibco公司)的DMEM培养基中,培养条件为37°C、5% CO₂,以每12孔板3×10⁵个细胞的密度接种。
- 过氧化氢(H₂O₂)检测:使用辣根过氧化物酶偶联的Amplex Red荧光法检测试剂盒(Cayman公司),按说明书测定细胞稳态H₂O₂生成量。
- 超氧化物(O₂•⁻)检测:使用二氢乙锭(DHE)和线粒体超氧化物指示剂(MitoSOX,Thermo Fisher公司),通过酶标仪(Tecan公司)测定荧光强度,反映细胞内稳态O₂•⁻水平。
体内活性氧(ROS)检测
采用Carestream MS FX-Pro临床前成像系统(Carestream Health公司,美国纽约州罗切斯特市)进行体内活性氧检测。给小鼠腹腔注射二氢乙锭(DHE,5 mg/kg),共注射2次,间隔12小时。第2次注射二氢乙锭5小时后,对4只异氟烷麻醉的小鼠进行荧光成像。成像参数设置为:采集时间30秒,激发波长(ex)520 nm,发射波长(em)600 nm(配备相应滤光片),并与X射线图像叠加。随后对小鼠实施安乐死,收集肝脏、肾脏和心脏组织,立即采用与活体成像相同的参数对组织进行成像。使用ImageJ软件(Fiji版本)量化图像:测量每个器官的平均荧光强度,校正器官大小后,以背景荧光强度为参照进行标准化处理。
组织二氢乙锭(DHE)染色
将未处理的高脂饮食(HFD)小鼠和暴露于静磁-静电场(静磁电场)3天的高脂饮食小鼠肝脏组织,置于Tissue-Teck O.C.T.包埋剂中冷冻。将O.C.T.冷冻肝脏组织切成8 μm厚的切片,将1个对照组样本和1个静磁电场暴露组样本的切片放在同一张载玻片上。在共聚焦显微镜(奥林巴斯FLUOVIEW FV1000)观察前,用含10 μM二氢乙锭、5 mM丙酮酸的磷酸盐缓冲液(PBS)对组织切片染色10分钟。阳性对照样本在二氢乙锭染色期间,需同时加入10 μM抗霉素A处理。每个样本拍摄3张图像,使用ImageJ软件(Fiji版本)量化每张图像:测量300个细胞核的平均荧光强度,以背景荧光强度为参照进行标准化处理。
超氧化物歧化酶(SOD)模拟物处理
向小鼠腹腔注射GC4403(Galera Therapeutics公司)和TEMPOL(Sigma公司),剂量分别为10 mg/kg和150 mg/kg。每种药物均在静磁电场暴露开始前15分钟注射第1次,之后在3天静磁电场暴露期内,每天注射1次。
组织病理学检测
将组织置于4%多聚甲醛中固定至少24小时,随后进行石蜡包埋和切片(切片厚度7 μm),对切片进行苏木精-伊红(HE)染色。
透射电子显微镜检测
将小鼠组织置于卡尔诺夫斯基固定液(含2.5%戊二醛和2%多聚甲醛)中固定过夜,随后用二甲胂酸钠缓冲液固定,并进行轻度锇化处理(使用0.5%四氧化锇)。之后通过梯度乙醇脱水处理组织,将其包埋于树脂中并聚合48小时。制作超薄切片,在爱荷华大学中央显微镜核心设施的JEOL 1230透射电子显微镜下观察。使用ImageJ软件的“多区域测量(Multi Measure ROI)”工具,测量线粒体面积和线粒体数量。
超声心动图与血压检测
参照此前研究方法(Hill等,2000;Weiss等,2006),对C57BL/6J小鼠进行超声心动图检测。简要步骤如下:通过皮下注射0.15 mg咪达唑仑对小鼠进行镇静;为改善声学界面,剃除小鼠胸前毛发并涂抹导热凝胶;使用15 MHz线阵探头连接Sonos 5500R超声仪,以约200帧/秒(s⁻¹)的速度采集图像;获取胸骨旁长轴和短轴二维图像用于分析;通过脉冲波多普勒检测二尖瓣流入道血流,评估心率。
采用BP-2000系统(Visitech Systems公司),通过尾套法检测对照组和暴露于静磁电场 30天的高脂饮食小鼠血压。检测前,先让小鼠适应5天,再休息2天;最终报告的血压值为5天实验期内的平均测量值。
代谢舱检测
将小鼠适应代谢舱环境24小时后,置于环境可控的Promethion代谢舱或综合实验室动物监测系统(CLAMS)代谢舱中监测。每个代谢舱均配备间接测热仪,以及食物消耗、自主活动和气体交换监测装置,对动物进行连续72小时监测。
质粒与病毒构建
从人肝脏cDNA文库(Clontech 639307)中扩增人超氧化物歧化酶2(SOD2)cDNA,将其克隆到爱荷华大学病毒载体核心设施提供的pFBAAV-mcs-BgHpA载体中。随后,将白蛋白增强子与最小α1抗胰蛋白酶启动子融合,构建肝脏特异性嵌合启动子(Kramer等,2003)。由爱荷华大学病毒载体核心设施包装靶向肝脏的重组腺相关病毒(AAV2/8),该病毒携带绿色荧光蛋白(GFP)或SOD2基因。最终,GFP病毒滴度为5.1×10¹³病毒基因组拷贝/毫升(vg/mL),SOD2病毒滴度为4.2×10¹³ vg/mL。
胰岛素刺激与组织收集
对暴露于静磁电场 10天的正常饲料喂养(NCD)小鼠和高脂饮食小鼠,通过静脉注射胰岛素或溶媒(PBS)刺激15分钟后,检测胰岛素信号通路活性。简要步骤如下:对小鼠进行镇静,静脉注射胰岛素(剂量1 mU/g体重)或等量溶媒;循环15分钟后,对小鼠实施安乐死,收集肝脏、白色脂肪组织和腓肠肌骨骼肌,将组织迅速置于液氮中冷冻,随后储存在-80°C环境中,待后续提取蛋白质。
蛋白质提取与蛋白质印迹分析
将小鼠肝脏、白色脂肪组织和腓肠肌骨骼肌置于匀浆缓冲液中裂解。采用Bradford法(赛默飞世尔科技公司)测定蛋白质浓度,随后通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质。将分离后的蛋白质转移到硝酸纤维素膜(Licor公司)上,用含封闭缓冲液(Licor公司)的TBST溶液( Tris-缓冲盐水+吐温20)封闭10分钟。按照制造商说明,用Revert染色剂(Licor公司)处理膜,以量化总蛋白质水平。之后,将膜与一抗孵育过夜,再与荧光标记的二抗(Licor公司)在室温下孵育60分钟。
所用一抗及稀释比例如下:磷酸化AKT(S473)、磷酸化GSK3β(S9)和GSK3β(均购自Cell Signaling Technologies公司,稀释比例1:1000);AKT、SOD1、SOD2和过氧化氢酶(均购自ProteinTech公司,稀释比例1:1000)。使用Image Studio软件(Licor公司)量化荧光强度。
核蛋白提取与蛋白质印迹分析
参照Verma等(2013)的方法并稍作修改,从暴露于静磁电场 3天的高脂饮食小鼠肝脏中提取核蛋白组分。简要步骤如下:取约100 mg肝脏组织,置于500 μL低渗缓冲液(含10 mM HEPES(pH 7.9)、1.5 mM MgCl₂、10 mM KCl、0.2% NP40、1 mM EDTA、5%蔗糖、0.5 mM DTT、1×罗氏cOmplete蛋白酶抑制剂和1×西格玛奥德里奇PhosSTOP磷酸酶抑制剂)中匀浆;将肝脏匀浆轻轻铺在缓冲液垫(含10 mM Tris(pH 7.5)、15 mM NaCl、60 mM KCl、1 mM EDTA、10%蔗糖)上,在4°C条件下以5000转/分钟(rpm)离心10分钟;去除含胞质组分的上清液,用1 mL低渗缓冲液洗涤核沉淀,在4°C条件下以5000 rpm离心5分钟,去除胞质污染物;将核沉淀重悬于200 μL缓冲液(含50 mM Tris(pH 8.0)、1 mM EDTA、15%甘油、500 mM NaCl、1×蛋白酶抑制剂和1×磷酸酶抑制剂)中;将核溶液置于冰浴中短暂超声处理,随后在4°C条件下旋转孵育30分钟;每100 μL核溶液中加入25 U核酸酶(Benzonase,Millipore/Novagen公司),在4°C条件下孵育60分钟以去除基因组DNA污染物;在4°C条件下以7800 rpm离心10分钟,沉淀基因组DNA污染物;收集上清液,采用Bradford蛋白分析法测定蛋白质浓度。
所用一抗及稀释比例如下:NRF2(1:500,Proteintech公司)、组蛋白3(H3,1:2000,Abcam公司)。使用Image Studio软件(Licor公司)量化荧光强度。
氧化还原状态检测
高效液相色谱(HPLC)检测样本的制备和HPLC检测方法参照此前研究(Jones等,2000)。简要步骤如下:以γ-谷氨酰-谷氨酸(gamma-Glu-Glu)为内标,通过HPLC将半胱氨酸(Cys)、胱氨酸(CySS)、谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)衍生化为S-羧甲基-N-丹磺酰基衍生物后进行检测。通过内标量化确定各物质浓度;对于氧化还原状态检测,将浓度代入能斯特方程(Eo – RT/nF ln[还原型]²/[氧化型]),计算氧化还原对的半电池还原电位(Eh)。其中,Eo为氧化还原对的标准半电池还原电位,R为气体常数,T为绝对温度,n为转移电子数(此处n=2),F为法拉第常数。pH值按7.4估算,因此GSSG/2GSH的Eo=-264 mV,CySS/2Cys的Eo=-250 mV(Schafer和Buettner,2001)。
组织样本的氧化还原状态检测步骤:将样本收集到含10 μM γ-谷氨酰-谷氨酸的5%高氯酸中并匀浆;离心收集沉淀的蛋白质,上清液衍生化后进行HPLC检测。采用BCA法测定蛋白质浓度,并参照其他研究方法(Kirlin等,1999),通过蛋白质浓度估算细胞体积,进而量化GSH、GSSG、Cys和CySS的含量。
为量化蛋白质中对氧化还原敏感的翻译后修饰(即S-谷胱甘肽化和S-半胱氨酸化),需收集高氯酸(PCA)沉淀过程中得到的血浆/组织蛋白质:离心样本,收集蛋白质沉淀,用冰浴的高氯酸洗涤;随后将沉淀重悬于0.50 mL 0.1 M氢氧化钠溶液中,取0.25 mL转移至含0.25 mL 0.1 M磷酸盐缓冲液(pH 6.0,含5 mM二硫苏糖醇)的新离心管中,在室温下孵育30分钟;加入0.50 mL 10%高氯酸/硼酸溶液(含10 μM γ-谷氨酰-谷氨酸)使蛋白质再次沉淀;离心后,上清液衍生化并进行HPLC分析。结果以每毫克蛋白质中谷胱甘肽的纳摩尔数(nmol GSH/mg蛋白)和每毫克蛋白质中半胱氨酸的纳摩尔数(nmol Cys/mg蛋白)表示。
谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)氧化还原输注
在含0.1%牛血清白蛋白(BSA)的磷酸盐缓冲液(溶媒)中,制备具有特定GSH/GSSG半电池还原电位的GSSG+GSH输注液。调整GSSG和GSH的浓度,使GSH/GSSG氧化还原电位达到约-170 mV(更偏向还原性)或约-80 mV(更偏向氧化性)。对仅输注溶媒并接受正常血糖-高胰岛素钳夹试验的高脂饮食小鼠,通过颈静脉以3 μL/分钟的速度输注上述溶液。在钳夹试验成功建立后开始输注GSH/GSSG溶液,约60-70分钟后再次进行钳夹。通过钳夹试验第一阶段和第二阶段的葡萄糖输注率,评估不同GSH/GSSG半电池还原电位对胰岛素敏感性的影响。
酶活性检测
所有酶活性检测中,均将肝脏组织置于含1.34 mM DETAPAC(二乙烯三胺五乙酸)的50 mM磷酸钾缓冲液(pH 7.8)中匀浆。采用Lowry法测定蛋白质浓度。
- 超氧化物歧化酶(SOD)活性检测:参照此前研究(Spitz和Oberley,1989),采用Spitz-Oberley法,使用组织全匀浆检测SOD活性。
- 过氧化氢酶活性检测:参照此前研究(Aebi,1984),通过紫外光谱法检测。简要步骤:向样本中加入500 μL 30 mM H₂O₂储备液,在25°C条件下,用Beckman DU-600紫外-可见分光光度计(Beckman-Coulter公司)监测240 nm处吸光度的下降情况,通过拟合一级动力学方程计算酶活性。
- 谷胱甘肽还原酶活性检测:参照此前研究(Ray和Prescott,1975),通过监测还原型辅酶Ⅱ(NADPH)的消耗情况检测。简要步骤:将肝脏全匀浆加入含70 mM磷酸钾缓冲液(pH 7.6)、2.4 mM EDTA、0.1% BSA、94 μM NADPH和1 mM GSSG的溶液中,在25°C条件下,通过紫外-可见光谱法监测340 nm处吸光度的下降情况。
- 硫氧还蛋白还原酶活性检测:使用试剂盒(Sigma CS0170),按照制造商说明进行检测。
- 葡萄糖-6-磷酸脱氢酶活性检测:参照Glock-McLean法(Glock和McLean,1953)进行检测。简要步骤:将肝脏全匀浆加入含75 mM Tris(pH 8.0)、0.75 mM MgCl₂、1.5 mM NADP⁺和1.2 mM葡萄糖-6-磷酸(G6P)的溶液中,通过监测340 nm处NADPH的生成速率确定酶活性。为确保检测特异性,需额外检测匀浆在含1.2 mM 6-磷酸葡萄糖酸(有无G6P均可)条件下的活性。
量化与统计分析
统计信息
将小鼠随机分组,确保各组小鼠年龄和体重匹配。未通过功效分析确定样本量,样本量参考此前小鼠血糖相关研究的经验值。在以下研究中,实验人员对处理组信息设盲:正常血糖-高胰岛素钳夹试验、糖原分析、二氢乙锭(DHE)分析、透射电子显微镜(TEM)分析、组织病理学分析、超声心动图检测、血压检测、蛋白质检测、氧化还原状态检测和异前列腺素检测。
在进行后续统计分析前,先检验数据的正态性和方差齐性:
- 符合正态分布且方差齐的数据,采用双尾非配对Student’s t检验分析;
- 多次t检验通过Holm-Sidak法校正多重比较;
- 配对数据采用配对t检验分析;
- 三组及以上数据采用单因素或双因素方差分析(ANOVA),并通过Dunnett法或Tukey法进行事后检验。
上述统计分析均使用Prism 8(8.3.1版本)软件完成。重复测量数据采用混合效应模型分析(使用R软件包lme4,1.1.21版本)以纳入生物学重复,P值通过lmerTest软件包(3.1.0版本)计算。除非另有说明,数据均以“均数±标准误(mean ± SEM)”表示,并标注P值。
涉嫌挪用30万美元经费!“新星”学者称被大学毁掉了人生—新闻—科学网
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1498871.html?mobile=1
收藏

