博文
氢水缓解草莓盐胁迫的多组学研究【上交】
||
氢水缓解草莓盐胁迫的多组学研究【上交】富氢水缓解草莓盐胁迫:生理、转录组和代谢组响应 摘 要 气候变化影响加剧及人类活动强化,使土壤盐渍化问题愈发严重,对农业生产力构成重大挑战。因此,解决作物盐胁迫问题是关键研究领域。本研究以草莓幼苗(*Fragaria×ananassa* Duch. ‘Benihoppe’)为材料,通过整合转录组和代谢组分析,探究富氢水(HRW)对盐胁迫的缓解效应。结果表明,HRW处理显著促进植株生长,尤其使根系生物量增加49.50%。此外,HRW调控了可溶性糖、丙二醛(MDA)水平及抗氧化酶活性等关键参数,并促进K+吸收和Na+外排。转录组分析显示,HRW诱导了根系中与离子转运、抗氧化防御和细胞壁生物合成相关基因的表达。代谢组分析表明,酚酸、类黄酮和氨基酸是HRW介导盐胁迫缓解的关键代谢物。多组学整合分析强调,苯丙烷生物合成以及氨基酸和核苷糖代谢两条关键代谢通路,对所观察到的保护效应起决定性作用。本研究为HRW缓解草莓幼苗盐胁迫的机制提供了分子层面的见解,突显了氢气在可持续农业中的应用潜力。 本文作者来自上海交通大学氢科学中心周培教授团队。
1 引言 土壤盐渍化是全球紧迫的环境挑战,显著限制植物生长发育和农业生产力。土壤盐渍化的主要驱动因素包括气候变化、工业污染、过度灌溉和不当施肥(Fu & Yang, 2023)。令人担忧的是,每年约有1-2%的耕地因盐渍化问题变得不适宜耕作(Bomle et al., 2021)。当过量钠离子(Na+)渗入植物细胞时,会破坏细胞内水势,引发渗透胁迫。此外,Na+内流破坏钾钠(K/Na)离子平衡,加剧植物体内的氧化胁迫和离子胁迫(Das et al., 2023)。根系作为与盐渍环境直接接触的主要器官,在土壤、基质、水培和雾培等多种栽培系统中,对植物适应盐胁迫起关键作用。为维持生长并优化水分和养分吸收,根系必须有效适应周围介质的盐度(Ji et al., 2013; Wang et al., 2021b; Zheng et al., 2024)。因此,从根系适应角度研究植物耐盐性至关重要。此外,随着农业向盐渍土壤扩张以满足全球人口增长需求,理解和增强植物对盐胁迫的适应能力,已成为确保粮食安全的关键(Zulfiqar et al., 2022)。 硫化氢(H₂S)、一氧化氮(NO)、α-生育酚、褪黑素、海藻糖、抗坏血酸、壳聚糖和多胺等外源物质的施用,已显示出改善植物耐盐性的潜力(Akram et al., 2022; Marone et al., 2022; Menhas et al., 2022)。其中,氢气(H₂)因其绿色、无毒、无残留且符合可持续农业实践的独特优势而备受关注(Li et al., 2021a)。在农业中,氢气通常通过富氢水(HRW)施用,已证明其能增强植物对多种非生物胁迫的耐受性(Wang et al., 2024a; Zhao et al., 2021)。栽培草莓(*Fragaria × ananassa*, 8x)是具有重要经济价值的水果作物,以其丰富的营养价值和独特的风味著称(Mao et al., 2023; Song et al., 2024)。然而,草莓对盐胁迫尤为敏感,盐胁迫会导致水分失衡和电解质紊乱,进而造成生长受阻及产量和品质下降(Mohammad et al., 2023; Pourebrahimi et al., 2023; Sangiorgio et al., 2023)。因此,增强草莓的耐盐胁迫能力至关重要。 研究表明,HRW可调节参与抗氧化防御的基因和蛋白质,减轻植物中活性氧(ROS)积累和脂质过氧化(Wang et al., 2024a; Xie et al., 2012)。此外,它还能增强质膜和液泡膜中的ATP酶活性,有助于在盐渍条件下维持渗透平衡(Wang et al., 2024a; Xie et al., 2012)。HRW还与褪黑素等化合物相互作用,调节氧化还原状态和离子稳态,如在拟南芥研究中所证实(Su et al., 2021)。尽管氢气在植物胁迫缓解中的潜力已得到广泛认可,但其确切机制仍知之甚少,需要进一步深入研究。因此,从代谢组和转录组水平理解草莓在HRW处理下应对盐胁迫的复杂防御机制至关重要。转录组技术已彻底改变了胁迫响应基因的全面分析,而代谢组学是继基因组学、转录组学和蛋白质组学之后新兴的科学学科(Gan et al., 2021; Song et al., 2022)。代谢组学提供了环境刺激引发的整体代谢变化的见解,是连接植物基因组和表型组的关键纽带。整合这些方法可更详细地理解胁迫条件下功能基因的表达和代谢通路的调控(Lu et al., 2022; Mei et al., 2023; Wang et al., 2023)。因此,该方法将通过鉴定关键基因、代谢通路和代谢物,阐明植物胁迫适应的分子基础和调控机制。 在本研究中,我们假设HRW通过激活特定通路缓解草莓盐胁迫。通过聚焦草莓幼苗根系的转录组和代谢组分析,旨在揭示HRW增强耐盐性的机制。这一研究工作将推进我们对氢气诱导植物抗性的分子和调控框架的理解,并为将基于氢气的策略纳入草莓及其他作物的盐胁迫管理提供理论和技术基础。
2 材料与方法
2.1 富氢水的制备
使用氢气发生器(QL-300,赛克赛斯氢能源有限公司)通过电解产生纯氢气(99.99%, v/v),以320 mL min⁻1的速率向4000 mL去离子水中鼓泡2小时(h)。使用前确保所得HRW中的氢气浓度超过1.0 ppm。氢气浓度使用ENH-2000设备(TRUSTLEX)测量,并通过顶空气相色谱校准。2.2 植物材料与实验设计
草莓幼苗来源于组织培养,并在基质中预培养一周。将具有五片叶的幼苗转移至装有25 L无土基质的塑料盆(44×33×21 cm)中。实验包含两种处理:100 mM NaCl(Na)和100 mM NaCl + 100% 富氢水(Na_HRW)。每种处理设6个独立生物学重复,每盆种植4株幼苗,采用完全随机区组设计。为减轻盐胁迫,每48小时施用400 mL NaCl溶液,14天内累计施用2800 mL,使幼苗逐步适应。富氢水新鲜制备,每两天施用一次。处理21天后,采集植物样品并储存于-80°C。选择3个代表性重复(每个重复由4株幼苗混合组成)用于生理、生化和转录组分析。代谢组学分析使用全部6个重复。
2.3 生物量和叶绿素含量的测定
将幼苗分为根和地上部组织,用电子天平测量鲜重。叶绿素含量使用叶绿素检测试剂盒(南京建成生物工程研究所)测定。
2.4 可溶性糖、MDA和抗氧化酶活性的测定
将储存于液氮中的新鲜植物样品(0.2 g)在0.1 mol/L磷酸盐缓冲液(PBS)中研磨成匀浆。匀浆离心后收集上清液。丙二醛(MDA)含量采用硫代巴比妥酸反应法测定(Liu et al., 2024)。可溶性糖含量和抗氧化酶活性使用商业试剂盒(南京建成生物工程研究所)分析。
2.5 亚细胞离子含量的测定
通过差速离心法分离草莓根细胞的亚细胞组分(Wang et al., 2021a)。将冷冻根组织(1 g)在冰上的冷提取缓冲液(250 mM蔗糖、50 mM Tris-HCl、1 mM二硫苏糖醇)中匀浆。匀浆随后在3500 g下离心20分钟,沉淀为细胞壁组分(F1)。上清液进一步在12000 g下离心30分钟,沉淀为细胞器组分(F2),剩余上清液为细胞质组分(F3)。所有步骤在4°C下进行。将组分在70°C下干燥,用HNO3和HClO4(3:1, v/v)在120°C下消化,用超纯水稀释,并使用电感耦合等离子体发射光谱仪(ICP-OES, Optima 800, PerkinElmer)分析。
2.6 转录组分析
使用OminiPlant RNA试剂盒(DnaseI)(江苏科赢生物技术有限公司)提取总RNA。高质量RNA用于构建文库,并在Illumina NovaSeq X Plus平台上测序(Chen et al., 2022)。RNA质量通过Nanodrop 2000、琼脂糖凝胶电泳和Agilent 5300生物分析仪评估。构建文库时,RNA必须满足以下标准:总量至少1 μg,浓度≥30 ng/μL,RQN>6.5,OD260/280比值在1.8-2.2之间。文库制备和测序详见支持信息。使用fastp默认参数对原始双端读段进行修剪和质量控制。然后使用HISAT2以定向模式将清洁读段比对到参考基因组。使用StringTie以基于参考的方法组装每个样品的比对读段。表达定量使用RSEM,差异表达分析使用DESeq2。进行功能富集分析,包括基因本体论(GO)和京都基因与基因组百科全书(KEGG),以鉴定哪些差异表达基因(DEGs)在GO术语和代谢通路中显著富集。参考基因来源:*Fragaria x anassa*;参考基因组版本:WSU;参考基因组来源。转录组数据已上传至NCBI(PRJNA1166142)。
2.7 qRT-PCR验证分析
选择18个候选DEGs(9个上调和9个下调)进行qRT-PCR验证,使用*Fragaria x anassa*肌动蛋白(FaACTIN)作为标准化基因(Lei et al., 2022)。引物设计基于Primer Premier 5.0软件。详细方法见支持信息。使用逆转录试剂盒(TaKaRa生物技术大连有限公司)进行逆转录。使用ABI 7500实时PCR系统进行扩增,条件如下:95°C初始变性5分钟,随后45个循环:95°C 15秒,60°C退火/延伸30秒。相对基因表达使用2-△△Ct法计算。特异性引物列于表S3。
2.8 非靶向代谢组学分析
将新鲜样品(50 mg)在400 μL甲醇:水(4:1, v/v)中匀浆,加入0.02 mg/mL L-2-氯丙氨酸作为内标。样品在-10°C和50 Hz下用冷冻珠研磨6分钟,然后在5°C和40 kHz下超声提取30分钟。随后,混合物在-20°C下静置30分钟,在4°C和13000 g下离心15分钟,将上清液转移至带内管的进样瓶中进行分析。作为系统调节和质量控制过程的一部分,通过混合所有样品的等体积制备混合质量控制样品(QC)。QC样品的处理和测试方式与分析样品相同,代表整个样品集。这些QC样品按固定间隔(每5-15个样品)进样,以监测分析的稳定性(Wang et al., 2022)。样品在上海美吉生物医药科技有限公司使用Thermo UHPLC-Q Exactive系统进行LC-MS分析。对于LC-MS/MS分析,样品LC-MS/MS分析的流动相A由水和乙腈(95:5, v/v)组成,并加入0.1%甲酸(47.5:47.5:5, v/v)。流速设定为0.40 mL/min,柱温维持在40°C。质谱数据也使用配备电喷雾电离(ESI)源的Thermo UHPLC-Q Exactive质谱仪采集,可在正负模式下运行。最佳条件为:源温度425°C,鞘气流量50任意单位,辅助气流量13任意单位,负离子模式的离子喷雾电压为-3500 V,正离子模式为3500 V。MS/MS分析的归一化碰撞能量设定为20-40-60 V的滚动值。全MS分辨率设定为60000,MS/MS分辨率设定为7500,数据采集采用数据依赖采集(DDA)模式。检测覆盖质荷比(m/z)范围为70-1050。数据通过美吉云平台(https://cloud.majorbio.com)上的免费在线工具进行分析。数据预处理后,对矩阵文件进行方差分析。然后,基于LipidMaps、Metlin、人类代谢组数据库、植物代谢网络和上海美吉生物医药科技有限公司自建的标准数据库,对代谢物进行注释和鉴定(表S5)。两组间的差异代谢物通过基于KEGG数据库的代谢富集和通路分析映射到其生化通路。原始数据已上传至MetaboLights。
2.9 统计分析
所有统计分析使用IBM SPSS Statistics 21.0软件(IBM, Armonk)进行。使用Student's t检验进行统计分析,显著性水平设为p<0.05。
3 结果与讨论
3.1 HRW对盐胁迫下草莓幼苗生长响应的影响
HRW对草莓幼苗生长的有益影响显著体现在植物鲜重和叶绿素含量的改善上。光合作用作为植物生长发育的基础,对盐胁迫高度敏感。了解光合作用对盐胁迫的响应是阐明植物适应机制和增强耐盐性的关键(Tobiasz-Salach et al., 2023; Weng et al., 2023)。叶绿素作为光合作用中捕获光能和能量转换的关键色素,是光合能力的直接指标。叶绿素含量升高与光合效率增强相关(Cao et al., 2024; Helaoui et al., 2023)。HRW处理显著促进了草莓幼苗的生长,地上部和根鲜重分别增加11.48%和49.50%(图1a)。叶绿素a和b水平分别增加25%和19.05%(图1b),反映出在盐渍条件下光合能力和生理适应性的改善。盐胁迫诱导氧化损伤,通常通过MDA等脂质过氧化标志物评估,而可溶性糖在渗透调节中起关键作用(Chen et al., 2022; Lu et al., 2023b)。本研究中,HRW显著降低了MDA和可溶性糖含量(图1c),表明氧化胁迫减轻。此外,HRW增强了超氧化物歧化酶(SOD)和过氧化物酶(POD)等抗氧化酶的活性,而过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性未观察到显著变化。抗氧化防御系统的这些改善似乎是减轻盐诱导损伤的关键,与先前研究结果一致(Zahedi et al., 2020)。总体而言,HRW通过提高光合效率、渗透调节和抗氧化防御能力,显著改善了草莓幼苗的耐盐性,为盐胁迫管理提供了一种有前景的方法。
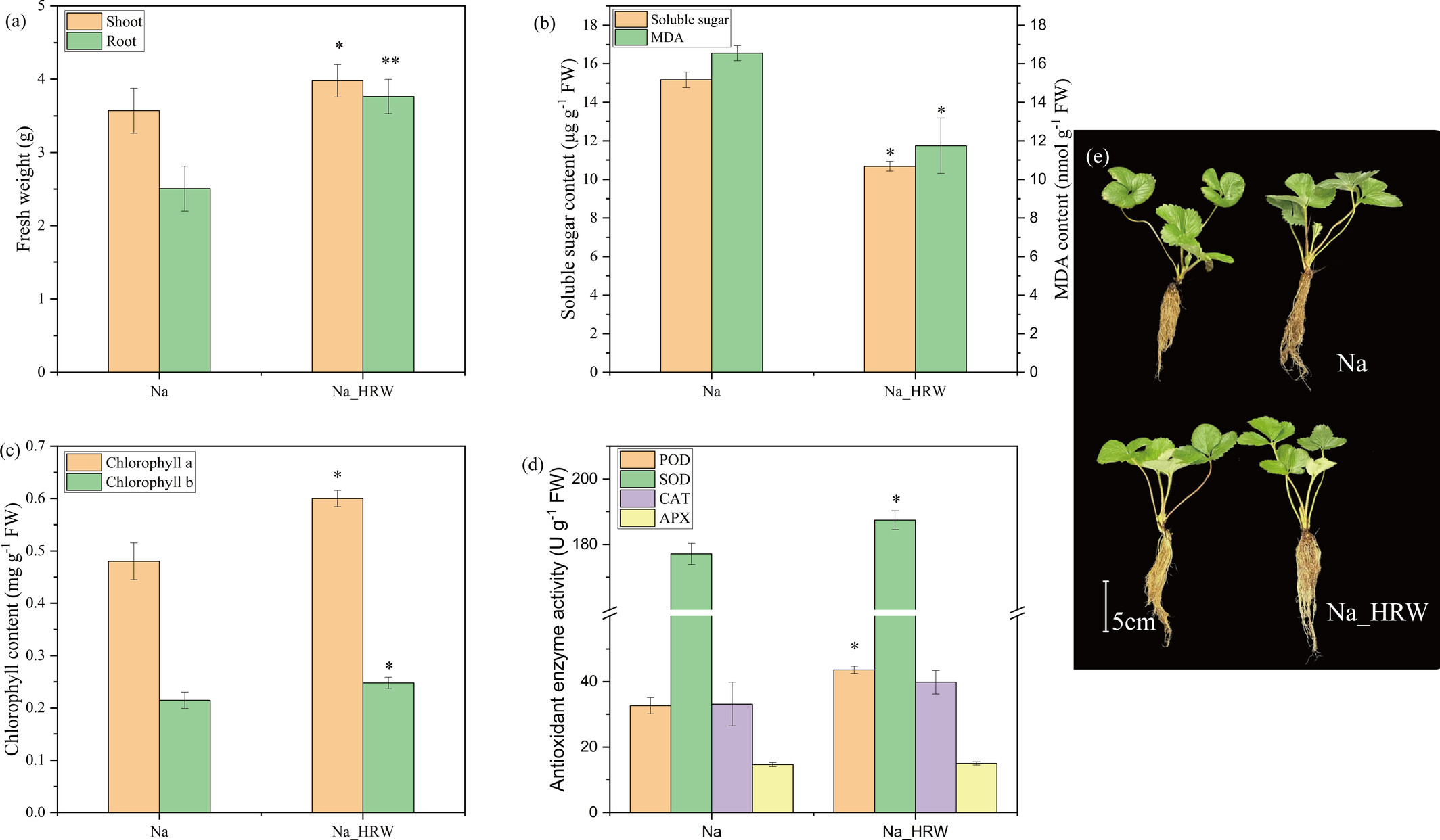 图1 富氢水对盐胁迫下草莓幼苗生物量(a)、叶绿素含量(b)、氧化胁迫(c)、抗氧化酶活性(d)及形态差异(e)的影响。竖线表示三次重复的标准差。对于同一参数,柱形上方的*表示在p<0.05水平上存在显著差异。Na表示100 mM NaCl处理组,Na_HRW表示100 mM NaCl+1.0 ppm富氢水处理组。MDA:丙二醛,POD:过氧化物酶,SOD:超氧化物歧化酶,CAT:过氧化氢酶,APX:抗坏血酸过氧化物酶。 3.2 富氢水对离子亚细胞分布的影响 如图2所示,富氢水处理显著提高了F1和F2组分中的K+水平,分别增加40.62%和43.27%,F3中也小幅上升0.27 mg/g。类似地,F2中的Ca2+和Mg2+水平分别显著增加2.06倍和2.45倍。相反,三个组分中的Na+水平分别显著降低7.93%、16.79%和19.49%。盐胁迫通过增加Na+破坏离子平衡,由于Na+与K+的离子半径相似,二者会竞争结合位点,损害质外体钾通道功能并破坏细胞壁和细胞膜的稳定性(Hussain et al., 2021; Yamaguchi et al., 2013)。维持最佳K+/Na+比值是耐盐性的关键(Yan et al., 2024)。富氢水处理下观察到的Na+减少和K+增加表明离子平衡得以恢复,这是缓解盐胁迫的关键因素(Wu et al., 2021)。通过重塑K+/Na+平衡,富氢水可能改善根细胞功能和结构完整性,突显其在盐渍条件下缓解离子胁迫的作用。
图1 富氢水对盐胁迫下草莓幼苗生物量(a)、叶绿素含量(b)、氧化胁迫(c)、抗氧化酶活性(d)及形态差异(e)的影响。竖线表示三次重复的标准差。对于同一参数,柱形上方的*表示在p<0.05水平上存在显著差异。Na表示100 mM NaCl处理组,Na_HRW表示100 mM NaCl+1.0 ppm富氢水处理组。MDA:丙二醛,POD:过氧化物酶,SOD:超氧化物歧化酶,CAT:过氧化氢酶,APX:抗坏血酸过氧化物酶。 3.2 富氢水对离子亚细胞分布的影响 如图2所示,富氢水处理显著提高了F1和F2组分中的K+水平,分别增加40.62%和43.27%,F3中也小幅上升0.27 mg/g。类似地,F2中的Ca2+和Mg2+水平分别显著增加2.06倍和2.45倍。相反,三个组分中的Na+水平分别显著降低7.93%、16.79%和19.49%。盐胁迫通过增加Na+破坏离子平衡,由于Na+与K+的离子半径相似,二者会竞争结合位点,损害质外体钾通道功能并破坏细胞壁和细胞膜的稳定性(Hussain et al., 2021; Yamaguchi et al., 2013)。维持最佳K+/Na+比值是耐盐性的关键(Yan et al., 2024)。富氢水处理下观察到的Na+减少和K+增加表明离子平衡得以恢复,这是缓解盐胁迫的关键因素(Wu et al., 2021)。通过重塑K+/Na+平衡,富氢水可能改善根细胞功能和结构完整性,突显其在盐渍条件下缓解离子胁迫的作用。
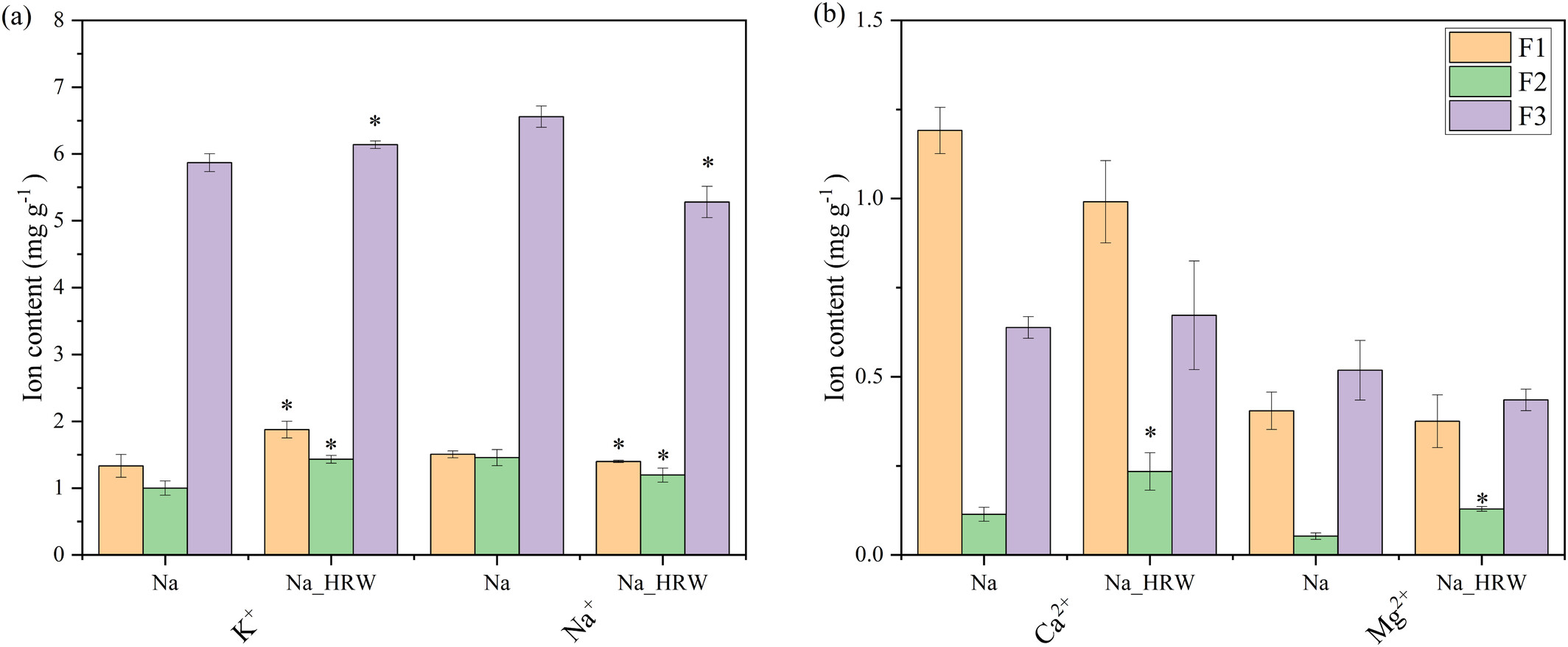
图2 离子的亚细胞分布。Na表示100 mM NaCl处理组,Na_HRW表示100 mM NaCl+1.0 ppm富氢水处理组。亚细胞组分分为细胞壁组分(F1)、细胞器组分(F2)和细胞液(F3)。 3.3 转录组测序分析 3.3.1 转录组测序质量分析 转录组测序结果显示可靠性高,Q20和Q30值分别超过98%和94%(表S1)。唯一比对读段和总读段占比超过75%(表S2)。相关性热图显示所有处理的相关系数超过0.99(图S1),主成分分析(PCA)表明处理间表达差异显著(图S2)。此外,以|Fold Change|≥2且校正p<0.05为标准进行两两比较,以鉴定组间差异表达基因(DEGs)(图3a)。与NaCl处理相比,富氢水处理在草莓根中产生4868个DEGs,包括2013个上调基因和2855个下调基因。对18个选定基因进行qRT-PCR验证,Pearson相关指数为0.872(如图S11所示),证实了转录组数据的可靠性。
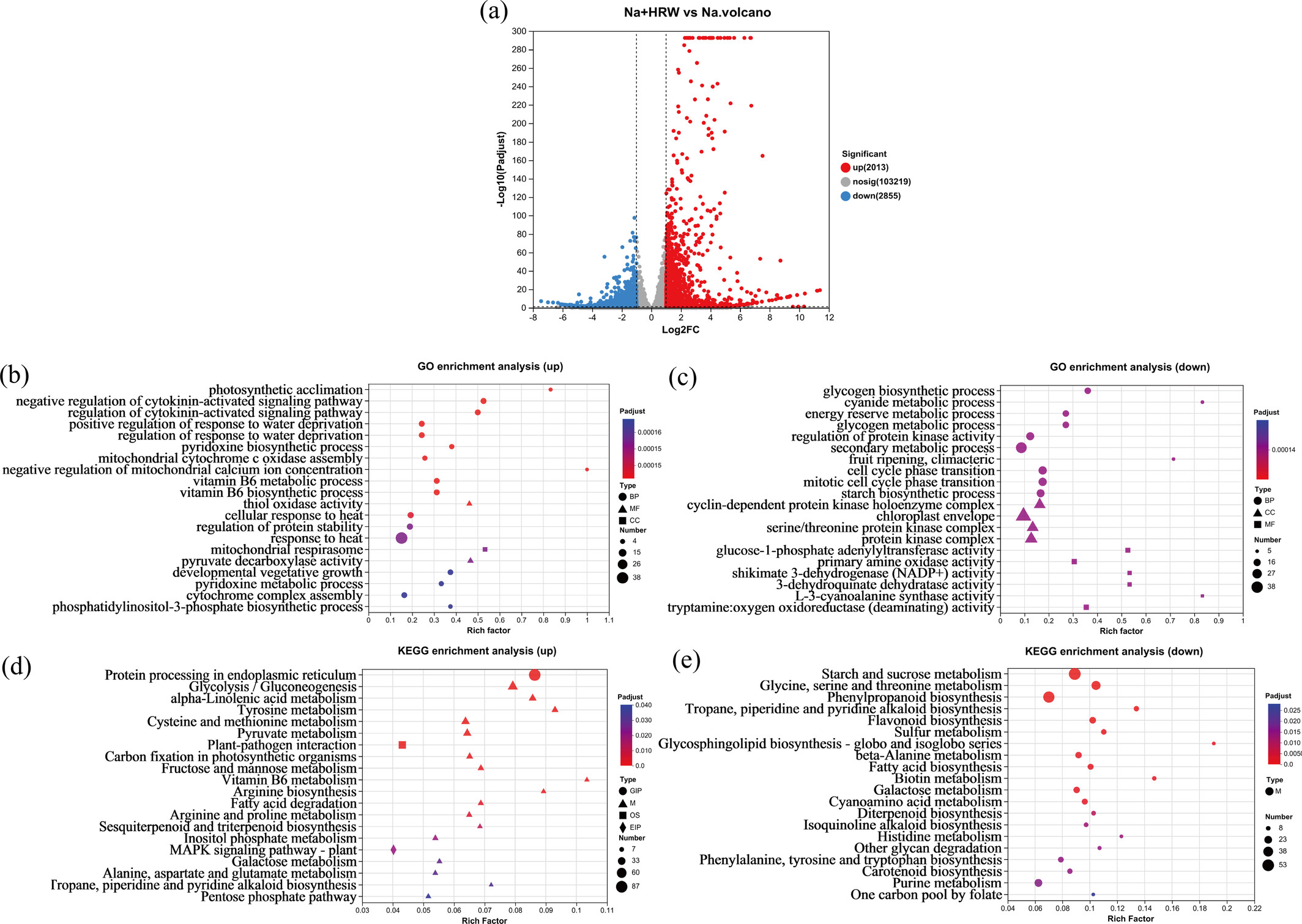
图3 不同处理的转录组分析。DEGs火山图(a);上调DEGs的GO富集分析(b);下调DEGs的GO富集分析(c);上调DEGs的KEGG富集分析(d);下调DEGs的KEGG富集分析(f)。Na表示100 mM NaCl处理组,Na_HRW表示100 mM NaCl+1.0 ppm富氢水处理组。BP:生物学过程,MF:分子功能,CC:细胞组分,GIP:遗传信息处理,M:代谢,OS:生物系统,EIP:环境信息处理。 3.3.2 DEGs的GO富集分析 GO分析基于分子功能(MF)、生物学过程(BP)和细胞组分(CC)对DEGs进行分类。图3b显示,上调DEGs中前20个显著富集的GO术语包括最显著富集的BP术语“光合适应”(GO:0009643)、“细胞分裂素激活信号通路的调控”(GO:0080037)和“对缺水响应的调控”(GO:0080036, GO:2000070)。MF术语为“硫醇氧化酶活性”(GO:0016972),CC术语为“线粒体呼吸体”(GO:0005746)。盐胁迫下光适应对植物的影响包括叶片解剖结构、生化代谢、叶绿素和类胡萝卜素水平、矿物质浓度及整体植物生物量的改变(Zhang et al., 2020)。这些调整使植物能够适应盐胁迫环境,同时维持最佳生长和光合效率。光合适应的激活可能有助于草莓幼苗生物量和光合作用的增加。此外,细胞质激素(如细胞分裂素)可能在植物生长和胁迫响应中发挥作用(Zhao et al., 2023)。与我们的发现一致(图1c),富氢水改善了草莓幼苗的叶绿素含量。盐离子的积累众所周知会导致植物脱水,而植物中水分和溶质相容性的增加可能有助于维持细胞膨压,支持基本生命过程,并减轻水分流失引发的生长抑制(Sanchez et al., 2012)。与我们之前的结果一致,富氢水已被证明能提高盐胁迫下草莓幼苗的相对含水量(Wang et al., 2024b)。对缺水响应的调控激活可能对这些幼苗盐胁迫的缓解产生积极影响。在下调DEGs中(图3c),BP术语为“糖原生物合成过程”(GO:0005978),CC术语为“细胞周期蛋白依赖性蛋白激酶全酶复合物”(GO:0000307)和“叶绿体被膜”(GO:0009941),MF术语为“葡萄糖-1-磷酸腺苷酰转移酶活性”(GO:0008878)和“伯胺氧化酶活性”(GO:0008131)。这些结果表明,富氢水可能在盐胁迫下调节草莓根的能量消耗并维持细胞功能平衡,最终减少可能对细胞完整性产生不利影响的氧化产物生成(Greene et al., 1996; Kim et al., 2019; Zhao et al., 2024)。该途径可能使富氢水处理能够防止过度氧化并缓解氧化胁迫。总之,这些发现表明草莓幼苗的基因表达对富氢水反应敏感。富氢水刺激草莓中与光合适应、细胞分裂素激活信号通路调控和缺水响应等重要生物学功能相关的基因,从而增强草莓幼苗的耐受性。 3.3.3 DEGs的KEGG通路富集分析 为深入了解富氢水对草莓幼苗生物学过程的影响,我们还对DEGs进行了KEGG注释。如图3d所示,上调DEGs中前20个显著富集的KEGG通路包括“内质网中的蛋白质加工”(map04141)、代谢过程如“糖酵解/糖异生”(map00010)、生物系统如“植物-病原体相互作用”(map04626)和环境信息处理如“植物MAPK信号通路”(map04016)。 内质网(ER)对维持细胞稳态至关重要,参与分泌蛋白和跨膜蛋白的折叠及初始修饰等多个过程(Chen et al., 2020)。当植物暴露于盐胁迫时,会诱导内质网应激,涉及蛋白质折叠、蛋白质修饰、信号转导和内质网相关降解等过程(Kim et al., 2019)。大多数与蛋白质加工通路相关的基因属于热休克蛋白(HSPs)家族。HSPs被认为在蛋白质加工中至关重要,并通过防止蛋白质聚集和错误折叠为非生物胁迫提供保护功能。HSPs也与耐盐性密切相关(Cao et al., 2022; Wang et al., 2004)。本研究中观察到的内质网中蛋白质加工通路的激活可能在增强植物对盐胁迫的抗性中起关键作用。此外,富氢水的应用激活了糖酵解/糖异生通路,这对能量产生至关重要。在芝麻的耐盐基因型中,与这些通路相关的DEGs呈富集趋势(Zhang et al., 2019)。糖酵解/糖异生在干旱胁迫下显著上调,促进根中通过糖酵解产生三磷酸腺苷(ATP),从而帮助植物应对不利环境条件(An et al., 2016)。糖酵解和糖异生通路对能量产生和碳源供应至关重要,因为它们分解和转化葡萄糖以生成ATP和其他能量分子,同时为细胞代谢提供碳骨架(Zhao et al., 2020)。通过上调参与这些通路的基因表达,植物可以增强能量产生和碳代谢,满足细胞的能量和碳需求,并在盐胁迫下促进生长(图1a)。此外,糖酵解/糖异生通路与胁迫信号转导和抗氧化反应相关,可能在植物对盐胁迫的响应和适应中发挥作用(Das et al., 2020; Zeng et al., 2019; Zhang et al., 2021a)。这种调控机制可能有助于维持细胞生理平衡并增强对盐胁迫的适应性。此外,植物-病原体相互作用通路在富氢水介导的盐胁迫缓解中也起关键作用。研究表明,激活该通路可增强植物耐盐性(Fan et al., 2016; Peng et al., 2023; Zhang et al., 2021b)。此外,丝裂原活化蛋白激酶(MAPKs)在真核生物中传递有丝分裂原、激素和各种胁迫等外部信号方面发挥关键作用,这可能有助于减轻植物盐胁迫(Khan et al., 2023; Parihar et al., 2015; Xiong et al., 2020)。 如图3d所示,下调DEGs中前20个显著富集的KEGG通路均与代谢过程相关,最显著富集的通路包括“淀粉和蔗糖代谢”(map00500)、“甘氨酸、丝氨酸和苏氨酸代谢”(map00260)和“苯丙烷生物合成”(map00260)。富氢水有可能通过激活这些特定通路来提高植物生长发育的能量水平,增强抗氧化和保护机制,微调次生代谢物生成,并促进对盐胁迫的适应。总之,这些关键DEGs突显了富氢水缓解草莓幼苗盐胁迫的潜在分子机制。
3.3.4 关键差异表达基因的筛选
对差异表达基因(DEGs)的生物信息学分析显示,富氢水(HRW)诱导了根组织内复杂调控网络通路的显著变化。鉴定出的DEGs涉及离子调控、抗氧化酶和细胞壁合成(表S4)。具体而言,共筛选出9个与钠离子吸收和转运相关的基因,其中2个上调、7个下调;此外,鉴定出11个与Na+吸收和转运相关的基因,8个上调、3个下调;还筛选出13个与Ca2+相关的基因,9个上调、4个下调,以及1个与Mg2+相关的上调基因。本研究中,鉴定出10个与抗氧化酶系统相关的基因,包括5个过氧化物酶(POD)相关基因(2个上调、3个下调)、3个超氧化物歧化酶(SOD)相关下调基因、1个过氧化氢酶(CAT)上调基因和1个抗坏血酸过氧化物酶(APX)下调基因。共鉴定出41个与细胞壁响应盐胁迫相关的基因,20个上调、21个下调。 平衡K+/Na+比值是植物抵御盐胁迫的有效策略,但高浓度Na+会限制K+的吸收。HKT在维持番茄K+/Na+稳态和耐盐性中起关键作用(Li et al., 2021b)。AKT1和NHX2质膜转运蛋白在植物K+的吸收和转运中发挥重要作用(Nieves-Cordones et al., 2014; Pinedo et al., 2015)。本研究中,上调基因包括2个NHX2和2个AKT1,还鉴定出3个TPK1和2个TPK5。类似地,筛选出2个钙调磷酸酶B类似蛋白(CBL)和3个Ca2+吸收蛋白,均为上调基因。Ca2+信号通过促进Na+外排或区室化,在缓解离子胁迫中起关键作用,Ca2+的吸收对植物缓解Na+离子胁迫也有积极影响(Mehra & Bennett, 2022)。我们观察到,富氢水处理导致盐胁迫下草莓幼苗根细胞组分中K+/Na+平衡的变化,以及F2组分中Ca2+和Mg2+的显著变化(图2)。因此推测,富氢水通过调控离子吸收和转运相关基因,调节草莓幼苗根中因Na+积累导致的离子失衡。 在胁迫条件下,植物组织易积累过量活性氧(ROS),而植物可通过激活抗氧化酶系统有效清除过量ROS,避免氧化损伤(Chen et al., 2022)。研究发现,盐胁迫导致抗氧化酶活性下降,而使用富氢水可提高SOD、POD、CAT和APX的活性(Wu et al., 2020)。本研究中抗氧化酶相关基因和抗氧化酶活性的变化也表明,富氢水通过增强抗氧化酶活性来缓解草莓幼苗的盐胁迫(图1d)。 细胞壁提供机械支撑和稳定性,使细胞能够抵抗外部压力和变形,这对盐胁迫环境下维持细胞形态和结构的完整性至关重要(Zhao et al., 2018)。同时,盐胁迫下细胞壁会发生一系列变化,包括细胞壁结构和成分的调整。盐胁迫时,植物可能增加纤维素和果胶等细胞壁成分的含量,从而增强细胞壁的机械强度和抗张能力,有助于维持细胞完整性(Lu et al., 2023a; Rui & Dinneny, 2020)。植物细胞壁是高度响应且动态的结构,在植物生长及生物和非生物胁迫下会发生重塑,以实现对各种条件的适应性调控。植物对盐胁迫的耐受性可能与次生细胞壁的形成以及纤维素和木质素的沉积模式密切相关(Le Gall et al., 2015; Oliveira et al., 2020)。本研究中,上调基因主要包括编码蔗糖合成酶、果胶甲酯酶、葡萄糖酸脱氢酶和扩张蛋白的基因。植物细胞壁扩张蛋白在细胞壁松弛和膨胀中起重要作用,被广泛认为是细胞壁延展性响应胁迫和植物生长的关键调控因子(Lu et al., 2013; Yang et al., 2023b)。富氢水显著改变了与草莓幼苗细胞壁生物合成和代谢相关的基因表达,增强了细胞壁的稳定性和结构,从而提高了耐盐性。需进一步研究确认富氢水对细胞壁稳定性的影响。
3.4 代谢组学分析
3.4.1 代谢组学数据的质量控制
本研究利用非靶向代谢组学技术(LC-MS)探索响应盐胁迫的各种植物代谢物,旨在深入了解富氢水如何影响盐胁迫条件下草莓幼苗根的响应机制。质量控制(QC)样品在图S3中良好聚类,表明本研究使用的LC-MS设备稳定。同时,在正负离子模式下,相对标准偏差(RSD)<30%,峰累积率超过90%,这些结果表明数据可靠。正交偏最小二乘判别分析(OPLS-DA)显示,Na组和Na_HRW组明显分离,表明富氢水改变了草莓根的代谢物谱(图S4)。本研究共鉴定出601种代谢物,其中在变量重要性预测值(VIP)>1且p<0.05的条件下,筛选出135种差异代谢物(DEMs)(图4a)。与Na处理相比,富氢水处理中有48种代谢物上调、87种下调。在135种DEMs中,包括33种类黄酮(24.44%)、11种碳水化合物(8.15%)、12种甘油磷脂(8.89%)和6种氨基酸(4.44%)(图S5)。
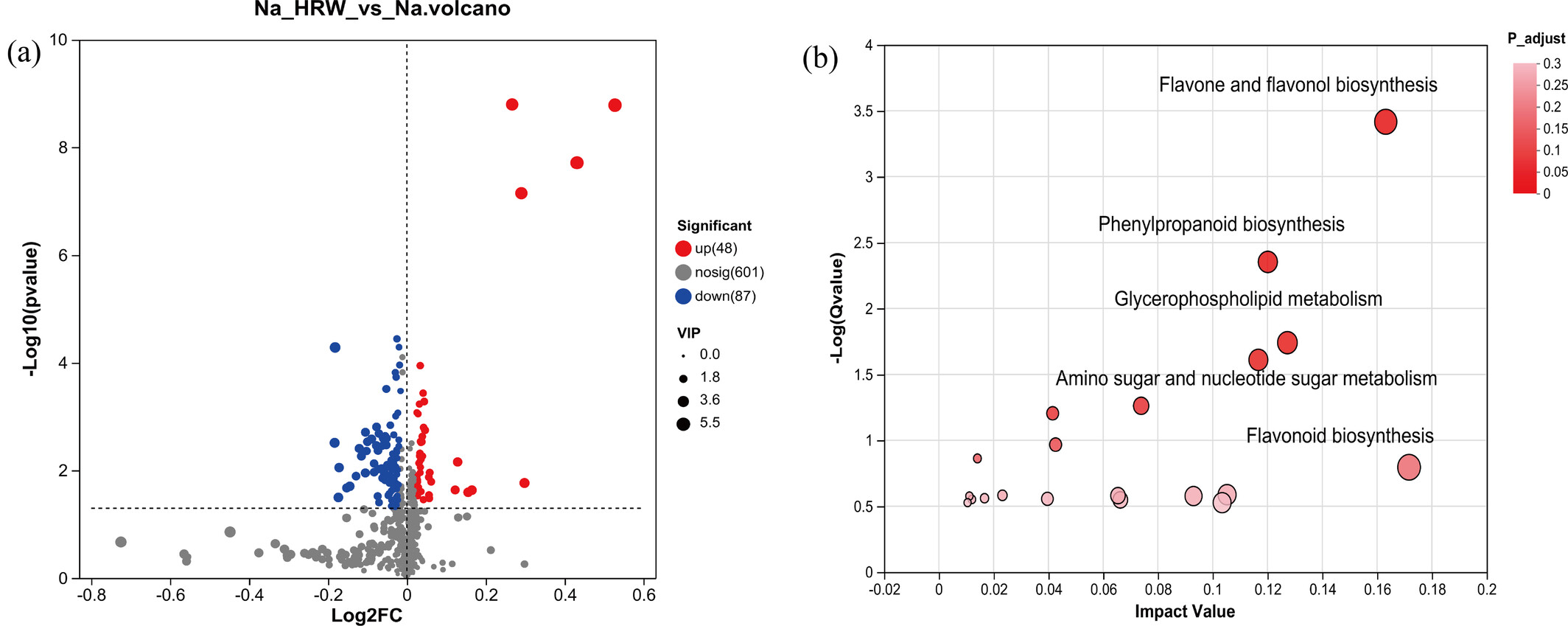
图4
差异代谢物火山图(a);KEGG拓扑分析(b)。Na表示100 mM NaCl处理组,Na_HRW表示100 mM NaCl+1.0 ppm富氢水处理组。VIP:变量重要性投影值。
3.4.2 差异代谢物的关键通路分析
KEGG完善了整合代谢通路的查询功能。因此,本研究通过拓扑分析和代谢通路,对KEGG中富集的代谢通路进行分析,以探究富氢水在盐胁迫下调控草莓的关键代谢过程。如图4b所示,以p<0.05为筛选标准并按影响值排名前5,从36条代谢通路中鉴定出5条显著富集的代谢通路,分别为“类黄酮和黄酮醇生物合成”“苯丙烷生物合成”“氨基糖和核苷酸糖代谢”“甘油磷脂代谢”以及“丙氨酸、天冬氨酸和谷氨酸代谢”(图4b)。其中,17种差异代谢物富集于这5条关键代谢通路,显著上调的差异代谢物包括苯丙烷类(阿魏酸、对香豆醇、莨菪亭)、类黄酮(黄芪甲苷、异槲皮苷)和氨基酸(L-丙氨酸)。
3.4.3 关键通路中差异代谢物的分析
如图5a所示,阿魏酸、对香豆醇和莨菪亭的丰度显著增加。阿魏酸作为植物细胞壁成分中的羟基肉桂酸衍生物,具有多种生物学功能,可中和过量活性氧(ROS)、直接清除自由基并抑制产生自由基的酶(Zdunska et al., 2018)。不同程度的盐胁迫显著诱导水稻中阿魏酸的积累,同时减少ROS和丙二醛(MDA)的积累(Gupta & De, 2017)。我们的结果表明,在盐胁迫下,富氢水促进阿魏酸的相对丰度并降低MDA水平,该化合物已在多种胁迫研究中被证实具有广泛应用。外源阿魏酸预处理通过提高黄瓜叶片中脯氨酸和可溶性蛋白含量,增强黄瓜对干旱胁迫的抗性,从而减少脂质过氧化(Li et al., 2013)。然而,5-羟基阿魏酸的丰度显著降低(图S6b),可能是由于富氢水促进了与阿魏酸合成相关酶的活性,同时抑制了将阿魏酸转化为5-羟基阿魏酸的酶活性,最终导致其丰度降低。对香豆醇是木质素合成的关键中间体,通过多步酶促反应转化为木质素,影响木质素的合成和含量。在豌豆芽中,对香豆醇已被证明可调节木质素合成,可能影响生长和抗逆性(Lin et al., 2023),其也被认为是一种抗氧化化合物(Ly et al., 2003)。本研究中,其可能对提高草莓幼苗的抗氧化能力产生积极影响。莨菪亭属于香豆素类化合物,参与清除活性氧和抵御病原体,渗透胁迫可诱导根中莨菪亭的积累(Beesley et al., 2023; Doell et al., 2018)。在柠檬叶片切片中,莨菪亭已被发现可对抗铜毒性和低pH环境(Zhang et al., 2022)。类似地,莨菪亭的减少可能影响植物对病原体感染的防御,从而削弱其抗性(Siwinska et al., 2014)。富氢水诱导的莨菪亭相对丰度增加可增强草莓幼苗的盐胁迫耐受性。 类黄酮和黄酮醇生物合成是植物中最大且最多样化的次生代谢物群体之一。已知类黄酮作为强效抗氧化剂,可中和自由基并减少氧化胁迫损伤,稳定细胞内氧化还原平衡,调节生长素合成和响应,并控制根生长等重要生理过程(Brunetti et al., 2013; Taylor & Grotewold, 2005)。在非生物胁迫下,类黄酮化合物通过清除ROS发挥抗氧化作用,从而防止细胞功能损伤并增强植物耐受性(Izbianska et al., 2014; Jayaraman et al., 2021)。本研究中,富氢水处理后异槲皮苷和黄芪甲苷的丰度显著增加(图5b),而芹菜素7-O-葡萄糖苷和 scolymoside的丰度显著降低(图S6a)。槲皮素作为类黄酮的一个亚类,参与多种植物生理过程,包括种子萌发、抗氧化机制和光合作用,可促进植物生长发育,并对多种生物和非生物胁迫提供有效耐受性(Singh et al., 2021)。然而,已发现异槲皮苷在超氧阴离子清除试验中比槲皮素具有更高的活性水平,使其作为细胞保护剂更为有效(Li et al., 2016)。糖基化是一个重要的修饰过程,在植物生长和胁迫响应中起关键作用。黄芪甲苷作为黄酮醇的糖基化产物,被认为对提高植物抗性具有积极作用(Yang et al., 2023a)。结果表明,富氢水调控苯丙烷生物合成以及类黄酮和黄酮醇的生物合成,导致抗氧化物质的丰度显著增加。这种抗氧化能力的增强有效减少了盐胁迫引起的氧化损伤,从而提高了草莓幼苗的耐盐性。
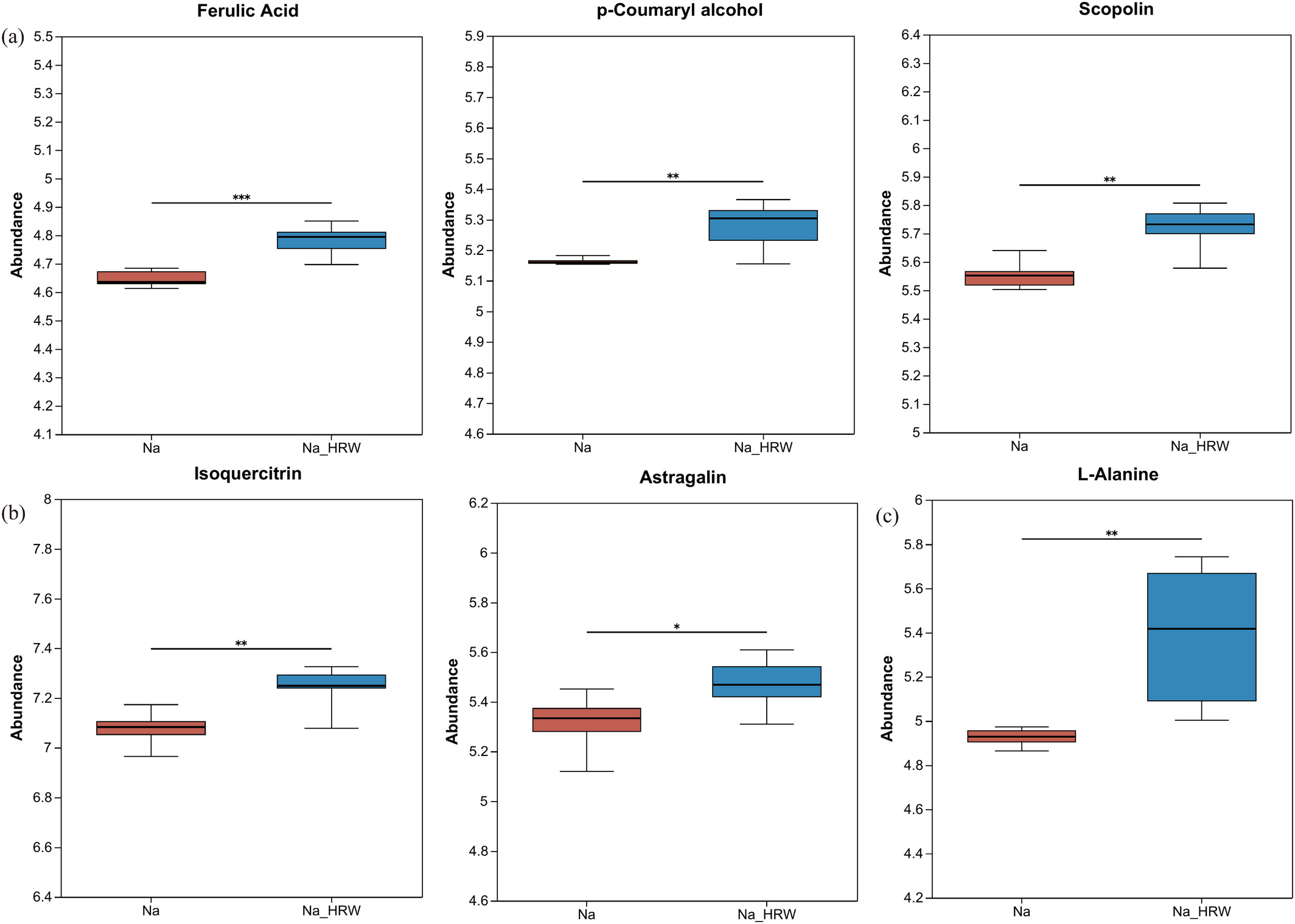
图5
6种已鉴定差异代谢物中显著上调的苯丙烷类(a)、类黄酮(b)和氨基酸(c)。*表示p<0.05,**表示p<0.01,***表示p<0.001。Na表示100 mM NaCl处理组,Na_HRW表示100 mM NaCl+1.0 ppm富氢水处理组。 丙氨酸、天冬氨酸和谷氨酸的代谢通路在调节和保护植物氮代谢平衡、光合作用及抗氧化反应中发挥关键作用。如图所示,L-丙氨酸显著增加(图5c),而L-天冬酰胺显著减少(图S6c)。研究表明,L-天冬酰胺无法有效减轻盐胁迫对水稻幼苗生长的抑制作用(Lin & Kao, 1995),这表明在盐胁迫下L-天冬酰胺对植物的影响较小。相比之下,L-丙氨酸是最小的手性化合物之一,广泛应用于食品、医药和兽医学等领域。L-丙氨酸可促进叶绿素合成、调节气孔开放并增强对病原体的抗性(Wu et al., 2023)。此外,L-丙氨酸可能有助于介导光呼吸氨基酸代谢与细胞质氨基酸代谢之间的氨基酸交换(Betsche & Eising, 1986)。富氢水诱导的L-丙氨酸增加可能在增强草莓幼苗耐盐性中起关键作用。非生物胁迫会激活氨基糖和核苷酸糖代谢通路(Chen et al., 2023; Lu et al., 2023c),本研究也观察到这一现象,表明该通路在植物抗逆性中发挥关键作用。 此外,大量研究证实盐胁迫可诱导植物磷脂酸(PA)积累。同样,盐胁迫可诱导磷脂酰胆碱(PC)生成(Li et al., 2024; Xue et al., 2024)。PC通过增加磷脂酶D的活性并转化为磷脂酰丝氨酸、磷脂酰乙醇胺和磷脂酰甘油来稳定细胞膜,从而增强植物耐盐性(Qiao et al., 2018)。本研究发现,施用富氢水后,PA和PC的含量也显著降低(图S6e),表明盐胁迫得到缓解。 总体而言,富氢水通过产生更多抗氧化剂和防御物质来改变根系代谢,以维持生物活性,从而缓解盐胁迫并促进草莓幼苗生长。这表明富氢水有效增强了植物应对不利环境条件的能力,尤其是在盐胁迫环境中。
3.5 转录组与代谢组联合分析
我们对转录组和代谢组进行了联合分析,以全面阐明富氢水缓解草莓幼苗盐胁迫的响应机制,采用超几何分布算法获得基因集显著富集的通路和代谢物集显著富集的代谢通路。通过研究两个组学的共同通路,发现了4条通路:苯丙烷生物合成、氨基糖和核苷酸糖代谢、丙氨酸-天冬氨酸-谷氨酸代谢、半乳糖代谢(图6a)。其中苯丙烷生物合成涉及5种代谢物和64个基因,氨基糖和核苷糖代谢通路涉及4种代谢物和42个基因,丙氨酸-天冬氨酸-谷氨酸代谢通路涉及2种代谢物和25个基因,半乳糖代谢涉及2种代谢物和29个基因。
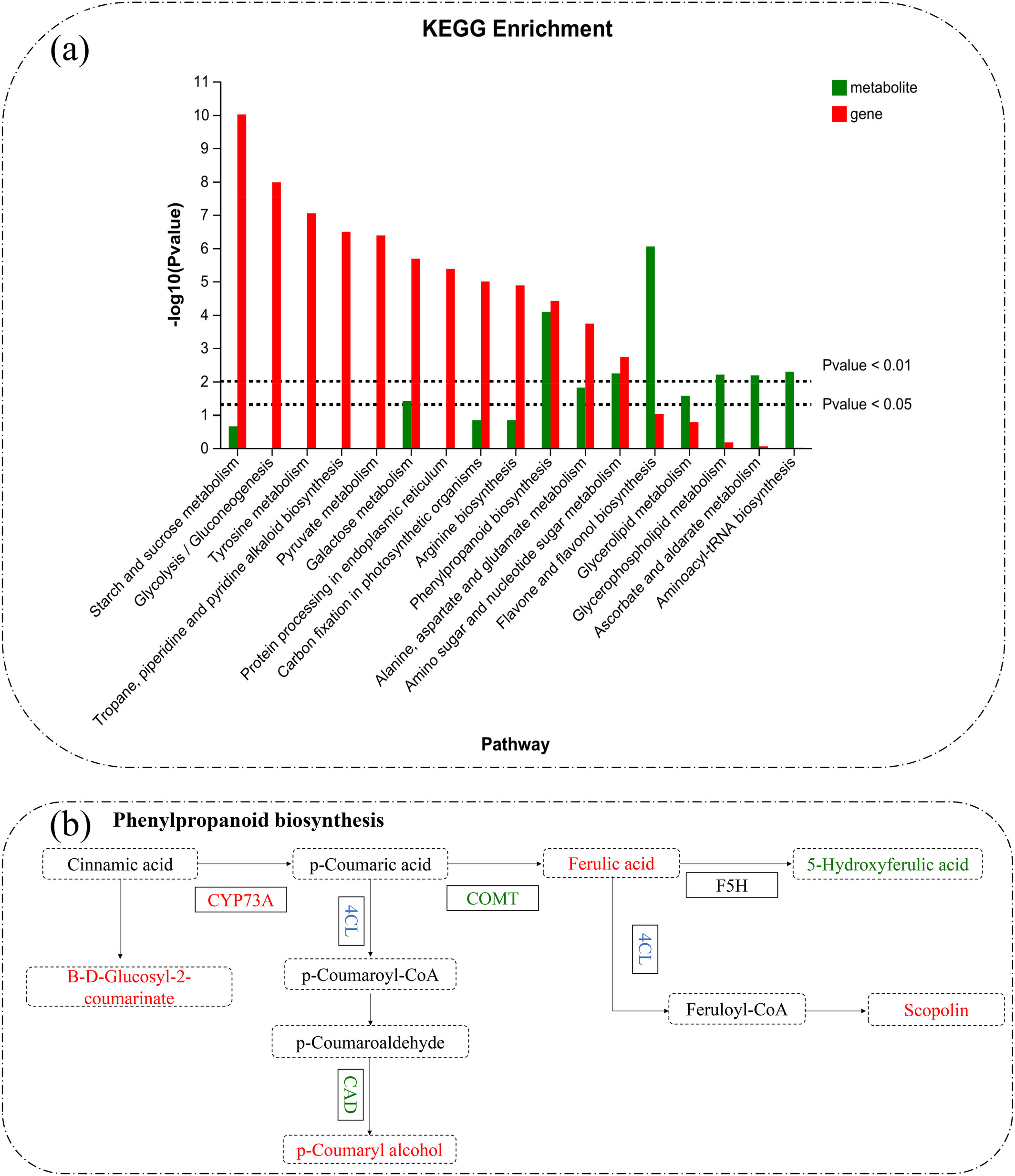
图6
差异代谢物与差异表达基因的KEGG富集分析(a);富氢水作用下草莓根系响应盐胁迫的主要通路(b)。CYP73A:细胞色素P450 73A,COMT:咖啡酸O-甲基转移酶,F5H:阿魏酸5-羟化酶,4CL:4-香豆酸辅酶A连接酶,CAD:肉桂醇脱氢酶。 虚线框代表代谢物,实线框代表相关基因,红色字体表示上调,绿色字体表示下调,蓝色字体表示既有上调又有下调。 苯丙烷生物合成是响应盐胁迫的重要通路(Zhang et al., 2023)。苯丙烷代谢通路的产物有助于缓解活性氧(ROS)积累(Zhu et al., 2021)。本研究中,苯丙烷代谢通路的代谢物也参与了ROS清除(图5a)。类似地,苯丙烷代谢通路在番茄、高粱和大麦等其他植物的耐盐机制中也是关键通路(Ho et al., 2020; Jia et al., 2022; Ren et al., 2022)。氨基糖和核苷酸糖代谢通路可能影响能量代谢通路,调节盐胁迫下植物的能量供应与利用,维持细胞正常功能。盐胁迫极大地刺激能量代谢,而氨基糖和核苷酸糖代谢通路的产物对细胞壁维持和修复至关重要(Lee et al., 2016)。转录本和代谢物在苯丙烷生物合成和氨基糖与核苷酸糖代谢通路中显著共富集,表明它们是富氢水在盐胁迫下诱导的最关键通路。基于主要结果,提出分子模型假设(图7)。富氢水促进K+、Ca2+和Mg2+的吸收,同时增强Na+的外排,从而恢复植物细胞内的离子稳态。此外,富氢水增强光合适应性,使植物即使在胁迫条件下也能维持高效的能量生产。富氢水刺激抗氧化酶系统,通过中和盐胁迫期间产生的ROS有效缓解氧化胁迫。富氢水激活苯丙烷生物合成通路,导致大量抗氧化物质积累。通过增强细胞壁合成与稳定性,富氢水提供了强大的机械支持系统,使草莓幼苗能够更好地抵御盐胁迫带来的挑战。
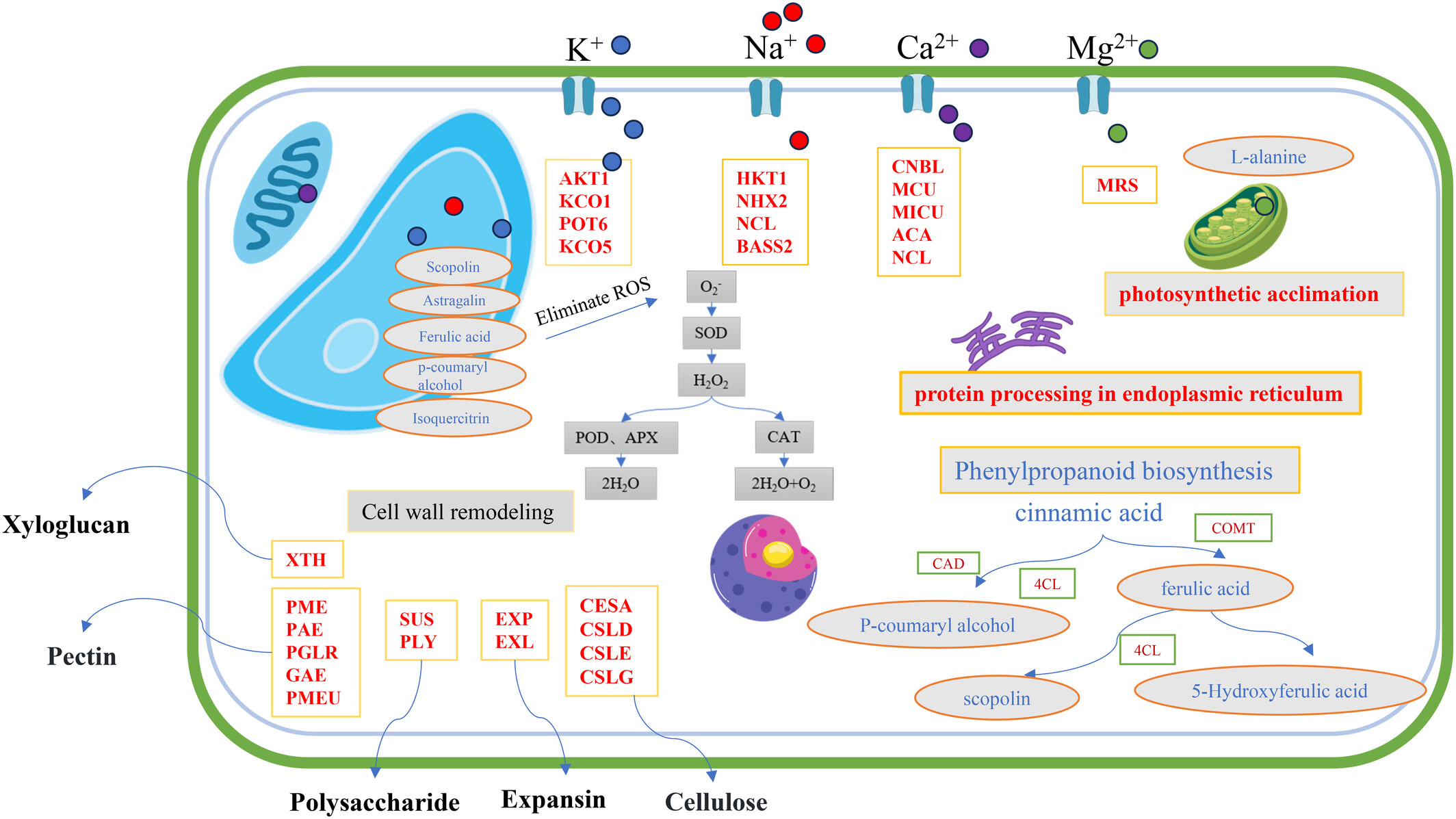
图7
富氢水缓解盐胁迫的分子机制模型。
该模型阐明了富氢水缓解盐胁迫的多方面途径,包括离子转运调节、氧化胁迫调控、细胞壁重构和代谢过程增强。每个组成部分在维持细胞稳态和提高植物对盐胁迫的适应能力中都起着关键作用。 红色字体代表相关基因,蓝色字体代表相关代谢物。灰色背景金色边缘的矩形代表关键代谢通路。蓝色圆点代表钾离子,红色圆点代表钠离子,紫色圆点代表钙离子,绿色圆点代表镁离子。金色边缘灰色背景的椭圆形代表关键代谢物。金色边框红色字母的矩形代表关键相关基因。
AKT1:钾转运蛋白1,KCO1:双孔钾通道1,POT6:钾转运蛋白6,KCO5:双孔钾通道5,HKT1:钠转运蛋白HKT1,NHX2:钠/氢交换器2,NCL:钠/钙交换器,BASS2:钠/丙酮酸共转运蛋白,CNBL:钙调磷酸酶B类似蛋白,MCU:钙单向转运蛋白,MICU:钙吸收蛋白,ACA:钙转运ATP酶,NCL:钠/钙交换器,MRS:镁转运蛋白,XTH:木葡聚糖内转糖基酶/水解酶,PME:果胶酯酶,PAE:果胶乙酰酯酶,PGLR:多聚半乳糖醛酸酶,GAE:UDP-葡萄糖醛酸4-差向异构酶,PMEU:果胶酯酶/果胶酯酶抑制剂,SUS:蔗糖合成酶,PLY:果胶酸裂合酶,EXP:扩张蛋白,EXL:扩张蛋白类似物,CESA:纤维素合成酶,CSLD:纤维素合成酶类似蛋白D,CSLE:纤维素合成酶类似蛋白E,CELG:纤维素合成酶类似蛋白G,CAD:肉桂酸-4-羟化酶,4CL:4-香豆酸辅酶A连接酶,COMT:儿茶酚-O-甲基转移酶。
4 结论
本研究结果表明,富氢水(HRW)可有效缓解草莓幼苗的盐胁迫。富氢水不仅促进了盐渍条件下幼苗的生长,还显著提高了叶绿素含量。此外,富氢水调节了可溶性糖、丙二醛(MDA)和抗氧化酶的水平,从而改善了草莓幼苗的胁迫响应能力。关键的是,富氢水重新校准了细胞内的K+/Na+离子平衡,并增强了根细胞对Ca2+和Mg2+的吸收。转录组和代谢组分析显示,富氢水主要影响与苯丙烷生物合成以及丙氨酸、天冬氨酸、谷氨酸和碳水化合物代谢相关的通路。这些通路促进了更多抗氧化剂和氨基酸的产生,这对增强耐盐性至关重要。此外,富氢水似乎重新分配了幼苗内的能量资源,有助于其在盐胁迫下的整体生长和适应能力。我们的研究还鉴定了参与离子调控、抗氧化酶和细胞壁合成的关键基因,突显了富氢水作用背后复杂的分子相互作用。总之,这些发现为富氢水缓解草莓幼苗盐胁迫的分子机制提供了新见解,并为其在农业生产中的应用提供了理论指导和实践策略。
https://wap.sciencenet.cn/blog-41174-1489382.html
上一篇:氢气对烧伤后脓毒症治疗效应
下一篇:减肥新时代,如何维持体重反弹?