母体缺铁导致小鼠胚胎中雄性与雌性发生性别逆转
亚铁离子(Fe²⁺)的关键作用
亚铁离子(Fe²⁺)在所有真核细胞的多种氧化还原酶反应中不可或缺,包括DNA和蛋白质的去甲基化过程。在雄性性别决定期间,发育中的性腺对Y染色体性别决定基因 Sry进行正常表观遗传调控时,组蛋白去甲基化是必需的<sup>1,2</sup>。在此,我们探讨了哺乳动物中铁代谢、组蛋白去甲基化与性别决定之间的潜在联系。
我们发现,在性别决定期,小鼠胚胎性腺中的Fe²⁺生成通路被显著激活。在培养的XY性腺中,铁的螯合作用降低了KDM3A介导的 Sry 基因H3K9去甲基化水平,几乎完全消除了 Sry的表达,并导致性腺表达卵巢标记物。在体内实验中,条件性敲除胎儿XY性腺体细胞中负责铁摄入的基因 Tfrc,或通过药物急性抑制怀孕小鼠体内可用铁,均导致部分后代出现性腺性别逆转(雄性→雌性),这突显了铁代谢在雄性性别决定中的关键作用。最后,给怀孕小鼠长期喂食低铁饮食,同时结合本身无明显影响的Kdm3a 杂合变异体,会抑制Sry表达并导致部分子代出现性别逆转,揭示了母体饮食铁与胎儿发育结局之间的关联。
主要内容
在哺乳动物的性别决定过程中,具有双向潜能的性腺会因睾丸决定基因 Sry 的表达(参考文献3、4)而分化为睾丸。在小鼠中,Sry 的表达受到严格调控5:它仅在性腺体细胞的一个亚群(称为前支持细胞)中激活,且仅在胚胎期(E)10.5至E12.5期间表达。染色质中DNA和/或组蛋白的甲基化会影响发育基因的转录,我们之前的研究表明,JmjC家族的H3K9去甲基化酶KDM3A(主要在发育中的性腺前支持细胞中表达6)通过对 Sry 基因座上的H3K9me2(转录抑制性异染色质的标志)进行去甲基化来激活 Sry1。
铁不仅在氧气运输中具有不可或缺的作用,还参与一系列广泛的细胞内氧化还原酶促反应。JmjC家族组蛋白去甲基化酶的酶活性需要不稳定的Fe²⁺。铁代谢受到细胞摄入、利用、储存和排泄机制的严格调控7;然而,在发育和生理过程中,铁代谢与组蛋白去甲基化之间相互作用的程度和性质在很大程度上尚不清楚。在这里,我们发现铁代谢在KDM3A介导的小鼠雄性性别决定中具有关键作用,揭示了哺乳动物代谢与雄性性别决定之间意想不到的联系。
Fe²⁺在前支持细胞中主动积累
参与细胞铁代谢的基因和蛋白质根据其功能可分为三类:铁摄入(Tfrc(编码TFR1)和 Scara5(SCARA5));Fe²⁺生成(Steap3(STEAP3)、Slc11a2(DMT1)、Ncoa4(NCOA4)和 Hmox1(HO1));以及铁排泄(Slc40a1(FPN)和 Heph(HEPH))(图1a)。我们首先检测了这些基因在小鼠性腺发育过程中的活性。
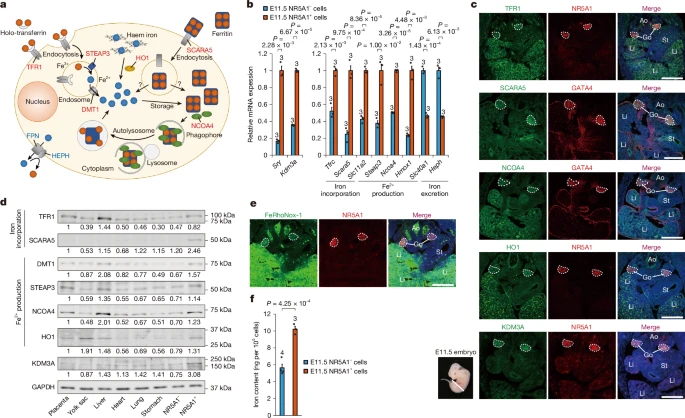

图1a:细胞内铁代谢示意图。TFR1(由 Tfrc 编码)和SCARA5(Scara5)分别通过转铁蛋白和铁蛋白介导铁摄入。STEAP3(Steap3)将依赖TFR1摄入的铁从Fe³⁺转化为Fe²⁺。DMT1(Slc11a2)是包括Fe²⁺在内的二价金属离子转运蛋白。HO1(Hmox1)通过血红素分解代谢产生Fe²⁺。NCOA4(Ncoa4)通过铁蛋白降解上调细胞内铁水平。FPN(Slc40a1)将Fe²⁺排出细胞,HEPH(Heph)将其转化为Fe³⁺。红色和蓝色文本分别表示增加和减少细胞内Fe²⁺的因子。
图1b:使用逆转录定量PCR(RT-qPCR)分析NR5A1⁺和NR5A1⁻细胞中的基因表达。左图:Sry 和 Kdm3a 的表达。右图:Tfrc 和 Scara5(铁摄入)、Steap3、Slc11a2、Ncoa4 和 Hmox1(Fe²⁺生成)以及 Slc40a1 和 Heph(铁排泄)的表达。顶部显示所检测的胚胎数量。数据为平均值±标准差。所有P<0.01的均值差异均已标注;双尾配对t检验。
图1c:E11.5 XY胚胎中TFR1、SCARA5、NCOA4、HO1和KDM3A的免疫荧光分析。使用带有性腺和肝脏的横切面(左下角)。性腺用抗GATA4和抗NR5A1抗体进行复染。白色虚线勾勒出性腺轮廓。Ao:主动脉;Go:性腺;Li:肝脏;St:胃。比例尺:5 μm(从上数第二张);10 μm(其他所有图)。
图1d:通过免疫印迹法比较E11.5胚胎组织中铁代谢蛋白和KDM3A的表达。相对值基于GAPDH信号计算。
图1e:使用开启式荧光探针(FeRhoNox-1)检测不稳定Fe²⁺,分析E11.5 XY胚胎切片中的Fe²⁺分布。白色虚线勾勒出性腺轮廓。比例尺:10 μm。
图1f:使用电感耦合等离子体质谱法(ICP-MS)定量E11.5 NR5A1⁺和NR5A1⁻细胞中的细胞铁含量。顶部显示实验次数。数据为平均值±标准差。P<0.01的均值差异已标注;双尾配对t检验。
我们按照先前发表的方法1,在性别决定期E11.5从性腺和中肾中分离出NR5A1⁺性腺体细胞和NR5A1⁻中肾细胞及生殖细胞(扩展数据图1a):只有前者群体参与性别决定。定量mRNA表达分析证实,NR5A1⁺组分包含表达 Sry 的(前支持)细胞,而NR5A1⁻组分则不包含(图1b)。与先前研究1,6一致,Kdm3a 在NR5A1⁺细胞中的表达比在NR5A1⁻细胞中更丰富(图1b)。铁摄入基因 Tfrc 和 Scara5,以及Fe²⁺生成基因 Slc11a2、Steap3、Ncoa4 和 Hmox1 在NR5A1⁺细胞中的表达比在NR5A1⁻细胞中更丰富,而铁排泄基因 Slc40a1 和 Heph 则相反(图1b)。线粒体Fe²⁺摄入基因 Slc25A37 在NR5A1⁺细胞中的表达低于NR5A1⁻细胞(扩展数据图1b)。总体而言,我们的基因表达分析表明,Fe²⁺在负责性腺性别决定的细胞的细胞质和细胞核中积累。
先前的一项研究使用单细胞RNA测序(scRNA-seq)分析了小鼠性腺性别决定期间不同性腺细胞区室中的基因表达8。我们分析了所得的scRNA-seq数据集(可在Gene Expression Omnibus(GEO)中检索GSE184708),以检测E11.5性腺和中肾中每种细胞类型中铁代谢相关基因的表达谱(扩展数据图1c)。与我们上述实验结果一致,铁摄入和Fe²⁺生成基因的mRNA以及 Kdm3a 在前支持细胞中的表达比在其他性腺细胞类型中更丰富。我们分析了人类XY发育中性腺的scRNA-seq数据9,发现KDM3A以及铁摄入和Fe²⁺生成基因在负责雄性性别决定的细胞中的表达比在性别决定期前后的其他细胞类型中更丰富(扩展数据图1d)。
接下来,我们通过免疫荧光检测了完整E11.5 XY性腺中铁代谢蛋白的表达。NR5A1和GATA4蛋白被用作性腺体细胞的标记物。除了作为铁储存主要器官的肝脏外,铁摄入蛋白TFR1和SCARA5以及Fe²⁺生成蛋白NCOA4和HO1在性腺中的检测信号比在其他组织中更强(图1c)。KDM3A在性腺中也高度表达,与先前研究结果一致1。我们还通过免疫印迹法检测了这些蛋白的组织分布(图1d)。在E11.5 XY胚胎组织和器官中,铁摄入和Fe²⁺生成蛋白在NR5A1⁺性腺细胞、胎盘和肝脏中大量表达(图1d)。为了检测细胞内不稳定Fe²⁺,我们使用了荧光探针FeRhoNox-1(参考文献10)。如图1e所示,在E11.5性腺中检测到高水平的对应Fe²⁺的荧光。
综上所述,这些数据表明存在一种基因和蛋白质表达谱,其特别有利于Fe²⁺在负责性别决定的性腺细胞中积累。因此,电感耦合等离子体质谱(ICP-MS)分析显示,NR5A1⁺细胞中的总铁(非血红素和血红素)含量是NR5A1⁻细胞的1.8倍(图1f)。
讨论
我们的研究表明,细胞内铁水平是发育中性腺H3K9去甲基化的关键限速因素。体外培养分析显示,将细胞内铁降低至对照组水平的40%会导致 Sry 基因座的H3K9me2显著增加,并几乎完全消除 Sry 的表达。因此,我们推断雄性性别决定所需的性腺铁阈值水平约为野生型的40%。由于H3K9甲基转移酶EHMT1-EHMT2复合物的高表达会催化E11.5性腺体细胞中 Sry 基因座的H3K9甲基化2,富含H3K9me2的异染色质似乎是 Sry 基因座的默认特征。为了在性别决定期克服 Sry 基因座的异染色质化,不仅需要上调KDM3A的表达,还必须增加必需辅因子Fe²⁺的生成。
我们发现性腺体细胞中的细胞铁水平与 Kdm3a 表达呈负相关,这表明铁水平与 Kdm3a 表达之间可能存在反馈调节系统。众所周知,铁调节蛋白(IRPs)对mRNA稳定性至关重要:在缺铁条件下,IRPs与3'非翻译区(3'-UTR)的铁反应元件(IREs)结合,使mRNA具有铁依赖性稳定性22,23。然而,由于我们在 Kdm3a 的3'-UTR中未发现IREs,因此 Kdm3a 的上调可能独立于IRP-IRE系统。已知当细胞内可用铁减少时,转录因子缺氧诱导因子1α(HIF1α)会稳定。HIF1α与 Kdm3a 启动子结合并诱导其在多种肿瘤细胞系中表达24,25,26。因此,在发育中的性腺中,缺铁诱导的 Kdm3a 上调可能受HIF1α调控。
除KDM3A外,哺乳动物基因组中还存在近20个编码含JmjC结构域组蛋白去甲基化酶的基因,这些酶的去甲基化活性也需要Fe²⁺。组蛋白甲基化根据甲基化的赖氨酸残基不同,既参与基因抑制(如H3K9和H3K27甲基化),也参与基因激活(如H3K4和H3K36甲基化)。此外,参与DNA去甲基化途径的TET酶也需要Fe²⁺来发挥活性。值得研究的是,铁缺乏如何通过改变组蛋白和DNA甲基化状态,在性腺性别决定以外的发育过程中改变基因表达谱。
总之,我们发现药物抑制可用铁或给怀孕小鼠喂食低铁饮食会导致子宫内发育中小鼠胚胎的表观遗传状态改变,损害XY胚胎性腺中 Sry 的激活,并导致部分小鼠胚胎出现雄性向雌性的性别逆转。据估计,孕期缺铁影响约35.5%的孕妇。此外,先天性纯红细胞再生障碍性贫血(Diamond–Blackfan anemia)和范可尼贫血(Fanconi anemia)已被报道为人类46,XY性发育障碍的危险因素27,28。我们的研究结果揭示了铁在哺乳动物性别决定中的作用,并强调了维持孕妇(尤其是可能有缺铁风险的孕妇)足够铁水平对确保胎儿正常性别分化的潜在重要性。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1488966.html?mobile=1
收藏

