博文
富氢水减轻大鼠肝性脑病
||
富氢水减轻大鼠肝性脑病
富氢水通过稳定肝脑紊乱减轻硫代乙酰胺诱导的大鼠肝性脑病
摘要
肝性脑病(HE)是肝硬化和肝功能衰竭继发的神经精神并发症,是终末期肝病患者死亡的主要原因。尽管高氨血症仍是HE进展的核心致病因素,但越来越多的证据表明,氧化应激、神经炎症和神经元凋亡是HE发病机制中的关键协同因素。富氢水因其抗氧化、抗炎和抗凋亡特性而闻名,但其在HE治疗中的疗效尚未得到系统研究。在本研究中,我们通过腹腔注射硫代乙酰胺成功建立了HE大鼠模型。通过观察大鼠的一般状态和行为变化,检测肝功能和血氨水平,以及观察肝脑组织的病理变化,探讨富氢水对肝性脑病是否具有防治作用。同时检测血浆、前额叶皮层和海马中的氧化应激、炎症和神经元凋亡水平,以探讨其保护作用的可能机制。结果表明,富氢水可改善肝性脑病大鼠的行为变化,降低血氨水平,减轻肝功能损伤,缓解肝脑组织病理改变,显著抑制肝性脑病大鼠全身及脑组织局部的氧化应激和炎症反应,并减少神经元凋亡。综上所述,富氢水可能通过抗炎、抗氧化应激和减少神经元凋亡来稳定硫代乙酰胺诱导的肝性脑病大鼠的肝脑紊乱。
引言
肝性脑病(HE)是肝功能不全的神经精神表现,其特征为一系列神经功能障碍,包括情感障碍、记忆缺陷、认知功能障碍、精神运动迟缓、注意力不集中、睡眠-觉醒周期异常和感觉处理障碍。在晚期,患者可能进展为以昏迷或昏睡为特征的全身性神经抑制,严重影响生活质量。肝性脑病是肝硬化和肝衰竭的常见并发症,约50-70%的门静脉高压和肝硬化患者最终会发展为肝性脑病。肝性脑病也是各类肝病终末期患者最常见的死亡原因,死亡率极高。
肝性脑病的发病机制复杂,存在多种假说,包括氨中毒、血脑屏障(BBB)异常等。氨中毒假说是国内外公认的核心假说,氨被认为是所有类型肝性脑病的主要致病因素。肝性脑病患者常因肠道内氨的产生和吸收增加及机体清除氨的能力下降而伴有高氨血症。由于氨分子小,极易通过血脑屏障进入脑组织。因此,血氨升高会导致颅内氨浓度升高,改变脑组织能量代谢,引起神经元细胞水肿,抑制神经传导功能,最终导致脑水肿、认知功能障碍和神经功能障碍。目前研究提供了有力证据,表明氧化应激和炎症反应是肝性脑病发生发展的独立因素,并与氨具有协同作用。实验结果表明,抗氧化干预也可减轻肝性脑病症状并增强肝性脑病大鼠的空间学习能力。在昏迷早期进行治疗还可提高大鼠的存活率。临床研究表明,肝硬化患者肝性脑病的发作伴随炎症因子的增加,且肝性脑病患者的炎症水平高于对照组。抗炎治疗干预可减轻脑水肿,降低肝性脑病分级,减缓肝性脑病进展,提高存活率,增强运动和认知功能,并促进学习记忆能力的恢复。在肝性脑病实验模型中,高氨血症可启动细胞凋亡通路,而氧化应激和炎症的激活也可触发中枢神经系统中导致神经细胞程序性死亡的病理生理事件。这些发现共同表明,氧化应激、炎症和神经元凋亡与氨具有协同作用,共同促进肝性脑病的发生和发展。
大量临床前和临床研究证实,氢具有抗氧化、抗炎、抗过敏和抗凋亡的治疗特性,并可调节自噬过程,而富氢水与氢具有相同的生物学效应。富氢水(HRW)对器官缺血-再灌注损伤、听神经病、2型糖尿病、代谢综合征等疾病具有保护作用。HRW可通过减轻氧化应激改善乙型肝炎患者的肝功能,通过抗氧化和抗炎作用减轻小鼠非酒精性脂肪肝,减轻梗阻性黄疸引起的肝损伤,显著降低肝癌的发生率,减少最大肿瘤体积,并对脑病、肝缺血再灌注和肝切除损伤具有保护作用。乳果糖是临床治疗肝性脑病的一线药物,可减少肠道内氨的产生和吸收。最近的研究表明,乳果糖可被肠道细菌分解,产生大量氢气,进而减轻体内氧化应激水平,是一种间接抗氧化剂。对部分肝切除大鼠进行乳果糖治疗可增强内源性氢气的产生,减轻肝脏的氧化应激和过度炎症,并促进肝再生。这些发现表明,乳果糖内源性氢气的增加可能是其对肝性脑病保护作用的机制之一,而HRW则富含氢气。
新兴证据表明,氧化应激、神经炎症和神经元凋亡与氨毒性具有协同作用,共同驱动肝性脑病的发病和进展。值得注意的是,HRW已显示出多方面的治疗特性,包括强效的抗炎、抗氧化和抗凋亡活性,并已证实对肝脏和神经系统疾病具有保护作用。基于这些机制见解和治疗特性,我们假设HRW可能对肝性脑病的发生和发展具有显著的保护作用。
硫代乙酰胺(TAA)具有选择性肝毒性,其肝损伤程度与肝功能障碍呈剂量依赖性相关,所导致的肝脏病理变化与肝硬化患者的特征性表现高度相似。基于其病理生理学相关性,国际肝性脑病和氮代谢学会(ISHEN)已正式推荐TAA诱导的肝损伤作为研究肝性脑病的有效实验模型。900 mg/Kg的剂量可诱导大鼠包括昏迷在内的所有阶段症状,是研究肝性脑病的推荐剂量。在本研究中,我们通过腹腔注射900 mg/kg的TAA建立了肝性脑病大鼠模型。进行了综合评估,包括:(1)监测一般生理状态和行为改变,(2)评估肝功能和血浆氨水平,(3)肝脑组织的组织病理学检查。这些研究旨在确定HRW对肝性脑病的潜在防治效果。为了阐明潜在机制,我们系统分析了血浆、前额叶皮层和海马组织中的氧化应激标志物、炎症介质和神经元凋亡情况。我们的研究结果为开发针对肝性脑病发病机制的新型治疗策略提供了大量实验证据和理论基础。
结果
富氢水对大鼠Morris水迷宫实验结果的影响
定位导航测试用于评估大鼠的空间学习能力。在定位导航训练期间:随着训练次数的增加,各组大鼠的寻台潜伏期逐渐缩短(图1A)。实验第6天,T组(模型组)的寻台潜伏期显著长于N组(正常对照组)(P<0.01),而H5组和H10组(富氢水低、高剂量组)的寻台潜伏期显著短于T组(P<0.05或P<0.01)(图1B)。
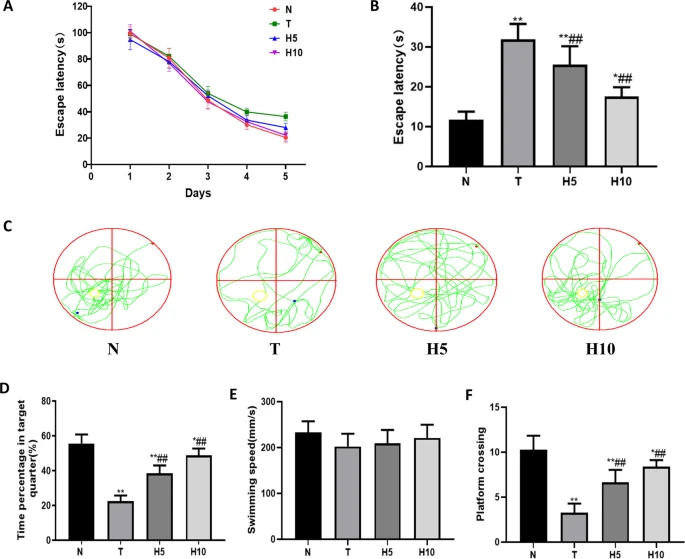
[MWM实验结果](图1)
A. 定位导航实验前5天各组大鼠寻台潜伏期变化趋势;B. 定位导航实验第6天逃避潜伏期;C. 空间探索实验游泳轨迹;D. 目标象限停留百分比;E. 游泳速度;F. 穿越平台次数。*P<0.05,P<0.01 vs. N组;#P<0.05,##P<0.01 vs. T组
在空间探索实验中,通过游泳轨迹、游泳速度和穿越平台次数评估大鼠的空间记忆能力。空间探索实验第6天(图1E),各组游泳速度无统计学差异(P>0.05)。与N组相比,T组大鼠在目标象限的停留时间百分比和穿越平台次数显著减少(P<0.01),而给予HRW后显著增加(P<0.01)(图C-F)。
富氢水对大鼠一般状态观察、神经功能评分和开场实验的影响
N组大鼠体重持续增加,精神状态正常,活动活跃,毛发有光泽,粪便成型。相比之下,T组大鼠体重明显下降,进食量减少,自发活动减少,逐渐出现嗜睡并最终昏迷,同时伴有毛发暗淡或脱落,粪便稀溏。H5组大鼠的变化较T组有所减轻,但仍精力不足、嗜睡、活动较少、毛发光泽度较低、粪便较少。H10组大鼠体重无明显下降,进食量接近正常,精神状态稍差,活动较少,毛发暗淡,粪便湿软。
T组神经功能评分显著低于N组(P<0.01),而H5组和H10组神经功能评分显著高于T组(P<0.01)(图2A)。开场实验用于评估各组大鼠的自发运动能力,T组大鼠的跨格次数、总运动距离和直立次数均显著低于N组(P<0.01)。H5组和H10组较T组显著增加(P<0.05或P<0.01)(图2B-D)。
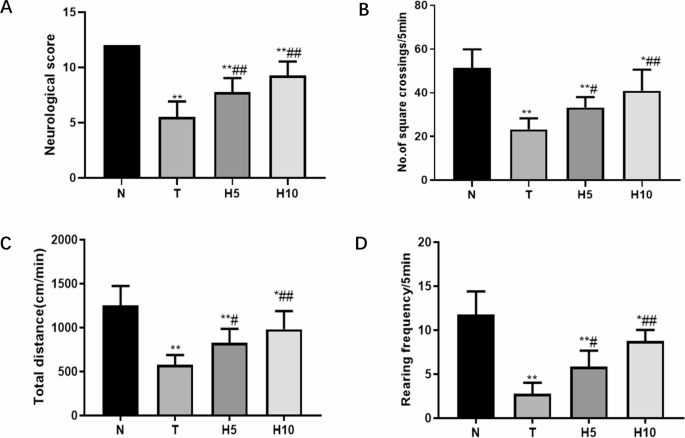
图2
神经功能评分与开场实验
A. 神经功能评分;B. 跨格次数;C. 总运动距离;D. 直立次数。*P<0.05,P<0.01 vs. N组;#P<0.05,##P<0.01 vs. T组
富氢水降低肝性脑病大鼠血氨水平及肝功能损伤
HRW对血浆氨(Amm)、总胆红素(TBIL)、谷丙转氨酶(ALT)和谷草转氨酶(AST)水平的影响:T组血浆Amm、TBIL、ALT和AST水平显著高于N组(P<0.01);H5组和H10组显著低于T组(P<0.01)(图3)。
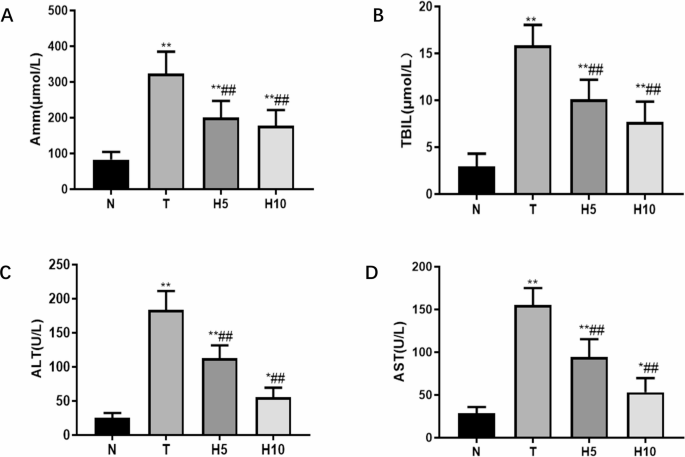
[图3 大鼠血氨及肝功能水平](图3)
A. 血氨含量;B. TBIL水平;C. ALT活性;D. AST活性。*P<0.05,P<0.01 vs. N组;##P<0.01 vs. T组
富氢水减轻肝性脑病大鼠肝组织损伤
N组大鼠肝脏大小正常,表面光滑。T组肝脏肿大,边缘钝圆,表面有粗颗粒感,缺乏光泽,可见坏死灶。H5组和H10组的病变较T组减轻(图4A)。
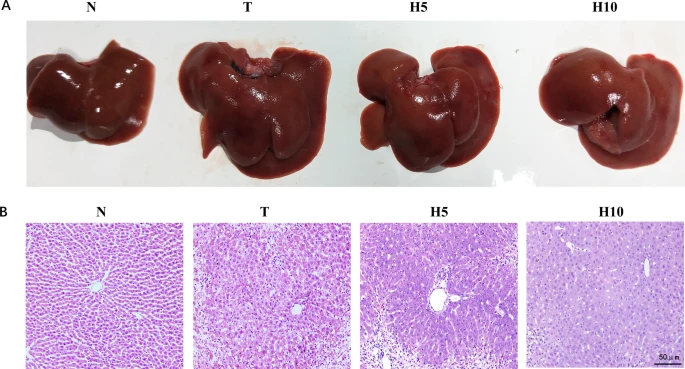
[图4 肝脏大体及病理变化](图4)
A. 肉眼观察肝脏病理变化;B. 光学显微镜观察肝脏病理变化(HE×200,比例尺=50 μm)
显微镜观察显示,N组肝小叶结构清晰,肝索排列整齐,无肝细胞变性坏死及炎症细胞浸润。T组发生纤维组织增生,正常肝组织被破坏包裹形成团块,结构改变类似肝硬化,肝小叶结构无法区分,肝索紊乱,肝细胞水肿,胞质淡染疏松,部分区域出现坏死,可见大量炎症细胞。H5组可区分肝小叶结构,轻度纤维组织增生,炎症细胞浸润少于T组,细胞变性坏死程度较轻。H10组肝小叶结构基本正常,肝细胞轻度水肿,少数呈气球样变,少量炎症细胞浸润,无坏死(图4B;表1)。
表1 光学显微镜下肝损伤程度
富氢水对肝性脑病大鼠前额叶皮层及海马CA1区组织形态的影响
前额叶皮层:N组前额叶皮层结构清晰,神经元形态正常;T组前额叶皮层结构明显改变,层次不清,多数神经元形态不规则,细胞核固缩,染色加深,胞质淡染;H5组和H10组前额叶皮层结构及神经元病理改变较T组显著改善。T组正常神经元数量较N组显著减少(P<0.01),H5组和H10组正常神经元数量较T组显著增加(P<0.01)(图5A、B)。
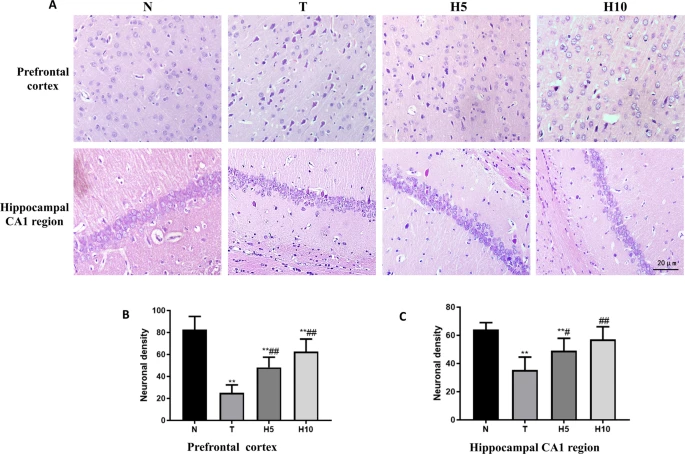
[图5 脑组织形态变化](图5)
A. 前额叶皮层及海马CA1区病理变化(HE×400,比例尺=50 μm);B. 前额叶皮层正常神经元计数;C. 海马CA1区正常神经元计数。P<0.01 vs. N组;##P<0.01 vs. T组
海马CA1区:N组海马神经元排列整齐,核大而圆;T组海马神经元排列松散,结构紊乱,部分神经元胞质红染、染色加深,正常神经元数量较N组显著减少(P<0.01);H5组和H10组神经元病理改变较T组显著改善,正常神经元数量较T组显著增加(P<0.01)(图5A、C)。
富氢水降低肝性脑病大鼠氧化应激水平
T组血浆、前额叶皮层和海马中谷胱甘肽过氧化物酶(GPx)和总超氧化物歧化酶(T-SOD)活性显著低于N组(P<0.01),H5组和H10组显著高于T组(P<0.01)。T组血浆、前额叶皮层和海马中丙二醛(MDA)含量显著高于N组(P<0.01),H5组和H10组显著低于T组(P<0.05或P<0.01)(图6)。
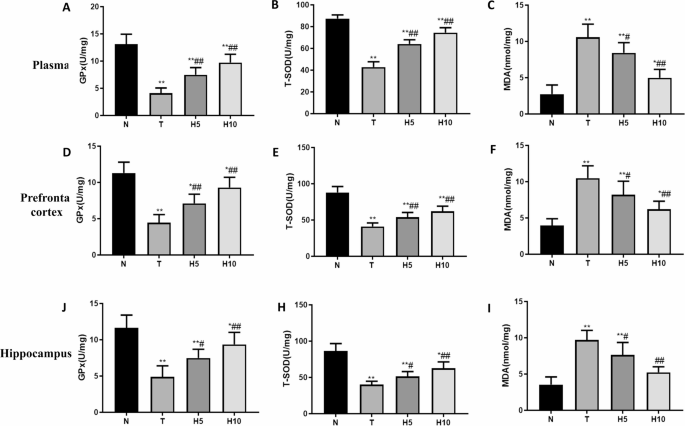
[图6 血浆、前额叶皮层及海马氧化应激水平](图6)
A-C. 血浆中GPx、T-SOD活性及MDA含量;D-F. 前额叶皮层中GPx、T-SOD活性及MDA含量;G-I. 海马中GPx、T-SOD活性及MDA含量。*P<0.05,P<0.01 vs. N组;#P<0.05,##P<0.01 vs. T组
富氢水减轻肝性脑病大鼠炎症反应
T组血浆、前额叶皮层和海马中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)含量显著高于N组(P<0.01),H5组和H10组显著低于T组(P<0.01)(图7)。
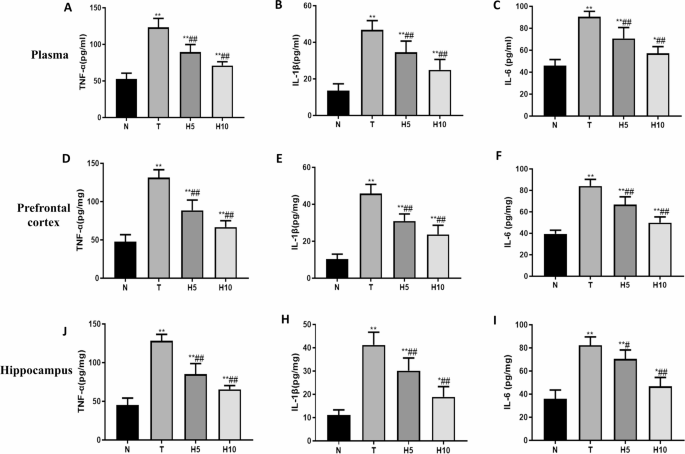
[图7 血浆、前额叶皮层及海马炎症水平](图7)
A-C. 血浆中TNF-α、IL-1β、IL-6含量;D-F. 前额叶皮层中TNF-α、IL-1β、IL-6水平;G-I. 海马中TNF-α、IL-1β、IL-6水平。*P<0.05,P<0.01 vs. N组;#P<0.05,##P<0.01 vs. T组
富氢水减轻肝性脑病大鼠神经元凋亡
与N组相比,T组前额叶皮层和海马CA1区神经元凋亡数量显著增加,H5组和H10组较T组显著减少。T组凋亡指数显著高于N组(P<0.01),H5组和H10组显著低于T组(P<0.01)(图8)。
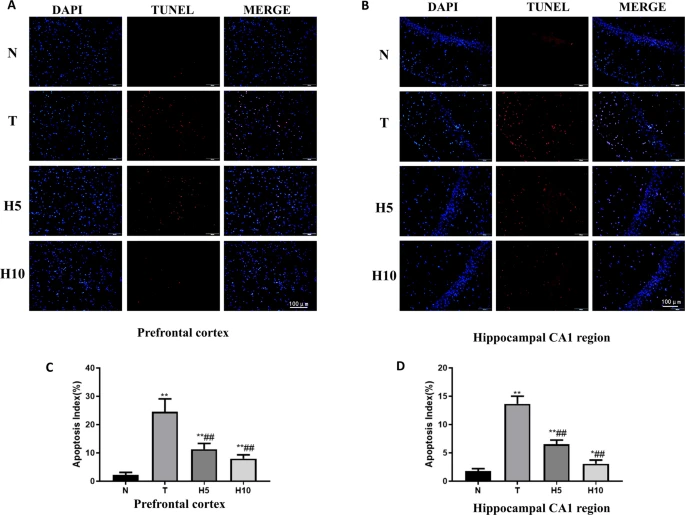
[图8 TUNEL染色结果](图8)
A, B. 前额叶皮层及海马CA1区TUNEL荧光染色结果(×200),细胞核用蓝色荧光(DAPI)标记,TUNEL阳性细胞用红色荧光标记,比例尺=100 μm;C, D. 前额叶皮层及海马CA1区凋亡指数。*P<0.05,P<0.01 vs. N组;##P<0.01 vs. T组
讨论
肝性脑病是与急慢性肝功能衰竭常伴随的神经精神综合征,提示疾病恶化状态。氨被认为是肝性脑病发病机制的核心因素,通过门静脉进入肝脏的氨主要通过尿素循环代谢为尿素和谷氨酰胺。随着肝病进展,肝脏尿素合成减少,导致氨代谢受损,引发高氨血症。氨易通过血脑屏障,导致颅内氨浓度升高,星形胶质细胞中的谷氨酰胺合成酶可降低氨浓度。然而,谷氨酰胺是一种渗透活性物质,可引起神经元水肿并破坏神经元代谢稳态。当氨浓度升高时,谷氨酸合成增加,谷氨酸与氨合成谷氨酰胺增多,影响细胞能量代谢过程并消耗ATP,同时氨抑制Na+-K+-ATP酶活性,ATP生成减少,大脑能量来源不足,最终导致昏迷。脑内氨浓度升高打破了兴奋性神经递质谷氨酸与抑制性神经递质GABA的平衡,引发神经精神障碍。
硫代乙酰胺(TAA)是一种选择性肝毒性化学物质,可剂量依赖性诱导肝细胞坏死和肝功能障碍。TAA可导致血氨升高、神经元水肿、颅内氧化应激、炎症和神经功能损害。TAA诱导的肝损伤与肝硬化患者相似,已广泛用于肝性脑病病理机制研究。血浆天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)和总胆红素(TBIL)水平是检测肝功能最常用的指标。本实验通过测量寻台潜伏期评估大鼠空间学习能力,通过穿越平台指数评估空间记忆能力,通过总运动距离和跨格次数评估自发运动能力,通过直立次数评估探索能力,并检测血浆AST、ALT和TBIL水平以评估肝功能。根据文献描述的方法,通过腹腔注射300 mg/Kg/天TAA连续3天建立肝性脑病大鼠模型。观察到模型组大鼠出现精神状态恶化、食欲减退、体重下降、嗜睡、共济失调、昏迷等症状,血氨升高,肝功能下降,肝组织坏死。病理切片显示肝组织结构紊乱,肝细胞变性坏死,伴随神经元损伤、学习记忆和自发运动能力下降,证明我们成功建立了肝性脑病模型。
在本研究中,我们观察到肝性脑病大鼠模型肝脏肿大,表面可见坏死灶。这一发现与临床肝硬化病例中典型的肝萎缩特征形成对比。观察到的肝肿大可能归因于以下病理生理机制:(1)TAA代谢产生大量活性氧,诱导氧化应激损伤肝细胞膜和细胞器,导致细胞水肿;(2)后续炎症反应加剧组织水肿;(3)门静脉血流受阻导致肝淤血;(4)窦状内皮细胞损伤伴随微血栓形成引起窦状隙充血,共同导致肝脏体积增大。肝组织可能因缺血性损伤或TAA的直接细胞毒性作用出现局灶性坏死区域,这种病理表现可能由微循环障碍导致细胞缺氧或TAA诱导的代谢紊乱最终触发肝细胞死亡。
HRW可在体内释放氢气,氢气具有分子量小、渗透性强的特点,可迅速扩散至重要细胞器,并快速通过血脑屏障到达脑组织。氢气对人体无毒性副作用,不影响正常生理参数,也不影响动脉血氧饱和度或血流动力学。临床实验发现,口服HRW可降低ALT和AST活性,增加γ-谷氨酰转移酶活性,升高TBIL含量,但变化均维持在生理正常范围内。氢气是理想的抗氧化剂,可增强抗氧化酶活性并具有选择性抗氧化能力,能清除过氧亚硝酸盐(ONOO-)等对人体有害的强氧化性物质,而对具有正常生理功能的弱氧化性物质如过氧化氢(H2O2)无影响。HRW具有良好的抗炎作用,可有效抑制炎症细胞浸润,减少促炎因子产生,减轻炎症反应。HRW还具有显著的抗凋亡作用,可调节促凋亡因子和抗凋亡因子的表达。在本实验中,我们观察到HRW治疗可改善肝性脑病大鼠神经精神异常症状,提高神经功能评分,降低血氨,减轻肝脑组织损伤,改善肝性脑病大鼠的空间学习记忆能力,增强其自发运动和探索能力。为探讨富氢水减轻肝性脑病大鼠损伤的可能机制,我们检测了血浆、前额叶皮层和海马中的氧化应激、炎症反应和神经元凋亡水平。
近年来,有充分证据表明氧化应激和炎症也是肝性脑病(HE)的重要病理机制,并与氨共同促进肝性脑病的发生发展。研究显示,肝性脑病可通过氧化应激、神经元炎症和凋亡造成中枢神经系统损伤。前额叶皮层具有记忆、分析、判断、思维和执行控制等功能,在行为、意识和认知中作用显著;海马主要负责记忆和学习,与情绪及睡眠-觉醒密切相关。肝性脑病患者出现情绪异常、记忆障碍、认知功能下降、学习记忆能力减退及睡眠紊乱,可能与前额叶皮层和海马损伤有关。
大脑因其高代谢率、需消耗大量氧气且富含脂质,是最易受氧化损伤的器官之一。丙二醛(MDA)是脂质过氧化最稳定的产物,代表体内氧化应激水平。为抵御活性氧(ROS)损伤,大脑必须激活抗氧化防御系统,其中抗氧化酶(如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx))起关键作用,其活性反映机体清除氧自由基的能力。肝功能正常时,单纯血氨升高即可降低大鼠大脑皮层和小脑抗氧化酶活性,诱导氧化应激损伤。此外,氨浓度升高诱导星形胶质细胞毒性水肿,在脑实质内引发氧化应激级联反应,最终导致神经元功能障碍和神经损伤。星形胶质细胞水肿与炎症介质均可激活N-甲基-D-天冬氨酸(NMDA)受体,降低抗氧化酶活性,削弱机体抗氧化能力,造成神经元损伤和脑细胞凋亡。星形胶质细胞水肿与氧化应激反应之间形成恶性循环:细胞水肿导致神经元间谷氨酸蓄积,谷氨酸通过激活离子型谷氨酸受体(NMDA)增加神经元Ca²⁺内流,引起线粒体渗透压改变,最终导致ROS增多;而NMDA受体激活和氧化应激反应又会加重星形胶质细胞肿胀。在本实验中,模型组大鼠血浆、前额叶皮层和海马组织中GPx、T-SOD活性较正常组降低,MDA含量显著升高,表明肝性脑病大鼠氧化应激水平升高,与既往研究结果一致;而给予富氢水(HRW)后,大鼠上述组织中抗氧化酶活性升高,MDA含量显著降低,说明富氢水可改善肝性脑病大鼠抗氧化酶活性,抑制脂质过氧化,减轻TAA诱导的氧化损伤。
全身炎症反应加速急性肝衰竭患者肝性脑病进展并可升高肝性脑病分期,表明炎症与肝性脑病密切相关。本实验中,模型组大鼠血浆、前额叶皮层和海马组织中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)水平较正常组显著升高,表明肝性脑病大鼠炎症水平显著升高;而富氢水可显著降低肝性脑病大鼠促炎因子水平,减轻炎症损伤。我们观察到肝性脑病大鼠出现神经元损伤、学习记忆和自发运动能力下降,且其血浆及脑内促炎因子水平显著升高,而HRW治疗可改善肝性脑病大鼠神经精神异常症状和脑组织损伤,提高认知能力并降低促炎因子水平。据此推测,TNF-α、IL-1β、IL-6等炎症因子减少可能与肝性脑病大鼠认知功能改善相关。炎症是肝性脑病脑损伤的重要致病特征,高氨和自由基可诱导炎症基因表达并产生多种炎症介质。TNF-α、IL-1β、IL-6作为最重要的促炎细胞因子,在肝性脑病中升高并触发中枢神经系统有害炎症反应。在肝性脑病患者和动物中,脑内这些细胞因子水平升高与神经炎症及后续认知和运动活动异常相关。外周产生的炎症介质无法通过血脑屏障(BBB)直接作用于脑,但外周免疫系统可向脑传递信号,诱导脑组织表达促炎因子,促进氧化应激和线粒体功能障碍,进一步加重神经炎症和神经元损伤。HRW可能通过以下机制降低肝性脑病大鼠炎症因子水平,从而改善认知功能:(1)抗氧化作用:HRW中的分子氢具有强抗氧化能力,可清除过量ROS,抑制核因子-κB(NF-κB)、丝裂原活化蛋白激酶(MAPK)等促炎信号通路激活,减少炎症因子生成,而炎症因子减少可降低神经元凋亡和坏死,保护海马、前额叶皮层等学习记忆相关脑区\[49\];(2)抑制小胶质细胞活化:分子氢可抑制小胶质细胞过度活化,减少TNF-α、IL-1β、IL-6释放,同时TNF-α、IL-1β减少可减轻谷氨酸兴奋性毒性,促进突触可塑性和长时程增强(LTP),从而改善学习记忆能力;(3)保护血脑屏障:HRW通过减轻氧化应激和炎症反应,有助于维持BBB完整性,阻止外周炎症因子进入中枢神经系统(CNS),而炎症因子减少可改善脑微环境,促进神经元修复和功能恢复。研究表明,肝性脑病患者及动物模型中TNF-α、IL-1β、IL-6水平升高与认知功能障碍密切相关,且肝性脑病患者血浆TNF-α、IL-6水平与认知功能评分呈负相关,与本研究中减少炎症因子伴随认知功能改善的结果一致。
氧化应激和炎症激活可在中枢神经系统启动一系列病理生理事件,促进脑细胞凋亡。凋亡在TAA诱导的肝性脑病病理生理中起重要作用:既往研究显示,TAA可诱导肝组织中caspase-3和Fas表达上调,提示TAA具有促凋亡活性;另有报道称,高氨血症可在肝性脑病实验模型中激活凋亡通路。本研究通过腹腔注射300 mg/Kg/天TAA连续3天建立肝性脑病大鼠模型,模拟人类肝性脑病相关病理生理事件。结果显示,TAA注射后,脑组织氨水平升高,GPx、T-SOD水平降低,MDA升高,表明脑细胞ROS过量产生和脂质过氧化,最终导致促炎细胞因子水平升高并引发凋亡。既往研究证实,氧化细胞损伤直接激活凋亡,氧化产物过量生成导致线粒体功能障碍(包括线粒体膜电位丧失、细胞色素c从线粒体释放至胞质、caspase-3激活)和细胞凋亡。苏木精-伊红(H&E)染色显示,正常组前额叶皮层和海马结构清晰,神经元形态正常、排列整齐,核大而圆;TAA处理后,前额叶皮层结构明显改变、层次不清,前额叶皮层和海马多数神经元形态不规则、核固缩深染,正常神经元计数显著减少;HRW给药后,前额叶皮层和海马结构及神经元病理改变不同程度改善,正常神经元数量显著增加。末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)法灵敏度和特异性强,是检测凋亡的首选方法。本研究TUNEL染色显示,肝性脑病大鼠脑细胞凋亡死亡增多,而HRW给药后前额叶皮层和海马CA1区凋亡神经元数量显著减少,凋亡指数降低。因此,实验数据表明HRW对TAA诱导的大鼠脑组织具有抗凋亡作用。
如图9所示,本研究证实HRW可能通过抗氧化、抗炎和抗凋亡机制,对TAA诱导的大鼠肝性脑病发挥保护作用,为治疗开发提供了新见解,但其具体机制和临床应用需进一步研究。本研究存在以下局限性:(1)未阐明HRW抗肝性脑病保护作用的分子机制,未来需聚焦于鉴定HRW介导神经保护和肝保护的特定信号通路及分子靶点;(2)啮齿类动物模型因与人类生理代谢差异,研究结果转化价值有限,且临床肝性脑病患者常合并多种并发症可能影响治疗效果,建议后续在肝生理更接近人类的高等哺乳动物模型中开展研究,并进行早期临床试验;(3)本研究仅评估HRW对肝性脑病大鼠学习和运动功能的短期影响,HRW的长期疗效(如认知恢复、生存获益)需在未来研究中通过延长治疗和观察周期进行综合评估;(4)尽管数据显示HRW单药治疗可减轻大鼠肝性脑病病理,但临床肝性脑病管理通常以乳果糖和/或利福昔明为一线治疗,HRW与临床标准方案的潜在协同效应尚待探索,这可能为肝性脑病患者带来更大治疗获益。这些局限性为未来研究指明了方向,以进一步验证和优化基于HRW的肝性脑病治疗策略。
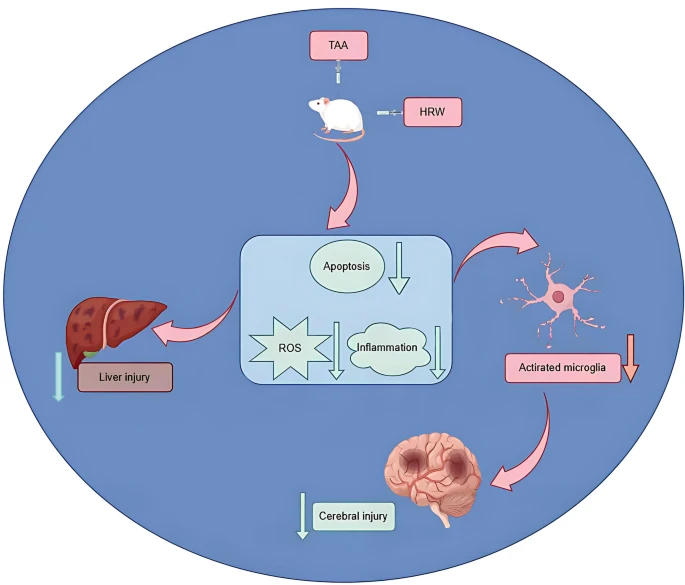
[图9 假设靶标通路](图9)
氧化应激、炎症和神经元凋亡共同促进肝性脑病的发生发展。富氢水通过抗氧化、抗炎和抑制细胞凋亡,减轻肝性脑病大鼠的肝脏和脑损伤
https://wap.sciencenet.cn/blog-41174-1487443.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:神奇疗法成为常规药物的在体编辑CAR-T进行时!