博文
中国学者解析心肌梗塞死亡率昼夜节律分子基础《自然》  精选
精选
|
当一对蛋白质的活性下降时,早晨心脏病发作的后果更严重
一对会影响心肌损伤如何随昼夜节律波动的蛋白质,可能是优化心脏病发作后恢复效果的关键所在。
湘雅二医院阮溦团队在nature上发表论文,破解心肌梗死治疗的“生物钟密码”-中南大学湘雅医学院
心脏病发作的频率和严重程度在早晨达到高峰,但导致这种规律的分子机制才刚刚开始被揭示。心血管功能的昼夜节律调控十分复杂,受到心肌细胞(心肌ocytes)内在或外在因素的影响,比如血压、心率以及激素分泌等。阮(Ruan)等人在《自然》杂志上发表的文章指出,人体内部的分子钟可通过一种机制影响心肌因供血不足(也称为缺血)而造成的损伤的昼夜(每日)变化模式。
昼夜节律由一种基因编码的转录反馈回路所控制,该回路以大约24小时为一个周期运行。这个调控网络在全身都处于活跃状态,调节着组织特异性功能,并对肥胖、糖尿病、癌症以及心血管疾病等状况产生影响。在分子层面上,昼夜节律过程主要由转录因子蛋白控制,其中BMAL1和CLOCK是这一循环的关键激活因子。
BMAL1和CLOCK属于一个在进化上相关的转录因子大家族,其中包括缺氧诱导因子(HIFs),这类因子会在低氧水平下被激活。上世纪90年代,人们发现BMAL1在体外可与HIF1α和HIF2α相互作用,并在一段为结合这些异二聚体而优化的人工DNA序列的控制下,共同调节一个报告基因的表达。过去十年的研究进一步证明了BMAL1在不同生物体和细胞类型中对调控HIF1α和HIF2α功能所起的作用。在心脏病发作(也称为心肌梗死)的情况下,与正常表达分子钟成分的小鼠相比,那些基因敲除了分子钟成分的小鼠表现出更严重的梗死(组织死亡),这可能是由于HIF1α所靶向基因的表达受到了昼夜节律的调节。
阮等人研究了HIF对缺血的协调反应是否通过与BMAL1的直接相互作用而表现出昼夜节律调控。他们发现,在成年小鼠的心肌细胞中删除Bmal1基因后,缺血再灌注损伤(即血液重新供应到受损区域时发生的情况)后心脏损伤的昼夜模式消失了。
这一发现证实了内在的分子钟对于受损心脏组织的修复和存活是必要的。小鼠心脏组织中Bmal1基因的表达与损伤严重程度呈负相关,而且在对人体进行常常会导致缺血的外科手术前后的不同时间点所采集的心肌活检样本的RNA测序数据中,也观察到了类似的昼夜模式。这些数据表明,BMAL1通过一种很可能在人类中也保守的机制来调节缺血性损伤。
鉴于HIF1α和HIF2α在缺血过程中的重要性,作者评估了在人类心肌细胞中BMAL1与HIF1α或HIF2α直接相互作用的可能性。一项检测蛋白质间相互作用的体外实验表明,BMAL1与HIF2α存在相互作用。在小鼠中,当心肌梗死损伤最不严重时,BMAL1和HIF2α的含量都达到了峰值,而且在心肌细胞中缺乏Epas1基因(该基因编码HIF2α)表达的小鼠,其损伤反应的昼夜差异消失了。作者随后发现,一个名为Areg的HIF2α靶基因(该基因编码AREG,一种促进心脏组织修复和保存的蛋白质)会进行与时间相关的转录,并且是心肌损伤严重程度昼夜变化所必需的(图1)。
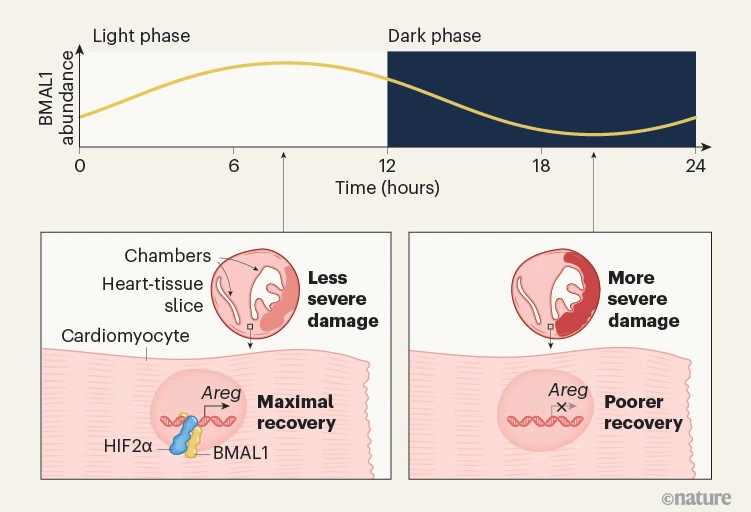
图1 | 昼夜节律影响心脏损伤的结果。阮等人发现,一种名为BMAL1的转录因子蛋白(人体内部生物钟的关键调节因子)在心肌细胞(心肌细胞)中的含量在24小时内会发生波动。在24小时内的不同时间点,研究人员让小鼠(饲养在具有12小时光照-黑暗周期的笼子里)的心肌(心肌)经历供血中断及随后恢复所造成的损伤,模拟心脏病发作后的情况。在光照阶段开始后8小时(相当于下午3点)遭受心肌损伤的小鼠中,组织损伤最不严重,恢复效果也最好。作者发现,BMAL1与在低氧水平下具有活性的转录因子HIF2α直接相互作用。BMAL1-HIF2α异二聚体与DNA结合,并调节Areg基因的表达,该基因编码一种促进心脏组织修复的蛋白质。在黑暗阶段(相当于凌晨3点)遭受心肌损伤的小鼠中,此时BMAL1的含量最低,Areg基因未被诱导,导致严重的组织损伤和较差的恢复效果。
阮及其同事接着证明了BMAL1与HIF2α直接相互作用的存在和功能。值得注意的是,他们使用一种名为冷冻电子显微镜的技术解析出了BMAL1-HIF2α异二聚体的首个单颗粒结构。他们证明,BMAL1呈现出与另一个HIF2α结合伴侣HIF1β类似的构象。这种排列与它和典型伴侣CLOCK结合时的构象截然不同,这表明BMAL1能够发生巨大的构象变化,以便与多种不同的伴侣结合。
在使用培养的人类细胞进行的功能实验中,人为降低BMAL1或EPAS1基因的表达会降低AREG的表达,而降低编码BMAL1和HIF2α典型相互作用伴侣(CLOCK、HIF1α和HIF1β)的基因的表达,则对AREG的表达没有影响,这意味着这个基因是BMAL1-HIF2α二聚体的直接靶标。为支持这一点,一项检测蛋白质与DNA相互作用的实验表明,在缺氧条件下,BMAL1和HIF2α会结合到相同的AREG启动子区域,而HIF1β则不会结合到该区域。
作者进一步证明,针对这一通路中任何一个成分(BMAL1、HIF2α或AREG)的治疗性干预措施,都能通过减少心肌细胞的凋亡(程序性细胞死亡)、缩小梗死面积或改善小鼠的心脏功能,来促进缺血性损伤后的恢复。当在心脏中Bmal1基因表达的自然低点给予一种名为川陈皮素(nobiletin)的BMAL1激活化合物进行治疗时,可改善心肌损伤反应。同样,在Bmal1基因表达达到峰值时给予vadadustat(一种稳定HIF2α的化合物)进行治疗,可进一步促进恢复,这凸显了在心脏保护中时机的重要性。此外,在再灌注时给予AREG可显著缩小梗死面积,在Bmal1基因表达最低时观察到的效果更明显。这些发现强调了在一天中的最佳时机针对这一通路进行干预,以减轻缺血性心脏损伤的治疗潜力。
对BMAL1-HIF2α异二聚体的特征描述引发了一些关于BMAL1驱动不同转录程序能力的关键问题。未来需要开展研究来确定这种异二聚体在体内的功能,并明确它所作用的全套调控序列。此外,研究在缺血过程中BMAL1的典型结合伴侣CLOCK会发生什么情况,以及BMAL1与HIF1α相互作用的潜在后果也至关重要。作者证明,BMAL1的缺失会导致HIF2α蛋白的表达降低或降解增加,这表明在缺血应激期间,BMAL1对HIF2α的调控存在多个层面。
更广泛地说,在缺血性损伤期间,除心肌细胞外的其他细胞中,HIFs与生物钟成分之间相互作用可能发挥的作用,非常值得深入研究。先天免疫反应受到昼夜节律的调节,并且对心脏损伤的修复很重要。与此一致的是,作者发现了许多与免疫相关的基因特征会随一天中的时间而变化,而且先前的研究表明,在心脏损伤中AREG与先天免疫功能之间存在关联。研究昼夜节律调控、缺氧和免疫信号之间的相互作用,可能会加深科学家对心肌恢复的时间依赖性本质的理解,并为缺血性损伤的有效治疗策略提供依据。
https://wap.sciencenet.cn/blog-41174-1483218.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:几十卷烧焦的赫库兰尼姆纸卷上的文字很快就会被解读