博文
阻断“跳跃基因”能治疗疾病和衰老吗?
|
阻断“跳跃基因”能治疗疾病和衰老吗?
贝丝·弗罗斯特(Bess Frost)看到自己通过基因工程培育的果蝇开始更长久地漫步时,兴奋不已。这些果蝇会表现出阿尔茨海默病的特征,随着年龄的增长,它们的神经元会逐渐死亡,行走能力也会下降。但当时在得克萨斯大学圣安东尼奥健康科学中心(UT Health San Antonio)的细胞与分子生物学家弗罗斯特及其同事发现,一种名为拉米夫定(3TC)的药物能够减缓甚至逆转这些变化。
2018年的这一研究结果支持了这样一种观点,即针对转座子(在基因组中四处跳跃的活跃DNA序列)采取措施,或许有助于治疗阿尔茨海默病以及其他多种疾病。这是因为原本用于治疗艾滋病的拉米夫定,也能使转座子保持稳定,不再四处移动。
尽管如此,弗罗斯特的朋友坎贝尔·沙利文(Campbell Sullivan),一位同样在得克萨斯大学圣安东尼奥健康科学中心研究阿尔茨海默病患者的神经心理学家,告诉她不要过于激动。“她说,‘我的患者可不会对这个结果有什么深刻印象。’” 现就职于布朗大学的弗罗斯特回忆道。
两人决定开展一项更具说服力的临床试验。12名早期阿尔茨海默病患者服用拉米夫定6个月后,该药物并未提升他们的认知能力。但其他指标显示出了一些益处,正如弗罗斯特、沙利文及其同事上个月在《npj 痴呆症》(npj Dementia)杂志上所揭示的那样。例如,一种关键的神经退行性病变指标水平有所下降,这表明拉米夫定对患者的脑细胞起到了保护作用。“这是最让我兴奋的变化。” 弗罗斯特说。
他们最近的这项研究是首个针对阿尔茨海默病的抗转座子策略的临床试验,并最终得出了结果。但这只是学术研究人员和生物技术公司开展的越来越多的试验之一,这些试验旨在评估抑制转座子(即所谓的 “跳跃基因”)的效果。这些游荡的序列,其中一些是很久以前入侵细胞的病毒残余,甚至可能源自共生细菌,它们占人类基因组的40%以上,但曾经人们大多认为它们基本无害。然而,来自人类细胞系、实验动物以及流行病学研究的各种证据表明,它们的活动与狼疮、肌萎缩侧索硬化症(ALS)、帕金森病、癌症等疾病以及衰老过程都存在关联。
令人鼓舞的结果正陆续传来。2022年,一项2期临床试验确定,拉米夫定在一些结直肠癌患者体内阻止了肿瘤的生长。去年,转座子治疗公司(Transposon Therapeutics)透露,另一种能够阻碍这些序列复制的药物,减缓了肌萎缩侧索硬化症患者或另一种神经退行性疾病——额颞叶痴呆患者身体机能衰退的一个迹象。“这个研究进展之快真的令人惊叹。” 布朗大学的分子生物学家、该公司的联合创始人约翰·塞迪维(John Sedivy)说。
除了测试拉米夫定等已有的药物,研究人员还在专门研发化合物,以阻断人类体内主要的 “捣乱” 转座子——LINE-1。据罗马治疗公司(ROME Therapeutics)的首席科学官海克·凯尔哈克(Heike Keilhack)称,该公司已经开发出了一系列针对LINE-1的药物,并希望在18至24个月内公布其首个临床试验结果。
研究人员表示,转座子抑制剂的临床试验不仅对于确定潜在的治疗方法很重要,而且对于检验跳跃基因是否确实会引发人类疾病也至关重要。“现在很清楚的是,LINE-1在许多常见疾病中都很重要。但不清楚的是,它的影响程度究竟有多大。” 布朗大学生物化学家马丁·泰勒(Martin Taylor)说。
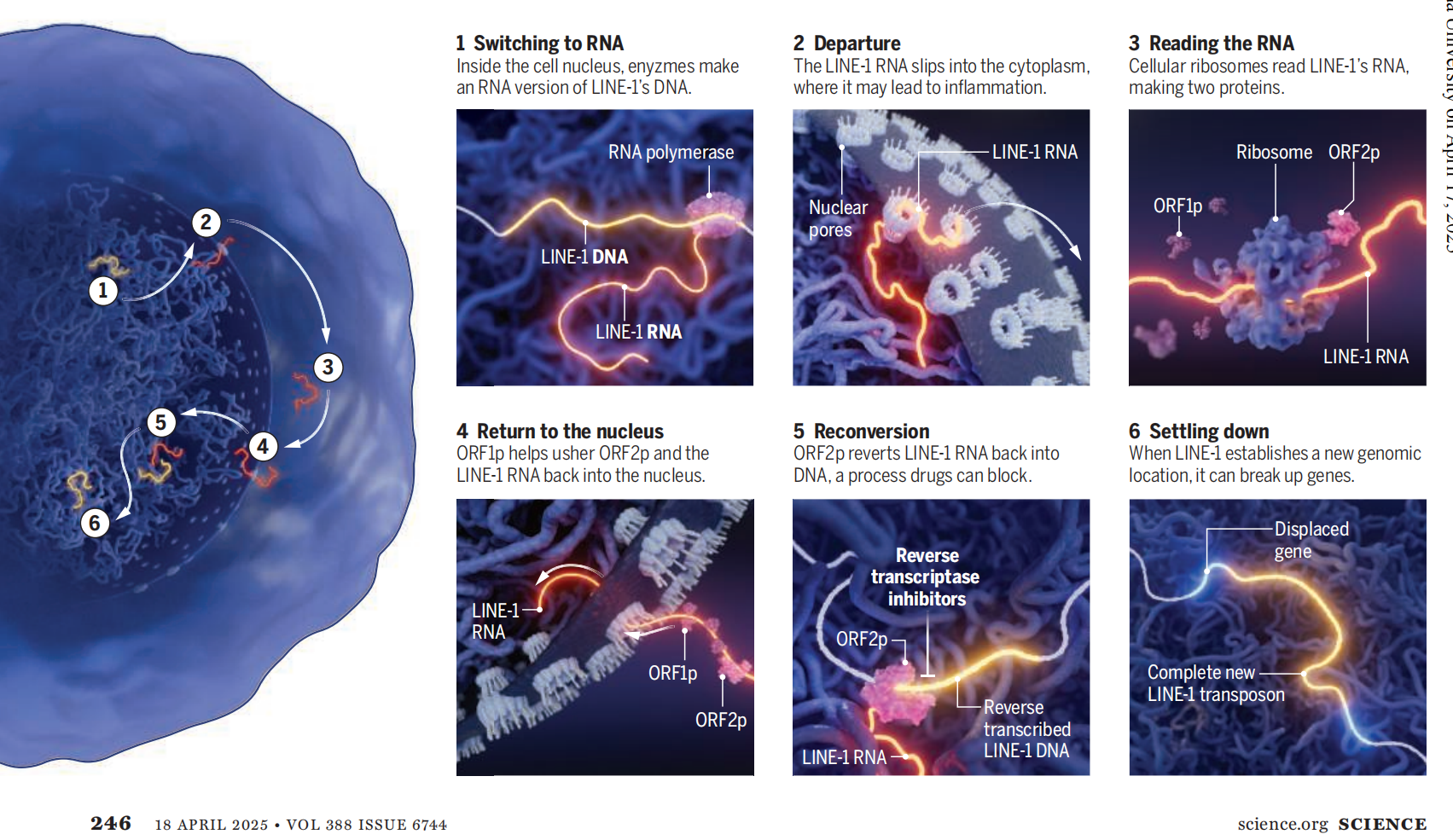
自遗传学家芭芭拉·麦克林托克(Barbara McClintock)在玉米中对这类可转座元件开展开创性研究以来,大约80年的时间里,生物学家们已经认识到基因组中包含一些可以移动的片段。麦克林托克的这项研究为她赢得了1983年的诺贝尔生理学或医学奖。许多转座子只是简单地从染色体上切割下来,然后转移到一个新的位置。但像LINE-1这样的逆转座子能够自我复制。一个位置上的逆转座子DNA序列可以产生一个RNA拷贝,然后这个RNA拷贝会成为新的DNA复制品的模板,新的DNA复制品会插入到其他位置(见下图)。
活跃的DNA
大约有100个LINE-1转座子拷贝能够自我复制,并在我们的基因组中 “殖民” 新的位置。这些跳跃依赖于细胞酶以及由LINE-1自身DNA编码的蛋白质。由于这种活动可能会引发疾病,研究人员和生物技术公司正在寻找阻止它的方法。
1. 转录为RNA
在细胞核内,酶会将LINE-1的DNA转录成RNA版本。
2. 离开细胞核
LINE-1的RNA进入细胞质,在那里它可能会引发炎症。
3. 读取RNA
细胞核糖体读取LINE-1的RNA,产生两种蛋白质。
4. 返回细胞核
开放阅读框1蛋白(ORF1p)帮助引导开放阅读框2蛋白(ORF2p)和LINE-1的RNA返回细胞核。
5. 重新转化
ORF2p将LINE-1的RNA重新转化为DNA,药物可以阻断这一过程。
6. 稳定下来
当LINE-1在基因组中找到一个新的位置后,它可能会破坏基因。
A. 费舍尔(A. Fisher)/《科学》杂志
逆转座子在人类基因组中占了很大比例——仅LINE-1就占了17%。相比之下,传统基因只占基因组的约2%。“想到我们体内的逆转座子比真正属于人类自身的基因还要多,真让人觉得自己很渺小。” 华盛顿大学的免疫学家托马斯·穆斯泰林(Tomas Mustelin)说。
一些逆转座子是感染了我们祖先的RNA病毒的残余。还有一些显然是细胞在偶然情况下将正常的RNA分子转化为DNA版本,并使其滑入基因组而形成的。LINE-1的历史可以追溯到10亿多年前,它与细菌中的序列相似。当产生线粒体(细胞的能量产生细胞器)的古老细菌进入细胞并定居时,LINE-1的祖先可能就渗入了基因组。
我们基因组中的50万个LINE-1拷贝,大多数随着时间的推移已经退化,不再能够移动。然而,大约有100个这种逆转座子拷贝,分散在染色体中,能够诱使细胞复制它们,并将复制品强行插入到我们DNA的新位置上。穆斯泰林说,在生命的历史进程中,LINE-1及其类似序列一直是一股创造性的力量。“逆转座子在多细胞生物的进化过程中发挥了重要作用。它们带来了许多基因组创新,并促进了基因组规模的增长。”
想到我们体内的逆转座子比真正属于人类自身的基因还要多,真让人觉得自己很渺小。
华盛顿大学托马斯·穆斯泰林
然而,从短期来看,最近的研究结果表明它们的影响可能是有害的。研究人员知道,转座子在哺乳动物细胞的胚胎发育过程中会四处跳跃。但他们认为,在这一阵活跃期过后,细胞基本上能够控制好转座子。成年动物细胞会收紧基因组中这些寄生序列所在的部分,将复制它们所需的酶拒之门外。
但塞迪维和其他研究人员最近发现,在许多非胚胎细胞中,转座子能够逃脱这些限制。2013年,他和同事在研究细胞衰老(一种半休眠状态,处于这种状态的衰老或受损细胞会失去分裂能力)时偶然发现了这一现象。他们注意到,LINE-1 RNA的水平(转座子活性的一个指标)在人类细胞进入衰老状态后急剧上升。塞迪维从上世纪90年代就开始研究细胞衰老,但他说这一发现改变了他的职业生涯方向。“我算是转而研究逆转座子了。”
后来的研究证实,衰老会激活潜伏的转座子,而且在许多炎症性和神经退行性疾病中,成年细胞中的转座子也会活跃起来。身体的某些部位似乎特别容易受到影响。“越来越清楚的是,中枢神经系统对LINE-1的激活尤其 ‘宽容’。” 塞迪维说。此外,“我们肯定知道它们在大量癌症中更为活跃。” 马萨诸塞州总医院的癌症生物学家大卫·丁(David Ting)说。一项研究发现,在至少31%的肿瘤中,转座子都处于活跃移动状态。
罗切斯特大学医学中心的分子生物学家维拉·戈尔布诺娃(Vera Gorbunova)说,这些疾病各不相同,但可能存在一个共同的线索。就像我们的下巴和腹部会随着年龄增长而松弛一样,我们基因组的某些部分也会如此。“我们失去了控制转座子的机制。” 她说。这种基因组的 “解旋” 不仅会随着年龄增长而发生,在阿尔茨海默病、肌萎缩侧索硬化症、癌症和狼疮等疾病中也会出现。
这一过程可能会以意想不到的方式造成危害。多年来,传统观点认为,只有当转座子在其插入位点改变了DNA,在现有基因中产生突变或破坏遗传控制序列时,它的移动才会成为一个问题。这样的变化可能会引发癌症,或者如果发生在生殖细胞中,会导致遗传疾病。
荧光标记凸显了分散在人类染色体中的众多LINE-1转座子中的一部分。
V. 米利奥托(V. Milioto)等人,《MDPI》,13:1742(2022),DOI: 10.3390/MDPI.2022.07.07
但研究人员发现,当活跃的逆转座子的RNA拷贝被释放到细胞质中时,也会引发问题。玛格丽特公主癌症中心的癌症生物学家丹尼尔·德·卡瓦略(Daniel De Carvalho)说,许多这样的序列 “具有与病毒序列难以区分的分子模式”。2015年,他和其他研究人员报告称,逆转座子RNA可以折叠成类似病毒基因组的双链形状,从而触发细胞的病毒检测机制。这些RNA还能进一步产生其他类型的分子,包括双链DNA和RNA-DNA杂交体,它们也能触发细胞的入侵警报。
其结果是,转座子活跃的细胞往往表现得就像受到了病毒攻击一样。它们采取的应对措施之一是大量产生I型干扰素,这是一种能够协调各种防御反应的蛋白质。它们还能引发炎症,而炎症与一系列疾病相关,也是衰老的一个特征。塞迪维说,这一发现出乎他们的意料。他和其他试图了解转座子影响的科学家 “当时并没有考虑到干扰素”,他说,“我们考虑的是DNA损伤”。
为了抑制细胞内的这种混乱情况,研究人员和生物技术公司将目标对准了对LINE-1移动性至关重要的一种蛋白质:开放阅读框2蛋白(ORF2p)。这种由转座子DNA编码的蛋白质,除了其他功能外,还充当逆转录酶,将转座子RNA复制成DNA拷贝,这样LINE-1就可以插入到基因组中。由于一些RNA病毒,如艾滋病病毒(HIV)和乙肝病毒,依赖于逆转录酶的不同形式来感染细胞,研究人员已经开发出了多种被称为逆转录酶抑制剂的药物,这些药物可以阻断这些酶的作用。
这些抑制剂不会阻止LINE-1产生最初的RNA拷贝,但它们可以中断复制过程,并减少能够触发病毒检测机制的DNA-RNA杂交体和双链DNA的形成。而且一些研究表明,这些抑制剂还能阻止促进炎症的细胞控制中心发挥作用。因此,研究人员希望这些药物能够抑制I型干扰素的释放并减轻炎症。
在他们对果蝇的研究中,弗罗斯特及其同事选择了一种已获批的艾滋病病毒逆转录酶抑制剂。转座子治疗公司重新启用了一种不同的化合物,其开发者在针对艾滋病病毒的2期临床试验后,因经济原因放弃了这种化合物。“它当时就在日本的实验室架子上放着。” 塞迪维说。事实证明,这种名为TPN-101的药物对LINE-1的抑制作用比对艾滋病病毒的抑制作用更强。
去年,该公司公布了TPN-101针对三种LINE-1活跃的神经退行性疾病(进行性核上性麻痹、肌萎缩侧索硬化症和额颞叶痴呆)的2期临床试验的有前景的结果。在进行性核上性麻痹患者中,这种药物降低了神经丝轻链蛋白(NfL)的水平,这是一种由死亡或濒临死亡的神经元释放的蛋白质,同时也降低了炎症指标。在肌萎缩侧索硬化症和额颞叶痴呆患者中,TPN-101不仅降低了NfL水平,还将肺活量(衡量呼吸肌力量的一个指标,在这些疾病中会下降)的下降幅度减少了50%。
纪念斯隆·凯特琳癌症中心的计算生物学家本杰明·格林鲍姆(Benjamin Greenbaum)指出,然而,像TPN-101这样现有的药物 “并不是为抑制LINE-1的目的而设计的”。这就是他和丁共同创立罗马治疗公司(ROME Therapeutics)的原因。凯尔哈克说,该公司已经开发出了几百种专门用于阻断LINE-1的ORF2p的新化合物。罗马治疗公司尚未启动任何临床试验,但已经展示了在实验动物和人类细胞研究中取得的积极成果。例如,去年该公司公布的研究结果表明,其一种化合物提高了模拟帕金森病的小鼠的脑细胞存活率。
2024年发表在《自然》杂志上的两项研究,通过首次提供ORF2p蛋白的高分辨率三维结构视图,可能有助于研究人员设计出更好的ORF2p抑制剂。这两个研究团队独立开展工作,但都不得不应对同一个问题——收集足够的ORF2p用于研究。其中一个团队通过基因改造昆虫细胞来生产这种蛋白质。然而,每个细胞只能安全地制造出极少量的ORF2p。“瓶颈在于这种酶对细胞非常有毒性。” 加州大学伯克利分校的分子与结构生物学家阿坎莎·萨瓦尼(Akanksha Thawani)说。
她和她的同事需要20升的细胞才能合成足够量的这种蛋白质。他们使用一种称为冷冻电子显微镜的蛋白质图谱绘制方法,确定了当ORF2p准备将LINE-1的RNA复制成DNA版本时,它会与RNA分子的尾部结合。她说,阻断这种相互作用可能为抑制这种蛋白质提供一个新的机会。

在这种矮牵牛品种中,一些花细胞中转座子活性的释放使它们呈现出红色或粉色,而正常情况下是白色的。
米希尔·范登布舍(Michiel Vandenbussche)
在第二项研究中,泰勒、格林鲍姆及其同事通过基因改造细菌,使其大量产生足够的ORF2p核心部分,以便制成晶体进行分析。他们找到了一些逆转录酶抑制剂对艾滋病病毒有效但对LINE-1无效的原因。艾滋病病毒的逆转录酶有一个可以容纳这些药物的 “口袋”,药物进入后会使酶失去活性。然而,科学家们报告称,ORF2p缺乏这一特征——这是另一个可能有助于药物开发者开发出更好的LINE-1阻断剂的线索。
研究人员渴望在神经退行性疾病和癌症之外的疾病中试用这些药物。狼疮,一种常见的自身免疫性疾病,就是其中之一。狼疮患者不仅通常会产生高水平的I型干扰素,而且他们的血细胞中也可能充满转座子RNA。“我们还没有确凿的证据” 证明转座子活性会引发这种疾病,密歇根大学的分子免疫学家J. 米歇尔·卡伦伯格(J. Michelle Kahlenberg)说。但针对LINE-1的化合物可能会缓解症状。而且它们对患者来说可能比目前的狼疮药物更容易耐受,目前的狼疮药物会广泛抑制免疫系统,“基本上就像一把大锤,作用太粗暴”,她说。
卡伦伯格及其同事已经在狼疮患者的细胞上测试了罗马治疗公司的一些LINE-1抑制剂。I型干扰素会激活许多基因,但在2024年,科学家们表明,其中两种候选药物阻止了皮肤组织样本中基因活性的增加。然而,卡伦伯格警告说,“现在还为时尚早”。
另一个有吸引力的目标是衰老。2022年的一项在模拟早老症(Hutchinson-Gilford progeria syndrome,HGPS,会产生类似过早衰老的症状)的小鼠身上的研究结果暗示,抑制LINE-1可能会减缓随着年龄增长而出现的身体机能衰退。研究人员在《科学·转化医学》杂志上报告称,当他们使用被称为反义寡核苷酸的小分子链降低小鼠体内LINE-1转座子的水平时,这些小鼠的寿命比未接受治疗的小鼠延长了约25%。该研究团队的负责人之一是干细胞生物学家胡安·卡洛斯·伊兹皮苏亚·贝尔蒙特(Juan Carlos Izpisua Belmonte),他刚刚离开索尔克研究所,加入了阿尔托斯实验室(Altos Labs),这是一家致力于 “细胞年轻化” 的初创公司,获得了约30亿美元的资金支持。阿尔托斯实验室尚未公开证实它是否在采用同样的方法,但伊兹皮苏亚·贝尔蒙特表示,针对转座子的反义寡核苷酸是 “促进健康寿命的一个极具潜力的候选物质,值得进一步研究其在衰老干预方面的潜力”。
戈尔布诺娃说,对于抗衰老研究人员来说,从小鼠研究到人类研究还有很长的路要走,在人类身上证实一种药物能够延长寿命可能需要几十年的时间。但她指出,一些较短时间的研究如果能显示出衰老指标的积极变化,比如可以作为衰老时钟的DNA上的甲基化模式的变化,可能会提供关键证据。戈尔布诺娃说,从事抗衰老研究的研究人员 “需要一些新的东西,而抑制转座子显示出了巨大的潜力”。
许多研究人员表示,这种新方法不会带来轰动性的治愈效果。他们所针对的疾病和状况过于复杂,存在多种病理机制。例如,在阿尔茨海默病中,“可转座元件绝对不是唯一出问题的因素”,弗罗斯特说。在癌症中可能也是如此。当丁和同事在结直肠癌患者中测试拉米夫定时,他们发现这种药物抑制了肿瘤的生长,但并没有杀死异常细胞。他说,这些药物最有用的地方可能是增强当前的治疗效果。“我一直希望将(转座子抑制)药物与化疗结合使用,看看会有什么效果。”
一些该领域的研究人员也担心,为了对抗衰老或特定疾病而让人们长期服用转座子抑制剂的想法。目前这一代的逆转录酶抑制剂似乎很少产生副作用——一些艾滋病患者已经服用了几十年。但更有效的转座子抑制剂可能会有一些意想不到的缺点,尤其是如果这些序列对正常功能至关重要的话,穆斯泰林说。“该领域越来越多的人认为,逆转座子已经被用于许多生理过程。”
例如,它们可能有助于身体产生新的血细胞。2024年发表在《科学》杂志上的一项研究表明,逆转座子的活性,可能是通过促进I型干扰素的释放,帮助唤醒了怀孕或大量失血的小鼠骨髓中休眠的干细胞,使这些动物能够增加血细胞的生成。
穆斯泰林不希望关于转座子抑制剂的临床研究放缓,但他认为研究人员需要仔细观察那些跳跃基因被抑制的患者是否会出现严重的副作用。“在临床试验完成之前,我们可以随意猜测,但我们不会有任何确凿的证据。”
https://wap.sciencenet.cn/blog-41174-1482455.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:大型海底富氢气热液系统【中国学者】