 精选
精选
衰老和疾病状态下糖萼失调损害血脑屏障《自然》
血脑屏障(BBB)具有高度特异性,可保护大脑免受血液中有害循环因子的侵害,并维持大脑的内环境稳态【1,2】。大脑内皮细胞糖萼层是一层富含碳水化合物的网状结构,主要由蛋白聚糖、糖蛋白和糖脂组成,覆盖在血脑屏障的管腔表面,是血脑屏障的关键结构组成部分【3,4】。这一层构成了血液与脑血管之间的首个界面,然而,对于它在体内平衡和患病状态下的组成成分,以及在支持血脑屏障功能方面所起的作用,我们知之甚少。在此,我们发现大脑内皮细胞糖萼在衰老和神经退行性疾病过程中会出现高度失调。我们确定了一类此前未被充分研究的、高度O-糖基化的蛋白质(即粘蛋白结构域糖蛋白)发生了显著扰动。我们证明,与衰老和疾病相关的大脑内皮细胞粘蛋白结构域糖蛋白的异常会导致血脑屏障功能失调,在严重情况下,还会引发小鼠脑出血。最后,我们证明,通过使用腺相关病毒将核心1型粘蛋白型O-聚糖恢复到大脑内皮细胞中,我们能够改善老年小鼠的血脑屏障功能,并减少神经炎症和认知缺陷。总体而言,我们的研究结果为衰老过程中大脑内皮细胞糖萼层提供了详细的组成和结构图谱,并揭示了与衰老和疾病相关的糖萼失调对血脑屏障完整性和大脑健康的重要影响。
AI总结:
这篇论文研究了在衰老和疾病过程中,糖萼(glycocalyx)失调对血脑屏障(BBB)的影响。
研究背景:
问题:血脑屏障(BBB)是保护大脑免受血液中有害因素侵害的重要结构,但其功能失调在衰老和神经退行性疾病中非常常见。
难点:尽管糖萼层是BBB的重要组成部分,但关于其在稳态和疾病状态下的组成和作用了解甚少。
相关工作:现有研究表明,糖萼层的失调可能导致BBB功能受损,但具体机制尚不明确。
研究方法:
使用透射电子显微镜(TEM)和镧硝酸盐染色观察年轻(3个月大)和年老(21个月大)小鼠大脑内皮糖萼层的变化,发现年老小鼠的糖萼层显著减少。
通过RNA测序分析年轻和年老小鼠大脑内皮细胞的转录组数据,发现与糖基化相关的基因表达显著失调,特别是硫酸乙酰肝素代谢基因的上调和粘蛋白型O-糖基化生物合成基因的下调。
使用免疫荧光和流式细胞术分析大脑内皮细胞的糖基化状态,发现年老小鼠中透明质酸、硫酸乙酰肝素和硫酸软骨素的表达增加,而粘蛋白域糖蛋白的表达减少。
通过腺相关病毒(AAV)介导的基因敲降和过表达实验,研究C1GALT1和B3GNT3基因对BBB功能的影响。
实验设计:
使用AAV9衍生的PHP.V1衣壳和简化的CLDN5启动子构建了针对C1galt1基因的AAV载体(AAV-miR-C1galt1),并在3个月大的小鼠中进行静脉注射。
通过Sulfo-NHS-生物素示踪剂评估BBB通透性,发现AAV-miR-C1galt1处理的小鼠出现BBB渗漏,表现为皮质血管外的生物素泄漏热点。
进一步研究显示,StcE处理导致大脑内皮细胞中氧化应激增加和紧密连接蛋白减少,导致BBB功能失调和大面积脑出血。
结果与分析:
年老小鼠大脑内皮糖萼层的厚度和面积显著减少,糖基化相关基因表达失调。
AAV介导的C1GALT1和B3GNT3过表达显著改善了年老小鼠的BBB功能,减少了神经炎症标志物的表达,并改善了认知功能。
行为学测试(Y迷宫和恐惧条件反射测试)显示,AAV-B3GNT3处理的小鼠在空间工作记忆和海马依赖性学习和记忆方面表现出显著改善。
总体结论:
这篇论文揭示了大脑内皮糖萼失调在衰老和神经退行性疾病中导致BBB功能障碍的分子机制,并证明了通过AAV介导的基因过表达恢复糖萼功能可以有效改善BBB完整性和大脑健康。
这些发现为开发针对年龄相关中枢神经系统疾病的新型治疗策略提供了重要的理论基础。
Glycocalyx dysregulation impairs blood–brain barrier in ageing and disease | Nature
血脑屏障在血液和大脑之间形成了一个严格调控的血管界面,这对于维持大脑的正常功能至关重要。血脑屏障的高度限制性源于大脑内皮细胞的独特特性,包括特化的紧密连接、极低的液相胞吞转运速率,以及选择性的流入和流出转运蛋白【1,2】。大脑内皮细胞糖萼层对血脑屏障功能的作用正日益受到认可【3,4】。糖萼层是由聚糖和糖结合物(蛋白聚糖、糖蛋白和糖脂)组成的复杂网状结构,覆盖在血脑屏障的管腔表面,更广泛地说,它介导了许多细胞表面过程,包括细胞信号传导、黏附、运输和形态形成【3,5,6】(图1a)。尽管糖萼层是任何血液来源的因子进入血脑屏障的第一道屏障,但我们对大脑内皮细胞糖萼层的组成和功能作用知之甚少。此外,血脑屏障功能障碍,通常表现为血管对神经毒性和炎症性循环因子的通透性增加,是衰老和神经退行性疾病的一个关键病理特征【2,7,8,9】。然而,目前缺乏研究探讨糖萼在这一过程中所起的作用。在这里,我们对衰老和疾病相关的大脑内皮细胞糖萼的结构和组成变化进行了分析,以确定在这些状态下糖萼失调如何导致血脑屏障功能障碍。
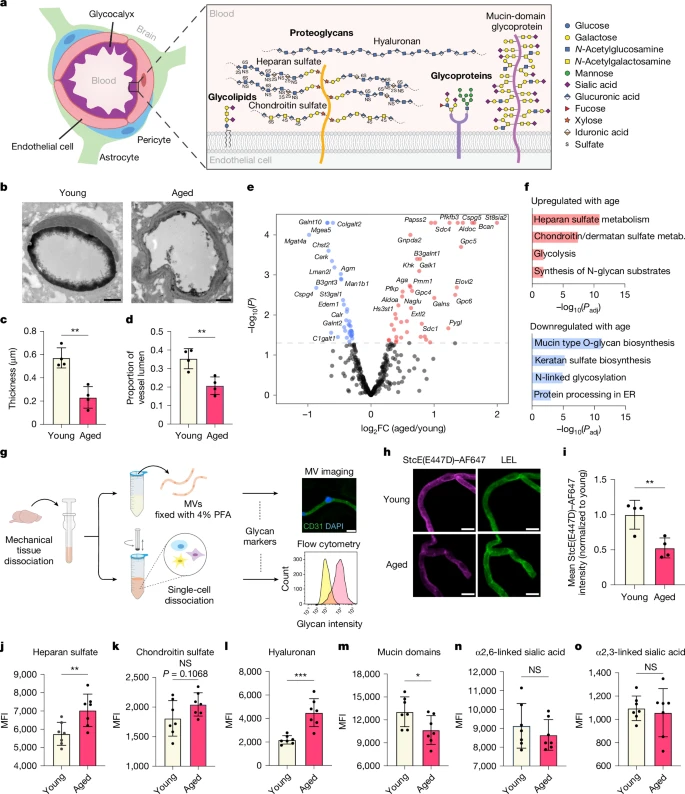
图1:衰老过程中大脑内皮细胞糖萼高度失调。
a. 血脑屏障和大脑内皮细胞糖萼层的示意图。糖萼成分相对大小的近似表示方法见补充说明。b. 对年轻(3个月大)和年老(21个月大)小鼠的皮质毛细血管进行硝酸镧染色后的透射电子显微镜(TEM)图像。比例尺为1微米。c. 年轻(3个月大)和年老(21个月大)小鼠管腔内内皮细胞糖萼厚度的定量分析(每组n = 4只小鼠;双侧t检验;平均值±标准误)。d. 年轻(3个月大)和年老(21个月大)小鼠管腔内内皮细胞糖萼面积的定量分析(每组n = 4只小鼠;双侧t检验;平均值±标准误)。e. 年轻(3个月大)和年老(19个月大)小鼠大脑内皮细胞中差异表达的糖基化相关基因的火山图(随年龄上调的基因用红色表示,随年龄下调的基因用蓝色表示)。原始的批量RNA测序(RNA-seq)数据来自Yousef等人的研究【12】。f. 大脑内皮细胞中随年龄上调和下调的主要糖基化相关通路。ER表示内质网;metab.表示代谢。g. 通过微血管(MV)成像和流式细胞术对大脑内皮细胞的聚糖和糖结合物进行分析的实验方案。PFA表示多聚甲醛。h. 急性分离的微血管中粘蛋白结构域糖蛋白的表达以及番茄凝集素(LEL;内皮细胞标记物)的标记。比例尺为10微米。AF647表示Alexa Fluor 647。i. 对h的定量分析(每组n = 4只小鼠;双侧t检验;平均值±标准误)。j - o. 年轻(3个月大)和年老(21个月大)小鼠机械分离的大脑内皮细胞上硫酸乙酰肝素(j;通过10E4抗体检测)、硫酸软骨素(k;通过CS-56抗体检测)、透明质酸(l;通过透明质酸结合蛋白(HABP)检测)、粘蛋白结构域糖蛋白(m;通过StcE(E447D)–AF647检测)、α2,6连接的唾液酸(n;通过黑接骨木凝集素(SNA)检测)和α2,3连接的唾液酸(o;通过马褂木凝集素II(MAAII)检测)的中位荧光强度(MFI)(每组n = 7只小鼠;双侧t检验;平均值±标准误)。NS表示无显著性差异。
衰老过程中的糖萼失调
为了初步表征与衰老相关的大脑内皮细胞糖萼层的整体结构变化,我们使用透射电子显微镜(TEM)结合硝酸镧染色,来观察年轻(3个月大)和年老(21个月大)小鼠的大脑内皮细胞糖萼层。传统的血脑屏障电子显微镜无法观察到糖萼层,但在样本中加入阳离子金属染色剂,如硝酸镧或钌红,可显示出血管管腔表面有一层大量的聚糖【4,10,11】(图1b)。我们观察到,与年轻小鼠相比,年老小鼠皮质毛细血管的管腔糖萼层明显减少(图1b - d和扩展数据图1a - d)。定量分析表明,随着年龄的增长,糖萼的平均厚度(0.540±0.086微米对比0.232±0.092微米)和平均面积(占管腔面积的比例,0.367±0.054对比0.207±0.047)均有所下降(图1c,d)。
为了确定可能导致这些与衰老相关的糖萼异常的糖结合物类别(图1a),我们分析了我们实验室之前从年轻(3个月大)和年老(19个月大)小鼠的大脑内皮细胞中收集的批量RNA测序(RNA-seq)数据集【12】。我们发现,许多与糖基化相关的基因在衰老过程中出现了显著失调(图1e)。通路分析显示,与年轻的大脑内皮细胞相比,年老的大脑内皮细胞中参与硫酸乙酰肝素代谢的基因(Sdc4、Hs3st1、Extl2和Gpc5)显著上调,而参与粘蛋白型O-聚糖生物合成的基因(Galnt10、B3gnt3、Galnt2和C1galt1)则显著下调(图1e,f)。
为了确定这些转录变化是否反映在细胞表面糖基化水平上,我们通过成像和基于流式细胞术的检测方法,直接分析了大脑内皮细胞的糖基化情况。我们使用了一组对几类主要聚糖、糖结合物和特定单糖具有选择性的抗体和结合蛋白(图1g)。大脑中广泛的细胞外基质使得使用传统的浸泡染色方法在完整的脑切片中难以对许多聚糖和糖结合物进行可靠的内皮细胞特异性定量分析。因此,我们优化了将脑组织解离成微血管或单个细胞的方法,并一致发现,与常用的酶解方法相比,机械解离方法能更好地保留大脑内皮细胞糖萼的染色情况【12,13,14】(图1g和扩展数据图2a)。对年轻和年老小鼠急性分离的微血管进行荧光成像显示,随着年龄的增长,透明质酸(通过透明质酸结合蛋白(HABP)检测)、硫酸乙酰肝素(通过10E4抗体检测)和硫酸软骨素(通过CS-56抗体检测)的表达显著增加,粘蛋白结构域糖蛋白(通过StcE(E447D)检测)的表达显著降低,而α2,6或α2,3连接的唾液酸(分别通过黑接骨木凝集素(SNA)和马褂木凝集素II(MAAII)检测)或末端N-乙酰半乳糖胺(通过绒毛野豌豆凝集素(VVA)检测)的表达则没有显著变化(图1h,i和扩展数据图2b - i)。对急性分离的大脑内皮细胞进行流式细胞术分析也得到了一致的结果,这在很大程度上也与我们在RNA测序分析中确定的失调的糖基化通路相符(图1j - o和扩展数据图2j)。
综上所述,这些数据表明,大脑内皮细胞表面的糖基化在衰老过程中会经历显著的结构和组成变化,这在一定程度上可能是由转录变化所决定的。值得注意的是,之前有报道称,在衰老和神经退行性疾病状态下,血管上的透明质酸和硫酸乙酰肝素会增加,并且通常与血脑屏障功能受损和阿尔茨海默病的病理过程相关【15,16,17,18,19】。然而,据我们所知,粘蛋白型O-糖基化的下调之前尚未被认为与衰老相关的血脑屏障损伤有关,因此我们进一步研究了这一发现。
粘蛋白型O-糖基化下调
粘蛋白型O-糖基化是一种翻译后修饰,由通过丝氨酸和苏氨酸残基与蛋白质相连的α-N-乙酰半乳糖胺(α-GalNAc)引发的聚糖组成。密集的粘蛋白型O-糖基化区域形成粘蛋白结构域,这些结构域呈现出扩展的毛刷状结构,具有独特的生物物理和生化特性。尽管这些结构域传统上是在经典的粘蛋白(MUC)蛋白家族中进行研究的,而MUC蛋白家族在黏膜上皮细胞中高度表达,但除了MUC家族之外,还有许多含有粘蛋白结构域的糖蛋白在组织中广泛表达,并介导多种细胞表面过程,包括调节膜形态、信号传导和细胞间相互作用【6,20,21,22】。尽管这一类糖蛋白尚未在脑血管上进行整体研究,但许多粘蛋白结构域糖蛋白在大脑内皮细胞中大量表达,包括PODXL、CD34和DAG1(补充表1和补充图1)。为了评估粘蛋白结构域糖蛋白对大脑内皮细胞糖萼层的贡献,我们利用了一组源自一种广泛切割的细菌粘蛋白酶(称为C1酯酶抑制剂分泌蛋白酶(StcE))的重组粘蛋白选择性蛋白【22,23,24】(扩展数据图3a)。StcE具有一种独特的基于肽和聚糖的切割基序,对粘蛋白结构域具有特异性【23】。利用这种特异性,之前开发了Alexa Fluor 647(AF647)偶联的催化失活的StcE(StcE(E447D)–AF647)作为一种粘蛋白选择性染色试剂【22】,并在本研究中用于通过心内灌注标记管腔粘蛋白结构域糖蛋白,而不受管腔外糖蛋白的干扰(扩展数据图3a - e)。这项技术显示,年轻小鼠的管腔粘蛋白结构域糖蛋白染色强烈,而年老小鼠的染色较弱且更不均匀(图2a,b)。值得注意的是,这种管腔StcE(E447D)–AF647信号随年龄的下降似乎是大脑特有的;我们观察到,随着年龄的增长,心脏或肝脏中的管腔粘蛋白结构域糖蛋白覆盖情况几乎没有差异(扩展数据图3f - i)。尽管StcE(E447D)和SNA之间存在一些底物特异性重叠,但灌注Cy3偶联的SNA(SNA - Cy3)显示,年轻和年老小鼠的管腔脑血管标记没有显著差异(扩展数据图2k,l)。此外,给年轻小鼠静脉注射0.25 mg/kg的具有酶活性的StcE,24小时后,通过硝酸镧染色的透射电子显微镜观察到,大脑内皮细胞糖萼层显著降解(图2c - e和扩展数据图1e,f)。这些数据表明,粘蛋白结构域糖蛋白是大脑内皮细胞糖萼层的关键结构组成部分,并表明它们的失调可能导致在衰老过程中观察到的糖萼层结构损伤(图1b)。
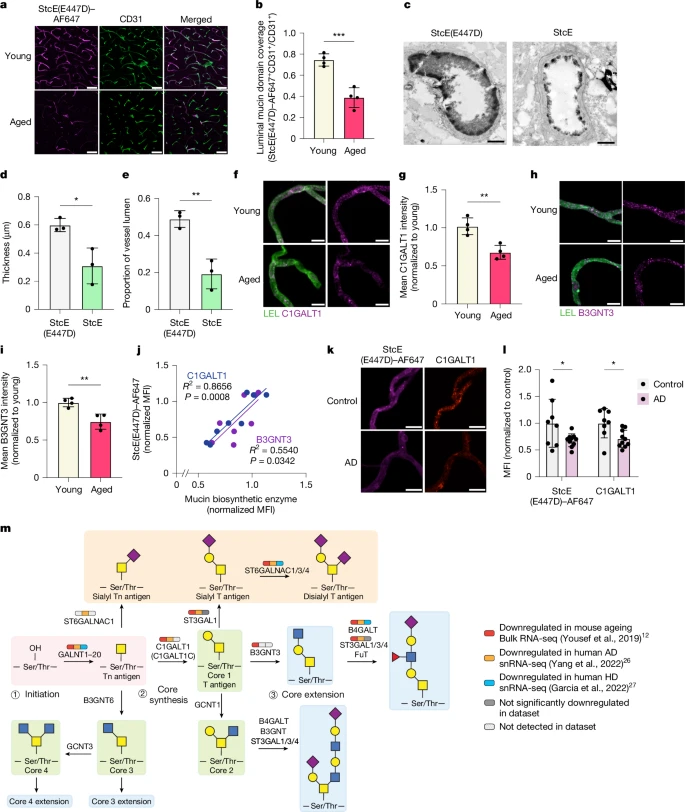
图2:在衰老和神经退行性疾病过程中,大脑内皮细胞中的粘蛋白型O-糖基化下调。
a. 基于StcE(E447D)–AF647标记的CD31<sup>+</sup>皮质血管中管腔粘蛋白结构域糖蛋白的表达情况。比例尺为20微米。b. 对a的定量分析(每组n = 4只小鼠;双侧t检验;平均值±标准误)。c. 用StcE(E447D)或StcE处理24小时后,小鼠皮质毛细血管经硝酸镧染色后的透射电子显微镜(TEM)图像。比例尺为1微米。d. 对用StcE(E447D)或StcE处理的小鼠管腔内内皮细胞糖萼厚度的定量分析(每组n = 3只小鼠;双侧t检验;平均值±标准误)。e. 对用StcE(E447D)或StcE处理的小鼠管腔内内皮细胞糖萼面积的定量分析(每组n = 3只小鼠;双侧t检验;平均值±标准误)。f. 用番茄凝集素(LEL)标记的急性分离微血管中C1GALT1的表达情况。比例尺为10微米。g. 对f的定量分析(每组n = 4只小鼠,双侧t检验;平均值±标准误)。h. 用番茄凝集素(LEL)标记的急性分离微血管中B3GNT3的表达情况。比例尺为10微米。i. 对h的定量分析(每组n = 4只小鼠,双侧t检验;平均值±标准误)。j. 急性分离微血管中StcE(E447D)与C1GALT1(蓝色)或B3GNT3(紫色)表达之间的线性相关性。k. 阿尔茨海默病(AD)患者和年龄匹配的对照者大脑中,急性分离微血管中C1GALT1和粘蛋白结构域糖蛋白的表达情况。比例尺为10微米。l. 对m的定量分析(n = 8个对照样本和10个阿尔茨海默病样本,双侧t检验;平均值±标准误)。m. 粘蛋白型O-聚糖生物合成途径。在小鼠衰老、阿尔茨海默病和亨廷顿病(HD)的RNA测序数据集中【12,26,27】,观察到大脑内皮细胞核心1型粘蛋白型O-聚糖生物合成酶存在广泛的转录下调现象。
通过StcE(E447D)–AF647标记所显示的粘蛋白结构域标记随年龄增长而减少的现象,可能是由于粘蛋白型O-糖基化水平降低(正如我们的批量RNA测序数据所显示的那样,见图1e、f),也可能是由于粘蛋白结构域糖蛋白支架本身减少。为了验证后一种可能性,我们向小鼠灌注了不可透过细胞膜的磺基-NHS-生物素,对年轻和年老小鼠的管腔富集脑血管蛋白质组进行了比较,用生物素标签对管腔蛋白进行化学修饰,随后通过基于质谱的蛋白质组学分析对其进行富集(扩展数据图4a - c和补充图2a - c)。我们鉴定出了1080种独特的蛋白质,基因本体论(GO)术语分析证实,定位于细胞膜和周边区域且参与细胞表面过程(包括细胞连接组织、黏附作用和运输过程)的蛋白质得到了显著富集(扩展数据图4d - f和补充数据1)。此外,我们观察到一些先前已知会随年龄增长而上调的脑内皮细胞膜蛋白出现了上调,包括ALPL和CAV125。然而,在我们的数据集中,NID1是唯一被检测到的显著下调的已知粘蛋白结构域糖蛋白,但年老小鼠中管腔StcE(E447D)–AF647信号的缺失与NID1信号的缺失并不相关(扩展数据图4f - i)。尽管我们受到粘蛋白结构域糖蛋白注释的可获得性以及液相色谱-串联质谱(LC–MS/MS)检测局限性的限制,但我们并未发现血管管腔上的粘蛋白结构域糖蛋白支架随年龄增长而明显减少。相比之下,我们观察到,与年轻小鼠相比,年老小鼠急性分离的脑微血管中粘蛋白型O-聚糖生物合成酶C1GALT1和B3GNT3的水平显著降低(图2f - i),这与我们的转录组数据一致。微血管中C1GALT1和B3GNT3的水平也与StcE(E447D)–AF647的标记强度密切相关(图2j),这进一步表明,粘蛋白型O-聚糖生物合成酶的下调可能导致了在衰老过程中观察到的粘蛋白结构域糖蛋白染色缺失。
考虑到在不同的中枢神经系统疾病状态下,许多与血脑屏障功能障碍相关的分子变化是相同的【7】,我们试图确定在我们的衰老数据集中观察到的脑内皮细胞糖萼失调的类似途径,是否也能在不同的神经退行性疾病中被观察到。我们对先前发表的阿尔茨海默病【26】和亨廷顿病【27】的单核RNA测序(snRNA-seq)数据集进行了差异糖基化相关基因分析,发现脑内皮细胞粘蛋白型O-聚糖生物合成是在这两种疾病数据集中都富集的一个共同下调的途径(扩展数据图5a - d)。尽管在任意两个数据集(衰老、阿尔茨海默病或亨廷顿病)之间,上调的糖基化相关基因几乎没有重叠,但在任意一个数据集中显著下调的糖基化相关基因中,大约有三分之一在另一个数据集中也存在(扩展数据图5e、f)。在19个共同下调的基因中,有8个是粘蛋白型O-聚糖生物合成酶(图2m和扩展数据图5f)。随后,我们通过染色证实,与年龄匹配的对照者相比,阿尔茨海默病患者大脑中急性分离的微血管中C1GALT1和粘蛋白结构域糖蛋白的水平降低(图2k、l)。这些数据表明,粘蛋白型O-糖基化的下调可能促成了在多种神经退行性状态下观察到的血脑屏障功能障碍的一种保守的糖基化特征。
血管功能损伤
为了测试粘蛋白型O-聚糖生物合成下调对血脑屏障功能的影响,我们采用了一种脑内皮细胞特异性的腺相关病毒(AAV)靶向方法,在体内敲低小鼠脑内皮细胞中*C1galt1*基因的表达(图3a)。C1GALT1催化将半乳糖添加到核心GalNAc-Ser/Thr残基上,生成核心1型O-聚糖,这是内皮细胞上一种重要的粘蛋白核心结构【28,29】(图2m)。选择敲低*C1galt1*基因,也是为了更好地理解在衰老和阿尔茨海默病中观察到的脑内皮细胞中该基因下调所产生的影响(图2a、b、k、l)。我们使用源自AAV9的衣壳PHP.V1【30】和一个简化的*CLDN5*启动子(sCLDN5),构建了AAV-PHP.V1-sCLDN5::EGFP-miR-E-C1galt1(以下简称AAV-miR-C1galt1),用于脑内皮细胞特异性敲低*C1galt1*基因。我们证实,与我们的对照病毒AAV-PHP.V1-sCLDN5::EGFP(以下简称AAV-EGFP)以及另外两种效果较差的靶向*C1galt1*的miR-E构建体AAV-miR-C1galt1-NE1和AAV-miR-C1galt1-NE2相比,AAV-miR-C1galt1转染bEnd.3细胞后,通过StcE(E447D)–AF647检测到的粘蛋白结构域标记减少(扩展数据图6a和补充表2)。给3个月大的小鼠静脉注射AAV-miR-C1galt1和AAV-EGFP八周后,我们在CD31<sup>+</sup>脑内皮细胞中检测到了强烈的EGFP表达(图3f)。此外,与AAV-EGFP相比,AAV-miR-C1galt1有效地降低了脑内皮细胞中C1GALT1的水平和StcE(E447D)–AF647的标记,其降低程度与年老小鼠相较于年轻小鼠所观察到的程度明显相似(图1h、i,图2f、g和图3b - d)。我们使用小分子示踪剂磺基-NHS-生物素(0.5 kDa)来评估血脑屏障的通透性,观察到用AAV-miR-C1galt1转导的小鼠出现了血脑屏障渗漏,在皮质血管外有许多磺基-NHS-生物素渗漏的热点区域(图3e - g和扩展数据图6b)。相比之下,用AAV-EGFP转导的小鼠,示踪剂仍局限在血脑屏障的管腔内,这表明它们的血脑屏障保持完整且功能正常。在用AAV-miR-C1galt1处理的小鼠皮质中也观察到了白蛋白和IgG的渗漏,且通常与磺基-NHS-生物素渗漏的区域共定位(扩展数据图6c - h)。这些结果表明,在衰老和神经退行性疾病中观察到的脑内皮细胞核心1型粘蛋白型O-聚糖生物合成酶的下调,可能导致了这些状态下血脑屏障功能的受损。
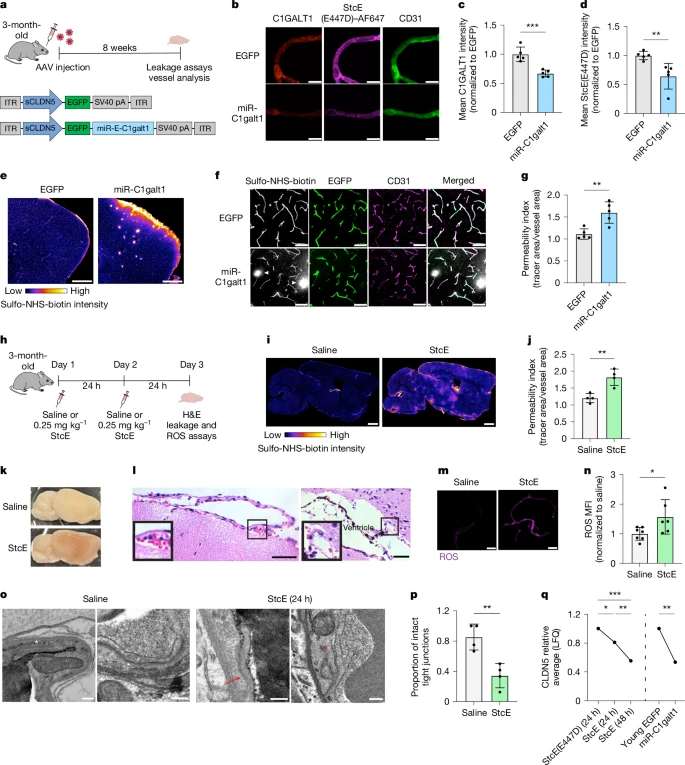
图3:脑内皮细胞粘蛋白型O-糖基化水平降低会增加血脑屏障的通透性并导致脑出血。
a. AAV介导的*C1galt1*基因敲低模式概述。ITR表示反向末端重复序列。b. 急性分离微血管中C1GALT1的表达和粘蛋白结构域糖蛋白的标记情况。比例尺为10微米。c. 对b中C1GALT1表达的定量分析(每组n = 5只小鼠,双侧t检验;平均值±标准误)。d. 对b中粘蛋白结构域糖蛋白标记的定量分析(n = 5只小鼠,双侧t检验;平均值±标准误)。e. 用AAV-EGFP和AAV-miR-C1galt1转导的年轻小鼠皮质中磺基-NHS-生物素的渗漏情况。比例尺为500微米。f. AAV-miR-C1galt1转导的小鼠中,EGFP<sup>+</sup>皮质血管的磺基-NHS-生物素渗漏情况(白色箭头所示)。比例尺为50微米。g. 对f中血管通透性的定量分析(每组n = 5只小鼠;双侧t检验;平均值±标准误)。h. 使用StcE处理48小时降解管腔粘蛋白结构域糖蛋白的模式概述。H&E表示苏木精-伊红染色。i. 用StcE处理48小时的小鼠全脑磺基-NHS-生物素渗漏图像。渗漏表现为浅色热点区域以及整个大脑中更高的总体信号。比例尺为1毫米。j. 对i中皮质血管通透性的定量分析(每组n = 4只小鼠;双侧t检验;平均值±标准误)。k. 用StcE处理48小时的小鼠大脑出现出血现象。l. 用StcE处理48小时的小鼠脑膜和脑室中脑出血的H&E图像。比例尺为50微米。m. 用StcE处理48小时的小鼠急性分离微血管中的活性氧(ROS)信号情况。比例尺为25微米。n. 对m中ROS信号的定量分析(每组n = 6 - 7只小鼠,双侧t检验;平均值±标准误)。o. 脑内皮细胞紧密连接的透射电子显微镜图像,显示了用生理盐水或StcE处理24小时的小鼠中完整的紧密连接(白色星号)和异常的紧密连接(分离,红色星号;不连续,红色箭头)。比例尺为200纳米。p. 对用生理盐水或StcE处理24小时的小鼠中完整紧密连接的定量分析(每组n = 4只小鼠;双侧t检验;平均值±标准误)。q. 通过质谱法对微血管中CLDN5进行无标记定量(LFQ)(每组n = 4 - 5只小鼠;双侧t检验;平均值±标准误)。
为了进一步测试对管腔粘蛋白型O-糖基化进行靶向破坏的效果,我们通过静脉注射StcE,在体内切割管腔粘蛋白结构域糖蛋白。我们发现,用StcE处理年轻小鼠24小时后,StcE(E447D)–AF647的标记显著减少,血脑屏障的通透性增加(扩展数据图7a - e)。此外,持续两天用StcE处理,导致血脑屏障功能出现更广泛、更严重的障碍,并且出现了意想不到的脑出血,在脑膜和脑室中有明显的红细胞渗漏(图3h - l和扩展数据图7f - h)。值得注意的是,在这个剂量下,我们在检测的血液中未观察到细胞因子风暴,在外周组织中也未观察到出血现象,这表明StcE处理没有引发严重的全身炎症反应或全身性血管破坏(扩展数据图7i,j)。先前的一项研究发现,C1galt1基因敲除(C1galt1−/−)的小鼠会发育出有缺陷的血管网络,并因中枢神经系统出血而在子宫内死亡【28】,这进一步表明脑血管可能对粘蛋白型O-聚糖的扰动格外敏感。
为了更好地理解粘蛋白降解所诱导的脑内皮细胞的分子变化,我们在StcE处理bEnd.3细胞16小时后,进行了批量RNA测序(扩展数据图8a,b)。差异基因表达分析显示,参与血管发育和完整性的基因(Fli1、Tie1和Hes1)、TGFβ信号通路的基因(Tgfbr2、Acvrl1和Tgfb2)以及氧化应激调节的基因(Gpx1、SelH和Txnrd1)显著下调(扩展数据图8c - g)。鉴于下调最显著的基因中包括活性氧(ROS)清除剂,我们进行了细胞ROS检测,发现用StcE处理的bEnd.3细胞以及从用StcE处理的小鼠中急性分离的脑微血管中,ROS生成增加(图3m,n和扩展数据图8h - k)。氧化应激增加会损伤大分子,并且与衰老和中枢神经系统疾病中的血脑屏障破坏有关【7,9,31】。对血脑屏障的超微结构分析显示,与用生理盐水处理的对照组相比,用StcE处理的小鼠中,异常、不连续的紧密连接出现的频率更高(图3o,p)。同样,质谱分析确定,在用StcE处理24小时后,包括CLDN5在内的紧密连接蛋白减少,在48小时时减少得更多,在C1galt1基因敲低后也有类似的情况(图3q和扩展数据图9a - d)。这些发现突显了粘蛋白结构域糖蛋白在维持脑内皮细胞内环境稳定和血脑屏障完整性方面的关键作用。
糖萼修复改善大脑内环境稳定
接下来,我们测试了是否可以通过在脑内皮细胞中过表达两种随年龄下调的粘蛋白型O-聚糖生物合成酶,即C1GALT1和B3GNT3,来逆转老年小鼠中脑内皮细胞粘蛋白型O-糖基化下调所带来的有害影响(图2f - i和图4a)。与转染AAV-EGFP相比,用AAV-PHP.V1-sCLDN5::EGFP-C1GALT1和AAV-PHP.V1-sCLDN5::EGFP-B3GNT3(以下分别简称AAV-C1GALT1和AAV-B3GNT3)质粒转染bEnd.3细胞后,通过StcE(E447D)–AF647检测到的粘蛋白结构域标记增加(扩展数据图6i)。给17个月大的小鼠注射AAV八周后,我们验证了所有构建体在CD31+脑内皮细胞中都有强烈的EGFP表达,并且与AAV-EGFP相比,转导AAV-C1GALT1和AAV-B3GNT3分别使脑内皮细胞中C1GALT1和B3GNT3的水平升高(图4b - e,h)。我们还观察到,与AAV-EGFP相比,用AAV-C1GALT1和AAV-B3GNT3转导的小鼠中,StcE(E447D)–AF647对脑血管的标记增加(图4f)。在评估这些小鼠的血脑屏障完整性时,我们发现,用AAV-EGFP转导的老年小鼠在大脑各区域广泛存在磺基-NHS-生物素的不均匀渗漏,这证实了老年小鼠中血脑屏障功能障碍的预期迹象(图4g和扩展数据图6j,k)。然而,用AAV-C1GALT1和AAV-B3GNT3转导的老年小鼠,其大脑中血管的磺基-NHS-生物素渗漏显著减少,与年轻小鼠中观察到的水平相当(图4g - i)。这些数据表明,增加脑内皮细胞上的核心1型粘蛋白型O-糖基化可以有效地改善老年小鼠的血脑屏障功能(图4j)。

图4:恢复粘蛋白型O-糖基化可改善老年小鼠的血脑屏障功能。
a. C1GALT1和B3GNT3过表达模式及相关AAV构建体概述。b. 用番茄凝集素(LEL)标记的急性分离微血管中C1GALT1的表达情况。比例尺为10微米。c. 对b的定量分析(每组n = 5只小鼠;双侧t检验;平均值±标准误)。d. 用番茄凝集素(LEL)标记的急性分离微血管中B3GNT3的表达情况。比例尺为10微米。e. 对d的定量分析(每组n = 5只小鼠;采用Dunnett事后检验的单因素方差分析;平均值±标准误)。f. 急性分离微血管中粘蛋白结构域糖蛋白标记的定量分析(每组n = 5只小鼠;双侧t检验;平均值±标准误)。g. AAV转导的小鼠全脑切片中磺基-NHS-生物素的渗漏情况。h. AAV转导的小鼠中,EGFP+皮质血管的磺基-NHS-生物素渗漏情况(箭头所示)。比例尺为50微米。i. 对h的定量分析(每组n = 5只小鼠;采用Dunnett事后检验的单因素方差分析;平均值±标准误)。j. 衰老和神经退行性疾病中血脑屏障功能障碍的示意图,突出了本文的新发现。脑内皮细胞糖萼层随着衰老而退化,从而导致血脑屏障功能失调。恢复糖萼可能是在与衰老相关的疾病状态下恢复血脑屏障功能的一种有效治疗方法。
由于先前的研究表明,血液来源的分子渗漏到大脑中会促进形成更具炎症性和神经毒性的大脑环境【7,32】,我们测试了增加核心1型粘蛋白型O-糖基化,进而减少血脑屏障渗漏,是否可以促进大脑状态和功能的内环境稳定变化。为了评估认知功能的变化,我们在注射AAV 12周后,让接受三种AAV处理的老年小鼠组进行使用Y迷宫和恐惧条件反射测试的记忆和学习任务(图5a)。值得注意的是,用AAV-B3GNT3处理的老年小鼠在Y迷宫中的自发交替行为显著增加,在情境恐惧条件反射测试中的静止时间增加,这分别表明空间工作记忆以及海马体依赖的学习和记忆能力得到了改善(图5b,c)。用AAV-C1GALT1处理的老年小鼠在这两种行为测试中均未表现出显著改善,并且在三个老年组中,在线索恐惧条件反射测试中的静止时间没有观察到显著差异。
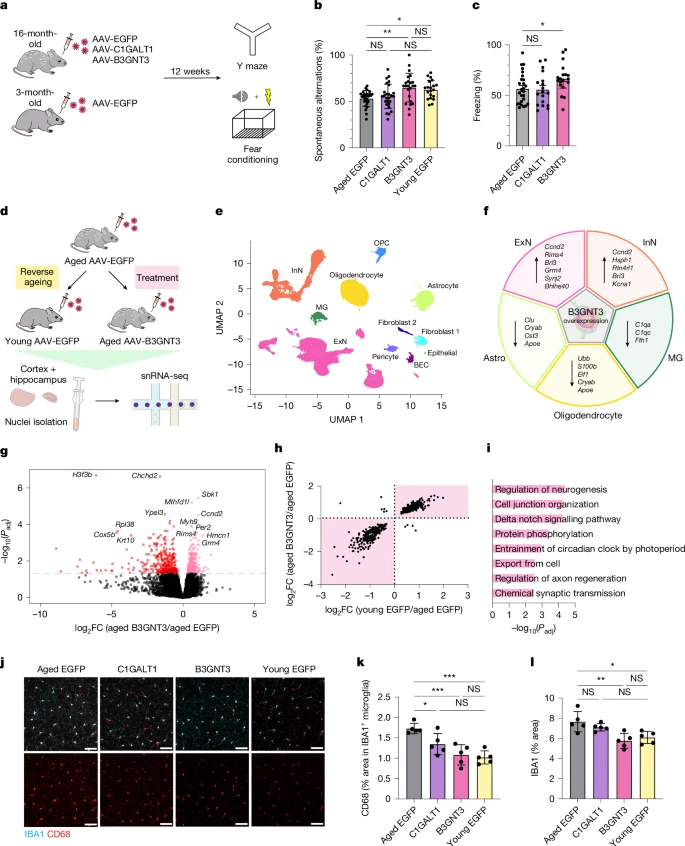
图5:恢复粘蛋白型O-糖基化可增加老年小鼠的神经元内环境稳定,减少神经胶质炎症,并改善记忆和学习能力。
a. 用于小鼠行为测试的实验方案。b. 使用Y迷宫进行空间工作记忆评估(n = 26(老年EGFP组),19(C1GALT1组),23(B3GNT3组)和20(年轻EGFP组);采用Tukey事后检验的单因素方差分析;平均值±标准误)。c. 通过情境恐惧条件反射进行海马体依赖的学习和记忆评估(n = 26(EGFP组),18(C1GALT1组)和19(B3GNT3组);采用Dunnett事后检验的单因素方差分析;平均值±标准误)。d. 年轻AAV-EGFP组、老年AAV-EGFP组和老年AAV-B3GNT3处理组的皮质和海马体组织混合样本的单核RNA测序(snRNA-seq)分析概述。e. 年轻AAV-EGFP组、老年AAV-EGFP组和老年AAV-B3GNT3处理组(每组n = 3只小鼠)的皮质和海马体组织混合样本中69,250个细胞核的均匀流形近似与投影(UMAP),按细胞类型着色。BEC表示脑内皮细胞;ExN表示兴奋性神经元;InN表示抑制性神经元;MG表示小胶质细胞;OPC表示少突胶质前体细胞。f. 与AAV-EGFP组相比,老年小鼠中AAV-B3GNT3处理诱导的各主要细胞类型中关键差异表达基因(DEGs)概述。Astro表示星形胶质细胞。g. 老年小鼠中AAV-B3GNT3处理诱导的兴奋性神经元(ExN)差异表达基因的火山图(上调基因用粉色表示,下调基因用红色表示)。Padj表示校正后的P值。h. AAV-B3GNT3过表达(y轴)和逆衰老(x轴)引起的兴奋性神经元差异表达基因倍数变化的比较。突出显示了AAV-B3GNT3处理导致与衰老方向相反变化的区域。i. 基于AAV-B3GNT3处理和逆衰老之间共享的差异表达基因(h图右上角象限),兴奋性神经元中上调的主要通路。j. AAV转导的小鼠皮质中IBA1和CD68的表达情况。比例尺为50微米。k. 对j中IBA1+小胶质细胞中CD68+信号的定量分析(每组n = 5只小鼠;采用Tukey事后检验的单因素方差分析;平均值±标准误)。l. 对j中皮质IBA1+区域的定量分析(每组n = 5只小鼠;采用Tukey事后检验的单因素方差分析;平均值±标准误)。
为了表征脑内皮细胞中B3GNT3过表达所诱导的老年大脑的细胞和分子变化,我们对从老年AAV-EGFP组、老年AAV-B3GNT3组和年轻AAV-EGFP处理组分离的皮质和海马体组织混合样本进行了单核RNA测序(图5d)。这产生了69,250个单核转录组,涵盖了所有主要的脑细胞类型(图5e和扩展数据图10a,b)。尽管在三组之间未观察到细胞类型比例的显著变化(扩展数据图10c),但伪批量分析显示,所有主要细胞类型中都存在基因表达变化,其中在兴奋性神经元和少突胶质细胞中观察到的差异表达基因(DEGs)数量最多(扩展数据图10d)。对这两种细胞群体的进一步研究表明,AAV-B3GNT3诱导的许多差异表达基因的变化方向与衰老过程中观察到的相反,这表明脑内皮细胞中B3GNT3的过表达促进了细胞向更年轻的大脑状态变化(图5g - i和扩展数据图10e - i)。确实,用AAV-B3GNT3处理的老年小鼠在神经元群体中与神经元内环境稳定(Rims4、Wnt5a和Foxo3)和神经发生(Smad1、Syngap1和Ccnd2)相关的基因表达增加,在包括星形胶质细胞(Clu、Cryab和Apoe)和小胶质细胞(C1qa和C1qc)在内的神经胶质细胞群体中,与激活和疾病相关的基因表达减少(图5f - i和扩展数据图10e - i)。对神经炎症标志物的额外免疫荧光表征显示,用AAV-B3GNT3处理的老年小鼠中,小胶质细胞激活标志物CD68显著减少,用AAV-C1GALT1处理的老年小鼠中也有一定程度的减少(图5j - l)。这些结果表明,脑内皮细胞中B3GNT3的过表达促进了大脑内环境稳定过程的恢复,这与老年小鼠认知能力的改善相关。
讨论
总之,我们确定脑内皮细胞糖萼失调是导致衰老和神经退行性疾病中血脑屏障功能障碍的一种分子机制。我们观察到,在这些情况下,脑内皮细胞粘蛋白型O-糖基化存在一种普遍的下降趋势,并证明这种修饰的减少会导致血脑屏障通透性增加,以及更容易发生脑出血。通过腺相关病毒(AAV)介导的脑内皮细胞粘蛋白型O-聚糖生物合成酶的过表达,恢复了老年小鼠的血脑屏障完整性,减少了神经炎症标志物,并改善了认知功能。这些结果表明,恢复脑内皮细胞糖萼可能是对抗与年龄相关的中枢神经系统疾病中血脑屏障破坏的一种有效治疗途径。
尽管糖胺聚糖作为糖萼的主要成分已被广泛研究【5】,但我们的研究强调了粘蛋白结构域糖蛋白对脑内皮细胞糖萼层和血脑屏障功能的重要贡献。关于粘蛋白结构域糖蛋白影响血脑屏障功能的具体机制,仍有许多有待研究的地方。糖萼在血管管腔上形成了一个物理和电荷屏障,如先前的研究所示,去除任何主要成分,包括糖胺聚糖,或者如本研究所示,去除粘蛋白结构域糖蛋白,似乎都会破坏糖萼层的稳定性并增加血管通透性【3,33】。除了对糖萼层的结构完整性有贡献外,粘蛋白结构域糖蛋白还具有多种生物学作用,包括在信号传导、细胞间相互作用和膜形态调节方面【6,20,21,22】。从脑内皮细胞中去除它们会广泛损害血脑屏障的完整性,包括通过调节紧密连接、增加氧化应激和破坏其他关键的血管内环境稳定通路。进一步的研究对于确定参与血脑屏障调节的关键粘蛋白结构域糖蛋白,以及它们发挥作用的具体分子途径至关重要。
尽管我们的研究表明,通过AAV介导的C1GALT1和B3GNT3的过表达可降低血脑屏障的通透性并改善大脑健康,但其产生这些有益效果的确切机制仍不清楚。通过限制血液来源分子的非特异性摄取,这些治疗方法可能有助于保护大脑免受有害循环因子的侵害,如白蛋白、IgG和纤维蛋白原,这些物质已被证明会引发大脑中的神经炎症变化【7,32】。然而,需要注意的是,C1GALT1和B3GNT3可能会影响广泛的蛋白质和聚糖结构。理解这些糖基转移酶所影响的分子途径,对于我们理解大脑衰老和恢复活力至关重要。
最后,尽管这项工作重点关注粘蛋白结构域糖蛋白对血脑屏障功能的贡献,但我们发现,在衰老和神经退行性疾病中,许多其他脑内皮细胞糖基化途径也出现了失调(图1e,f和扩展数据图5a - f)。未来研究构成脑内皮细胞糖萼层的各种聚糖和糖结合物的作用,对于我们理解大脑功能和神经退行性变将是基础性的工作。
糖萼是对由细菌、上皮细胞,或其他细胞分泌的,覆盖在细胞表层的粘稠物的统称。鱼类表皮的粘液就是一种糖萼。这个名词的本意是指覆盖在上皮组织表面的,由上皮细胞分泌的多糖结构。介于荚膜和粘液层之间的结构称为糖萼。
糖萼(glycocalyx)是覆盖于血管内皮细胞顶膜表面的多糖蛋白复合物的总称。它通过一些主干支柱与内皮细胞连接,这些支柱包括蛋白聚糖(proteoglycans)和糖蛋白(glycoproteins)。二者相互作用形成一个网状结构,这样一些血浆源性和内皮细胞源性的可溶性生物大分子并入此网络构成糖萼基本结构。可溶性的血浆成分直接或间接(通过蛋白聚糖和粘多糖)相连。在糖萼的可溶性成分与血浆之间存在一个动态的平衡,这种平衡持续的影响着糖萼的组成和和厚度,同时糖萼收到酶和剪切力的作用不断脱落,同时生成与脱落之间新的动态平衡。
炎症几乎是所有疾病的共同基础,炎症反应达到一定规模,会导致系统炎症。炎症反应会产生一系列的病理生理过程,血管内皮细胞是参与局部和全身炎症反应的重要成分,炎症反应过程也会导致内皮细胞自身的破坏,其中一个典型的损伤特征就是血管内皮糖萼消耗,这会导致血管内皮细胞功能下降,带来更严重的损伤和后果。因此如何保护血管内皮糖萼,应该作为一个重要的抗炎症损伤策略。
氢气的抗炎症效应是最近发现的新现象,又因为氢气对人体的极大安全性,适合于多种病理过程,尤其是非特异性病理过程的干预策略。例如慢性代谢性炎症是许多慢性病的普遍表现,而慢性病由于病程长,损伤不剧烈,导致难以使用副作用大的强效抗炎症药物,但长期慢性炎症依然会导致血管内皮糖萼等的破坏。使用氢气作为一种长期抗炎症干预工具,如果能有效保护血管内皮糖萼,将对于许多慢性病导致的血管等末梢器官损伤带来重要价值。长期使用氢气对血管的保护,对糖尿病后心脏肾脏视网膜等器官的保护作用,也从另一个角度,证明了氢气抗慢性炎症的价值。
最近日本学者采用体外循环这种全身炎症导致的血管内皮糖萼损伤,观察到氢气吸入对血管内皮糖萼损伤的保护效果。给氢气预防慢性病血管和器官损伤提供了新的证据。
论文摘要
体外循环 (CPB) 会导致全身炎症和内皮糖萼损伤。氢气具有抗氧化和抗炎特性;因此,我们假设氢气可以减轻CPB引起的内皮糖萼损伤。将28只雄性Sprague-Dawley大鼠随机分为4组(每组n = 7),分别为:假手术组、对照组、2%氢气组和4%氢气组。对大鼠进行 90 分钟的部分 CPB,然后观察 120 分钟。在氢气组中,CPB期间通过呼吸机和人工肺给药,CPB后通过呼吸机给药60分钟。观察后,进行采血、肺提取、灌注固定,电镜测量心、肺、脑内皮糖萼厚度。4%氢组(5.7 ± 4.4 pg/mL)的血清糖萼成分syndecan-1浓度低于对照组(19.5 ± 6.6 pg/mL)和2%氢(19.8 ± 5.0 pg/mL)组(P < 0.001),但与假手术组(6.2 ± 4.0 pg/mL,P = 0.999)无显著差异。 4%氢气组心肺内皮糖酵母较对照组厚。与对照组相比,4%氢组血清和肺组织中的炎性细胞因子浓度(白细胞介素-1β和肿瘤坏死因子-α)较低,血清丙二醛浓度也较低。与对照组相比,2%氢组血清syndecan-1浓度差异无统计学意义。然而,观察到血清和肺组织炎性细胞因子浓度以及血清丙二醛浓度的非显着降低。通过人工肺和自体肺施用 4% 氢气可减轻大鼠部分 CPB 引起的内皮糖萼损伤,这可能是由氢的抗炎和抗氧化特性介导的。
Iwata H, Katoh T, Truong SK, Sato T, Kawashima S, Mimuro S, Nakajima Y. Hydrogen attenuates endothelial glycocalyx damage associated with partial cardiopulmonary bypass in rats. PLoS One. 2023 Dec 19;18(12):e0295862.
介绍
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1475062.html?mobile=1
收藏

