博文
肿瘤细胞破坏免疫细胞的策略:线粒体转移
|
肿瘤细胞策反免疫细胞的策略:线粒体转移
肿瘤微环境中的癌细胞会利用多种机制逃避免疫系统,尤其是T细胞的攻击 。例如,肿瘤微环境中的代谢重编程以及肿瘤浸润淋巴细胞(TIL)的线粒体功能障碍会损害抗肿瘤免疫反应 。然而,这些过程的详细机制仍不明确。在此,我们分析了临床样本,发现TIL中的线粒体DNA(mtDNA)突变与癌细胞中的突变相同。此外,癌细胞中携带mtDNA突变的线粒体能够转移至TIL。通常情况下,TIL中的线粒体很容易通过活性氧发生线粒体自噬。但是,从癌细胞转移而来的线粒体却不会发生线粒体自噬,我们发现这是由于存在抑制线粒体自噬的分子。这些分子附着在线粒体上,一同转移至TIL,从而导致同质性替换。从癌细胞获得mtDNA突变的T细胞会表现出代谢异常和衰老,在效应功能和记忆形成方面存在缺陷。这反过来又会导致体外和体内的抗肿瘤免疫受损。相应地,肿瘤组织中mtDNA突变的存在是黑色素瘤或非小细胞肺癌患者使用免疫检查点抑制剂预后不良的一个因素。这些发现揭示了一种此前未知的癌细胞通过线粒体转移实现免疫逃逸的机制,有助于未来癌症免疫疗法的开发。
正文
癌细胞通过多种机制逃避免疫监视,包括产生免疫抑制分子以及生成能为肿瘤进展创造有利肿瘤微环境(TME)的细胞 。抑制性免疫检查点分子,如细胞毒性T淋巴细胞抗原 - 4(CTLA - 4)、程序性细胞死亡蛋白1(PD - 1)以及PD - 1配体1和PD - 1配体2(PD - L1/2),在这一过程中至关重要。因此,免疫检查点抑制剂(ICIs),包括抗PD - 1、抗PD - L1和抗CTLA - 4单克隆抗体,已提高了多种癌症类型患者的生存率 。然而,许多患者对治疗无反应,或者尽管初始有反应,但无法实现持久缓解 。因此,识别癌细胞使用的各种免疫逃逸机制对于提高ICI疗效至关重要。
TME中的代谢重编程对抗肿瘤免疫反应至关重要 。然而,肿瘤中的低氧和低糖环境促进糖酵解而非氧化磷酸化(OXPHOS)。这种转变会影响T细胞的效应功能、耗竭、衰老和记忆形成,从而有利于癌细胞存活 。线粒体在上皮细胞和免疫细胞(包括T细胞)的代谢重编程中发挥着重要作用 。TIL中的线粒体功能障碍会导致代谢不足,随后T细胞进入终末分化的耗竭状态 。然而,大多数研究集中在小鼠模型上,对人类TIL的研究较少 。此外,TIL中线粒体功能障碍的潜在机制仍不明确。
mtDNA编码能量生成所需的重要蛋白质,由于修复机制不完善,容易发生突变 。mtDNA中的许多突变会导致OXPHOS受损,并促进多种癌症的肿瘤生长和转移 。然而,很少有研究探讨它们对抗肿瘤免疫的影响 。
线粒体转移可发生在不同细胞之间,并改变受体细胞的线粒体代谢 。在体内,由于缺乏mtDNA而导致OXPHOS受损的癌细胞会从宿主获取线粒体基因组以恢复线粒体呼吸 。先前的一项研究表明,癌细胞通过隧道纳米管(TNTs)从T细胞获取线粒体,从而阻碍抗肿瘤反应 。此外,细胞外囊泡(EVs)可以通过EV - 细胞融合事件在不同细胞间运输线粒体 。尽管在TME中癌细胞的线粒体可以转移到T细胞,但这一过程的发生率及其对抗肿瘤免疫的影响仍不明确。
在此,我们分析了多种癌症类型的临床样本,发现TIL中存在mtDNA突变。这些mtDNA突变中有许多与癌细胞中的相同,并且是通过线粒体转移获得的。我们还研究了mtDNA突变T细胞的功能,包括PD - 1阻断介导的抗肿瘤免疫。同时评估了这些结果在接受ICI治疗的黑色素瘤或非小细胞肺癌(NSCLC)患者中的临床意义。本研究揭示了一种此前未被描述的涉及线粒体转移的免疫逃逸机制。
TIL和癌细胞中的mtDNA突变
为了解TIL中线粒体功能障碍的机制,我们首先对从12名不同类型癌症患者(队列A;患者样本及本研究使用的已建立细胞系的详细信息见方法部分)获取的TIL的mtDNA进行测序。分析显示,12名患者中有5名患者的TIL存在mtDNA突变(图1a,扩展数据图1a - c以及补充表1和2)。我们证实大量TIL主要由CD45⁺CD3⁺ T细胞组成,分选后的T细胞具有相同的突变(图1b、c以及扩展数据图1a)。我们从7名患者中建立了匹配的癌细胞系,其中4名患者的TIL存在mtDNA突变。值得注意的是,4名患者中有3名患者的TIL与癌细胞具有相同的突变(图1a、c以及扩展数据图1b、c)。我们从具有突变mtDNA(3290T > C)的大量TIL04细胞中建立了具有野生型mtDNA的单个T细胞克隆(TIL04#9)(扩展数据图1d)。电子显微镜成像显示,具有mtDNA突变的TIL(大量TIL04和TILc03)和癌细胞(MEL04和MELc03)中的线粒体形态异常且嵴减少。相比之下,具有野生型mtDNA的TIL(TIL02和TIL04#9)和癌细胞(MEL02)中的线粒体在形态上似乎正常。值得注意的是,在匹配的外周血淋巴细胞(PBL)样本(PBL02、PBL04和PBLc03)中主要观察到正常形态(图1d以及扩展数据图1e)。为了证实在培养过程中未发生mtDNA突变,我们分析了患者04的福尔马林固定石蜡包埋(FFPE)肿瘤组织。结果显示该组织样本具有相同的突变(图1e)。

图1:TIL和癌细胞共享携带mtDNA突变的线粒体**
a. 来自同一患者(02和04)的配对TIL和癌细胞的整个mtDNA的综合基因组浏览器(IGV)轨迹数据。从同一患者的PBL建立的淋巴母细胞系(LCL,通过爱泼斯坦 - 巴尔病毒转化)用作种系对照。
b. 大量TIL分析的代表性门控策略。
c. 患者04的mtDNA毛细管测序色谱图。对从大量TIL04细胞中分选的纯CD45⁺CD3⁺ T细胞、MEL04细胞和PBL04细胞的mtDNA进行测序。
d. 左图,患者04的大量TIL04、TIL04#9、MEL04和PBL04细胞的代表性透射电子显微镜图像。右图,对每个线粒体的嵴数量(每个线粒体n = 20)进行计数和量化。比例尺,2μm。
e. 患者04的FFPE肿瘤组织的整个mtDNA的IGV轨迹数据。对于a和e,使用下一代测序进行分析。P值(图表中显示)使用单因素方差分析(ANOVA)和Bonferroni校正计算(d)。误差线表示标准误。AF,等位基因频率;NS,无显著性差异。
癌细胞的线粒体转移
线粒体转移可发生在不同细胞之间 ;因此,我们推测在癌细胞和T细胞之间观察到的相同mtDNA突变可能是由于线粒体转移所致。为避免假阳性并准确评估转移过程,我们将线粒体特异性荧光蛋白MitoDsRed 引入MEL02细胞(野生型mtDNA)和MEL04细胞(突变型mtDNA)(分别为MEL02 - MitoDsRed和MEL04 - MitoDsRed;补充图2)。当TIL与这些过表达MitoDsRed的癌细胞共培养时,通过DsRed表达评估,24小时内癌细胞向T细胞的线粒体转移很少发生,这一结果与另一项研究一致 (扩展数据图1f)。然而,24小时后,癌细胞向T细胞发生了线粒体转移 (图2a、b以及扩展数据图1f)。mtDNA状态不影响转移效率(野生型MEL02到TIL02与突变型MEL04到TIL04#9)(扩展数据图1f)。TNTs的形成和EVs的释放可促进线粒体转移 ;因此,我们评估了不同条件下的线粒体转移(图2c以及扩展数据图1g)。使用以下处理可显著降低TIL中的转移:细胞松弛素B(一种TNT抑制剂);细胞培养柱插入物(3μm和0.4μm,以避免直接细胞 - 细胞接触);和/或GW4869(一种阻断小EVs(约200nm)释放的化合物) (图2c以及扩展数据图1g)。尽管较大的EVs和裸露的线粒体可以通过3μm的柱子而不能通过0.4μm的柱子,但这两种情况将线粒体转移水平降低到相同程度(图2c以及扩展数据图1g、h)。此外,细胞松弛素B将转移降低到与柱子相同的程度,但在插入柱中添加细胞松弛素B不会进一步降低转移水平(图2c以及扩展数据图1g、h)。这些结果表明,柱子的抑制作用可能主要源于通过TNT形成对直接细胞 - 细胞接触的抑制,而不是通过较大的EVs或裸露的线粒体间接抑制。相应地,一种较大EVs(微EVs;> 200nm)的抑制剂Y - 27632降低了线粒体转移,但程度小于GW4869。这一结果表明,微EVs不如小EVs重要,正如先前报道的那样 (图2c以及扩展数据图1g)。小EVs可以通过两种尺寸的柱子,在插入柱中添加GW4869可大幅降低转移水平,这表明通过TNT形成的直接细胞 - 细胞接触和通过小EVs的间接细胞 - 细胞相互作用可能在线粒体转移中都具有重要作用(图2c以及扩展数据图1g)。因此,我们分离、纯化并分析了小于200nm的EVs。纯化的EVs除了含有小EV蛋白CD9和TSG101外,还含有线粒体蛋白细胞色素c(扩展数据图1i),这表明小EVs实际上含有线粒体。综上所述,这些结果表明肿瘤浸润T细胞通过直接和间接的线粒体转移从癌细胞获得mtDNA突变。TNTs的形成实现了直接的细胞 - 细胞接触,而EVs实现了间接的细胞 - 细胞相互作用。

图2:癌细胞中携带mtDNA突变的线粒体转移至TIL,并在TIL中逐渐被替换为同质性**
a. 三次独立实验的线粒体转移代表性共聚焦显微镜图像。用MitoTracker Green标记的TIL04#9细胞与MEL04 - MitoDsRed细胞共培养2天。比例尺,10μm。
b. 四次独立实验的线粒体转移代表性流式细胞术染色分析。TIL04#9细胞与MEL04 - MitoDsRed细胞共培养14天,随后进行分析。
c. 对从MEL04细胞转移至TIL的线粒体进行定量分析。TIL与MEL04 - MitoDsRed细胞共培养2天,共培养体系中添加或不添加抗主要组织相容性复合体I类(MHC - I)单克隆抗体、TNT抑制剂(细胞松弛素B)、插入柱(3或0.4μm)、小细胞外囊泡释放抑制剂(GW4869)和/或微细胞外囊泡抑制剂(Y - 27632),随后通过流式细胞术进行分析。图中展示了相对于对照组的ΔDsRed平均荧光强度(MFI)的倍数变化总结(每组n = 4)(共培养的TIL的DsRed MFI - 未共培养的TIL的DsRed MFI)。
d. 与MEL04细胞共培养的TIL04#9细胞中mtDNA的毛细管测序色谱图。单细胞分选后,对mtDNA进行测序。
e、f. 延时成像。用MitoTracker Green标记的TIL04#9细胞与MEL04 - MitoDsRed细胞共培养。我们使用数字全息显微镜每30分钟采集一次图像。图中展示了三次独立实验中TIL的代表性荧光融合图像(上图)和三维折射率(RI)图像(下图)。比例尺,4μm。
g. 小鼠TIL分析的代表性门控策略。对肿瘤进行消化,用CD45和CD3染色后进行分析。
h、i. LLC/A11 - MitoDsRed肿瘤中DsRed⁺ T细胞的频率(h)以及TIL中mtDNA测序结果(i)。体内实验按照补充图3所述进行。图中展示了代表性流式细胞术染色(h,左图)、定量分析(h,右图,每组n = 4)以及DsRed⁻细胞(i,左图)和DsRed⁺ T细胞(i,右图)的毛细管测序色谱图。P值(图中所示)使用单因素方差分析(ANOVA)和Bonferroni校正计算(c,h)。误差线表示标准误。
线粒体同质性替换
接下来,我们研究了线粒体转移后是否会发生同质性。我们从与MEL04细胞共培养后的TIL04#9细胞中分离出单个CD45⁺CD3⁺ T细胞,并在不同时间点对每个单个T细胞中获得的mtDNA进行测序。共培养15天后,一部分T细胞中发生了线粒体向同质性的替换(图2d)。我们还使用用MitoTracker Green标记的TIL04#9细胞与MEL04 - MitoDsRed细胞进行了延时成像研究。在几个TIL中,共培养后TIL中的MitoTracker Green水平逐渐降低,而源自癌细胞的DsRed信号在TIL中逐渐增加。最终,TIL中的MitoTracker Green信号被DsRed取代,这表明发生了线粒体向同质性的替换,并且这种效应随后得以维持(图2e,f)。为了在体内证实线粒体转移,我们使用了在Nd6基因中有mtDNA 13997G > A突变的LLC/A11细胞(该细胞系源自小鼠Lewis肺癌)(补充图2)。与体外实验一样,我们也将MitoDsRed导入这些细胞(LLC/A11 - MitoDsRed)(补充图2)。将这些癌细胞接种到C57BL / 6J小鼠体内后,我们在第21天和第42天收集肿瘤并分析TIL(补充图3)。我们观察到TIL中DsRed⁺ T细胞的频率逐渐增加,这表明发生了从LLC/A11细胞的线粒体转移(图2g,h)。我们根据DsRed染色在单细胞水平从TIL中分离出DsRed⁺ T细胞,并对mtDNA进行测序。结果显示,在DsRed⁺ T细胞的单细胞水平存在mtDNA突变,其中一些是同质性的(图2i)。相比之下,所有DsRed⁻ T细胞都具有野生型mtDNA(图2i)。利用这个模型,我们从TIL中分离出线粒体转移的DsRed⁺ T细胞并在体外培养。7天内DsRed表达逐渐降低,并且在大量TIL中异质性的mtDNA突变等位基因也减少了(扩展数据图2a,b)。
接下来,我们研究了同质性替换的机制。根据DsRed表达评估,从过表达MitoDsRed的癌细胞向T细胞的线粒体转移在共培养后逐渐增加(扩展数据图1f)。相比之下,用MitoTracker Green染色的T细胞内原位线粒体的转移在共培养后减少(图3a)。为避免假阳性并准确评估从T细胞到癌细胞的线粒体转移,我们使用了PhaMexcised OT - 1小鼠,该小鼠表达一种线粒体特异性荧光蛋白(mito - Dendra2)以及卵清蛋白(OVA)特异性T细胞受体,同时使用了过表达OVA的LLC/A11细胞(补充图2)。如先前报道的那样,我们证实了使用Dendra2(绿色)评估的从T细胞到癌细胞的线粒体转移的发生(扩展数据图2c)。相反,使用MitoTracker Green评估的癌细胞内原位线粒体数量,在小鼠和人类癌细胞中,共培养后并未减少,这一结果与T细胞内原位线粒体的情况形成对比(扩展数据图2d,e)。肿瘤微环境中癌细胞产生的活性氧(ROS)会导致周围细胞发生线粒体自噬 。如先前报道 ,当我们通过流式细胞术分析癌细胞来源的细胞外囊泡(EVs)时,检测到其中存在ROS(扩展数据图2f)。在共培养条件下,通过N - 乙酰 - L - 半胱氨酸(NAC)处理可以清除ROS。NAC处理阻止了用MitoTracker Green染色的T细胞内原位线粒体数量的减少,并且与NAC共培养后未发生线粒体向同质性的替换(图3b,c)。相比之下,NAC处理不影响从过表达MitoDsRed的癌细胞向T细胞的线粒体转移(扩展数据图2g)。LC3B染色显示,与MEL04 - MitoDsRed细胞共培养可增强T细胞的线粒体自噬水平,但NAC处理可降低该水平(图3d,e)。我们分析了通过线粒体转移获得mtDNA突变的TIL中的基因表达(TIL是从与MEL04 - MitoDsRed细胞共培养后的DsRed⁺TIL04#9细胞中分离出来的)。与TIL04#9细胞或DsRed⁻TIL04#9细胞相比,DsRed⁺ TIL中与线粒体自噬相关和线粒体应激反应基因(BNIP3和ATF4)的表达水平更高(图3f)。线粒体自噬抑制剂巴弗洛霉素A1阻止了T细胞内原位线粒体数量的减少(图3g)。这些发现表明,T细胞内的原位线粒体对ROS诱导的线粒体自噬敏感,而癌细胞来源的线粒体具有抗性。这种线粒体自噬的差异可能导致转移后发生同质性替换。
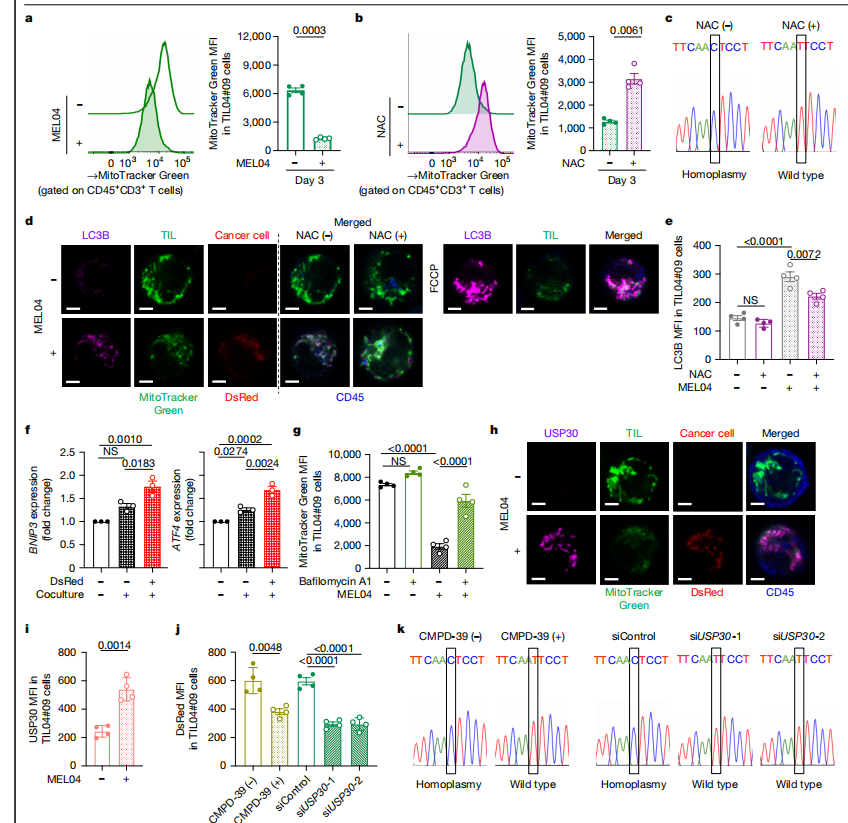
图3:癌细胞来源的线粒体因USP30而对线粒体自噬具有抗性
a、b. TIL中线粒体的定量分析。用MitoTracker Green标记的TIL04#9细胞与MEL04细胞共培养3天(a,无NAC;b,有NAC),随后进行分析。图中展示了代表性流式细胞术染色(左图)和定量分析(右图)(每组n = 4)。
c. 在第14天,与MEL04细胞共培养且添加或不添加NAC的TIL04#9细胞中mtDNA的毛细管测序色谱图。单细胞分选后,对mtDNA进行测序。
d、e. LC3B染色。用MitoTracker Green标记的TIL04#9细胞与MEL04 - MitoDsRed细胞共培养3天,随后进行染色和分析。图中展示了代表性共聚焦显微镜图像(d)和定量分析(e)(每组n = 4)。比例尺,2μm。FCCP,羰基氰化物4 - (三氟甲氧基)苯基腙。
f. BNIP3和ATF4的表达。TIL04#9细胞与MEL04 - MitoDsRed细胞共培养14天,对分选后的TIL进行实时PCR分析。图中展示了相对于对照组的倍数变化值的定量分析(每组n = 3)。
g. 用线粒体自噬抑制剂处理的TIL04#9细胞中线粒体的定量分析。按照a中所述进行共培养,添加或不添加巴弗洛霉素A1,随后对TIL进行分析。图中展示了定量分析结果(每组n = 4)。
h、i. USP30染色。用MitoTracker Green标记的TIL04#9细胞与MEL04 - MitoDsRed细胞共培养3天,随后进行染色和分析。图中展示了代表性共聚焦显微镜图像(h)和定量分析(i)(每组n = 4)。比例尺,2μm。
j. 用USP30抑制剂或siRNAs处理的TIL中线粒体转移的定量分析。TIL04#9细胞与MEL04 - MitoDsRed细胞共培养3天,添加或不添加CMPD - 39或siRNAs,随后进行分析。图中展示了定量分析结果(每组n = 4)。
k. 在第14天,与MEL04细胞共培养且添加或不添加CMPD - 39或siRNAs的TIL04#9细胞中mtDNA的毛细管测序色谱图。单细胞分选后,对mtDNA进行测序。P值(图中所示)使用双侧t检验(a,b,i)或单因素方差分析(ANOVA)和Bonferroni校正计算(e - g,j)。误差线表示标准误。
我们详细研究了这种对线粒体自噬敏感性差异背后的机制。我们的结果表明,从癌细胞转移到T细胞的线粒体对线粒体自噬具有抗性。因此,我们推测与线粒体一起转移的特定癌细胞因子可能使T细胞具有这种抗性。为此,我们寻找附着在线粒体上的线粒体自噬抑制分子。Parkin介导的泛素化在线粒体自噬中至关重要,而去泛素化酶USP30、USP33和USP35可以抑制Parkin介导的线粒体自噬并附着在线粒体上 。根据癌症基因组图谱的数据,USP30在黑色素瘤中高表达,并且USP30可以抑制线粒体自噬 (扩展数据图2h)。因此,我们将重点放在USP30上。正如预期的那样,USP30在癌细胞中高表达,在具有突变mtDNA的TIL中略有增加,但在具有野生型mtDNA的TIL和PBL中低表达(扩展数据图2i)。与癌细胞共培养后,USP30与线粒体一起从癌细胞转移到TIL(图3h,i)。通过USP30染色实验证实了这一结果,该实验表明USP30与从癌细胞转移来的线粒体共定位(图3h)。USP30抑制剂CMPD - 39部分降低了从过表达MitoDsRed的癌细胞到TIL的线粒体转移,进而部分阻止了向同质性的逐步替换(图3j,k)。考虑到CMPD - 39可能存在脱靶效应,我们使用了两种靶向USP30的小干扰RNA(siRNAs)(siUSP30 - 1和siUSP30 - 2)来证实该因子的作用。使用这些siRNAs得到的结果与CMPD - 39相似(图3j,k以及补充图2)。因此,线粒体自噬抑制分子,如USP30,使从癌细胞转移来的线粒体对线粒体自噬具有抗性,这可能部分与同质性替换有关。也就是说,与线粒体自噬抑制分子一起从癌细胞转移来的线粒体不会发生线粒体自噬,而T细胞内的原位线粒体由于癌细胞产生的ROS而发生线粒体自噬,从而导致线粒体的替换。

突变T细胞中的线粒体功能障碍
接下来,我们评估了线粒体相关分子,包括ND4、ND5、ND6、ND1、CYTB、COX1和ATP6。在tRNA区域有突变(3290T > C)的mtDNA突变型MEL04细胞,这些分子的表达低于其他野生型MEL02或MCF7细胞(扩展数据图3a以及补充图2)。如先前报道 ,牛磺酸处理可逆转这种表达降低的情况(扩展数据图3b)。在ND4(12084C > T)或ND5(13966A > G)有突变的mtDNA突变型MDA - MB - 231细胞,分别也有ND4和ND5的低表达 (扩展数据图3a以及补充图2)。一致地,使用通量分析仪评估,我们观察到mtDNA突变型MEL04细胞和MDA - MB - 231细胞的基础呼吸降低,对糖酵解的依赖性增加(扩展数据图3d,e)。此外,这些mtDNA突变细胞中总ATP以及由OXPHOS产生的ATP减少。而且,MEL04细胞中复合物I、II、III和IV的活性,以及MDA - MB - 231细胞中复合物I的活性降低(扩展数据图3f - i)。这些结果表明这些突变的线粒体功能受损。
基于DsRed表达,分析了具有野生型线粒体的TIL以及与黑色素瘤细胞(野生型MEL02 - MitoDsRed细胞或突变型MEL04 - MitoDsRed细胞)共培养后转移了mtDNA突变线粒体的TIL的功能(分别为DsRed⁻TIL04#9/02,野生型;DsRed⁺TIL04#9/02,野生型;DsRed⁻TIL04#9/04,野生型;以及DsRed⁺TIL04#9/04细胞,突变型)(图4a以及补充图2和4)。由于我们建立的TIL主要由CD8⁺ T细胞组成,我们主要评估了CD8⁺ T细胞的功能(图1b)。mtDNA突变的TIL(DsRed⁺TIL04#9/04细胞)的膜电位显著降低(图4b)。尽管ROS可以在许多细胞区室中产生,但大多数细胞内ROS是在通过OXPHOS产生ATP的过程中在线粒体中产生的 。mtDNA损伤会耗尽形成线粒体呼吸复合物的蛋白质数量。这会形成一个正反馈回路,由于复合物IV或V的抑制以及琥珀酸盐的过度产生,通过电子传递链还原状态的变化产生ROS 。实际上,具有突变mtDNA的DsRed⁺TIL04#9/04细胞显示出ROS产生的大幅增加(图4c)。先前的研究表明线粒体和ROS在细胞衰老中起着关键作用 ,这促使我们评估T细胞衰老和记忆形成。突变mtDNA的存在增加了β - 半乳糖苷酶活性以及衰老分子p16和p53的水平(图4d - f)。DsRed⁺TIL04#9/04细胞的CD27⁻CD28⁻衰老亚群以及衰老相关分泌表型(如IL6、CXCL8和IL1B)也增加了(图4g - j)。一致地,DsRed⁺TIL04#9/04细胞的分裂潜能降低,凋亡增加(图4k,l)。DsRed⁺TIL04#9/04细胞中CCR7高CD45RA低的中央记忆细胞亚群和长寿命KLRG1低的细胞亚群显著减少(图4m,n)。由于TIL中CCR7高CD45RA高的初始亚群较少,我们使用PBL进一步评估记忆形成。当从PBL中分离出的CCR7高CD45RA高的初始CD8⁺ T细胞在MEL02 - MitoDsRed细胞或MEL04 - MitoDsRed细胞存在的情况下分化时,mtDNA突变的DsRed⁺ CD8⁺ T细胞中CCR7高CD45RA低的中央记忆细胞和长寿命KLRG1低的细胞亚群也显著减少(扩展数据图3j,k)。此外,当从PBL中分离出的每个CD8⁺ T细胞亚群与MEL02 - MitoDsRed细胞或MEL04 - MitoDsRed细胞共培养时,mtDNA突变的DsRed⁺ CCR7高CD45RA低的中央记忆亚群比野生型细胞的凋亡略多。相比之下,其他亚群在野生型和突变型细胞之间的凋亡水平相当(扩展数据图3l)。这些数据表明mtDNA突变主要损害记忆形成,并部分诱导中央记忆亚群的凋亡。当我们使用抗CD3和抗CD28单克隆抗体刺激T细胞后评估效应功能时,mtDNA突变的DsRed⁺TIL04#9/04细胞中的激活标志物PD - 1和CD69显著减少。这一发现表明mtDNA突变的TIL由于线粒体功能受损而无法被有效激活(图4o,p)。为了证实这些结果,我们分析了具有非突变线粒体的TIL以及与乳腺癌细胞共培养后转移了突变线粒体的TIL。用MitoDsRed标记的MCF7细胞(野生型)和MDA - MB - 231细胞(突变型)(图4a以及补充图2和4)显示出与MEL02和M
a. DsRed⁻ TIL04#9细胞和DsRed⁺ TIL04#9细胞中mtDNA的毛细管测序色谱图。如补充图4所述,我们构建了DsRed⁻TIL04#9/02(野生型)、DsRed⁺TIL04#9/02(野生型)、DsRed⁻TIL04#9/04(野生型)、DsRed⁺TIL04#9/04(突变型)、DsRed⁻TIL04#9/MCF7(野生型)、DsRed⁺TIL04#9/MCF7(野生型)、DsRed⁻TIL04#9/MDA(野生型)和DsRed⁺TIL04#9/MDA细胞(突变型)。
b - p. 对在a中构建的TIL分析以下参数:使用MitoTracker Deep Red和Green评估膜电位(b);使用DCFDA评估细胞活性氧(ROS)生成(c);β - 半乳糖苷酶活性(d);p16(e)和p53(f)表达;CD27⁻CD28⁻衰老细胞比例(g);IL6(h)、CXCL8(i)和IL1B(j)表达;通过CFSE稀释评估快速分裂细胞(k);使用Annexin V评估细胞凋亡(l);CCR7高CD45RA低的中央记忆细胞(m)和KLRG1低的长寿命细胞(n)比例;以及PD - 1(o)和CD69(p)表达。为分析细胞分裂、PD - 1和CD69表达,用抗CD3和抗CD28单克隆抗体刺激TIL。在第3天第三次分裂后计数快速分裂细胞。图中展示了定量结果(每组n = 4)。P值(图中所示)使用单因素方差分析(ANOVA)和Bonferroni校正计算(b - p)。误差线表示标准误。
接下来,我们通过用溴化乙锭培养构建了mtDNA缺陷的Rho0细胞(Jurkat/Rho0),然后使用MitoCeption方案 从癌细胞(MEL02,野生型;MEL04,突变型;MCF7,野生型;MDA - MB - 231,突变型)中分离线粒体,并将其转移到Jurkat/Rho0细胞中(分别为Rho + MEL02 - Mito、Rho + MEL04 - Mito、Rho + MCF7 - Mito和Rho + MDA - Mito)(补充图4)。我们调整了mtDNA的量,使每个细胞系的mtDNA量相同,并确认了突变的存在(扩展数据图5a,b)。mtDNA突变的Rho + MEL04 - Mito细胞和Rho + MDA - Mito细胞的膜电位显著降低(扩展数据图5c)。然后,我们使用通量分析仪评估线粒体氧化磷酸化(OXPHOS)和糖酵解水平,结果表明mtDNA突变的Jurkat细胞基础呼吸降低,对糖酵解的依赖性增加(扩展数据图5d,e)。评估ATP组成时也得到类似结果,mtDNA突变的Jurkat细胞中总ATP和由OXPHOS产生的ATP减少(扩展数据图5f)。相应地,mtDNA突变的Jurkat细胞ROS生成大幅增加(扩展数据图5g)。与原代TIL类似,mtDNA突变的Jurkat细胞β - 半乳糖苷酶活性增加(扩展数据图5h),分裂潜能降低且凋亡增加(扩展数据图5i,j)。mtDNA突变的Jurkat细胞中CCR7高CD45RA低的中央记忆细胞和长寿命KLRG1低的细胞比例显著降低(扩展数据图5k,l)。用抗CD3和抗CD28单克隆抗体处理后,mtDNA突变的Jurkat细胞中PD - 1表达显著降低(扩展数据图5m)。当这些Rho +细胞在不含丙酮酸钠和尿苷的正常培养基中培养时,仍可观察到mtDNA条带。这一结果表明同质性替换后mtDNA突变的线粒体得以维持(扩展数据图5n)。总之,这些结果表明,接受癌细胞来源的mtDNA突变线粒体的T细胞会衰老,在效应功能和记忆形成方面存在缺陷,同时伴有代谢异常。
细胞外囊泡(EV)介导的mtDNA转移可改变受体细胞的线粒体功能 。因此,我们构建了通过EV转移线粒体的T细胞系(补充图4)。将从MEL02细胞(野生型mtDNA)和MEL04细胞(突变型mtDNA)中提取的EV添加到Jurkat/Rho0细胞中。调整mtDNA的量,使每个细胞系的mtDNA量相同,并确认了突变的存在(扩展数据图6a,b)。膜电位、代谢功能、衰老、代谢状态、ROS生成、细胞分裂、凋亡、记忆形成和激活参数显示出与原代TIL和直接转移线粒体的Jurkat细胞中观察到的相似趋势(扩展数据图6c - m)。因此,癌细胞通过EV转移mtDNA突变的线粒体也可导致T细胞线粒体功能障碍。
体内转移与抗肿瘤免疫
为进一步研究体内线粒体转移的影响,我们使用了另一种从具有非突变mtDNA的小鼠Lewis肺癌建立的细胞系(LLC/P29细胞) (补充图2)。Nd6突变的LLC/A11细胞中ND6蛋白的表达低于LLC/P29细胞(扩展数据图3c)。mtDNA突变的LLC/A11细胞OXPHOS受损,对糖酵解的依赖性增加,且复合物I活性降低(扩展数据图3d - i)。我们将MitoDsRed导入LLC/P29细胞(LLC/P29 - MitoDsRed)(补充图2),并在第42天分析LLC/P29 - MitoDsRed和LLC/A11 - MitoDsRed肿瘤中的TIL(补充图3)。LLC/P29和LLC/A11肿瘤中CD8⁺ T细胞浸润情况相当(扩展数据图7a)。此外,指示线粒体转移的肿瘤浸润CD8⁺ T细胞中的DsRed表达也相当(图5a)。LLC/P29细胞有一个单核苷酸多态性(SNP)(Nd6,13672A > T)(补充图2),从TIL中分离的DsRed⁺ T细胞具有该SNP,而DsRed⁻ TIL则没有,这与在LLC/A11细胞中观察到的情况相同(扩展数据图7b)。从LLC/A11肿瘤接受mtDNA突变线粒体的DsRed⁺CD8⁺ T细胞表现出显著更高的β - 半乳糖苷酶活性,且凋亡更多(图5b,c)。此外,观察到CD127高KLRG1低的长寿命记忆前体效应T细胞(MPECs)频率降低 (图5d)。来自具有mtDNA突变的LLC/A11肿瘤的DsRed⁺CD8⁺ T细胞中PD - 1表达显著低于来自具有非突变mtDNA的LLC/P29肿瘤的DsRed⁺CD8⁺ T细胞。这一发现表明,由于线粒体功能障碍,mtDNA突变的CD8⁺ T细胞无法被有效激活(图5e和补充图5),这一结果与体外实验观察到的结果相似。此外,与LLC/P29小鼠模型相比,LLC/A11肿瘤中的DsRed⁺PD - 1⁺CD8⁺ T细胞表现出更终末分化的耗竭表型,TIM3表达高且TCF1表达低 (图5f)。我们将LLC/P29或LLC/A11肿瘤移植到OT - 1小鼠中,并从TIL中收集DsRed⁺CD8⁺ T细胞。使用这些选定的T细胞对过表达OVA的癌细胞进行杀伤实验。野生型mtDNA的线粒体转移(LLC/P29细胞)略微降低了细胞毒性活性,而mtDNA突变的线粒体转移(LLC/A11细胞)则显著降低了这种活性(图5g)。相应地,CD8⁺ T细胞耗竭促进了LLC/P29肿瘤生长,但对LLC/A11肿瘤生长促进作用很小(扩展数据图7c)。此外,LLC/P29细胞在体外的生长速度比LLC/A11细胞快(扩展数据图7d)。这一结果表明,由于突变mtDNA线粒体的转移,LLC/A11肿瘤中的CD8⁺ T细胞功能失调。我们从TIL中分离出线粒体转移的DsRed⁺ T细胞,随后在体外培养。随着大量TIL中DsRed表达逐渐降低(扩展数据图2a),功能损伤部分得到恢复(扩展数据图7e,f)。值得注意的是,LLC/P29肿瘤(非突变mtDNA)对PD - 1阻断有反应,而LLC/A11肿瘤(突变mtDNA)无反应,且PD - 1阻断不影响线粒体转移(图5h和补充图3)。

图5:mtDNA突变的线粒体转移在体内降低抗肿瘤免疫**
a. 线粒体转移率的比较。体内实验按照补充图3所述进行。图中展示了代表性流式细胞术染色(左图)和定量分析(右图)(每组n = 6)。
b - f. LLC/P29 - MitoDsRed或LLC/A11 - MitoDsRed肿瘤中CD8⁺ TIL的β - 半乳糖苷酶活性(b)、通过Annexin V评估的凋亡(c)、CD127高KLRG1低的MPECs频率(d)、PD - 1表达(e),以及PD - 1⁺CD8⁺ TIL中TIM3⁺TCF1⁻终末分化耗竭CD8⁺ T细胞的频率(f)。体内实验按照补充图3所述进行。图中展示了定量结果(每组n = 6)。
g. 杀伤实验。将LLC/P29 - MitoDsRed或LLC/A11 - MitoDsRed细胞皮下注射到OT - 1小鼠中。42天后,我们从每个TIL组分中分离出DsRed⁻ 和DsRed⁺CD8⁺ T细胞(效应细胞(E)),分别用它们对LLC/P29 - OVA或LLC/A11 - OVA细胞(靶细胞(T))进行杀伤实验。图中展示了定量结果(每组n = 4)。
h. 用抗PD - 1抗体和/或EV释放抑制剂(GW4869)处理的LLC/P29 - MitoDsRed和LLC/A11 - MitoDsRed肿瘤的生长情况。体内实验按照补充图3所述进行(每组n = 6)。
i. GW4869局部注射后的线粒体转移情况。体内实验按照补充图3所述进行。图中展示了代表性流式细胞术染色(左图)和总结(右图)(每组n = 4)。
j - n. 用GW4869处理的LLC/P29 - MitoDsRed和LLC/A11 - MitoDsRed肿瘤中CD8⁺ TIL的β - 半乳糖苷酶活性(j)、通过Annexin V评估的凋亡(k)、CD127高KLRG1低的MPECs频率(l)、PD - 1表达(m),以及PD - 1⁺CD8⁺ TIL中TIM3⁺TCF1⁻终末分化耗竭CD8⁺ T细胞的频率(n)。体内实验按照补充图3所述进行。图中展示了定量结果(每组n = 4)。P值(图中所示)使用双侧t检验(a,i)、单因素方差分析(ANOVA)和Bonferroni校正(b - g,j - n)或双因素方差分析(ANOVA)和Bonferroni校正(h)计算。误差线表示标准误。
由于EV在转移中可能起关键作用,我们用EV释放抑制剂GW4869处理这些肿瘤(补充图3)。GW4869降低了线粒体转移,进而导致β - 半乳糖苷酶活性和凋亡减少(图5i - k),TIL中MPECs和PD - 1⁺CD8⁺ T细胞频率增加(图5l,m)。此外,GW4869将耗竭表型从终末分化转变为干细胞样祖细胞耗竭(图5n)。GW4869处理抑制了LLC/A11肿瘤生长,但不抑制LLC/P29肿瘤生长,并克服了LLC/A11肿瘤对PD - 1阻断的抗性(图5h和补充图3)。值得注意的是,GW4869对免疫缺陷的SCID小鼠中的LLC/A11肿瘤生长没有任何影响(扩展数据图7g)。
我们使用患有LLC/P29 - OVA - MitoDsRed和LLC/A11 - OVA - MitoDsRed肿瘤的免疫缺陷SCID小鼠进行体内过继性T细胞转移实验(补充图3)。从OT - 1小鼠转移的肿瘤浸润CD8⁺ T细胞中的DsRed表达显著高于从C57BL / 6J野生型小鼠转移的情况(扩展数据图7h)。这一结果突出了肿瘤微环境中T细胞转移时长期存在和直接细胞 - 细胞接触的重要性。当转移OT - 1小鼠的CD8⁺ T细胞时,从LLC/A11 - OVA肿瘤(突变mtDNA)接受线粒体转移的DsRed⁺CD8⁺ T细胞的PD - 1表达低于从LLC/P29 - OVA肿瘤(非突变mtDNA)转移的DsRed⁺CD8⁺ T细胞(扩展数据图7i)。此外,LLC/A11 - OVA肿瘤中的DsRed⁺PD - 1⁺CD8⁺ T细胞比LLC/P29 - OVA肿瘤中的同类细胞表现出更终末分化的耗竭表型(扩展数据图7j)。相应地,从OT - 1小鼠转移的T细胞对LLC/P29 - OVA肿瘤具有抗肿瘤作用,但对LLC/A11 - OVA肿瘤没有(扩展数据图7k)。总体而言,这些结果表明,从癌细胞转移到TIL的mtDNA突变线粒体可通过体内T细胞功能障碍降低抗肿瘤免疫,包括PD - 1阻断介导的免疫。
线粒体功能与免疫检查点抑制剂(ICI)疗效
为进一步进行体内分析,我们创建了一种条件性敲除小鼠模型,其中T细胞存在线粒体功能障碍(Tfamfl/flCd4cre小鼠) 。在这些小鼠中,T细胞的线粒体质量减少,基础线粒体呼吸降低,对糖酵解的依赖性增加,且T细胞衰老(扩展数据图8a - d)。此外,Tfamfl/flCd4cre小鼠中PD - 1阻断的疗效受损(扩展数据图8e和补充图3)。PD - 1阻断增加了对照小鼠中肿瘤浸润的CD44高CD62L低效应记忆CD8⁺ T细胞、PD - 1⁺CD8⁺ T细胞和颗粒酶B⁺CD8⁺ T细胞的频率,但在Tfamfl/flCd4cre小鼠中没有(扩展数据图8f - h)。
接下来,我们使用这些小鼠进行再挑战实验,以评估记忆形成和对PD - 1阻断的持久反应。在抗PD - 1单克隆抗体治疗后初始肿瘤完全根除的小鼠,在第32天用相同的癌细胞再次攻击(补充图3)。完全根除后,对照小鼠中大多数再次攻击的肿瘤被排斥(扩展数据图8i),而Tfamfl/flCd4cre小鼠中有超过一半的再次攻击肿瘤未被排斥(MC - 38肿瘤,8只中有8只对6只中有2只,P < 0.05;B16F10 - OVA肿瘤,8只中有6只对8只中有1只,P < 0.05)(扩展数据图8i)。Tfamfl/flCd4cre小鼠TIL中衰老的CD27⁻CD28⁻CD8⁺ T细胞频率增加(扩展数据图8j),而KLRG1低CD127高CD8⁺ TIL(MPECs)的频率降低(扩展数据图8k)。此外,对照小鼠中PD - 1阻断后MPECs频率增加,而Tfamfl/flCd4cre小鼠中没有(扩展数据图8k)。
为了在人类临床环境中评估这些结果,我们分析了黑色素瘤患者(队列B,n = 95)和非小细胞肺癌患者(队列C1,n = 86)的临床数据,这些患者在未接受任何细胞毒性化疗的情况下接受了一线PD - 1阻断治疗(扩展数据表1)。我们还分析了晚期非小细胞肺癌患者的其他样本,这些患者在未接受任何免疫检查点抑制剂(ICI)的情况下接受了一线含铂双药细胞毒性化疗(队列C2,n = 56)(补充表3)。队列C1和C2中很少有患者携带驱动突变,因为这类患者通常在PD - 1阻断治疗或含铂双药细胞毒性化疗之前,首先接受分子靶向治疗。如扩展数据图9a - c和补充表4所示,我们从237个福尔马林固定石蜡包埋(FFPE)肿瘤样本中鉴定出158个线粒体DNA(mtDNA)变异,包括48个移码变异和110个替换变异。如果变异呈现截断、错义、tRNA或rRNA变异,则归类为mtDNA突变阳性(队列B中95例有31例;队列C1中86例有44例;队列C2中56例有20例);如果变异为D - 环、基因间位点、沉默变异或无变异,则归类为mtDNA突变阴性。在我们的黑色素瘤队列中,慢性日光损伤似乎与mtDNA突变相关,因为在位于头、颈或远端肢体背侧表面的黑色素瘤中,mtDNA突变明显更为常见 (扩展数据表1)。与我们的实验结果一致,对患者肿瘤样本的分析表明,与无mtDNA突变的个体相比,mtDNA突变患者在开始PD - 1阻断治疗后的无进展生存期和总生存期显著缩短(扩展数据图9d)。相比之下,mtDNA突变并不影响未接受任何ICI的一线含铂双药细胞毒性化疗的非小细胞肺癌患者的预后(扩展数据图9e)。总体而言,肿瘤微环境(TME)中mtDNA突变的线粒体转移会损害抗肿瘤免疫,进而导致ICI疗效降低(补充图6)。
讨论
多项研究表明,肿瘤浸润淋巴细胞(TIL)中的线粒体功能障碍会损害抗肿瘤免疫 。然而,这一过程的详细机制和临床意义尚不清楚 。我们对TIL中的mtDNA进行测序,经常检测到与癌细胞共有的突变。此外,我们证明了在TME中,mtDNA突变的线粒体从癌细胞转移到T细胞会导致T细胞功能障碍。值得注意的是,肿瘤组织样本中mtDNA突变的存在预示着PD - 1阻断治疗的不良预后。这些发现表明,mtDNA突变的线粒体从癌细胞转移到TIL会导致线粒体功能障碍和抗肿瘤免疫受损。
由于缺乏组蛋白保护和修复机制不完善,mtDNA极易发生突变 。我们分析的mtDNA 3290T > C突变位于编码tRNA - Leu(UUR)的区域。一些tRNA突变被认为会阻止τm5U修饰酶识别tRNA,由于牛磺酸修饰受损,从而导致线粒体翻译缺陷 。实际上,这种突变诱导了线粒体翻译缺陷(牛磺酸处理可恢复),降低了氧化磷酸化(OXPHOS)并增加了对糖酵解的依赖性。我们分析的其他mtDNA突变也损害了OXPHOS并促进了糖酵解。除了我们评估的突变之外,据报道还有许多其他mtDNA突变可诱导线粒体功能障碍 。因此,癌细胞中的许多mtDNA突变可通过线粒体转移在TIL中诱导线粒体功能障碍。
先前的研究通过实验表明,线粒体通过隧道纳米管(TNTs)和/或小细胞外囊泡(EVs)转移,而非通过微细胞外囊泡或裸露的线粒体转移 。一些研究使用MitoTracker评估转移过程,但由于其存在渗漏问题,该方法存在局限性 。为解决这一问题,我们使用了线粒体报告蛋白,结果证实了TNT形成和小EVs对转移过程的重要性。我们纯化了小于200纳米的EVs,并检测到一种线粒体蛋白以及CD9和TSG101,这表明小EVs实际上含有线粒体。此外,阻断小EVs的释放抑制了转移和PD - 1阻断抗性,从而逆转了TIL表型。然而,如先前报道,EVs可包含其他免疫调节因子 。因此,我们还使用MitoCeption技术进行了纯线粒体转移 ,这些实验结果证实了与mtDNA突变相关的效应。T细胞通常含有约200 - 400个拷贝数的mtDNA ;因此,仅通过线粒体转移实现同质性替换似乎具有挑战性。我们的结果表明,由于癌细胞产生的活性氧(ROS)诱导的线粒体自噬,T细胞中原位线粒体的数量减少,用抗氧化剂或线粒体自噬抑制剂处理后,这种效应是可逆的。线粒体自噬在癌细胞中常常受损 ,而线粒体自噬抑制分子(如USP30)在各种癌细胞中高表达 ,但在T细胞中不表达。在此我们表明,癌细胞中的USP30可与线粒体一起转移到TIL。与USP30一起从癌细胞转移来的线粒体不会发生线粒体自噬。此外,抑制USP30可减少癌细胞的线粒体转移,这部分阻止了向同质性的替换并影响TIL功能。癌细胞和T细胞线粒体在诸如USP30等线粒体自噬抑制分子方面的这种线粒体自噬差异,可能解释同质性替换的机制。然而,可能还有其他因素起作用,这对未来的研究构成了挑战。此外,考虑到线粒体的融合和裂变等动力学过程,可能还涉及其他机制 ;因此有必要进一步研究。
线粒体对T细胞代谢至关重要 ,T细胞中的OXPHOS功能障碍会导致效应功能和记忆形成受损 。尽管T细胞效应分化依赖于糖酵解 ,但mtDNA突变会因能量产生不足而损害T细胞激活 。在T细胞激活过程中,PD - 1表达增加,作为一种负反馈回路抑制T细胞功能。因此,我们的数据表明mtDNA突变的T细胞无法被有效激活。线粒体功能障碍也会影响T细胞耗竭 ,我们的结果证实了这一效应。然而,我们还证明了TIL中的线粒体功能障碍可由癌细胞转移的mtDNA突变导致。因此,mtDNA突变的肿瘤对PD - 1阻断表现出抗性,但抑制EV可逆转这种情况。我们使用的小鼠模型存在一些局限性,因为难以特异性抑制线粒体转移。然而,体外数据表明,小EVs在转移过程中起关键作用,抑制剂处理后T细胞功能部分恢复。CD8⁺ T细胞耗竭和过继转移模型进一步强调了mtDNA突变的重要性。尽管我们希望有一个更强大的体内模型,但这是未来研究需要解决的问题。黑色素瘤和非小细胞肺癌样本的临床数据表明,mtDNA突变的存在是PD - 1阻断治疗预后不良的一个因素,但对单纯化疗(即无PD - 1阻断治疗)并非如此。在先前对未接受免疫治疗患者的研究中,mtDNA突变的预后意义一直存在争议 。我们观察到TIL中75%的mtDNA突变与癌细胞共享,这表明TIL经常通过从癌细胞转移获得线粒体。此外,在12个TIL样本中有5个发现了mtDNA突变,这一频率与FFPE肿瘤测序中观察到的频率相似。考虑到这些发现,尽管我们无法准确评估FFPE样本中TIL的mtDNA突变,但TIL中的大多数mtDNA突变可能是从癌细胞转移而来的。这些结果证实了T细胞线粒体,特别是mtDNA突变,在抗肿瘤免疫中的重要性。
线粒体转移可能发生在TME中的多种细胞类型之间。尽管一些研究表明线粒体从免疫细胞转移到癌细胞 ,但由于癌细胞产生的ROS以及免疫细胞线粒体对线粒体自噬的敏感性,癌细胞中发生同质性替换的情况可能很少见。在具有异质性的癌细胞中,可能不会发生TIL的完全替换,但高突变频率(超过60 - 80%)仍可影响T细胞功能 。因此,并非总是发生的完全替换,可能并非影响T细胞功能所必需。
总之,我们确定TIL中的mtDNA突变是线粒体功能障碍的一个原因。许多突变与癌细胞共享,并且很可能发生从癌细胞到TIL的线粒体转移。突变的T细胞表现出代谢异常和衰老,在效应功能和记忆形成方面存在缺陷,进而影响PD - 1阻断免疫。接受PD - 1阻断治疗的mtDNA突变患者预后不良。这些发现揭示了一种此前未知的癌细胞利用线粒体转移的免疫逃逸机制。
https://wap.sciencenet.cn/blog-41174-1470009.html
上一篇:氢气生物活性的理论评估
下一篇:中国廉价开源AI模型DeepSeek令科学家兴奋不已【自然】