氢气可降低血管紧张素II(AngII)诱导的心房颤动和心房纤维化易感性

摘要
心房颤动(AF)是常见的心律失常,也是导致中风和心力衰竭的主要因素。氢气(H₂)是一种具有抗炎和抗氧化作用的气体信号分子。我们的研究证实,氢气可降低由血管紧张素II(AngII)介导的心房颤动及心房纤维化的易感性。在连续给予血管紧张素II 28天后,接受血管紧张素II + 氢气(AngII + H₂)处理的大鼠对心房颤动的易感性降低,心房纤维化减轻,心房肌细胞内活性氧(ROS)减少,NLRP3炎症小体激活受到抑制,电重构得到改善,并且心脏成纤维细胞的增殖和迁移也受到抑制。我们进一步发现,在体内氢气通过抑制NOX4的活性来调节炎症小体的激活,从而改善钙离子(Ca²⁺)处理以及乙酰胆碱激活的内向整流钾电流(IKAch)和超快延迟整流钾电流(IKur)。此外,在体内氢气通过抑制转化生长因子-β1(TGF-β1)的激活和分泌,参与抑制由血管紧张素II介导的心房纤维化,进而抑制TGF-β1/Smad2/3通路。我们的研究结果表明,氢气对于预防和治疗由血管紧张素II介导的心房颤动及心房纤维化具有重要意义,提示氢气可作为预防和治疗心房颤动的候选方法。
引言
心房颤动(AF)是常见的心律失常,长期的心房颤动可诱发中风甚至心力衰竭。心房颤动的发生机制复杂,包括氧化应激、炎症和纤维化等。值得注意的是,心房颤动的发生受到肾素 - 血管紧张素 - 醛固酮系统(RAAS)的强烈影响。血管紧张素II(AngII)是肾素 - 血管紧张素 - 醛固酮系统(RAAS)的主要效应分子,它通过NADPH氧化酶激活活性氧(ROS)生成、转化生长因子-β1(TGF-β1)/Smad2/3通路以及NLRP3炎症小体,进而促进离子通道功能障碍、钙离子处理异常和纤维化。这些变化会诱导心房颤动的发生和发展。因此,NADPH氧化酶是心房重构和心房颤动的核心介导因子。NADPH氧化酶4(NOX4)通过促进活性氧(ROS)的生成影响心房颤动的电重构和结构重构。
含NACHT、LRR和PYD结构域的蛋白3(NLRP3)炎症小体是调控固有免疫应答的关键炎症信号转导复合物。NLRP3炎症小体通过上调磷酸化钙/钙调蛋白依赖性蛋白激酶II(p-CaMKII)以及钙/钙调蛋白依赖性蛋白激酶II(CaMKII)依赖性的磷酸化兰尼碱受体2(p-RyR2),促进肌浆网(SR)中钙离子(Ca²⁺)的异常释放。NLRP3还会促进离子通道功能障碍,包括超快延迟整流钾电流(IKur)以及乙酰胆碱激活的内向整流钾电流(IKAch)。血管紧张素II介导的成纤维细胞内转化生长因子-β1(TGF-β1)上调在血管紧张素II介导的心脏纤维化中起着关键作用。血管紧张素II介导的氧化应激(OS)也会增强转化生长因子-β1(TGF-β1)/Smad2/3通路的活性。
氢气是一种重要的生物调节因子,具有抗氧化、抗炎和抗凋亡等作用。氢气可预防癌症、缺血再灌注损伤、动脉粥样硬化、心力衰竭以及糖尿病等疾病。然而,关于氢气对心律失常影响的研究较为有限。
我们的研究结果显示,氢气可显著降低血管紧张素II诱导的心房颤动以及心房颤动的发生率和病程。氢气可能抑制NOX4表达及活性氧(ROS)产生,从而阻止NLRP3炎症小体激活并抑制电重构。此外,氢气可减少转化生长因子-β1(TGF-β1)的产生及其活性,抑制转化生长因子-β1(TGF-β1)/Smad2/3通路,进而防止结构重构。总体而言,我们的研究结果提示氢气可用于治疗心房颤动。
材料与方法
实验动物
本动物实验已获得中国哈尔滨医科大学动物实验伦理委员会批准,批准编号为20200915。所有实验操作均按照1975年《赫尔辛基宣言》以及中华民国国家科学委员会规定的指南进行。在整个研究过程中,通过确保人道地对待动物以及将动物福利纳入所有实验操作的设计和实施环节,保障了动物福利。我们从哈尔滨医科大学动物实验中心(中国哈尔滨)获取了雄性Sprague Dawley(SD)大鼠(体重180 - 200克),并将它们饲养在温度为24℃、光照/黑暗周期为12小时/12小时的环境中。所有大鼠均可自由摄取标准实验室饲料和饮用水。
渗透微型泵植入、氢气吸入
将所有动物随机分为四组(每组n = 10只),分别为对照组、氢气组、血管紧张素II组以及血管紧张素II + 氢气组。血管紧张素II组和血管紧张素II + 氢气组通过植入的渗透泵(美国Alzet公司,型号2ML)给予血管紧张素II(1080μg/kg/24小时),持续28天。向对照组和氢气组的大鼠植入灌注生理盐水的渗透泵。
如先前报道,2%的氢气已被证明具有安全性和有效性,因此,本研究采用该浓度的氢气。具体而言,通过将空气泵产生的空气与氢气发生器产生的氢气混合来获得2%的氢气,然后将其通入放置有接受氢气和血管紧张素II + 氢气处理的大鼠的盒子中。放置对照组和血管紧张素II组大鼠的盒子则充入空气。所有盒子中的大鼠连续28天每天接受6小时的相应处理。
超声心动图和血压测量
28天后,用戊巴比妥(1%,50mg/kg,腹腔注射)对大鼠进行麻醉,以便进行超声心动图检查和血压记录。对麻醉后的大鼠通过静脉注射氯化钾(75mg/kg)实施安乐死,用于体内实验。我们使用配备S12 - 4(4 - 12MHz)探头的高分辨率EPIQ5超声系统(荷兰飞利浦医疗超声公司),以二维和三维模式进行多普勒超声心动图检查,以评估心脏功能和直径。超声心动图检查过程中记录的参数包括所有大鼠的左心房面积(LA area)、左心房直径(LAD)以及射血分数(EF)。在本研究中,使用BL - 420生物机能实验系统(中国成都泰盟软件公司)测量并记录尾动脉的舒张压(DBP)和收缩压(SBP)。
电生理研究
我们按照另一项研究中描述的方法对动物进行电生理检查。大鼠麻醉后,将电极导管(1.9F,Scisense公司)插入右心房,然后以100毫秒的起搏周期长度提供电刺激。我们希望人工诱导的心房颤动状态包括快速的房性心律失常,并伴有持续超过60秒的不规则心室节律。测量心房颤动的诱导率及其持续时间。心房颤动易感性以诱导率的10倍来表示。
细胞培养
将HL - 1心房心肌细胞(BNCC编号BNCC288890)和大鼠成纤维细胞(BNCC编号BNCC354039)在含10%胎牛血清(FBS)的杜氏改良 Eagle培养基(DMEM)中,于37℃、5%二氧化碳浓度条件下培养。待HL - 1细胞达到70% - 80%汇合度后,将其接种到六孔板中,并在不同条件下进行处理。对照组的HL - 1细胞在DMEM中培养24小时,氢气组的细胞在含75%氢气的DMEM中培养24小时,血管紧张素II组的细胞用血管紧张素II(1.0μM)处理24小时。此外,血管紧张素II + 氢气组的细胞在含75%氢气的条件下用血管紧张素II(1.0μM)处理24小时。血管紧张素II + GLX351322(NOX4抑制剂)组的细胞用血管紧张素II(1.0μM)和GLX351322(10μM)处理24小时,而血管紧张素II + GLX351322 + 氢气组的细胞在含75%氢气的条件下用血管紧张素II(1.0μM)和GLX351322(10μM)处理24小时。对照组的大鼠成纤维细胞在DMEM中培养24小时,氢气组的细胞在含75%氢气的DMEM中培养24小时,血管紧张素II组的细胞用血管紧张素II(1.0μM)处理24小时,血管紧张素II + 氢气组的细胞在含75%氢气的条件下用血管紧张素II(1.0μM)处理24小时。
细胞内活性氧(ROS)检测
按照其他文献报道的方法,使用2′,7′ - 二氯荧光素二乙酸酯(DCFH - DA,中国北京索莱宝公司,产品编号CA1410)荧光染料检测细胞内活性氧(ROS)水平。简而言之,DCFH - DA是一种可自由扩散穿过细胞膜的非荧光化合物,能被细胞内的酯酶水解为DCFH。DCFH(非荧光化合物)可被细胞内活性氧(ROS)氧化为具有荧光的二氯荧光素(DCF)。因此,细胞内活性氧(ROS)的量与具有荧光的二氯荧光素(DCF)的强度相关。在用过氧化氢(H₂O₂)孵育24小时后,轻轻冲洗细胞三次,使用无血清培养基冲洗。随后,向HL - 1细胞中加入无血清培养基配制的终浓度为10μM的DCFH - DA,在37℃下避光孵育30分钟。最后,用无血清培养基将细胞洗涤三次,以去除未结合的DCFH - DA探针,然后与4′,6 - 二脒基 - 2 - 苯基吲哚(DAPI)一起孵育10分钟。之后使用激光共聚焦显微镜(德国蔡司LSM780型)对细胞进行成像观察。
细胞内钙离子(Ca²⁺)含量检测
按照其他文献描述的方法进行细胞内钙离子(Ca²⁺)含量检测。将HL - 1细胞培养在含10%胎牛血清(FBS)的DMEM培养基中。然后移除细胞培养基,用磷酸盐缓冲盐水(PBS)冲洗约1×10⁵个/毫升的细胞。随后,将用无血清培养基稀释的2μM的Fluo - 3(中国碧云天公司,产品编号S1056)加入细胞中,在37℃、5%二氧化碳浓度条件下孵育1.5小时。之后移除Fluo - 3,用磷酸盐缓冲盐水(PBS)将细胞冲洗两次。最后,将细胞重悬于培养基中,在荧光显微镜(放大倍数为20倍)下观察,以检测细胞内钙离子浓度([Ca²⁺]i)。
成纤维细胞迁移和增殖评估
成纤维细胞的Transwell迁移实验
按照其他文献描述的方法评估成纤维细胞迁移情况。简而言之,将100μl(细胞浓度为1×10⁵个/毫升)用无血清DMEM稀释的细胞接种到Transwell小室的上室。随后,向下室加入500μl含10%胎牛血清(FBS)的DMEM培养基。接着,将Transwell小室在37℃、5%二氧化碳浓度条件下培养36小时。之后,取出小室,用棉签去除小室上层的细胞。用磷酸盐缓冲盐水(PBS)将小室冲洗两次,在室温下用4%多聚甲醛固定30分钟。然后在室温下用1%结晶紫对细胞染色10分钟,将小室倒扣在载玻片上并晾干。在光学显微镜(放大倍数为200倍)下确定穿过膜的细胞数量。在4个随机选取的高倍视野中对细胞进行计数。该实验重复三次,以获得平均值±标准差。
成纤维细胞增殖实验。
成纤维细胞增殖实验按照其他文献所述方法进行。简而言之,使用MTT比色法(日本同仁化学研究所的试剂)测定氢气(H₂)、血管紧张素II(AngII)、血管紧张素II + 氢气(AngII + H₂)、血管紧张素II + GLX351322 + 氢气(AngII + GLX351322 + H₂)或血管紧张素II + GLX351322对细胞的毒性作用。将HL - 1细胞(每孔1.0×10⁴个细胞)接种到96孔板中。培养HL - 1细胞24小时后,对细胞进行如下不同条件处理:氢气(H₂)、血管紧张素II(AngII)、血管紧张素II + 氢气(AngII + H₂)、血管紧张素II + GLX351322 + 氢气(AngII + GLX351322 + H₂)或血管紧张素II + GLX351322,然后将其加入生长培养基中。孵育24小时和72小时后,用含5mg/mL MTT的新鲜培养基替换旧培养基,再将细胞孵育3小时。接着,用磷酸盐缓冲盐水(PBS)将细胞洗涤两次,以去除脱落的死亡细胞,然后将生成的甲臜结晶溶解在二甲基亚砜(DMSO)中。使用酶标仪在570nm波长处测量吸光度。与未处理细胞相比的相对细胞活力(%)通过以下公式计算:[样本吸光度]/[对照吸光度]×100。 酶联免疫吸附测定(ELISA)实验 为检测心房组织中的氧化应激情况,按照说明书使用来自中国南京建成生物工程研究所的丙二醛(MDA,一种氧化依赖型脂质过氧化标志物)和超氧化物歧化酶(SOD,一种抗氧化酶)的商品化试剂盒进行酶联免疫吸附测定(ELISA)实验。为测量成纤维细胞培养上清液中活性转化生长因子-β1(TGF-β1)的水平,按照制造商的操作流程使用大鼠转化生长因子-β1酶联免疫吸附测定(ELISA)试剂盒(北京索莱宝公司,产品编号SEKR - 0013)。 大鼠转化生长因子-β1酶联免疫吸附测定(ELISA)的操作流程包括样品和试剂的准备,试剂包含洗涤缓冲液、标准品以及检测抗体。按照试剂盒说明书要求,先将潜在的转化生长因子-β1酸化然后中和使其活化。为使检测值处于检测方法的动态范围内,用样品稀释液(按1:100比例)对样品进行稀释。将标准品和样品加入到包被有特异性识别转化生长因子-β1捕获抗体的酶标板中。孵育后,洗涤酶标板以去除未结合的物质。接着加入检测抗体并进行孵育,随后再进行一次洗涤步骤。加入链霉亲和素 - 辣根过氧化物酶(Streptavidin - HRP),使其与检测抗体结合,然后再次洗涤酶标板。加入底物溶液,由于酶促反应会产生颜色变化。用终止液终止反应,使用酶标仪测量吸光度。通过将样品的吸光度值与由已知浓度的转化生长因子-β1标准品生成的标准曲线进行比较,来确定样品中转化生长因子-β1的浓度[22]。 使用GEN5 CHS 3.03软件分析酶联免疫吸附测定(ELISA)数据,该软件通过导入酶标仪的吸光度读数,并依据指定的标准品、对照品和样品来定义酶标板布局。它利用已知的转化生长因子-β1浓度生成标准曲线,然后通过将样品吸光度与标准曲线进行比较,并根据稀释因子进行调整,从而计算出样品浓度。质量控制检查确保曲线的准确性并验证对照结果。该软件可导出分析数据并生成酶联免疫吸附测定(ELISA)数据处理报告,以便对转化生长因子-β1进行准确且高效的定量分析。 组织学分析 心房组织在4%多聚甲醛(PFA)中固定24小时后,包埋在石蜡中并切成厚度为5μm的切片。然后,按照标准流程使用天狼星红染色以及马松三色染色法对切片进行染色。将用于心肌细胞的二氢乙啶(DHE)染色剂(中国百奥莱博科技公司,产品编号KM0102)在37℃下对冰冻切片染色30分钟。之后对心房切片进行免疫组织化学分析,使用的一抗包括抗NOX4(武汉三鹰生物技术有限公司,产品编号14347 - 1 - AP,稀释比例为1:200)、抗NLRP3(英国艾博抗公司,产品编号ab214185,稀释比例为1:200)、抗I型胶原蛋白(北京博奥森生物技术有限公司,产品编号bs - 0578R,稀释比例为1:200)、抗III型胶原蛋白(北京博奥森生物技术有限公司,产品编号bs - 0549R,稀释比例为1:200)以及抗α - 平滑肌肌动蛋白(北京博奥森生物技术有限公司,产品编号bs - 10196R,稀释比例为1:200)。按照先前描述的方法,对HL - 1细胞进行NLRP3(英国艾博抗公司,产品编号ab214185)的免疫荧光染色,对成纤维细胞进行α - 平滑肌肌动蛋白(北京博奥森生物技术有限公司,产品编号bs - 10196R)的免疫荧光染色。 蛋白质印迹(WB)分析 收集大鼠心房组织和成纤维细胞中的蛋白质,用含有蛋白酶/磷酸酶抑制剂的RIPA裂解缓冲液处理,然后使用BCA蛋白浓度测定试剂盒进行定量。取80μg提取的总蛋白进行十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳(SDS - PAGE)分离,随后转移至聚偏二氟乙烯(PVDF)膜上。之后,加入一抗,包括NOX4(武汉三鹰生物技术有限公司,产品编号14347 - 1 - AP,稀释比例为1:1000)、p22phox(美国圣克鲁斯生物技术公司,产品编号sc - 271968,稀释比例为1:200)、NLRP3(英国艾博抗公司,产品编号ab214185,稀释比例为1:1000)、ASC(美国圣克鲁斯生物技术公司,产品编号sc - 514414,稀释比例为1:200)、半胱天冬酶1 - p20(美国圣克鲁斯生物技术公司,产品编号22915 - 1 - AP,稀释比例为1:1000)、磷酸化钙/钙调蛋白依赖性蛋白激酶II(phospho - CaMKII,英国艾博抗公司,产品编号ab182674,稀释比例为1:1000)、磷酸化兰尼碱受体2(phospho - RyR2,美国基因泰克公司,产品编号GTX00626,位点Ser2814,稀释比例为1:1000)、Kv1.5(北京伊美诺生物技术有限公司,产品编号YT2507,稀释比例为1:1000)、Kir3.1(北京伊美诺生物技术有限公司,产品编号YT2475,稀释比例为1:1000)、Kir3.4(北京伊美诺生物技术有限公司,产品编号YT2475,稀释比例为1:1000)、转化生长因子-β1(英国艾博抗公司,产品编号ab215715,稀释比例为1:1000)、磷酸化转化生长因子β受体I(phospho - TGFβR I,北京伊美诺生物技术有限公司,产品编号YP1191,稀释比例为1:1000)、磷酸化转化生长因子β受体II(phospho - TGFβR II,武汉爱博泰克生物科技有限公司,产品编号A1415,稀释比例为1:1000)、磷酸化Smad2(phospho - Smad2,北京伊美诺生物技术有限公司,产品编号YP1185,稀释比例为1:1000)、磷酸化Smad3(phospho - Smad3,北京伊美诺生物技术有限公司,产品编号YP0585,稀释比例为1:1000)、α - 平滑肌肌动蛋白(北京博奥森生物技术有限公司,产品编号bs - 10196R,稀释比例为1:1000)、I型胶原蛋白(北京博奥森生物技术有限公司,产品编号bs - 0578R,稀释比例为1:500)、III型胶原蛋白(北京博奥森生物技术有限公司,产品编号bs - 0549R,稀释比例为1:500)以及甘油醛 - 3 - 磷酸脱氢酶(GAPDH,武汉三鹰生物技术有限公司,产品编号10494 - 1 - AP,稀释比例为1:10000),在4℃下于摇床中对膜孵育过夜。最后,用含吐温的Tris缓冲盐水(TBS - T)洗涤膜,并用成像分析系统进行扫描。使用Image J软件对结果进行定量分析。 实时定量聚合酶链反应(qRT - PCR) 使用Trizol试剂(中国北京赛百盛公司)提取心房组织总RNA,然后按照制造商的操作流程,使用全能型一步法反转录cDNA合成试剂盒Ⅲ(用于实时定量聚合酶链反应,中国北京赛百盛公司)将其制备成第一链cDNA。之后,使用两步法反转录和实时定量聚合酶链反应试剂盒(中国北京赛百盛公司)在7500实时定量聚合酶链反应系统(美国应用生物系统公司的QuantStudio™设计与分析软件)上通过实时定量聚合酶链反应(qPCR)分析来测量Kv1.5、Kir3.1、Kir3.4、I型胶原蛋白、III型胶原蛋白的mRNA表达情况。实时定量聚合酶链反应(qPCR)的循环条件如下:95℃预变性30秒,然后进行40个循环,每个循环包括95℃变性10秒,接着60℃退火延伸34秒。在60 - 95℃温度范围内绘制熔解曲线。以甘油醛 - 3 - 磷酸脱氢酶(GAPDH)作为内参。表S1展示了本研究中使用的所有引物(中国上海生工生物工程技术服务有限公司)序列。通过相对定量方法对mRNA水平进行定量,并使用2⁻ΔΔCq法进行分析。 统计分析 数据以平均值±标准差(SD)形式呈现。多组数据间比较采用单因素方差分析(ANOVA)及事后检验(Student - Newman - Keuls检验,使用GraphPad Prism 7.0软件),两组数据间比较采用非配对t检验。P < 0.05被视为具有统计学显著性。 结果 氢气降低了血管紧张素II介导的心房颤动易感性及心房颤动持续时间,改善了大鼠由血管紧张素II诱导的心房结构 在任何一组大鼠中均未出现自发性心房颤动。心房电生理检查结果显示,与血管紧张素II组大鼠相比,血管紧张素II + 氢气组大鼠的心房颤动易感性及心房颤动持续时间均降低(图1A - 1C)。随后,我们发现注射血管紧张素II 28天后,血管紧张素II组大鼠的左心房面积(LA area)增大,而吸入氢气后虽略有减小,但无显著差异。血管紧张素II + 氢气组的左心房直径(LAD)相较于血管紧张素II组有所减小(图1D和1F)。然而,四组大鼠的射血分数(EF)并无显著差异(图1G)。同时还发现,与血管紧张素II组相比,血管紧张素II + 氢气组的收缩压(SBP)降低;尽管舒张压(DBP)也略有降低,但差异无统计学意义(图1H和1I)。因此,氢气治疗可降低血管紧张素II诱导的心房颤动,并对心房大小起到保护作用。

图1. 氢气降低血管紧张素II(AngII)诱导的大鼠心房颤动易感性及持续时间,并改善心房结构和血压。
(A)心房电图和体表心电图。高实线代表猝发起搏。心房颤动用红色虚线表示,而窦性心律用黑色实线表示。(B)和(C)四组大鼠心房颤动易感性及心房颤动持续时间的量化结果。(D)四组大鼠左心房的超声检查情况。(E)和(F)左心房面积和内径。(G)心脏射血分数。(H)和(I)四组大鼠尾动脉的收缩压(SBP)和舒张压(DBP);(样本量n = 5)。*P < 0.05,**P < 0.01,***P < 0.001,与对照组(Con组)相比;#P < 0.05,##P < 0.01,###P < 0.001,与血管紧张素II组(AngII组)相比。
氢气抑制血管紧张素II诱导的大鼠心房氧化应激
与血管紧张素II组相比,血管紧张素II + 氢气组大鼠心房组织中的丙二醛(MDA)浓度显著降低。相反,血管紧张素II + 氢气组大鼠的超氧化物歧化酶(SOD)活性高于血管紧张素II组(图2A和2B)。免疫组织化学检测和蛋白质印迹分析显示,与血管紧张素II组相比,血管紧张素II + 氢气组的NOX4水平降低(图2C - 2F)。此外,通过蛋白质印迹分析测定,与血管紧张素II组大鼠相比,血管紧张素II + 氢气组大鼠中p22phox(一种促进NOX4激活的膜亚基[27, 28])的表达降低。另外,通过二氢乙啶(DHE)染色显示,血管紧张素II组大鼠的活性氧(ROS)生成量相较于血管紧张素II + 氢气组大鼠显著增加(图2G)。这些结果表明,在血管紧张素II诱导的大鼠中,氢气发挥抗氧化作用并减少了活性氧(ROS)的产生。
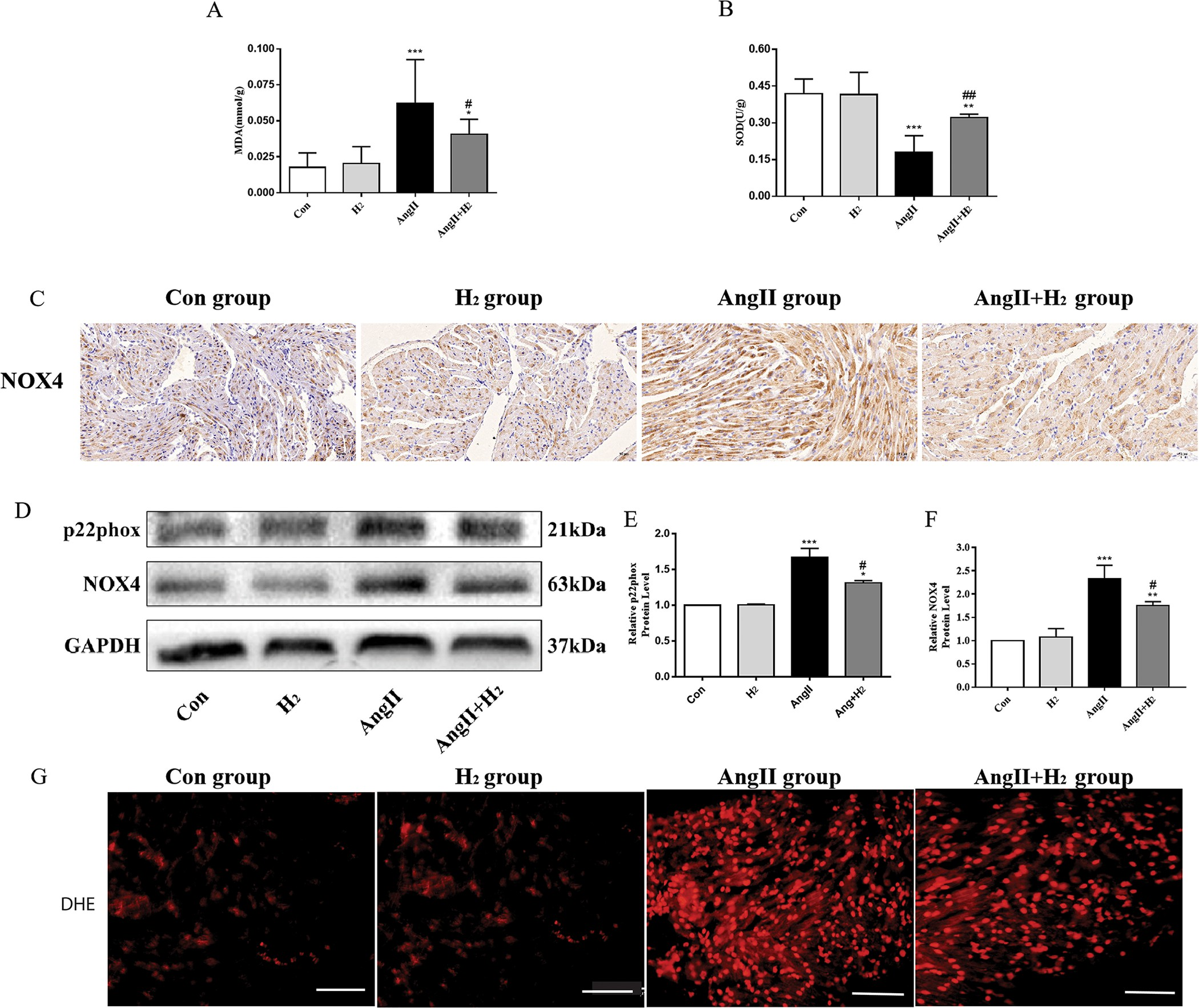
图2. 氢气抑制血管紧张素II诱导的大鼠氧化应激。
(A)通过酶联免疫吸附测定(ELISA)检测心房组织中的丙二醛(MDA)水平。(B)通过酶联免疫吸附测定(ELISA)检测心房组织中的超氧化物歧化酶(SOD)活性。(C)通过免疫组织化学染色检测心房中NOX4(棕色)的表达。(D)显示NOX4和p22phox的蛋白质印迹条带。(E)。(F)相对的NOX4和p22phox蛋白水平。(G)二氢乙啶(DHE)染色显示心房组织中活性氧(ROS)表达(红色)情况;(样本量n = 3)。*P < 0.05,**P < 0.01,***P < 0.001,与对照组(Con组)相比;#P < 0.05,##P < 0.01,###P < 0.001,与血管紧张素II组(AngII组)相比。
氢气抑制大鼠体内NLRP3炎症小体激活
我们首先通过对NLRP3进行免疫组织化学(IHC)检测确定,与对照组(Con组)和氢气组(H₂组)相比,血管紧张素II组大鼠的NLRP3表达增加,而血管紧张素II + 氢气组的NLRP3表达则显著更低(图3A)。血管紧张素II组大鼠体内的ASC、NLRP3、成熟白细胞介素 - 1β(IL - 1β)以及半胱天冬酶1 - p20(Caspase1 - p20)水平相对于对照组(Con组)和氢气组(H₂组)有所升高,并且血管紧张素II + 氢气组大鼠体内这些指标的水平相较于血管紧张素II组大鼠更低(图3B - 3F)。因此,氢气通过抑制活性氧(ROS)的产生来抑制NLRP3炎症小体激活。
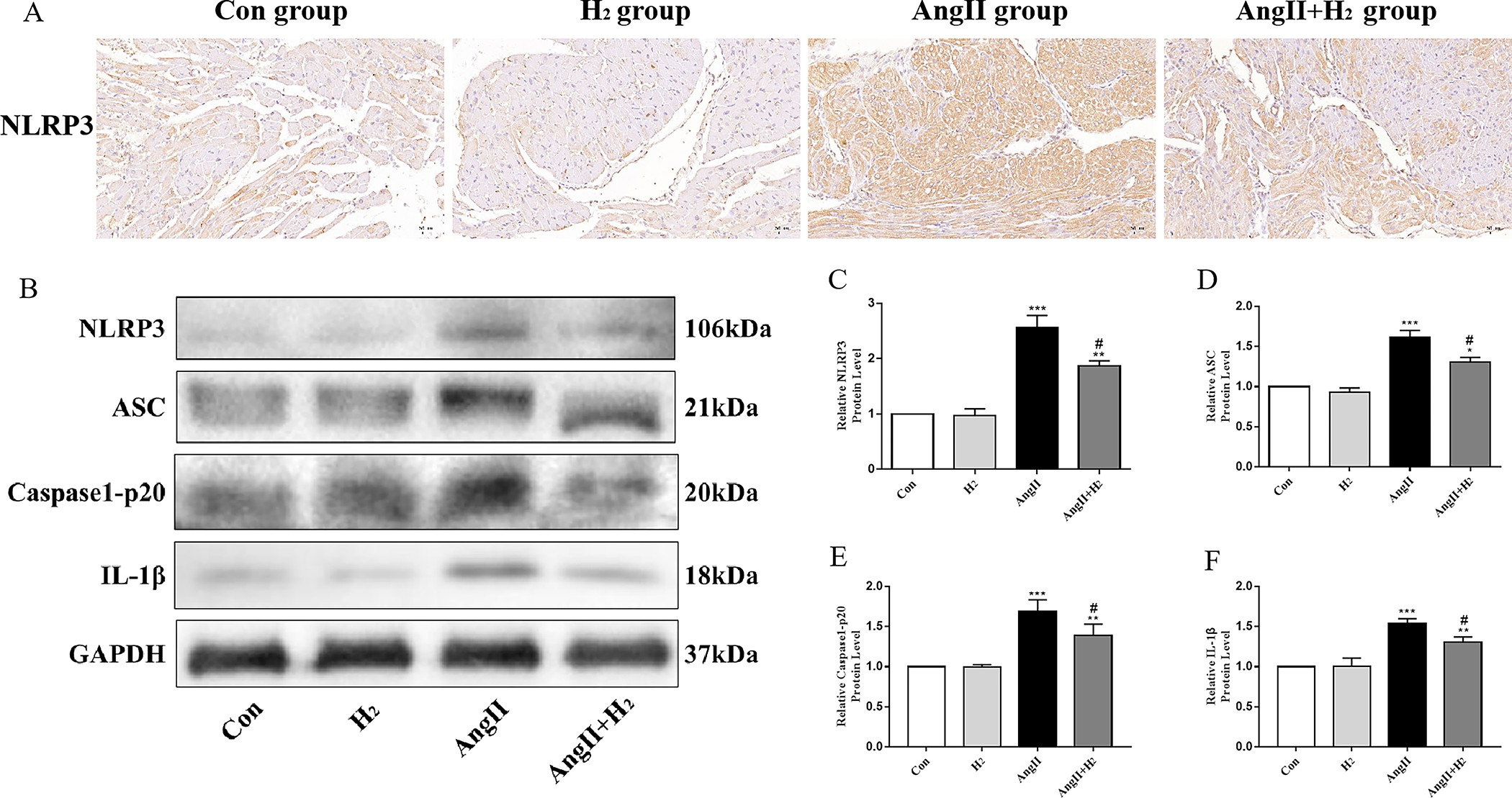
图3. 氢气抑制血管紧张素II介导的大鼠体内NLRP3炎症小体活性。
(A)通过免疫组织化学染色(放大倍数×200)检测每组大鼠心房中NLRP3(棕色)水平。(B)NLRP3、ASC、半胱天冬酶1 - p20(Caspase1 - p20)以及成熟白细胞介素 - 1β(IL - 1β)的蛋白质印迹条带。(C - F)ASC、NLRP3、半胱天冬酶1 - p20(Caspase1 - p20)以及成熟白细胞介素 - 1β(IL - 1β)蛋白的相对水平;(样本量n = 3)。*P < 0.05,**P < 0.01,***P < 0.001,与对照组(Con组)相比;#P < 0.05,##P < 0.01,###P < 0.001,与血管紧张素II组(AngII组)相比。
氢气改善血管紧张素II介导的大鼠心房电重构
NLRP3炎症小体的激活会促进钙离子(Ca²⁺)处理异常和电重构[13]。基于蛋白质印迹(WB)分析,与血管紧张素II + 氢气组大鼠相比,血管紧张素II组大鼠的钙/钙调蛋白依赖性蛋白激酶II(CaMKII)磷酸化水平显著升高(由于NLRP3激活)。与受磷酸化钙/钙调蛋白依赖性蛋白激酶II(p - CaMKII)调控、调节肌浆网中钙离子(Ca²⁺)释放的兰尼碱受体2(RyR2)的磷酸化情况也呈现出类似模式(图4A - 4C)。我们还检测了受NLRP3异常表达调控的Kir3.1、Kir3.4(乙酰胆碱激活的内向整流钾电流,IK - Ach)以及Kv1.5(超快延迟整流钾电流,IKur)蛋白水平[13, 29 - 31]。我们还发现,与血管紧张素II组相比,血管紧张素II + 氢气组中上述钾离子通道的表达降低(图4D - 4G)。这些结果表明,氢气治疗通过活性氧(ROS)激活的NLRP3炎症小体,改善了由血管紧张素II诱导的钙离子(Ca²⁺)异常释放和电重构情况。
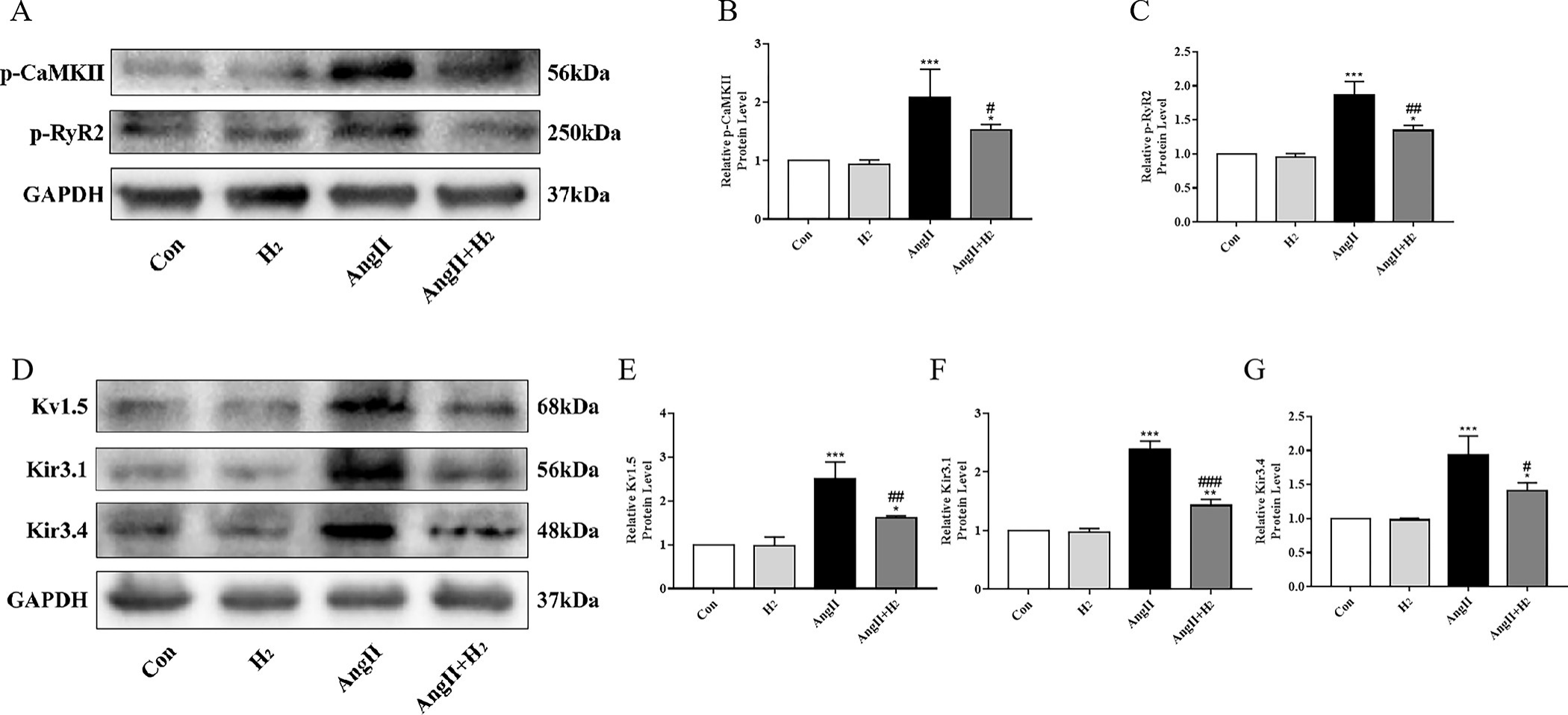
图4. 氢气改善血管紧张素II诱导的大鼠心房电重构。
(A)显示磷酸化钙/钙调蛋白依赖性蛋白激酶II(p - CaMKII)以及磷酸化兰尼碱受体2(p - RyR2)的蛋白质印迹条带。(B)和(C)磷酸化钙/钙调蛋白依赖性蛋白激酶II(p - CaMKII)和磷酸化兰尼碱受体2(p - RyR2)蛋白的相对表达情况。(D)Kv1.5、Kir3.1和Kir3.4的蛋白质印迹条带。(E - G)Kv1.5、Kir3.1和Kir3.4蛋白的相对水平;(样本量n = 3)。*P < 0.05,**P < 0.01,***P < 0.001,与对照组(Con组)相比;#P < 0.05,##P < 0.01,###P < 0.001,与血管紧张素II组(AngII组)相比。
氢气通过转化生长因子-β1(TGF - β1)/Smad2/3通路减轻血管紧张素II介导的大鼠心房纤维化
连续注射血管紧张素II 28天后,通过马松染色测定,血管紧张素II组的左心房纤维化面积相对于血管紧张素II + 氢气组有所增加(图5A)。根据天狼星红染色结果,血管紧张素II组左心房的胶原蛋白水平相对于血管紧张素II + 氢气组显著升高(图5B)。免疫组织化学检测和蛋白质印迹分析结果相似,血管紧张素II + 氢气组的I型胶原蛋白、α - 平滑肌肌动蛋白(α - SMA)以及III型胶原蛋白表达相对于血管紧张素II组显著降低。这些发现表明,吸入氢气可减少心房胶原蛋白沉积(图5C - 5G)。转化生长因子-β1(TGF - β1)/Smad2/3通路是促进纤维化的经典通路,可在血管紧张素II刺激下分泌并被激活[15]。蛋白质印迹分析结果显示,与血管紧张素II组相比,血管紧张素II + 氢气组大鼠的心房组织蛋白中潜在转化生长因子-β1(latent TGF - β1)、活性转化生长因子-β1(active TGF - β1)、磷酸化Smad2(p - Smad2)、磷酸化Smad3(p - Smad3)、磷酸化转化生长因子β受体I(p - TGFβR I)以及磷酸化转化生长因子β受体II(p - TGFβR II)水平显著降低,并且两组大鼠中这些蛋白的水平相对于对照组(Con组)和氢气组(H₂组)均有所升高(图5H - 5N)。基于这些发现,氢气通过转化生长因子-β1(TGF - β1)/Smad2/3通路下调心房纤维化。
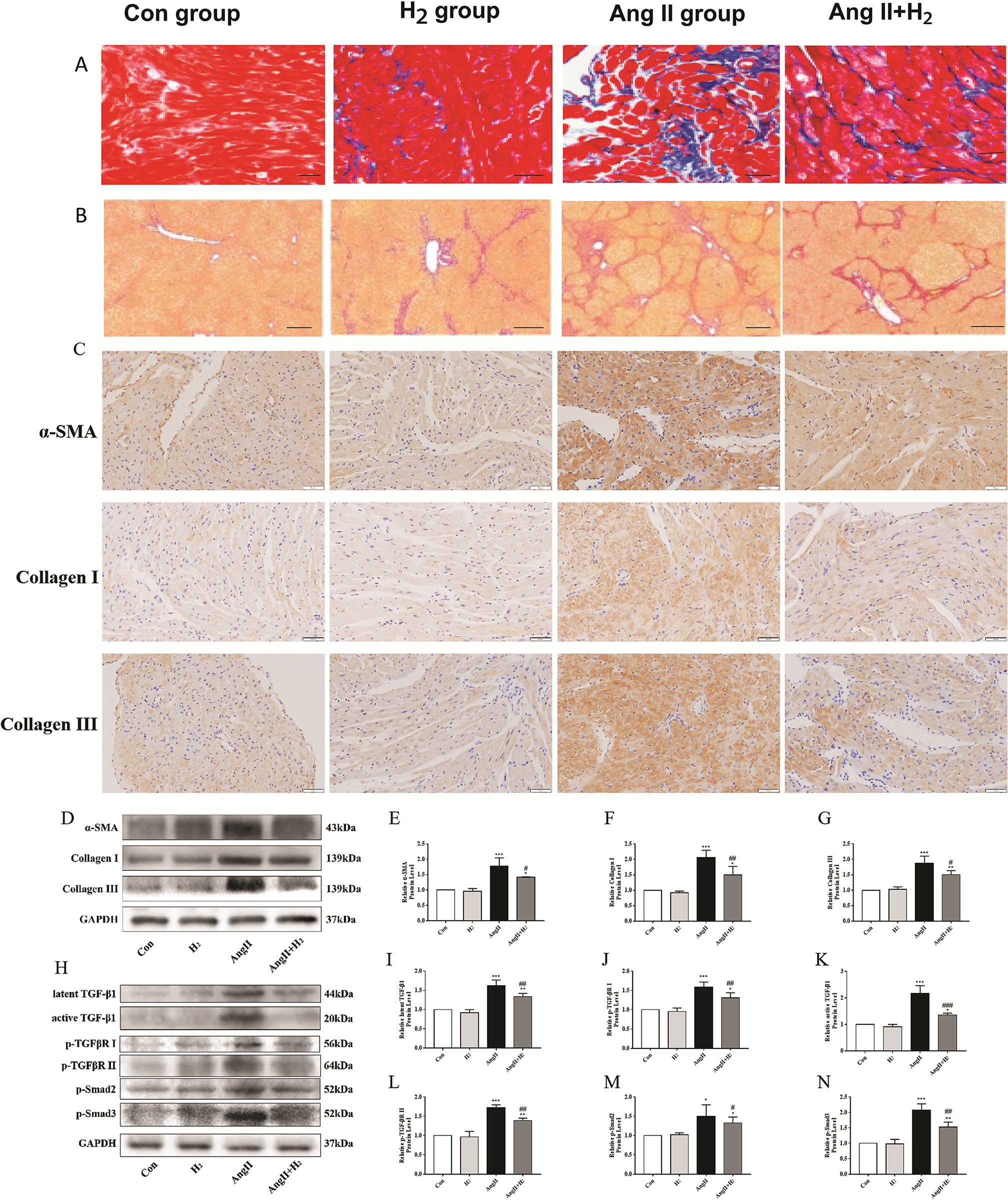
图5. 氢气通过转化生长因子-β1(TGF - β1)/Smad2/3通路减轻血管紧张素II处理的大鼠中血管紧张素II介导的心房纤维化。
(A)和(B)马松染色和天狼星红染色显示心房中的纤维化病变(蓝色)和胶原蛋白沉积(红色)情况。(C)通过免疫组织化学染色检测心房中α - 平滑肌肌动蛋白(α - SMA)、I型胶原蛋白以及III型胶原蛋白(棕色)水平。(D)显示α - 平滑肌肌动蛋白(α - SMA)、I型胶原蛋白以及III型胶原蛋白的蛋白质印迹条带。(E - G)α - 平滑肌肌动蛋白(α - SMA)、I型胶原蛋白和III型胶原蛋白蛋白的相对表达情况。(H)蛋白质印迹条带以及(I - N)潜在转化生长因子-β1(latent TGF - β1)、活性转化生长因子-β1(active TGF - β1)、磷酸化Smad2(p - Smad2)、磷酸化Smad3(p - Smad3)、磷酸化转化生长因子β受体I(p - TGFβR I)以及磷酸化转化生长因子β受体II(p - TGFβR II)的相对水平(样本量n = 3)。*P < 0.05,**P < 0.01,***P < 0.001,与对照组(Con组)相比;#P < 0.05,##P < 0.01,###P < 0.001,与血管紧张素II组(AngII组)相比。
氢气通过NOX4/活性氧(ROS)/NLRP3通路改善血管紧张素II介导的HL - 1细胞电重构
为了验证NOX4在氢气保护作用中的角色,我们使用GLX351322抑制NOX4,并观察下游活性氧(ROS)和NLRP3的表达以及电重构的影响。与对照组相比,血管紧张素II处理后,活性氧(ROS)和NLRP3水平均升高。然而,在氢气(H₂)处理组和GLX351322处理组中,活性氧(ROS)和NLRP3水平降低,并且在氢气(H₂)和GLX351322联合处理组中,活性氧(ROS)和NLRP3的降低更为显著(图6A和6B)。
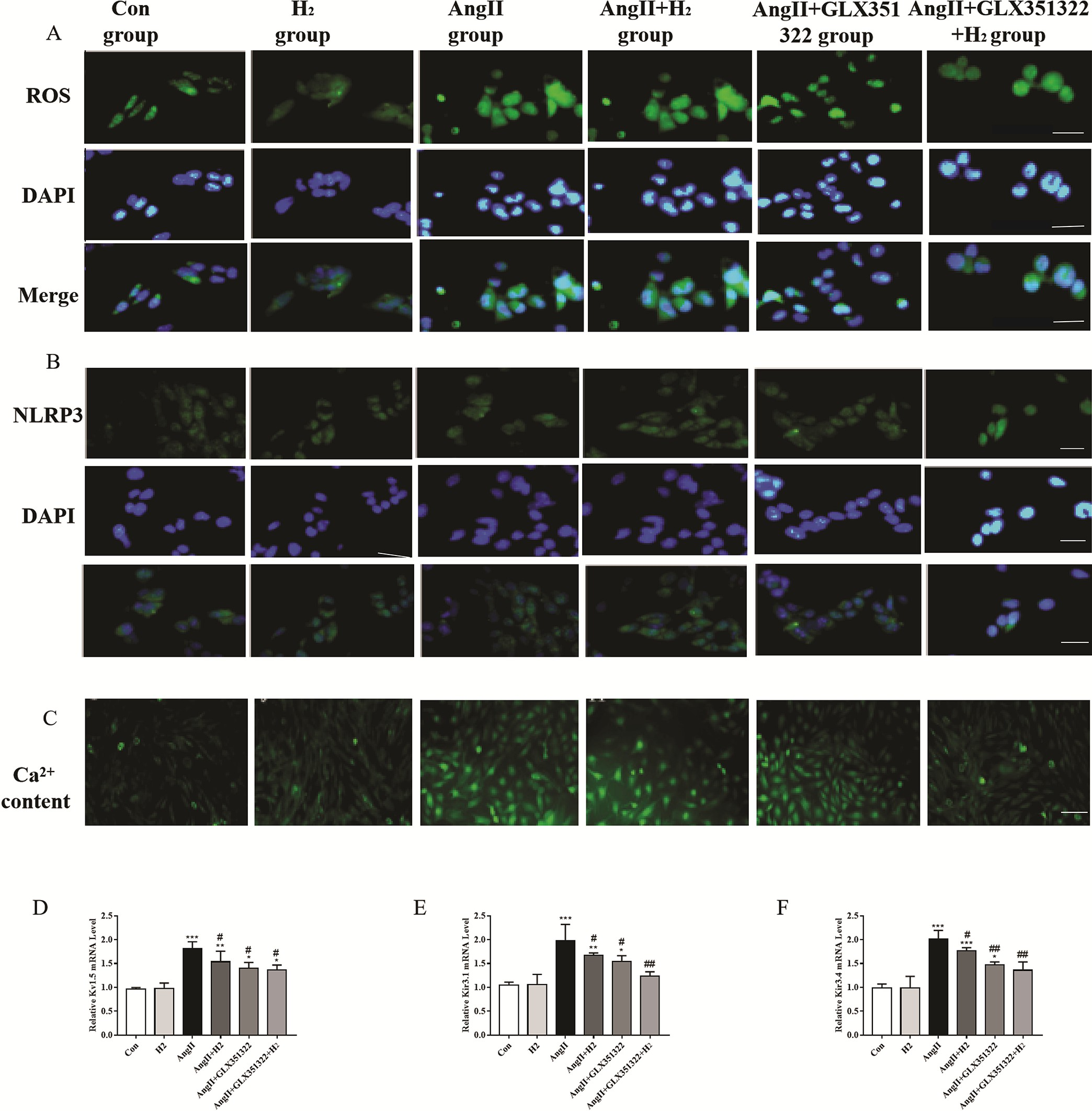
图6. 氢气通过NOX4/活性氧(ROS)/NLRP3通路改善血管紧张素II诱导的HL - 1细胞电重构。
(A)通过免疫荧光染色(放大倍数×200)检测HL - 1细胞中的活性氧(ROS)生成情况。(B)通过免疫荧光染色(放大倍数×200)检测HL - 1细胞内NLRP3的表达情况。(C)通过荧光探针检测HL细胞内的钙离子(Ca²⁺)浓度(放大倍数×200)。(D)、(E)和(F)通过实时定量聚合酶链反应(qRT - PCR)检测Kv1.5、Kir3.1和Kir3.4的mRNA情况。(样本量n = 3)。*P < 0.05,**P < 0.01,***P < 0.001,与对照组(Con组)相比;#P < 0.05,##P < 0.01,###P < 0.001,与血管紧张素II组(AngII组)相比。
此外,我们检测了HL - 1细胞内的钙离子(Ca²⁺)浓度以及Kv1.5、Kir3.1和Kir3.4的mRNA表达水平,以验证氢气(H₂)在电重构中的作用。与对照组相比,血管紧张素II组的细胞内钙离子(Ca²⁺)浓度明显升高,Kv1.5、Kir3.1和Kir3.4的mRNA水平也明显升高。然而,血管紧张素II + 氢气组和血管紧张素II + GLX351322组的钙离子(Ca²⁺)浓度以及Kv1.5、Kir3.1和Kir3.4的mRNA水平降低。此外,与血管紧张素II + 氢气组或血管紧张素II + GLX351322组相比,血管紧张素II + 氢气 + GLX351322组的钙离子(Ca²⁺)浓度以及Kv1.5、Kir3.1和Kir3.4的mRNA水平也有所降低,但未显示出更好的保护效果(图6C - 6F)。
氢气通过转化生长因子-β1(TGF - β1)/Smad2/3通路抑制成纤维细胞分化为肌成纤维细胞
MTT比色法和Transwell迁移实验证实,与血管紧张素II组的成纤维细胞相比,血管紧张素II + 氢气组的成纤维细胞增殖和迁移速率降低(图7A - 7C)。此外,出乎意料的是,与血管紧张素II组相比,血管紧张素II + 氢气组的α - 平滑肌肌动蛋白(α - SMA)水平大幅降低,I型胶原蛋白和III型胶原蛋白的mRNA表达也下调(图7D - 7F)。接下来,我们检测了成纤维细胞上清液中活性转化生长因子-β1(active TGF - β1)的表达以及成纤维细胞中与转化生长因子-β1(TGF - β1)/Smad2/3通路相关的蛋白水平。与对照组相比,血管紧张素II处理24小时后,潜在转化生长因子-β1(latent TGF - β1)和活性转化生长因子-β1(active TGF - β1)显著升高,但在给予氢气(H₂)处理后,两者的表达均降低。与血管紧张素II组相比,血管紧张素II + 氢气组中转化生长因子-β1(TGF - β1)的受体——磷酸化转化生长因子β受体I(p - TGFβR I)和转化生长因子β受体II(TGFRβ II)水平明显降低。其下游的磷酸化Smad2(p - Smad2)和磷酸化Smad3(p - Smad3)在血管紧张素II + 氢气组中的水平相较于血管紧张素II组也明显降低。有趣的是,在血管紧张素II处理成纤维细胞后,磷酸化Smad3(p - Smad3)相对于磷酸化Smad2(p - Smad2)的表达显著增加(图7G - 7N)。因此,氢气通过抑制转化生长因子-β1(TGF - β1)/Smad2/3通路,抑制转化生长因子-β1(TGF - β1)的分泌和激活,从而减轻血管紧张素II诱导的心房纤维化。

图7. 氢气通过转化生长因子-β1(TGF - β1)/Smad2/3通路抑制成纤维细胞分化为肌成纤维细胞。
(A)通过Transwell小室结晶紫染色展示的代表性图像(放大倍数×200)。(B)心房成纤维细胞的迁移情况;(C)通过MTT比色法测定的心房成纤维细胞增殖情况。(D)通过免疫荧光染色(放大倍数×200)检测每组成纤维细胞的α - 平滑肌肌动蛋白(α - SMA)水平。(E)和(F)通过实时定量聚合酶链反应(qRT - PCR)检测I型胶原蛋白和III型胶原蛋白的mRNA表达情况。(G)通过酶联免疫吸附测定(ELISA)检测成纤维细胞上清液中的活性转化生长因子-β1(active TGF - β1)。(H)蛋白质印迹条带以及(I - N)潜在转化生长因子-β1(latent TGF - β1)、活性转化生长因子-β1(active TGF - β1)、磷酸化转化生长因子β受体I(p - TGFβR I)、磷酸化转化生长因子β受体II(p - TGFβR II)、磷酸化Smad2(p - Smad2)和磷酸化Smad3(p - Smad3)的相对蛋白水平(样本量n = 3);(样本量n = 3)*P < 0.05,**P < 0.01,***P < 0.001,与对照组相比;#P <
讨论
根据我们的研究结果,给予氢气能够抑制由血管紧张素II(AngII)介导的心房颤动(AF)和心房纤维化的发生。氢气治疗可降低会增加活性氧(ROS)生成的NOX4的表达,进而抑制NLRP3炎症小体。此外,给予氢气可抑制转化生长因子-β1(TGF - β1)的分泌和激活,并抑制转化生长因子-β1(TGF - β1)/Smad2/3通路,从而改善电重构和结构重构。
氢气通过抑制NOX4活性减轻心房颤动中的氧化应激
心房颤动与氧化应激相关。过量的活性氧(ROS)水平可能与心房电重构/结构重构有关,这会导致心房颤动和心房纤维化。心房重构预示着心房颤动的发生和发展,还会引起左心房(LA)增大以及传导异常。这一过程涉及多种机制,例如氧化应激、炎症和心房纤维化。氧化应激也会促进局灶性电活动和折返。血管紧张素II(AngII)可显著升高收缩压(SBP),增加心功能障碍和左心室肥厚的风险,而这些已被确定为心房颤动的危险因素。
NADPH氧化酶是心房颤动期间活性氧(ROS)的主要来源,尤其是NOX2和NOX4。血管紧张素II(AngII)对NADPH氧化酶的激活有着重要影响,它会诱导心肌细胞内产生过量的活性氧(ROS)。NOX4在成纤维细胞、心肌细胞、血管平滑肌细胞和内皮细胞中均有表达。NOX4的激活仅需p22phox亚基的结合。在心房颤动患者中,NOX4增加可显著上调由NOX4产生的过氧化氢(H₂O₂)水平。NOX4对结构重构和心房电重构均有影响。它通过介导活性氧(ROS)生成来上调Kv1.5,而Kv1.5选择性地参与人类心房的复极化过程。罗(Luo)等人的研究表明,通过增加活性氧(ROS)和氧化型钙/钙调蛋白依赖性蛋白激酶II(ox - CaMKII),NOX4可导致钙信号异常,最终在大鼠和小鼠中引发心房颤动。我们的研究结果显示,氢气可预防血管紧张素II(AngII)诱导的大鼠发生氧化反应。心房中丙二醛(MDA)、活性氧(ROS)、NOX4和p22phox的变化表明,吸入氢气通过抑制氧化应激(OS)减轻了血管紧张素II(AngII)对心房造成的损伤。
氢气通过抑制NOX4/活性氧(ROS)/NLRP3通路改善心房颤动中的电重构
心房颤动(AF)的电重构与NLRP3炎症小体激活有关。触发因素和基质是引发和维持心房颤动所必需的,包括早期后除极和延迟后除极(EADs和DADs);两者都为心房颤动提供了基质。NLRP3炎症小体可调节钙离子(Ca²⁺)处理异常,这依赖于延迟后除极(DADs)。心肌细胞特异性的NLRP3炎症小体激活通过钙/钙调蛋白依赖性蛋白激酶II(CaMKII)磷酸化以及钙/钙调蛋白依赖性蛋白激酶II(CaMKII)依赖性的兰尼碱受体2(RyR2)丝氨酸2814位点(Ser2814)磷酸化,促进肌浆网(SR)中钙离子(Ca²⁺)异常泄漏以及电重构。肌浆网(SR)中钙离子(Ca²⁺)的异常释放为心房颤动中的局灶性异位活动提供了基质。此外,NLRP3炎症小体激活还会影响心房肌细胞中的离子通道功能障碍。
根据姚(Yao)等人的研究,NLRP3炎症小体的激活可增加超快延迟整流钾电流(IKur)和乙酰胆碱激活的内向整流钾电流(IKAch)的产生,它们都是内向整流钾电流,可缩短动作电位时程(APD),减少有效不应期(ERP),并促进折返,最终增加心房颤动的发生率。小斯科特(Scott Jr)等人也得出了相同的研究结果,即Kv1.5(超快延迟整流钾电流IKur的分子基础)、Kir3.1和Kir3.4(乙酰胆碱激活的内向整流钾电流IKAch的两个亚基)水平升高。因此,我们的研究结果表明,在体外和体内实验中,氢气通过其抗氧化和抗炎作用,抑制NLRP3炎症小体激活以及钙/钙调蛋白依赖性蛋白激酶II(CaMKII)和兰尼碱受体2(RyR2)磷酸化,通过产生延迟后除极(DADs)引发异位兴奋。氢气治疗还降低了钾离子通道(Kv1.5、Kir3.1和Kir3.4)相关蛋白的表达,这缩短了动作电位时程(APD)和心房有效不应期(AERP),并形成了折返基质。
氢气通过抑制转化生长因子-β1(TGF - β1)/Smad2/3通路减轻心房颤动中的结构重构和纤维化
血管紧张素II(AngII)可激活并维持纤维化动物心脏中重要的促纤维化生长因子——转化生长因子-β1(TGF - β1)的高水平表达。转化生长因子-β1(TGF - β1)的靶基因主要包括I型胶原蛋白、纤连蛋白、α - 平滑肌肌动蛋白(α - SMA,一种肌成纤维细胞标志物)和结缔组织生长因子。转化生长因子-β1(TGF - β1)的过表达会引发心肌间质中胶原蛋白过度沉积,进而导致心肌纤维化。
转化生长因子-β1(TGF - β1)的合成及其受体表达较为广泛,但转化生长因子-β1(TGF - β1)信号传导最重要的部分是其激活阶段。转化生长因子-β1(TGF - β1)的激活可受多种条件调节,主要包括:机械应力、特定酶的作用、酸性环境、细胞内氧化应激以及其他一些因素。根据姚(Yao)等人的研究,转化生长因子-β1(TGF - β1)的激活会加剧心肌纤维化并导致心功能丧失。经典的转化生长因子-β1(TGF - β1)通路可通过活性转化生长因子-β1(active TGF - β1)与磷酸化的转化生长因子β受体II(p - TGFβR II)结合来进行调节。磷酸化的转化生长因子β受体II(p - TGFβR II)负责招募并激活转化生长因子β受体I(TGFβR I)的磷酸化,进而使其下游的Smad2/3磷酸化。
作为转化生长因子-β1(TGF - β1)的下游因子,Smad2/3的磷酸化会诱导心脏成纤维细胞分化为肌成纤维细胞。Smad2和Smad3是Smad蛋白家族中两个密切相关的成员,它们对转化生长因子-β1(TGF - β1)通路有着重要影响。它们可被转化生长因子-β1(TGF - β1)受体激活并磷酸化,进而与Smad4结合形成转录复合物来调节基因表达。尽管它们都能调节纤维化,但功能有所不同。Smad2主要通过转化生长因子-β1(TGF - β1)信号通路对纤维化发挥关键作用,然而,Smad3还可参与非转化生长因子-β(TGF - β)信号通路,如丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3 - 激酶(PI3K)通路。此外,Smad3可通过调节促炎因子和趋化因子发挥作用,从而促进纤维化的发生。因此,Smad3在组织重构和纤维化中起着更为突出的作用。这与我们的研究结果相似,我们发现在血管紧张素II(AngII)诱导的纤维化中,磷酸化Smad3(p - Smad3)的表达明显高于磷酸化Smad2(p - Smad2),但在给予氢气(H₂)处理后,两者的表达均相应降低。
心肌纤维化对持续性心房颤动病例的心房重构有着重要影响。心房纤维化也可能是局灶性和折返性心律失常的原因之一。一些研究表明,氢气可改善心肌梗死后的心肌纤维化情况。根据我们的体外和体内研究结果,氢气抑制转化生长因子-β1(TGF - β1)的分泌和激活,抑制转化生长因子-β1(TGF - β1)/Smad2/3通路,最终改善心肌纤维化。
局限性
我们的研究存在一些局限性。首先,血管紧张素II(AngII)可通过心肌细胞中的NOX2和NOX4产生活性氧(ROS),但本研究仅针对NOX4及其亚基进行。其次,我们从翻译和转录层面验证了Kv1.5、Kir3.1和Kir3.4表达升高的情况,但受实验条件所限,无法进行膜片钳研究来观察上述超快延迟整流钾电流(IKur)和乙酰胆碱激活的内向整流钾电流(IKAch)的电流变化。最后,目前关于氢气应用的相关知识仅来源于动物和细胞实验,尚不能应用于临床试验。
结论
总之,根据我们的研究结果,使用氢气显著改善了由血管紧张素II(AngII)介导的心房颤动(AF)和心房纤维化情况,同时伴随着由NOX4介导的活性氧(ROS)过量产生减少、NLRP3炎症小体降低以及转化生长因子-β1(TGF - β1)/Smad2/3通路下调。这些变化分别改善了电重构和结构重构(图8)。因此,氢气(H₂)或许可用于治疗心房颤动。

Fig 8. Mechanism of H2 inhibition on AngII-mediated AF and atrial fibrosis.
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1468628.html?mobile=1
收藏

