氢气作为预防放射性皮炎的辐射防护剂的治疗潜力
摘要
放射性皮炎(RD)是接受放射治疗的患者中常见的副作用。目前,各机构针对急性放射性皮炎的临床皮肤护理方法差异很大,且缺乏共识。氢分子通过选择性清除自由基发挥辐射防护剂的作用,有潜力预防放射性皮炎。在本研究中,我们证实了氢气可减少HaCaT细胞中由辐射损伤诱导的双链断裂、线粒体去极化以及炎性细胞因子。此外,体内实验显示,让受辐射的皮肤区域暴露于氢气环境中可缓解放射性皮炎。通过对皮肤外观评分和组织学染色的评估发现,氢气直接经皮应用能够预防辐射诱导的毛囊损伤、真皮增厚以及白细胞浸润,从而减轻放射性皮炎的严重程度。另外,氢气可增强皮肤的抗氧化能力,使Bcl - 2相关X蛋白/B细胞淋巴瘤2(Bax/Bcl - 2)比值降低,减少凋亡细胞数量以及促炎细胞因子的表达。我们的数据表明,氢气具有抗氧化、抗炎和抗凋亡特性,可作为放射性皮炎的一种预防策略。
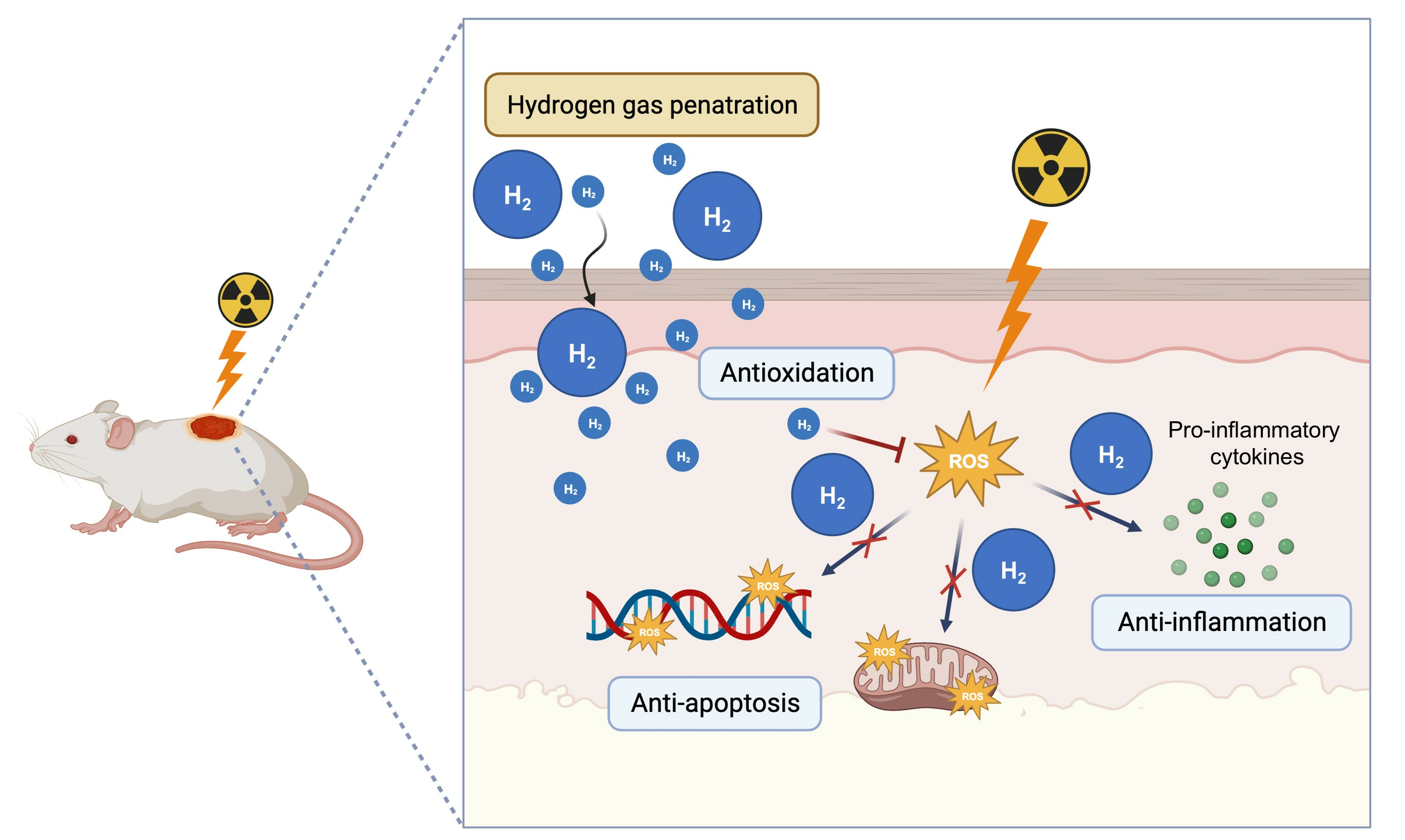
图文摘要
1. 引言
放射治疗(RT)是癌症的治疗手段之一,大约60%的癌症患者会接受放射治疗。电离辐射可产生自由电子和自由基,引发炎症反应和氧化应激。这些过程相互作用、相互强化,最终导致细胞损伤和死亡。当辐射杀死癌细胞时,也会损伤周围的正常组织。放射治疗的一个常见副作用是急性放射性皮炎(RD),在多达95%接受治疗的患者中会出现这种情况。放射性皮炎会影响患者的外貌和生活质量,进而降低他们继续接受治疗的意愿。放射性皮炎的发病机制涉及表皮、真皮和脉管系统受到的直接辐射损伤以及后续的炎症反应。急性反应会导致皮肤色素沉着变化、毛发生长中断以及真皮损伤。更高剂量会使基底角质形成细胞有丝分裂增加,导致皮肤增厚、出现鳞屑(干性脱屑)。在更高剂量下,基底层无法恢复,会造成湿性脱屑。这些损伤会损害皮肤的屏障和免疫功能,增加感染风险。此外,血管内皮损伤会导致缺氧,并增加转化生长因子(TGF)-β的表达。转化生长因子(TGF)-β进而刺激成纤维细胞产生过量的细胞外基质(ECM)蛋白,导致纤维化。
基于辐射诱导损伤的机制,辐射防护方法大致可分为四类:促进DNA损伤修复、清除活性氧(ROS)、抗炎以及抑制死亡信号通路。然而,各机构针对急性放射性皮炎的临床皮肤护理方法差异很大,在很大程度上依赖于个别临床医生的专业知识和观点。最近,多国癌症支持治疗协会(MASCC)肿瘤皮肤病学研究小组基于对现有急性放射性皮炎管理证据的系统综述制定了临床指南。这些指南推荐了各种外用产品,包括莫米松、倍他米松等皮质类固醇、橄榄油以及聚氨酯保护膜。虽然外用类固醇在预防头颈部或乳腺癌患者接受放射治疗时出现放射性皮炎方面已显示出疗效,但它们可能会导致皮肤萎缩、感染风险增加等副作用。橄榄油因其所含的油酸成分而具有抗氧化和抗炎特性,但可能会让皮肤有油腻感,并且难以保持清晰的放射治疗标记。保护膜可滋润和保护皮肤,降低外部机械损伤或细菌感染的风险,从而减少放射性皮炎的发生。然而,需要考虑的是,由于外用制剂或保护膜的厚度会产生等效材料(bolus)效应,在光子放射治疗中使用它们可能会增加皮肤的受照剂量。
氢气分子量小,能轻易穿透生物膜,扩散到细胞核和线粒体中。氢气的输送可通过多种途径实现,包括吸入、口服富氢水、注射富氢盐水、增加肠道内氢气以及直接接触等方式。氢气通过选择性清除羟基自由基(•OH)和过氧亚硝酸盐阴离子(ONOO⁻)等强活性氧(ROS),有望成为一种辐射防护剂。氢气已被证实具有抗氧化、抗炎和抗凋亡特性,使其成为适用于多种病症的治疗性气体,这些病症包括缺血性器官损伤、神经退行性疾病、骨关节疾病以及呼吸系统疾病。氢气在预防和治疗皮肤相关疾病方面显示出潜在的应用价值,其在临床上应用于患者的情况也日益增多。此外,皮肤位于体表,非常适合通过沐浴或气体暴露等方式直接接触氢气,且不会导致体内氢气剂量累积。然而,目前专门聚焦于分子氢对放射性皮炎保护作用的文献有限。现有研究尚未充分探究氢气针对放射性皮炎的保护机制,而且所采用的输送途径可能无法精准调控氢气向皮肤的输送。
在本研究中,我们通过体外试验模拟了放射性皮炎的发病机制,并验证了氢气保护作用的假设。在动物实验中,我们设计了一个腔室,使小鼠皮肤暴露于高浓度氢气环境中,期望能增强氢气向皮肤的渗透。目的是实现对放射性皮炎的预防作用,并探究皮肤中氧化、炎症以及凋亡相关分子的调控情况。
2. 材料与方法
2.1. 体外试验
2.1.1. 细胞培养
本研究使用人表皮角质形成细胞HaCaT(细胞系编号T0020001,购自美国加利福尼亚州圣地亚哥的AddexBio公司)。细胞在含有10%胎牛血清(FBS)和1%青霉素/链霉素的DMEM培养基中,于37℃、5%二氧化碳浓度的条件下培养。细胞每两天传代一次。培养在10厘米培养皿(中国广州的BIOFIL JET - TCD - 101型培养皿)中进行。
2.1.2. 辐射照射
对于细胞照射,单次给予4戈瑞(Gy)的剂量,细胞放置在距离辐射源5厘米处。所使用的X射线机为Nanoray(型号NS - 082505,由中国台湾台北的NanoRay生物技术有限公司生产),配备有Nanoray(型号NS - 08P - 01,同样由NanoRay生物技术有限公司生产)X射线源,其运行能量为50千电子伏特(keV),剂量率为3.88戈瑞/分钟(见图S1)。
2.1.3. 双链断裂检测
将HaCaT细胞以每孔8×10⁴个细胞的密度接种在12孔板(美国康宁公司的Corning® Costar®型12孔板)中,孔板内放置有18毫米的盖玻片(德国劳达 - 柯尼希斯霍芬的MARIENFIED公司生产)。细胞在37℃、5%二氧化碳浓度条件下培养24小时。指定用于氢气处理的样本被转移至氢气供应室中暴露1小时。氢气暴露后,XR组(接受X射线照射组)在室温下进行X射线照射。在37℃下孵育30分钟后,细胞在室温下用4%的甲醛(溶于双蒸水(DDIW,德国默克密理博公司生产,位于达姆施塔特))固定10分钟,接着在室温下用0.1%的Triton X - 100(溶于双蒸水)进行透化处理10分钟,然后在4℃下用含2.5%胎牛血清的含吐温20的Tris缓冲盐水(TBST)封闭1小时。随后,细胞在4℃下与一抗(1:500稀释,组蛋白H2A.X S139磷酸化抗体,产品编号GTX127340,美国得克萨斯州圣安东尼奥的GeneTex公司生产)孵育过夜,之后在室温下与二抗(1:1000稀释,山羊抗兔IgG,DyLight 488荧光标记,产品编号GTX213110 - 04,GeneTex公司生产)孵育1小时。最后,将浓度为1.5μg/mL的含4′,6 - 二脒基 - 2 - 苯基吲哚(DAPI,产品编号GTX30920,GeneTex公司生产)的Fluoroshield™试剂滴加到盖玻片上,将盖玻片置于载玻片上,使用荧光显微镜(德国徕卡公司的Leica 6000B型)对细胞进行成像观察。
2.1.4. 线粒体膜电位检测
在用氢气处理5×10⁴个HaCaT细胞1小时后,立即对细胞进行辐射照射。阳性对照组用10μmol/L的羰基氰化物4 - (三氟甲氧基)苯腙(FCCP,货号SML2959,美国密苏里州圣路易斯的西格玛奥德里奇公司生产)处理,该物质通过消除质子梯度破坏线粒体膜电位(MMP),使得经JC - 1染色的细胞呈现绿色荧光。照射后,细胞在37℃下孵育3小时,然后用0.25%胰蛋白酶处理3 - 5分钟并离心以去除培养基。将细胞重悬于含JC - 1染料(货号30001,美国加利福尼亚州弗里蒙特的BIOTI - UM公司生产)的磷酸盐缓冲盐水(PBS)中,在37℃下孵育15分钟以评估线粒体膜电位。随后立即进行流式细胞术分析(使用美国加利福尼亚州布雷亚的贝克曼库尔特公司的CytoFLEX流式细胞仪)。设门策略包括:(1)前向散射光面积(FSC - A)与侧向散射光面积(SSC - A)对比,以排除细胞碎片并选择主要细胞群;(2)前向散射光高度(FSC - H)与前向散射光面积(FSC - A)对比,以去除细胞聚集体,确保进行单细胞分析。使用藻红蛋白(PE)通道检测红色荧光,使用异硫氰酸荧光素(FITC)通道检测绿色荧光进行荧光分析。生成红/绿荧光散点图,依据线粒体膜电位区分细胞。线粒体膜电位高的健康细胞显示强红色荧光,而线粒体膜电位降低的细胞则发出绿色荧光。用FCCP处理的细胞作为数据解读的参照。
2.1.5. 促炎细胞因子检测
将6×10⁴个HaCaT细胞接种在24孔板(美国纽约州康宁公司的Costar®,型号COS3524型24孔板)中,孵育24小时直至细胞贴壁。然后将培养板放入氢气供应室,以1.2升/分钟的流速通入氢气1小时。氢气处理结束后,立即对细胞进行4戈瑞的辐射照射。照射24小时后,收集细胞培养上清液。收集的上清液在4℃下以13200转/分钟的转速离心15分钟,以去除细胞碎片等杂质。随后,提取澄清的上清液,使用酶联免疫吸附测定(ELISA)试剂盒(美国加利福尼亚州圣地亚哥的BioLegend公司,货号430501)对培养基中的白细胞介素 - 6(IL - 6)含量进行定量检测。
2.2. 离体试验
氢气经皮测试
取3微升(3μL)的MB - Pt探针(美国得克萨斯州普莱诺的H₂ Sciences公司生产),这是一种能与氢气反应生成无色溶液的亚甲基蓝探针,将其加入到0.6毫升去离子水(DIW)中,制备氢气检测试剂。然后将该试剂转移至1.5毫升的离心管中,将6 - 8周龄雌性BALB/c小鼠的新鲜皮肤样本放置在离心管上,确保与氢气腔室的出气口对齐。用组织胶水将皮肤固定在离心管开口处,并用胶带加固。接着放置一根氢气输送管,将氢气(流速为1.2升/分钟)导向皮肤表面。在0、1、2和3小时这几个时间点从微量离心管中收集试剂样本。该探针接触氢气时会从蓝色变为透明(无色)。使用Tecan Infinite 200酶标仪(瑞士帝肯公司的TECAN Sunrise、Infinite 200 Pro型,位于美国加利福尼亚州摩根希尔)在662纳米波长处测量试剂的吸光度。
2.3. 体内试验
2.3.1. 动物
6 - 8周龄的雌性BALB/c小鼠购自中国台湾台北市南港的BioLASCO台湾有限公司。小鼠饲养在可控环境中,温度范围为20 - 26℃,湿度在30% - 70%之间,光照/黑暗周期为12小时。为其提供经灭菌的实验室饲料。我们实验中使用的所有动物均按照国立阳明交通大学机构动物护理与使用委员会批准的方案(IACUC - NYCU 1110320r)进行处理和饲养。
2.3.2. 放射性皮炎模型
在实验前两天,使用脱毛膏(奈尔脱毛膏;活性成分:氢氧化钠)去除小鼠背部面积为1.5×1.5平方厘米区域的毛发。通过腹腔注射氯胺酮(10毫克/100克)和赛拉嗪(1.5毫克/100克)对小鼠进行麻醉。用竹签和橡皮筋固定小鼠背部皮肤,使其在操作台上保持平整,同时用铅板遮挡小鼠身体的其余部位(见图S1)。暴露的皮肤区域接受累计35戈瑞的剂量照射,连续五天每天给予7戈瑞的剂量。每次照射时对小鼠进行麻醉,以确保照射的稳定性和准确性。细胞和动物照射使用的是同一型号的仪器。不过,由于照射区域不同,动物放置在距离辐射源12厘米处,剂量率为0.68戈瑞/分钟。
2.3.3. 氢气供应室的设计
氢气供应室分为两个隔间:一个用于实施麻醉,另一个用于氢气暴露(见图S2)。用颈板作为隔板将小鼠颈部固定,使其头部位于麻醉室,身体位于氢气室(见图S3)。
2.3.4. 氢气处理
用异氟烷对小鼠进行麻醉后,将其放置在特制的腔室内。涂抹眼膏(Betasom - N)以防眼睛干燥。用颈板固定小鼠颈部,使其头部置于气体麻醉隔间,身体置于氢气供应隔间,确保两侧气体尽量少混合。向气体麻醉室供应氧气和异氟烷的混合气体,以1.2升/分钟的流速向氢气供应室通入氢气。每次处理时,小鼠背部皮肤暴露于氢气环境中约2小时。
2.3.5. 实验设计
详细的实验设计如方案1所示。将BALB/c小鼠随机分为四组:对照组(暴露于室内空气且假照射)、氢气组(给予氢气)、XR组(接受照射)以及XR + H₂组(接受照射并给予氢气)。在实验的第1天至第5天,XR组每天接受7戈瑞的照射。XR + H₂组先被放置在氢气供应室中暴露于氢气环境2小时,然后接受7戈瑞的照射,最后再暴露于氢气环境2小时。在实验的第6天至第14天,氢气组和XR + H₂组每天暴露于氢气环境2小时。
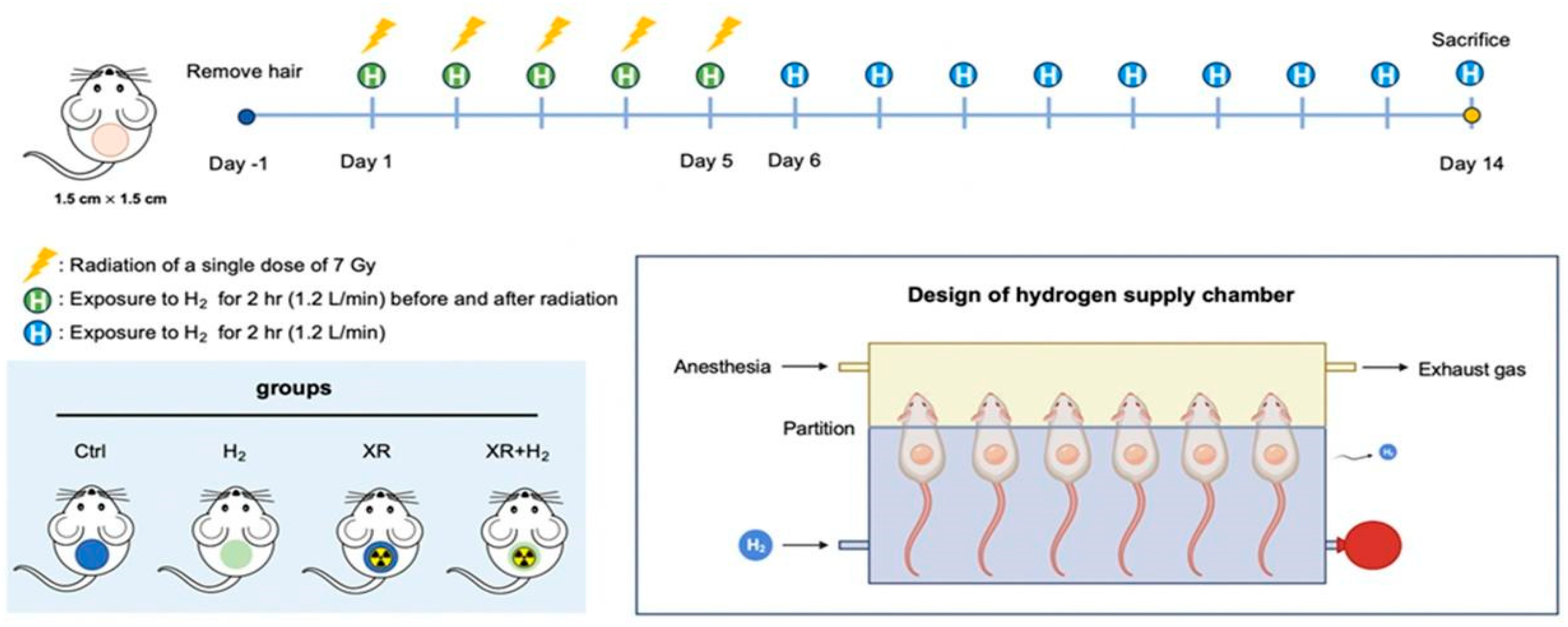
方案1. BALB/c小鼠接受X射线照射时氢气疗法的实验设计
2.3.6. 小鼠背部皮肤外观
观察每组小鼠的背部皮肤,并依据改良版的不良事件通用术语标准(CTCAE)进行评分,详见表1[23]。在第1、7、12和14天对每只小鼠的皮肤外观进行评估,并拍摄相应照片。在实验的第14天,使用二氧化碳对小鼠实施安乐死,然后从背部采集尺寸为2.0厘米×2.0厘米的皮肤组织。
表1. 放射性皮炎评分系统(改编自不良事件通用术语标准)
2.3.7. 组织病理学分析
皮肤组织在室温下用4%多聚甲醛固定至少24小时,然后包埋在石蜡中。对石蜡包埋的皮肤切片进行切片处理,并采用苏木精 - 伊红(H&E)染色、马松三色(MT)染色以及脱氧核糖核苷酸末端转移酶介导的dUTP缺口末端标记法(TUNEL)进行染色。使用全切片扫描系统(德国奥伯科亨的蔡司Axioscan 7型)观察图像。
2.3.8. 皮肤组织蛋白样品的制备与提取
将冷冻的皮肤组织在含蛋白酶抑制剂鸡尾酒I(无EDTA,100倍浓缩液,溶于二甲基亚砜,美国马萨诸塞州波士顿的TargetMol公司生产)的RIPA缓冲液(用于蛋白质印迹分析)或磷酸盐缓冲盐水(PBS)缓冲液(用于酶联免疫吸附测定(ELISA)分析)中进行匀浆和超声处理,每次处理5分钟,以8500转/分钟的转速重复该过程三次。然后,在4℃下以13200转/分钟的转速对其进行离心20分钟。从匀浆中获取上清液后,将蛋白样品储存在 - 80℃。
2.3.9. 蛋白质印迹分析
使用布拉德福德试剂(美国密苏里州圣路易斯的西格玛奥德里奇公司生产)测定蛋白质浓度,取30μg蛋白质制备用于电泳的样品。将等量的蛋白质在12%十二烷基硫酸钠 - 聚丙烯酰胺凝胶中进行分离。然后将凝胶上的蛋白质转移至聚偏二氟乙烯(PVDF)膜上,用封闭缓冲液对该膜封闭1小时。封闭后,在4℃下将膜与一抗孵育过夜。所用的一抗包括:β - 肌动蛋白(稀释比例为1:10000,货号GTX109639,美国马萨诸塞州波士顿的GeneTex公司生产)、甘油醛 - 3 - 磷酸脱氢酶(GAPDH,稀释比例为1:5000,货号GTX100118,美国得克萨斯州圣安东尼奥的GeneTex公司生产)、Bcl - 2相关X蛋白(Bax,稀释比例为1:3000,货号GTX109683,美国得克萨斯州的GeneTex公司生产)、B细胞淋巴瘤2(Bcl - 2,稀释比例为1:1000,货号#3498,美国马萨诸塞州丹弗斯的Cell Signaling公司生产)、白细胞介素 - 1β(IL - 1β,稀释比例为1:1000,货号A20529,美国马萨诸塞州波士顿的ABclonal公司生产)以及白细胞介素 - 6(IL - 6,稀释比例为1:1000,货号A0286,美国马萨诸塞州波士顿的ABclonal公司生产)。随后,用含吐温20的Tris缓冲盐水(TBST)缓冲液将膜洗涤三次,在室温下与二抗(1:5000,山羊抗兔IgG抗体辣根过氧化物酶标记,货号GTX213110 - 01,美国得克萨斯州的GeneTex公司生产)孵育1小时。使用增强化学发光(ECL)试剂(货号GTX400006,美国得克萨斯州的GeneTex公司生产)检测标记的蛋白质,使用发光/荧光成像系统(美国犹他州洛根的通用电气公司安玛西亚成像仪680型)采集图像。
2.3.10. 抗氧化酶分析
在分析前,使用布拉德福德方法对蛋白样品进行定量。使用凯曼公司(美国密歇根州安阿伯市)的特定检测试剂盒测定皮肤中超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性以及谷胱甘肽(GSH)含量(超氧化物歧化酶试剂盒货号为706002,过氧化氢酶试剂盒货号为707002,谷胱甘肽试剂盒货号为703002)。对于超氧化物歧化酶活性检测,将样品稀释后,加入到含自由基检测剂和黄嘌呤氧化酶的96孔板中,在室温下孵育30分钟,然后在450纳米波长处测量吸光度。对于过氧化氢酶活性检测,向稀释后的样品中加入过氧化氢以启动反应,反应进行20分钟后,用氢氧化钾终止反应,在540纳米波长处测量吸光度。对于谷胱甘肽含量检测,将样品与偏磷酸混合,离心后用三乙醇胺调节pH值。加入检测试剂后,让反应在室温下进行25分钟,然后在410纳米波长处测量吸光度。利用标准曲线和蛋白质浓度来计算超氧化物歧化酶和过氧化氢酶的活性以及谷胱甘肽的含量。
2.4. 统计分析
采用Prism软件(版本8,美国加利福尼亚州圣地亚哥的GraphPad软件公司)进行数据分析。体外和体内实验均独立进行至少三次(n≥3个生物学重复)。结果以平均值表示,标准差(SD)用误差棒表示。采用方差分析(ANOVA)及随后的多重比较检验分析组间差异,将p值小于0.05定义为具有统计学显著性。
3. 结果
3.1. 氢气在体外对放射性皮炎的保护作用
我们利用永生化的人角质形成细胞HaCaT细胞建立体外模型。对HaCaT细胞采用不同处理方式进行孵育:对照组(Ctrl)、氢气组(H₂,暴露于氢气中1小时)、XR组(接受照射)以及XR + H₂组(暴露于氢气中1小时后接受照射)。氢气流速为1.2升/分钟。X射线照射在50千伏下进行,总剂量为4戈瑞。细胞实验中选择4戈瑞剂量是基于先前的研究,并且也与临床乳腺癌放射治疗中通常使用的单次剂量相符合[24,25,26]。阳性对照组接受总剂量为10戈瑞的X射线照射。
辐射产生的电子和自由基可诱导DNA双链断裂,进而导致细胞损伤和死亡。双链断裂会促使H2AX迅速磷酸化,产生γ - H2AX[28]。如图1A所示,与XR组相比,经氢气处理的XR + H₂组显示出代表γ - H2AX的绿色荧光斑点更少,这表明氢气具有减少辐射所致DNA断裂的潜力。

图1. 体外试验中氢气对HaCaT细胞的影响。HaCaT细胞经过有无氢气(H₂)处理后,再接受X射线照射(4戈瑞)。(A)通过用4′,6 - 二脒基 - 2 - 苯基吲哚(DAPI)对细胞核(染为蓝色)染色以及用DyLight 488对γ - H2AX(染为绿色)染色来评估双链断裂情况。图像在100倍放大倍数下拍摄,比例尺代表20微米。接受10戈瑞X射线照射的细胞用作阳性对照。(B)利用JC - 1染料通过流式细胞术分析线粒体去极化情况。羰基氰化物 - 对 - 三氟甲氧基苯腙(FCCP),一种可诱导完全去极化的线粒体解偶联剂,被用作阳性对照。健康的线粒体发出红色荧光(JC - 1聚集体,通过藻红蛋白(PE)通道检测),而去极化的线粒体则在细胞质中发出绿色荧光(JC - 1单体,通过异硫氰酸荧光素(FITC)通道检测)。(C)利用酶联免疫吸附测定(ELISA)试剂盒检测白细胞介素6(IL - 6)水平。接受10戈瑞X射线照射的细胞用作阳性对照。数据以三个独立生物学样本(n = 3)的平均值±标准差形式呈现。使用单因素方差分析确定统计学显著性,显著性水平设定为*p < 0.05以及***p < 0.001。
电离辐射会产生活性氧(ROS),其可能诱导线粒体通透性转换孔开放,导致线粒体去极化(膜电位降低)并随后引发细胞凋亡[29]。我们利用JC - 1染料来分析线粒体膜电位(MMP)。在健康的线粒体中,该染料在线粒体内膜形成发出红色荧光(藻红蛋白 - A通道,即PE - A通道)的JC - 1聚集体。然而,在凋亡的线粒体中,该染料形成JC - 1单体,在细胞质中发出绿色荧光[30]。此外,羰基氰化物 - 对 - 三氟甲氧基苯腙(FCCP),一种线粒体解偶联剂,被用作阳性对照来破坏膜电位,使经JC - 1染色的细胞出现完全去极化并发出绿色荧光。图1B展示了通过流式细胞术进行的线粒体膜电位分析结果。在XR组中,绿色荧光所占百分比为13.9%,而在XR + H₂组中,该比例仅为6.01%。由此结果可以推断,氢气处理能够减少辐射诱导的细胞凋亡。
为了确认氢气是否能有效减轻辐射诱导的炎症反应,我们测量了HaCaT细胞促炎细胞因子的释放情况。图1C展示了每组HaCaT细胞释放的白细胞介素6(IL - 6)水平。经氢气处理的组(H₂组和XR + H₂组)中白细胞介素6(IL - 6)水平明显低于对照组(Ctrl组)和XR组,这表明氢气可减少HaCaT细胞中白细胞介素6(IL - 6)的释放。在本研究中,将照射后24小时的白细胞介素6(IL - 6)作为整体炎症标志物进行分析,它反映了对辐射暴露及后续炎症的免疫反应。由于重点在于测量总体炎症反应,所以未将白细胞介素6(IL - 6)分泌量按照细胞活力进行归一化处理。
3.2. 氢气的经皮渗透能力
为了验证氢气穿透皮肤的能力,我们使用MB - Pt探针进行了经皮测试。该探针在接触氢气时会从蓝色变为透明(无色)。实验过程是将探针放置在一个离心管中,把刚采集的小鼠全层皮肤固定在离心管顶部,如图2A所示。以1.2升/分钟的氢气流速引导氢气经过皮肤,我们观察到了离心管内的颜色变化。图2B展示了试剂在接触氢气后0至3小时的颜色变化情况。图2C呈现了在接触氢气后0、1、2和3小时时探针在662纳米波长处的吸光度值。很明显,放置在空气中的探针吸光度值相对保持恒定,而接触氢气的探针吸光度值随着时间的推移持续下降。这表明通过输送氢气的这种方式,氢气能够成功穿透皮肤。

图2. 氢气经皮测试。(A)经皮测试示意图。(B)一张展示MB - Pt探针蓝色在不同时间点被氢气还原后消失的照片。(C)MB - Pt探针被氢气还原后在662纳米波长处的吸光度(n = 3)。
3.3. 氢气在体内对放射性皮炎的保护作用
为了评估氢气对放射性皮炎(RD)的保护作用,我们使用BALB/c小鼠进行了体内试验。将小鼠随机分为四组:对照组(Ctrl)、氢气组(H₂)、XR组(仅接受辐射照射)以及XR + H₂组(既接受辐射照射又接受氢气处理)。氢气流速为1.2升/分钟,持续2小时。X射线照射在50千伏下进行,总剂量为35戈瑞(单次剂量为每天7戈瑞)。
3.3.1. 小鼠背部皮肤外观
在图3A中,在第7天,接受辐射照射的各组小鼠皮肤未观察到明显变化。到第12天,XR组的所有小鼠均出现皮肤干燥和轻微脱屑现象,而XR + H₂组中有两只小鼠出现干性脱屑情况。到第14天,XR组的所有小鼠都出现了湿性脱屑以及大面积结痂情况。相比之下,XR + H₂组中只有两只小鼠有结痂现象,另外两只小鼠未出现可见的脱皮或皮肤表面损伤情况。利用改良版的不良事件通用术语标准(CTCAE)评分系统(表1),我们观察到在第12天和第14天,XR组的放射性皮炎等级明显高于XR + H₂组(图3B)。
图3. 小鼠背部皮肤外观。(A)拍摄小鼠背部皮肤的照片以研究氢气(H₂)对放射性皮炎在体内的辐射防护功效。(B)小鼠在第7天、第12天和第14天的放射性皮炎皮肤评分。采用双向方差分析确定统计学显著性,显著性水平设定为*p < 0.05以及**p < 0.01。“ns”标记表示无统计学显著差异,即p > 0.05。
3.3.2. 氢气对放射性皮炎的抗炎作用
在第7天和第14天,我们进行了组织活检,以评估小鼠在接受照射及氢气暴露后的皮肤反应情况。图4展示了苏木精 - 伊红(H&E)染色结果。到第7天,XR组和XR + H₂组之间在皮肤组织学方面未观察到明显差异,也没有炎症细胞浸润现象。到第14天,XR组出现了明显的表皮破损伴结痂情况,并且在表皮和真皮中有大量白细胞浸润,这表明存在严重炎症。相比之下,XR + H₂组显示出表皮相对完整,真皮中的炎症细胞更少,且有更多存活的毛囊。

图4. 苏木精 - 伊红(H&E)染色显微照片。(A)苏木精 - 伊红(H&E)染色情况,(B)第7天和第14天BALB/c小鼠背部皮肤每个视野中的炎症细胞数量,(C)第7天和第14天BALB/c小鼠背部皮肤每个视野中的毛囊数量。比例尺为50微米。蓝色箭头指示炎症细胞所在位置,黄色箭头指示毛囊所在位置。数据以至少三个独立生物学样本(n≥3)的平均值±标准差形式呈现。采用单因素方差分析确定统计学显著性,显著性水平设定为****p < 0.0001。“ns”标记表示无统计学显著差异,即p > 0.05。
辐射会触发免疫反应,促使促炎细胞因子释放,进而引发炎症。图5展示了每组小鼠皮肤中白细胞介素 - 6(IL - 6)和白细胞介素 - 1β(IL - 1β)的蛋白质表达水平。在第7天,各组间白细胞介素 - 6(IL - 6)和白细胞介素 - 1β(IL - 1β)的表达水平无显著差异。然而,到第14天,与XR组相比,XR + H₂组中白细胞介素 - 6(IL - 6)的表达明显更低,白细胞介素 - 1β(IL - 1β)呈现下降趋势。局部施用氢气能够降低受辐射皮肤中炎症因子的表达,从而减轻辐射诱导的损伤。

图5. 氢气(H₂)对炎症标志物的调控作用。(A)实验第7天和(B)实验第14天小鼠皮肤中白细胞介素 - 6(IL - 6)和白细胞介素 - 1β(IL - 1β)表达的蛋白质印迹分析结果。数据以至少三个独立生物学样本(n≥3)的平均值±标准差形式呈现。采用单因素方差分析确定统计学显著性,显著性水平设定为***p < 0.001。“ns”标记表示无统计学显著差异,即p > 0.05。
在受到辐射后,皮肤会产生过量的细胞外基质(ECM)蛋白,其包含胶原蛋白、纤连蛋白和蛋白聚糖[6]。我们通过马松三色(MT)染色观察了真皮中胶原纤维的含量。在图6中,表面的红色区域代表表皮层,而蓝紫色区域代表存在于真皮层的胶原纤维(黄色虚线所示)。到第14天,XR组的真皮中胶原纤维堆积明显增多。相反,在接受氢气治疗的XR + H₂组中,胶原纤维含量相对较低,这表明氢气具有减少辐射诱导的细胞外基质堆积的潜力,从而降低组织的硬度和厚度。

图6. 马松三色(MT)染色显微照片。顶部红色区域代表表皮层,蓝紫色区域代表存在于真皮层的胶原纤维(黄色虚线所示)。比例尺为50微米。
3.3.3. 氢气对放射性皮炎的抗凋亡作用
脱氧核糖核苷酸末端转移酶介导的dUTP缺口末端标记法(TUNEL)染色通过标记DNA片段来检测组织中凋亡细胞的位置。在图7中,棕色代表组织中由TdT标记的凋亡位点。可以观察到,在第7天皮肤组织的真皮层中,只有XR组出现了少量凋亡细胞。到第14天,XR组的凋亡细胞数量不仅在真皮层中增加,在表皮层和毛囊中也有所增加,而与XR组相比,XR + H₂组呈现出更少的凋亡信号。

图7. 脱氧核糖核苷酸末端转移酶介导的dUTP缺口末端标记法(TUNEL)染色显微照片。棕色表示凋亡细胞所在位置。在第14天,XR + H₂组的凋亡信号比XR组更少。比例尺:每组左侧为50微米,右侧为10微米。
此外,我们通过蛋白质印迹分析检测了每组小鼠皮肤中凋亡相关蛋白的表达情况。Bcl - 2相关X蛋白(Bax)是促凋亡因子,而B细胞淋巴瘤2(Bcl - 2)是抗凋亡因子。Bax与Bcl - 2蛋白表达的比值决定了在凋亡刺激后细胞的存活或死亡情况。在图8中,分别展示了第7天和第14天小鼠皮肤中Bax/Bcl - 2的比值情况。与对照组(Ctrl组)相比,氢气组(H₂组)的Bax/Bcl - 2比值更低,这表明氢气能够减少正常组织中的细胞凋亡。在第14天接受照射的各组中,与XR组相比,XR + H₂组的Bax/Bcl - 2比值显著降低,这表明局部施用氢气能够有效减少皮肤组织中辐射诱导的细胞凋亡。
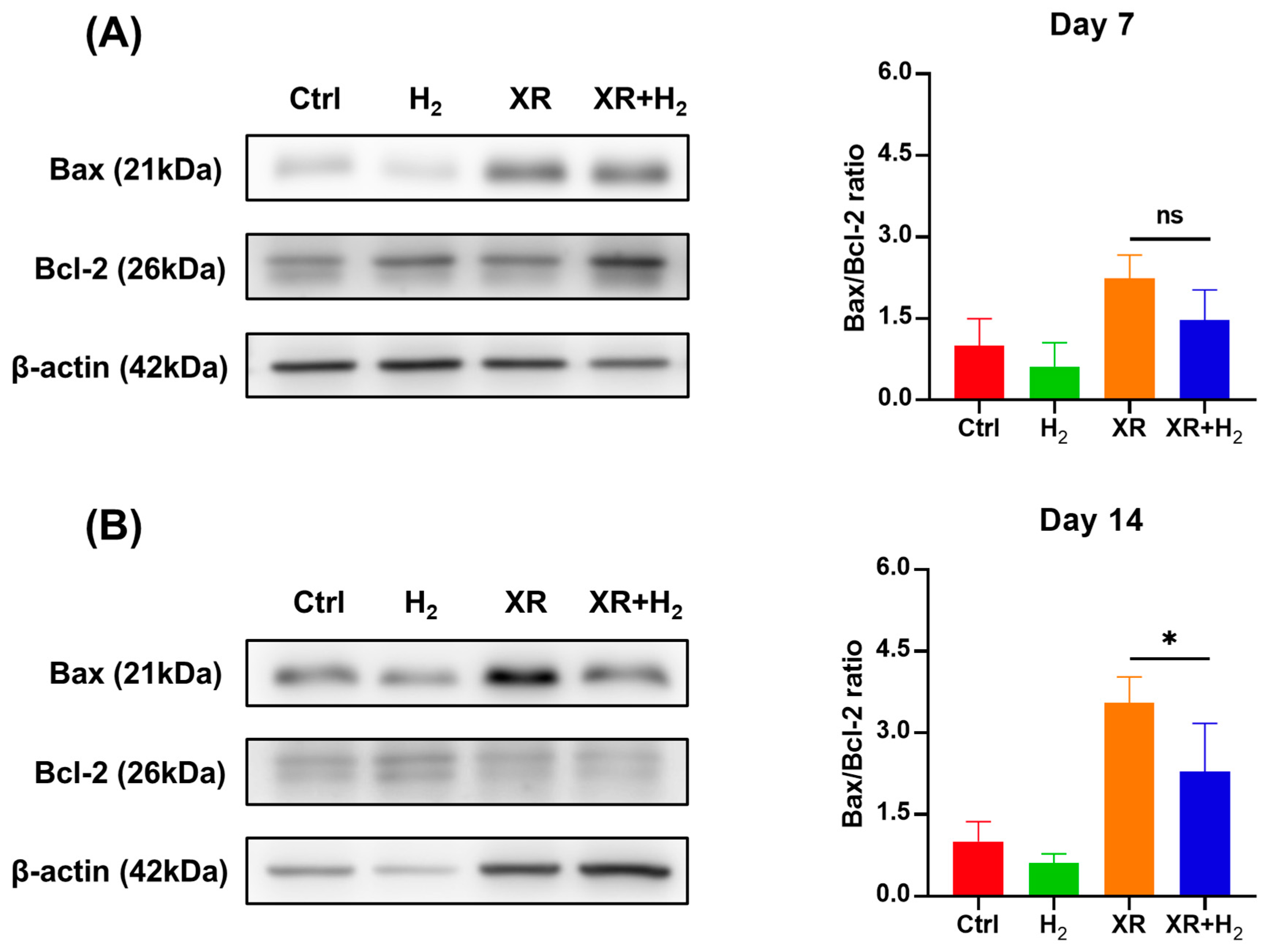
图8. 氢气(H₂)对凋亡相关标志物的调控作用。(A)第7天和(B)第14天Bcl - 2相关X蛋白(Bax)和B细胞淋巴瘤2(Bcl - 2)的表达情况。数据以至少三个独立生物学样本(n≥3)的平均值±标准差形式呈现。采用单因素方差分析确定统计学显著性,显著性水平设定为*p < 0.05。“ns”标记表示无统计学显著差异,即p > 0.05。
3.3.4. 氢气对放射性皮炎的抗氧化作用
电离辐射会产生过量的活性氧(ROS)并诱导氧化应激,进而导致炎症和细胞凋亡。因此,我们也旨在确定氢气对放射性皮炎(RD)的保护作用是否与体内抗氧化酶的活性有关。超氧化物歧化酶(SOD)是细胞中最有效的抗氧化酶,在对抗活性氧(ROS)方面起着关键作用。它能催化超氧阴离子自由基转化为过氧化氢和氧气,从而防止细胞损伤[33]。在图9A中,第7天小鼠皮肤中的相对超氧化物歧化酶(SOD)活性在对照组(Ctrl组)和XR组之间处于相似水平,氢气组(H₂组)和XR + H₂组略有升高,但无显著差异。到第14天,与对照组(Ctrl组)相比,XR组的超氧化物歧化酶(SOD)活性有所下降。相反,与XR组相比,XR + H₂组的超氧化物歧化酶(SOD)活性显著更高,这表明局部施用氢气可保护超氧化物歧化酶(SOD)活性,从而增强皮肤清除超氧阴离子的能力。
图9. 氢气(H₂)对抗氧化酶及相关分子的影响。(A)超氧化物歧化酶(SOD)、(B)过氧化氢酶(CAT)以及(C)谷胱甘肽(GSH)在第7天和第14天小鼠皮肤中的活性及浓度情况。数据以至少三个独立生物学样本(n≥3)的平均值±标准差形式呈现。采用单因素方差分析确定统计学显著性,显著性水平设定为*p < 0.05。“ns”标记表示无统计学显著差异,即p > 0.05。
另外两种一线防御抗氧化剂是过氧化氢酶(CAT)和谷胱甘肽(GSH)。它们的主要功能是催化过氧化氢(H₂O₂)还原为水和分子氧,从而完成由超氧化物歧化酶(SOD)启动的解毒过程[33]。在我们的研究中,使用氢气并未使抗氧化酶的活性产生显著差异。不过,我们观察到一种趋势,即氢气在早期能够提高过氧化氢酶(CAT)的活性,但随后该活性会下降至与XR组相同的水平。另一方面,持续的氢气处理使谷胱甘肽(GSH)水平有所升高。
4. 讨论
在本研究中,我们已经证实了局部氢气疗法在缓解放射性皮炎(RD)方面的有效性。其可能的作用机制如方案2所示。氢气通过保护皮肤细胞免受辐射暴露引发的DNA损伤和线粒体损伤来预防放射性皮炎。它能增强抗氧化酶活性,从而减轻活性氧(ROS)造成的危害以及后续促炎细胞因子的释放,最终减少细胞凋亡的发生。

方案2. 局部氢气疗法缓解放射性皮炎的可能机制
已有多项研究探索了氢气在应对放射性皮炎方面的潜力。梅(Mei)等人研究了皮下注射氢溶液对放射性皮炎的保护作用。该研究主要通过体内动物实验评估疗效,重点关注皮肤外观和组织学染色情况。渡边(Watanabe)等人利用吸入氢气作为一种治疗方法,证明了其对放射性皮炎的预防及治疗效果。他们的体内实验着重于评估皮肤外观以及进行与细胞凋亡相关的组织学染色分析。邹(Zou)等人通过体内实验探索了富氢水对放射性皮炎的愈合作用,评估了放射治疗(RT)所致伤口出现后皮肤外观及相关生物标志物的变化。在我们的研究中,我们选择使用纯氢气作为给药方式,并通过结合使用人表皮角质形成细胞(HaCaT)进行的体外实验以及涉及BALB/c小鼠的体内实验来探究其预防效果。我们的研究涵盖了对多个参数的评估,包括皮肤外观、组织学以及相关蛋白的表达情况。实验对象被分为四组:对照组(Ctrl,未处理)、氢气组(H₂,使用氢气处理)、XR组(接受照射)以及XR + H₂组(使用氢气处理并接受照射)。
体外细胞实验证实,氢气能够减少辐射导致的人表皮角质形成细胞(HaCaT)中的DNA损伤和线粒体膜去极化现象(图1)。氢气极低的分子量使其能够迅速穿透线粒体和细胞核。它可选择性地清除羟基自由基(•OH)和过氧亚硝酸盐阴离子(ONOO⁻)等有害自由基,保护人表皮角质形成细胞(HaCaT)免受辐射损伤。此外,给予氢气还降低了未受照射细胞的膜电位去极化情况。这种效应可能源于氢气抑制电子传递链中电子泄漏的能力,从而阻止其与氧气反应生成活性氧(ROS)。
在体内实验中,通过对皮肤外观评分、苏木精 - 伊红(H&E)染色以及马松三色(MT)染色的评估发现,氢气直接经皮应用能够预防辐射诱导的毛囊损伤、真皮增厚以及白细胞浸润,从而减轻放射性皮炎的严重程度。为了进一步探究氢气在保护受辐射皮肤方面的作用,我们对皮肤中与氧化、炎症和凋亡相关的蛋白表达情况进行了分析。放射治疗(RT)诱导的皮肤损伤会随时间逐渐累积并变得明显(图3和图4)。在第7天(累计达到35戈瑞剂量后的第2天),XR组和XR + H₂组之间在皮肤外观上未观察到明显差异。而且,在第7天,皮肤中的促炎细胞因子白细胞介素 - 1β(IL - 1β)和白细胞介素 - 6(IL - 6)也没有显著变化,这与苏木精 - 伊红(H&E)染色中未观察到明显白细胞浸润的情况相符(图4和图5)。然而,脱氧核糖核苷酸末端转移酶介导的dUTP缺口末端标记法(TUNEL)染色显示,XR组真皮中的凋亡细胞数量更多。分子生物学评估显示,与XR组相比,XR + H₂组中超氧化物歧化酶(SOD)活性虽无显著升高,但也表明其清除活性氧(ROS)的能力有所增强,这可能与XR + H₂组中较低的Bcl - 2相关X蛋白(Bax)/B细胞淋巴瘤2(Bcl - 2)比值以及凋亡细胞数量减少有关(图7、图8和图9)。
到第14天(累计35戈瑞辐射剂量后的第9天),XR组的皮肤外观和组织学呈现出明显损伤(图3和图4)。这可能是由于照射产生的活性氧(ROS)激活了炎症反应,进而通过诱导型一氧化氮合酶(iNOS)或环氧化酶 - 2(COX - 2)途径刺激持续产生更多的一氧化氮(NO)和活性氧(ROS),从而导致皮肤出现病理变化[3]。在分子生物学实验中,XR组小鼠皮肤中的抗氧化酶超氧化物歧化酶(SOD)活性相较于对照组(Ctrl组)更低(图9),这表明活性氧(ROS)的过量产生可能导致超氧化物歧化酶(SOD)的消耗和失活[35]。这随后可能引发细胞凋亡和炎症反应。与对照组(Ctrl)相比,XR组中作为细胞凋亡活性指标的Bcl - 2相关X蛋白(Bax)/B细胞淋巴瘤2(Bcl - 2)比值显著升高,同时通过脱氧核糖核苷酸末端转移酶介导的dUTP缺口末端标记法(TUNEL)染色可观察到真皮中有明显的凋亡信号,且促炎细胞因子白细胞介素 - 6(IL - 6)和白细胞介素 - 1β(IL - 1β)的表达也有所增加(图5、图7和图8)。在XR + H₂组中,氢气处理增强了皮肤的抗氧化能力,使Bcl - 2相关X蛋白(Bax)/B细胞淋巴瘤2(Bcl - 2)比值降低,凋亡细胞数量减少,促炎细胞因子的表达也降低。
除了上述抗氧化、抗凋亡和抗炎作用外,高浓度的氢气可能通过降低组织中的氧分压来预防放射性皮炎,从而减少活性氧(ROS)的产生以及辐射损伤。然而,在放射治疗期间为正常组织选择防护剂时,确保其不会干扰治疗效果至关重要,因为首要目标仍然是对肿瘤产生治疗效果。对于口服或注射给药途径,药物通过血液循环输送至目标区域,由于肿瘤血供丰富,可能会导致其在肿瘤部位浓度更高。因此,利用这些途径来预防放射性皮炎会引发一些担忧。尽管先前的文献曾提出氢气与放射治疗在肿瘤治疗方面可能存在协同效应,但确切机制仍不清楚。因此,我们的研究设计采用了局部氢气暴露的方式,组织中的氢气浓度取决于扩散情况以及组织深度。这意味着如果肿瘤位置较深,抗氧化治疗对肿瘤疗效的影响可以忽略不计。
我们认识到本研究存在一些局限性。首先,氢气暴露可能会改变酸碱度(pH)并诱发缺氧,进而抑制细胞生长。在研究中保持实验组和对照组之间的一致性至关重要。在本研究中,并未直接测量酸碱度(pH)、温度以及气体浓度。尽管考虑过使用氢气/氧气/二氧化碳混合气体,但由于氢气在水介质中的溶解度有限,可能会影响其在混合气体系统中的输送效果,这引发了一些顾虑。此外,混合气体存在燃烧和爆炸的潜在风险,所以这些实验选择了纯氢气。在对照组和氢气组之间,未观察到DNA双链断裂、线粒体去极化或白细胞介素 - 6(IL - 6)水平方面的显著差异,这表明所采用的氢气暴露水平并未对细胞生长产生不利影响。有必要开展进一步研究以确定长时间的氢气暴露是否会产生负面影响。其次,我们在体内实验中选择第7天和第14天作为评估时间点,可能无法捕捉到细胞反应的动态性和持续性。而且,组织中抗氧化酶和细胞因子的水平可能在我们所选的时间点上并未呈现出最显著的差异。此外,由于在第14天终止体内实验并对小鼠实施安乐死,我们错过了观察放射性皮炎恢复阶段的情况。虽然我们的研究结果表明氢气可能预防放射性皮炎,但其潜在的治疗效果或加速恢复的能力仍不清楚。
5. 结论
总之,我们的体外实验凸显了氢气保护细胞免受辐射损伤的潜力。此外,体内实验显示,让受辐射的皮肤区域暴露于氢气环境可减轻辐射诱导的皮肤损伤。这表明氢气直接经皮给药能够有效缓解放射性皮炎。未来,可通过使用制氢设备来促进给药,从而增强氢气经皮疗法的效果。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1468626.html?mobile=1
收藏



